Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Insertion de maille transvaginale dans le modèle ovine
Dans cet article
Résumé
Ce protocole décrit l'implantation du maillage dans le septum rectovaginal ovins en utilisant une seule technique d'incision vaginale, avec et sans l'insertion guidée par le trocart des bras d'ancrage.
Résumé
Ce protocole décrit l'insertion de maille dans le septum rectovaginal chez le mouton en utilisant une seule technique d'incision vaginale, avec et sans l'insertion guidée par les trocarts des bras d'ancrage. Le mouton parous a subi la dissection du septum rectovaginal, suivi de l'insertion d'un implant avec ou sans quatre bras d'ancrage, tous deux conçus pour s'adapter à l'anatomie ovine. Les bras d'ancrage ont été mis en place à l'aide d'un trocart et d'une technique "à l'extérieur". Les bras crâniens ont été passés à travers les muscles obturateur, gracilis et adducteur magnus. Les bras caudaux ont été fixés près du ligament sacrotubeux, à travers les muscles du coccygeus. Cette technique permet d'imiter les interventions chirurgicales chez les femmes souffrant de prolapsus d'organe pelvien. Les espaces anatomiques et les éléments sont facilement identifiables. La partie la plus critique de la procédure est l'insertion du trocart crânien, qui peut facilement pénétrer dans la cavité péritonéale ou dans les organes pelviens environnants. ThiS peut être évité par une dissection rétropéritonéale plus étendue et en guidant le trocart plus latéralement. Cette approche n'est conçue que pour le test expérimental d'implants novateurs dans de grands modèles animaux, car l'insertion guidée par un trocart n'est actuellement pas utilisée cliniquement.
Introduction
Le prolapsus de l'organe pelvien est cliniquement diagnostiqué dans la moitié des femmes qui ont eu au moins un accouchement vaginal, mais subjectivement, cela nuit à la moitié des femmes 1 . L'essentiel de la thérapie est la reconstruction chirurgicale en utilisant des tissus indigènes ou des matériaux d'implant, mais chacune de ces méthodes a ses limites, y compris la récurrence ou les complications locales 2 , 3 , 4 . L'implant idéal n'a pas encore été identifié; Par conséquent, il existe une demande continue pour l'innovation des produits et pour le développement d'un pipeline approprié pour l'expérimentation préclinique avant l'introduction de nouveaux produits et techniques sur le marché. L'une des étapes de cette piste est l'évaluation expérimentale sur les modèles animaux 5 , 6 appropriés. Idéalement, ils devraient imiter les environnements anatomiques, biomécaniques et biologiques. Quand il s'agit deE évaluation expérimentale des implants nouveaux, ils sont généralement testés d'abord dans des modèles plus petits, soit pour la biocompatibilité, soit pour la reconstruction des défauts de la paroi abdominale. Ce type d'expériences a été critiqué, car les implants ne sont pas insérés dans la zone d'intérêt ( c'est-à-dire le vagin) 7 . Les modèles de chirurgie vagale sont plus rares, certainement lorsque l'objectif de l'expérience est de documenter les caractéristiques biomécaniques des explants. Pour cette raison, il y a eu un passage des lapins au mouton 8 . Les brebis adultes sont des modèles à gros animaux avec un vagin de taille raisonnable et accessible. Ils peuvent être utilisés pour l'évaluation à mi-parcours d'implants nouveaux, et il est possible de reproduire des expositions vaginales avec certains matériaux 9 , 10 , 11 , 12 , 13 . Non seulement les dimensions et l'anatomieDu vagin des ovins et du plancher pelvien sont comparables à ceux des humains, mais aussi l'apparition spontanée de prolapsus, qui se produit chez 15% des brebis. Les facteurs de risque de prolapsus se chevauchent ( c'est-à-dire multipartite, antécédents de POP, augmentation de la pression intra-abdominale induite par un poids corporel plus élevé ou lors du pâturage sur les collines et effets comparables des œstrogènes phyto) 6 , 14 . En Europe, les moutons sont la seule alternative raisonnable, car la recherche sur les primates non humains a été presque complètement interdite. Ici, le modèle a été pris un peu plus loin en imitant l'insertion transvaginale des implants en utilisant des trocarts et des guides pour le placement sans tension des mailles dans le septum recto-vaginal. Ceci a été suivi par la fixation de l'implant en utilisant l'ancrage avec les bras à travers les ligaments des muscles, ce qui peut être considéré comme équivalent à la pratique clinique 15 , 16 . Jusqu'à présent, cette techniqueN'a pas été étudié, bien que beaucoup croient que des complications spécifiques peuvent se produire en raison de l'utilisation de ces bandes plus longues et / ou du piercing des structures anatomiques.
Dans une étude anatomique détaillée antérieure, le plancher pelvien ovins a été comparé au bassin féminin 17 . En ce qui concerne l'ancrage de l'implant, les moutons n'ont pas le ligament sacrospinique, mais ils ont un ligament sacrotubeux très développé et large. Le nerf pudendal court ventralement, ce qui rend dangereux d'utiliser ce point de repère comme point de suspension. À l'inverse, le muscle coccygeus et son fascia, ainsi que la membrane obturatrice, sont accessibles par l'espace rectovaginal. Ici, l'accès et la position des structures anatomiques pour la fixation des bras d'ancrage sont proposés. Les instruments qui peuvent être utilisés pour positionner le maillage sont discutés. Enfin, la relation des bras ou des trocarts aux structures anatomiques adjacentes, telles que les vaisseaux et les nerfs, uneAinsi que des complications intra-opératoires potentielles, sont également décrits.
Protocole
L'approbation éthique de cette expérience a été obtenue auprès du Comité d'éthique de l'expérimentation animale du KU Leuven (P065 / 2013). Les animaux ont été traités conformément aux directives nationales actuelles sur le bien-être des animaux.
1. Matériel et animal expérimental
- Préparation chirurgicale
- Dans le théâtre chirurgical, couvre une table avec un drap stérile et préparez un trocart stérile incurvé ( Figure 1 , panneau A), des instruments chirurgicaux stériles, des sutures et de la gaze stérile. Effectuer toute la procédure chirurgicale dans des conditions stériles si l'expérience comprend un suivi. Placez tous les instruments sur la table pour être prêts à être utilisés pendant la chirurgie.
- Enlevez un implant rectangulaire stérile et / ou un implant avec des bras d'ancrage de l'emballage stérile et mettez-les sur la table couverts de draps stériles ( Figure 1B , C et D ).
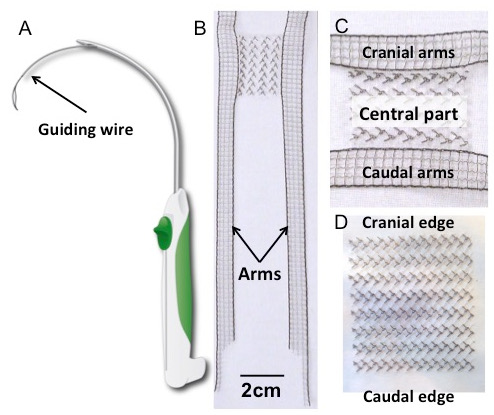
Figure 1: Trocarts et Implants. ( A ) Dessin schématique du trocart. ( B ) implant en fluorure de polyvinylidène en forme de H (PVDF), avec un détail de la partie centrale (panneau C ). Sa forme a été inspirée par les maillages à quatre bras actuellement disponibles pour la réparation des prolapsus transvaginales. Le corps rectangulaire (30 x 40 mm 2 ) est prolongé latéralement par quatre bras tendus (150 x 10 mm 2 ). Les dimensions des bras sont conçues pour être suffisamment longues pour percer les structures de suspension concernées, sur la base d'études anatomiques antérieures 17 . ( D ) L'implant rectangulaire (30 x 40 mm 2 ). Les deux implants étaient constitués de fluorure de polyvinylidène; Les caractéristiques et propriétés du textile se trouvent dans le tableau 1 .
- Animal expérimental (EwE, 45-60 kg)
- Administrer une prémédication de 1 mL de 15 mg / mL de sulfate d'atropine et 1 ml / 50 kg de HCl de xylazine par voie intramusculaire (im) 30 min avant l'intervention chirurgicale.
- Après 30 minutes, assurez-vous que la prémédication a rendu les moutons léthargiques et endormis.
- Insérer un cathéter intraveineux dans la veine jugulaire et administrer 0,075 ml / kg de Ketamine 100 mg / ml de HCl. Confirmer l'anesthésie profonde en observant le manque de réaction aux stimuli douloureux.
- Déplacez l'animal sur la table chirurgicale et sécurisez ses voies respiratoires par intubation. Maintenir l'anesthésie avec 2,5% d'isoflurane dans 5 L / min d'oxygène.
- Garder la ligne intraveineuse insérée dans la veine jugulaire et fournir 500 ml de solution saline à un débit de 150 mL / h.
- Administrer des antibiotiques prophylactiques im (clavulanate d'amoxicilline, 7 mg / kg) et des analgésiques post-opératoires (buprénorfin et chlorocrésol, 1 mL) ou l'équivalent selon les protocoles locaux.
- Placez l'animal en allumageUne position de hotomy sur la fin de la table chirurgicale et sécuriser ses membres, avec les hanches en hyper-flexion, en utilisant des cordes ( Figure 2 , panneau A).
- Vider manuellement la vessie et le rectum en les enfonçant trans-vaginalement.
- Raser le périnée, la partie médiale de la cuisse et la queue se plie et désinfecter avec de la polyvidone iodique à 7,5% ( figure 2 , panneau B et C).
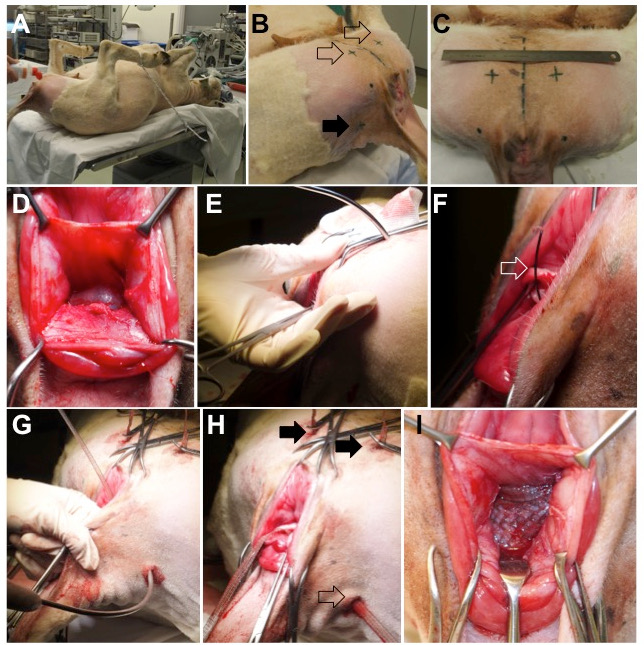
Figure 2: Chirurgie animale. ( A ) Un mouton placé en position couchée, les hanches hyper-flexibles en sécurisant les membres inférieurs. ( B ) Les points d'entrée externes pour l'insertion du trocart sont du côté ventral (flèche vide) et dorsalement sur les plis latéraux de la queue (flèche complète). ( C ) Position des points d'insertion ventrale; La ligne pointillée dans le milieu représenteLe plan midsagittal de l'animal. ( D ) Tabouret rectovaginal dissous. ( E ) Insertion du trocart ventral à travers les muscles du côté médian de la cuisse, du foramen obturateur et de l'espace paravaginal. La trajectoire du trocart perçant est contrôlée par le doigt. ( F et G ) Une fois que le trocart est en place, l'écharpe de fil (flèche ouverte) est avancée et chargée avec le bras de la maille vaginale. ( H ) Position finale des bras ventral (flèches complètes) et dorsal (flèche vide). ( I ) La partie centrale est placée sans tension entre la paroi vaginale et l'adventice rectale.
- Préparer le personnel pour une intervention chirurgicale dans des conditions stériles. Mettez un capuchon chirurgical et masque buccal, lavez-vous les mains pour une opération chirurgicale, et mettez une robe chirurgicale et des gants stériles.
- Couvrir l'animal avec un drap stérile et faire une ouverture au-dessus des organes génitauxhiatus.
2. Procédure chirurgicale
- Préparation du septum rectovaginal
- Saisissez la paroi vagale dorsale 3 cm cranial à l'anneau hyménal en utilisant la pince Allis.
- Prenez une seringue chargée avec 10 ml de solution saline et munie d'une aiguille de 22 G. Insérez-le à travers l'épithélium vaginal (environ 3 à 4 mm de profondeur) et dans la ligne médiane du septum rectovaginal, 1,5 cm cranial à l'anneau hyméné.
- Effectuer une "dissection d'aqua" par injection de solution saline dans le septum rectovaginal 11 .
- Faire une incision de la ligne médiane de 3 cm de long sur l'épithélium vaginal, commencer le caudal à la pince Allis (étape 2.1.1) et se terminer à l'anneau hyméné en utilisant un scalpel. Entrez l'espace recto-vaginal à travers cette incision.
- Placez le rétracteur auto-retenant (voir la table des matières ) sur le périnée et placez quatre crochets de maintien aigus dans l'incision vaginale pour le garder ouvert.
- Avec votre doigt, dissérez sans frein le fascia recto-vaginal de la paroi vaginale latéralement vers les parois latérales pelviennes et cranialement jusqu'à l'aspect caudal du cul-de-sac. Créez un espace approprié pour la partie centrale 30 x 40 mm 2 du maillage ( Figure 2 , panneau D).
- Effectuer une hémostase avec une pince hémostatique ou une ligature hémostatique croisée chaque fois que cela est nécessaire.
REMARQUE: Des petits saigneurs peuvent être serrés avec la pince hémostatique. Cela écrase le vaisseau et déclenche la cascade naturelle de la coagulation. Pour un saignement plus fort, saisissez le vaisseau saignant avec une pince et placez une ligature croisée, en le fixant avec un nœud carré. À ce stade, on peut insérer l'implant rectangulaire (étape 2.2) ou continuer avec la dissection pour insérer l'implant avec des bras d'ancrage (étape 2.3).
- Insertion de maille plate
- Insérez le rétracteur vaginal dans l'incision vaginale pour permettre une meilleure vue deLa partie crânienne de la zone disséquée.
- Suture le coin crânien gauche et droit de l'implant avec une simple suture de polypropylène 3/0 interrompue sur les côtés gauche et droit de l'aspect le plus crânien de l'espace recto-vaginal disséqué. Couper le matériau de suture résiduel. Gardez la suture loin de la lumière vaginale ( c'est-à-dire ne pénètre pas dans la paroi vaginale).
NOTE: L'implant est toujours suturé sur le tissu conjonctif comprenant le septum recto-vaginal. La paroi vaginale n'est pas pénétrée si le matériau de suture ne peut être vu dans le vagin. - Ajoutez une suture interrompue simple supplémentaire à mi-chemin le long de l'aspect crânien de l'implant.
- Suture les bords latéraux de l'implant à mi-chemin sur le tissu conjonctif environnant avec un simple polypropylène interrompu 3/0. Gardez l'implant aussi plat que possible et sans tension.
- Suture les coins gauche et droit de la caudale avec des sutures de polypropylène 3/0 interrompues simples à gauche et à droiteCôtés de l'aspect le plus caudal de l'espace rectovaginal.
- Ajoutez une suture interrompue simple supplémentaire à mi-chemin le long de l'aspect caudal de l'implant.
- Fermez les incisions vaginales avec une suture de polyglactine 3/0 en cours d'exécution.
- Insertion et ancrage de l'implant avec les bras (technique guidée par le trocart).
- Continuer la dissection de l'espace recto-vaginal créée à l'étape 2.1 cranio-ventrally pour atteindre l'aspect médian du foramen obturateur, qui peut facilement être palpé.
- Dissectionnez l'espace caudo-latéralement pour atteindre l'aspect caudal du ligament sacrotubeux et du muscle coccygeus situé au caudal.
- Avec un no. 24, faites quatre incisions de 1 cm de largeur sur le côté vulvaire, en coupant la peau et le fascia musculaire superficiel ( Figure 2 , panneau B et C).
- Faire deux incisions "ventrales" sur l'aspect médian de la cuisse, à proximité de 4 cm de cranio de la bordure caudale oF l'arc sciatique ( c'est-à - dire la bordure inférieure de la symphyse) et 3 cm latéral de la ligne médiane ( figure 2 , panneau C).
- Effectuez deux incisions "dorsales" au niveau de l'insertion des plis de la queue, 2 cm à l'intérieur du tubercule ischiadicum, qui peut être facilement palpé ( figure 2 , panneau B).
- Placez un trocart incurvé à travers une des incisions ventral ( Figure 2 , panneau E).
- Passez le trocart à travers le muscle adducteur magnus, l'obturateur externe et l'aspect médian du foramen obturateur.
- Contrôler la progression du trocart avec un doigt inséré à travers l'incision vaginale. Guidez sa pointe sur l'arc tendineux du muscle élévateur ani ( Figure 2 , panneau E).
- Déposer le fil de guidage dans l'incision de la paroi vaginale et le charger avec le bras de tissu crânien ipsilatéral correspondant ( Figure 2 , panneau F).
- Poussez le trocart chargé avec le mEsh bras à travers les structures ci-dessus. Gardez le bras sans tension.
- Répétez le processus avec le deuxième bras crânien à travers l'incision ventrale de l'autre côté de l'animal.
- À travers une des incisions dorsales, passez le trocart à travers le muscle coccygeus, juste distal au ligament sacrotubeux ( Figure 2 , panneau G).
- Exposez le fil guide à travers l'incision vaginale, saisissez le bras dorsal de la maille et retirez-le. Gardez le bras sans tension et répétez de l'autre côté.
- Réglez la position du maillage en l'aplatissant et en appliquant une tension aux bras, mais gardez le maillage sans tension ( Figure 2, panneau I, Figure 3 ).
- Fixez le corps de la maille avec une simple suture de polypropylène 3/0 interrompue au milieu de sa bordure caudale, en la fixant sur le tissu conjonctif environnant.
- Couper les bras au niveau de la peau et fermer toutes les incisions cutanées avec un simple polygone interrompu 3/0Sutures d'ecaprone ( figure 2 , panneau H).
- Fermez l'incision vaginale avec une suture en polyglecaprone 3/0 en cours d'exécution.
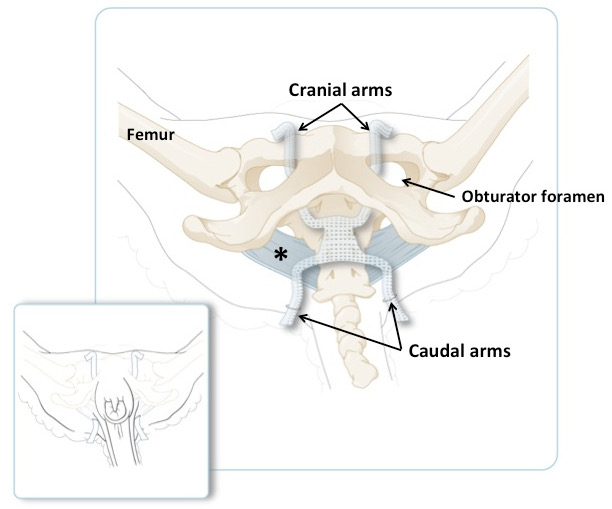
Figure 3: Illustration schématique du pieu d'ovine, avec les bras crâniens passant par le forment de l'obturateur et les bras caudaux passant par les replis de la queue. Le large ligament sacrotubeux est en bleu. Le panneau plus petit illustre la position des bras sur un animal en position couchée, juste avant de raccourcir la quantité excessive de matière. Le panneau principal montre la même chose mais avec la peau et les muscles enlevés.
Résultats
Gestion dans une configuration d'observation plus longue
Après la procédure chirurgicale, un emballage vaginal (un paquet de gaze trempé dans une solution saline insérée dans le vagin immédiatement après la chirurgie) peut être inséré pendant 24 heures pour sécuriser la position de l'implant. Le mouton doit être placé dans une cage de récupération et sa fonction respiratoire est suivie j...
Discussion
Ici, nous décrivons une procédure expérimentale chez le mouton, visant à imiter la dissection vaginale et l'insertion de maille transvaginale d'un implant avec ou sans bras d'ancrage. Les étapes et les instruments suivants ont été inspirés par des interventions chirurgicales faites pour le POP et l'incontinence urinaire 15 , 16 , 19 , 20 . Après des dissections anatomi...
Déclarations de divulgation
Ce programme de recherche sur le modèle des ovins a été soutenu par une subvention inconditionnelle de Medri et Blasingame, Burch, Garrard et Ashley (Atlanta GA, États-Unis). Les accords sont gérés par l'intermédiaire du bureau de transfert de la recherche et du développement de Louvain. Les commanditaires n'ont pas gêné la planification, l'exécution ou la déclaration de cette expérience, ni les résultats. NS et LH sont bénéficiaires d'une subvention de la CE dans le cadre FP7 (projet Bip-Upy, NMP3-LA-2012-310389). AF a été soutenu par une subvention de la CE dans le programme de partenariat industriel-universitaire (251356).
Remerciements
Nous remercions Ivan Laermans, Rosita Kinart, Ann Lissens (Centre for Surgical Technologies, KU Leuven, Louvain, Belgique). Jo Verbinnen et Kristof Reyniers (Institut Vesalius d'Anatomie, Faculté de Médecine, KU Leuven, Louvain, Belgique) ont fourni un soutien technique lors de l'expérimentation. Nous remercions Leen Mortier pour l'aide en matière de gestion des données et des manuscrits. Nous remercions FEG Textiltechniken de fabriquer des mailles prototypes, de les stériliser et de les faire don de manière inconditionnelle pour la recherche.
matériels
| Name | Company | Catalog Number | Comments |
| Animals: | |||
| parous female sheep (45 - 65 kg) | Zoötechnical Institute of the KU Leuven | NA | experimetnal animal |
| Sterile clothing: | |||
| sterile drape 45 x 75 cm | Lohmann & Rauscher, Regensdorf, Germany | 33002 | other material |
| sterile OR drape 150 x 180 cm | Lohmann & Rauscher, Regensdorf, Germany | 33009 | other material |
| sterile glowes 2x | Lohmann & Rauscher, Regensdorf, Germany | 16652 | other material |
| sterile surgical gown 2x | Lohmann & Rauscher, Regensdorf, Germany | 19342 | other material |
| surgical head cap 2x | Lohmann & Rauscher, Regensdorf, Germany | 17427 | other material |
| surgical face mask 2x | Lohmann & Rauscher, Regensdorf, Germany | 11983 | other material |
| Other surgical material | |||
| implant | FEG Textiltechnik GmbH, Aachen, Germany | NA | purposely designed implant |
| 3/0 polypropylene suture | Prolene, Ethicon, Diegem, Belgium | 8762H | suture material |
| 3/0 polygecaprone suture | Vicryl, Ethicon | J311H | suture material |
| gauze swabs 10 x 10 cm 10x, 12-ply | Lohmann & Rauscher, Regensdorf, Germany | 11574 | other material |
| syringe 20 mL | Becton Dickinsosn S.A., Madrid, Spain | 300613 | aqua-dissection |
| needle 16 gauge | Terumo, Leuven, Belgium | NN-2238R | aqua-dissection |
| Surgical equipment: | |||
| blade no.22 | Fine science isntruments, Heidelberg, Germany | 10022-00 | surgical instruments |
| Allis tissue forceps 1x | Fine science isntruments, Heidelberg, Germany | 11091-15 | surgical instruments |
| Standart pattern forceps 1x2 theeth 1x | Fine science isntruments, Heidelberg, Germany | 11023-14 | surgical instruments |
| Standart pattern forceps straight serrated 1x | Fine science isntruments, Heidelberg, Germany | 11000-14 | surgical instruments |
| Scalpel handle 1x | Fine science isntruments, Heidelberg, Germany | 10004-13 | surgical instruments |
| Halstead-Mosquito forceps 2x | Fine science isntruments, Heidelberg, Germany | 13008-12 | surgical instruments |
| Standart pattern scissors 1x | Fine science isntruments, Heidelberg, Germany | 14001-14 | surgical instruments |
| Metzenbaum scissors 1x | Fine science isntruments, Heidelberg, Germany | 14016-18 | surgical instruments |
| Crile Wood needle holder 1x | Fine science isntruments, Heidelberg, Germany | 12003-15 | surgical instruments |
| Kell forceps 1x | Fine science isntruments, Heidelberg, Germany | 13018-14 | surgical instruments |
| Long Starr Self-Retaining Retractor with eight 5mm sharp stay hooks | Cooper Surgical, Tumbull, USA | 3704 | surgical instruments |
| Heaney Simon Vaginal Retractor | Medical supplies & equipments co., Katy, Texas, USA | 403-129FSI | surgical instruments |
| Trocar (Insnare) | Bard, West Sussex, United Kingdom | NA | any trocar on market for transvaginal mesh implantation |
| Medication: | |||
| amoxilicilline clavulanate 1000mg / 300 mL (Ampiciline) | GSK, Wavre, Belgium | NA | antibiotics |
| buprenorfin 0.3 mg/mL + chlorocresol 1.35 mg/mL (Vetregesic) | Ecuphar, Oostkamp, Belgium | NA | analgesia |
| ketamin HCL 100mg/mL (Ketamine 1000) | Ceva Sante Animale, Brussels, Belgium | NA | anesthesia |
| isoflurane (IsoFlo) | Abbott Laboratories Ltd, Maidenhead, Berkshire, UK | NA | anesthesia |
| polyvidone iodium 7.5% (Braunol) | B. Braun Medical, Machelen, Belgium | NA | local desinfection |
| saline solution 500ml | B. Braun Medical, Machelen, Belgium | NA | aqua-dissection |
| Xxylazine HCl , 1 mL/50 kg | Vexylan, Ceva Sante Animale, Belgium | NA | premedication |
| atropine Sulfate 15 mg/ml (), | Viatris, Belgium | NA | premedication |
Références
- Glazener, C., et al. Childbirth and prolapse: Long-term associations with the symptoms and objective measurement of pelvic organ prolapse. BJOG An Int. J. Obstet. Gynaecol. 120 (2), 161-168 (2013).
- Jia, X., et al. Efficacy and safety of using mesh or grafts in surgery for anterior and/or posterior vaginal wall prolapse: systematic review and meta-analysis. BJOG. 115 (11), 1350-1361 (2008).
- Maher, C., et al. Transvaginal mesh or grafts compared with native tissue repair for vaginal prolapse. Review. 2 (2), 10-13 (2016).
- Nieminen, K., et al. Outcomes after anterior vaginal wall repair with mesh: a randomized, controlled trial with a 3 year follow-up. Am. J. Obstet. Gynecol. 203 (3), e1-e8 (2010).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: a review. Eur. J. Obstet. Gynecol. Reprod. Biol. 144, S146-S158 (2009).
- Couri, B., Lenis, A., Borazjani, A., Paraiso, M. F. R., Damaser, M. S. Animal models of female pelvic organ prolapse: lessons learned. Expert Rev. Obs. Gynecol. 7 (3), 249-260 (2012).
- Deprest, J., et al. The biology behind fascial defects and the use of implants in pelvic organ prolapse repair. Int. Urogynecol. J. Pelvic Floor Dysfunct. 17, S16-S25 (2006).
- Ozog, Y., Mazza, E., De Ridder, D., Deprest, J. Biomechanical effects of polyglecaprone fibers in a polypropylene mesh after abdominal and rectovaginal implantation in a rabbit. Int. Urogynecol. J. 23 (10), 1397-1402 (2012).
- Manodoro, S., et al. Graft-related complications and biaxial tensiometry following experimental vaginal implantation of flat mesh of variable dimensions. BJOG. 120 (2), 244-250 (2013).
- Endo, M., et al. Cross-linked xenogenic collagen implantation in the sheep model for vaginal surgery. Gynecol. Surg. , 113-122 (2015).
- Feola, A., et al. Host reaction to vaginally inserted collagen containing polypropylene implants in sheep. Am. J. Obstet. Gynecol. 212 (4), e1-e474 (2015).
- Barnhart, K. T., et al. Baseline dimensions of the human vagina. Hum. Reprod. 21 (6), 1618-1622 (2006).
- Tayrac, R., Alves, A., Thérin, M. Collagen-coated vs noncoated low-weight polypropylene meshes in a sheep model for vaginal surgery. A pilot study. Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (5), 513-520 (2007).
- Sobiraj, A., Busse, G., I, H. B. O. S. E. D. Ivastigation into the blood plasma profiles progesterone in sheep sufferingform vaignal inversion and prolapse. Br. Vet. J. 142 (142), 218-223 (1986).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Anatomical conditions for pelvic floor reconstruction with polypropylene implant and its application for the treatment of vaginal prolapse. Eur. J. Obstet. Gynecol. Reprod. Biol. 131, 214-225 (2007).
- Carey, M., Slack, M., Higgs, P., Wynn-Williams, M., Cornish, A. Vaginal surgery for pelvic organ prolapse using mesh and a vaginal support device. BJOG An Int. J. Obstet. Gynaecol. 115 (3), 391-397 (2008).
- Urbankova, I., et al. Comparative anatomy of the ovine and female pelvis. Gynecol. Obstet. Invest. , (2016).
- Maurer, M. M., Röhrnbauer, B., Feola, a., Deprest, J., Mazza, E. Mechanical biocompatibility of prosthetic meshes: A comprehensive protocol for mechanical characterization. J. Mech. Behav. Biomed. Mater. 40, 42-58 (2014).
- Leval, J. Novel Surgical Technique for the Treatment of Female Stress Urinary Incontinence. Transobturator Vaginal Tape Inside-Out. Eur. Urol. 44 (6), 724-730 (2003).
- Reisenauer, C., Kirschniak, A., Drews, U., Wallwiener, D. Transobturator vaginal tape inside-out. Eur. J. Obstet. Gynecol. Reprod. Biol. 127 (1), 123-129 (2006).
- Bafghi, A., et al. Bowel perforation as late complication of tension-free vaginal tape. J Gynecol Obs. Biol Reprod. 34 (6), 606-607 (2005).
- Hinoul, P., Vanormelingen, L., Roovers, J. P., de Jonge, E., Smajda, S. Anatomical variability in the trajectory of the inside-out transobturator vaginal tape technique (TVT-O). Int. Urogynecol. J. Pelvic Floor Dysfunct. 18 (10), 1201-1206 (2007).
- Schaller, O., et al. . Illustrated Veterinary Anatomical Nomenclature. , (2007).
- . Serious Complications Associated with Transvaginal Placement of Surgical Mesh for Pelvic Organ Prolapse. FDA Safety Communication. , (2016).
- Reinier, M., Groep, G. Final Opinion on the use of meshes in urogynecological surgery. SCENIHR- European Commission. , (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon