A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نهج أخذ العينات 4-السفينة إلى الدراسات التكاملية من فسيولوجيا المشيمة الإنسان
In This Article
Summary
نقدم طريقة مفصلة لدراسة علم وظائف الأعضاء المشيمة الإنسان في الجسم الحي على المدى. الأسلوب يجمع بين أخذ عينات الدم من السفن الواردة والصادرة على الجانبين الأم والجنين من المشيمة مع قياسات الموجات فوق الصوتية من حجم تدفق الدم والأوعية الأنسجة المشيمة.
Abstract
المشيمة البشرية غير قابلة للوصول للغاية للبحث في حين لا يزال في الرحم . وبالتالي فإن الفهم الحالي لعلم وظائف الأعضاء المشيمة الإنسان في الجسم الحي يعتمد إلى حد كبير على الدراسات الحيوانية، على الرغم من التنوع الكبير بين الأنواع في التشريح المشيمة، ديناميكا الدم ومدة الحمل. الغالبية العظمى من الدراسات المشيمة البشرية هي دراسات نضح خارج الجسم الحي أو في المختبر دراسات الأرومة الغاذية. على الرغم من الدراسات في المختبر والنماذج الحيوانية ضرورية، استقراء النتائج من هذه الدراسات إلى المشيمة البشرية في الجسم الحي غير مؤكد. ونحن نهدف إلى دراسة علم وظائف الأعضاء المشيمة البشرية في الجسم الحي على المدى، وتقديم بروتوكول مفصل من هذه الطريقة. استغلال الدخول داخل البطن إلى الوريد الرحمي فقط قبل شق الرحم خلال العملية القيصرية المخطط لها، نقوم بجمع عينات الدم من السفن الواردة والصادرة على الجانبين الأم والجنين من المشيمة. عند الجمع بين كونقياسات الترشيح من عينات الدم مع قياسات تدفق الدم حجم، ونحن قادرون على تحديد المشيمة وامتصاص الجنين والافراج عن أي مركب. وعلاوة على ذلك، عينات الأنسجة المشيمة من نفس أزواج الأم والجنين يمكن أن توفر قياسات كثافة الناقل والنشاط والجوانب الأخرى من وظائف المشيمة في الجسم الحي . من خلال هذا الاستخدام التكاملي لطريقة أخذ العينات من 4 سفن ونحن قادرون على اختبار بعض المفاهيم الحالية لنقل المغذيات المشيمة والتمثيل الغذائي في الجسم الحي ، سواء في حالات الحمل العادية والمرضية. وعلاوة على ذلك، فإن هذه الطريقة تمكن من تحديد المواد التي يفرزها المشيمة لدورة الأمهات، والتي يمكن أن تكون مساهمة هامة في البحث عن المؤشرات الحيوية للخلل المشيمة.
Introduction
وفقا للمعاهد الوطنية للصحة، الولايات المتحدة الأمريكية، المشيمة هو الجهاز الأقل تفهما في جسم الإنسان 1 ، 2 ، 3 . فمن الصعب الوصول إلى ودراسة المشيمة البشرية في الجسم الحي دون فرض مخاطر غير أخلاقية على الحمل المستمر. ولذلك، فإن دراسات وظيفة المشيمة في الإنسان تستند إلى حد كبير على نماذج في المختبر و فيفو السابقين . وقد أجريت غالبية الدراسات السابقة في الجسم الحي من نقل المشيمة والتمثيل الغذائي في الحيوانات 4 ، 5 ، 6 . ومع ذلك، كما هيكل المشيمة وظائف تختلف اختلافا كبيرا بين الأنواع، يجب أن يتم استقراء النتائج من الحيوانات للإنسان بحذر. فقط عدد قليل من الإنسان أصغر في الدراسات المجراة وقد حققت المشيمة وامتصاص الجنين والنقل في ظل الطبيعي الفسيولوجيةولم يستكشف أي منها النقل المتكامل للعديد من المركبات 7 و 8 و 9 و 10 و 11 و 12 و 13 . وتوضح هذه الدراسات الأساسية أنه في الدراسات المجراة من المشيمة البشرية هي ممكنة، وأنها قد تخدم عدة أغراض. أولا، المفاهيم الحالية لوظائف المشيمة المستمدة أساسا من في المختبر ، خارج الجسم الحي والحيوان دراسات يمكن اختبارها في بيئة الإنسان، وبالتالي توفير رؤية جديدة وأكثر تحديدا في المشيمة البشرية. ثانيا، خصائص المشيمة مختلة المرتبطة نمو الجنين الشاذة، تسمم الحمل، وسكري الأم، ومتلازمة التمثيل الغذائي وغيرها من الاضطرابات الأيضية الأمهات يمكن وصفها بشكل أفضل. ثالثا، الإنسان في الدراسات المجراة توفر فرصة لتطوير التشخيصتيك والأدوات التنبؤية من وظيفة المشيمة.
على هذه الخلفية كنا تهدف إلى إنشاء مجموعة شاملة من البيانات الفسيولوجية للتحقيق وظيفة المشيمة الإنسان في الجسم الحي. خلال عملية قيصرية المخطط لها، نستغل الوصول داخل البطن إلى الوريد الرحمي لجمع عينات الدم من السفن الواردة والصادرة على الجانبين الأم والجنين من المشيمة (طريقة أخذ العينات 4-السفينة). وتستخدم هذه العينات لحساب الاختلافات تركيز الشرايين المقترنة من المواد الغذائية وغيرها من المواد 14 . بالإضافة إلى ذلك، نقيس حجم تدفق الدم على جانبي المشيمة عن طريق الموجات فوق الصوتية. وبالتالي، امتصاص المشيمة والجنين من أي مركب قد يكون كميا. وعلاوة على ذلك، فمن الممكن لتحديد المواد الصادرة عن المشيمة إلى الأمهات والجنين التعاميم 15 ، 16 ، 17 . عند الجمعد مع المعلمات السريرية للأم والطفل، وتحليلات المشيمة والأنسجة الأخرى ذات الصلة، وهذا الأسلوب لديه القدرة المثيرة لدمج العديد من جوانب وظائف المشيمة في الجسم الحي في نفس أزواج الأم والجنين.
Protocol
تمت الموافقة على الدراسة من قبل مسؤولي حماية البيانات في مستشفى جامعة أوسلو واللجنة الإقليمية لأخلاقيات البحوث الطبية والصحية، جنوب النرويج 2419/2011. ووقع جميع المشاركين موافقة خطية مستنيرة عند الإدراج.
1 - الأعمال التحضيرية
ملاحظة: ويرد الجدول الزمني للإجراءات في الشكل 1 .
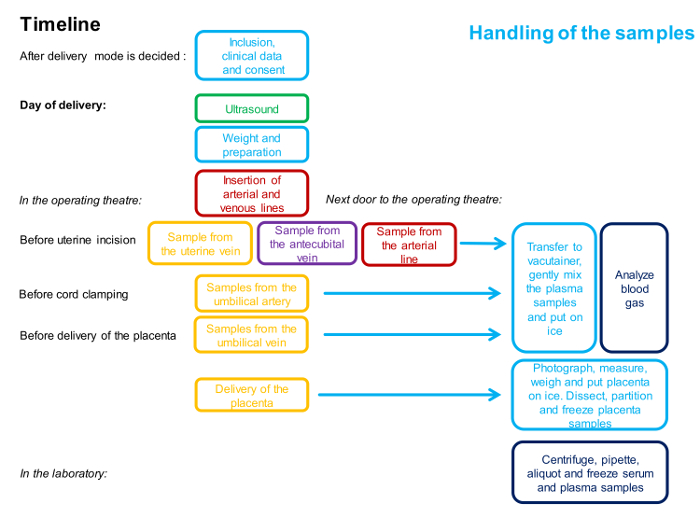
الشكل 1 : مخطط انسيابي يوضح التوقيت والموظفين المشاركين في إجراءات أخذ العينات المكونة من 4 سفن.
لون واحد يمثل شخص واحد. ويرد وصف تفصيلي لهذه الطريقة في البروتوكول. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- العاملين
- تأكد من توافر جميع الموظفين المطلوبين: أخصائي في مجال الجنين ذوي المهارات العالية إجراء قياسات الموجات فوق الصوتية، واثنين من أطباء التوليد إجراء الجراحة، واحدة من أطباء التوليد واثنين من الممرضات جمع العينات، ومساعد واحد التعامل مع تحليلات غازات الدم ومساعد واحد التعامل مع عينات أخرى متتالية وفورية بعد التحصيل.
ملاحظة: في حالات مجموعة أكثر تقدما من الأنسجة المشيمة، مطلوب شخص إضافي. - الرجعية
- إعداد المعدات، 50 مل من الجليد الباردة 1 M الفوسفات مخزنة المالحة (بس)، 25 مل من الحمض النووي الريبي الباردة استقرار الحل و 5 × 0.5 مل من الأمثل مجمع درجة الحرارة القطع (أكتوبر). تسمية فاكوتينرز والأنابيب. انظر قائمة مؤقتة من المعدات.
2. الخصائص الأمومية
- تسجيل الخصائص السريرية وغير السريرية الأمهات في إدراج وتكرار الأسئلة ذات الصلة وليبما في ذلك الوزن، في وقت التسليم. تسجيل مدة فترة الصيام قبل العملية القيصرية، وأي حلقات خافضة للضغط تحدث أثناء الجراحة.
ملاحظة: تضمين الحد الأدنى من البيانات السريرية الأمهات ذكرت في منشور صدر مؤخرا من الحمل العالمي كولابوراتوري (كولاب). تتضمن هذه المقالة أيضا بعض الجوانب الهامة جدا في اختيار مجتمع الدراسة وينبغي معالجتها أثناء التخطيط للدراسة 18 . - النظر في تسجيل الخصائص الأبوية، بما في ذلك الإثنية والعمر ومؤشر كتلة الجسم (بمي).
3. الموجات فوق الصوتية
- إجراء فحص الموجات فوق الصوتية دوبلر في يوم التسليم، مع النساء في حالة الصيام. إجراء الفحص خلال فترة من الاجهاد الجنين، مع امرأة في موقف شبه ضعيف، يميل قليلا عكسيا عكسيا إلى المنطقة ذات الاهتمام من أجل تجنب ضغط الشريان الأبهر والوريد الأجوف. مراقبة الإخراج فيمن خلال المؤشرات الميكانيكية والحرارية على الشاشة.
- الوريد السري
- تصور الوريد السري في ترانزكتيون سهمي أو منحرف من بطن الجنين. قياس القطر الداخلي للسفينة في الجزء المستقيم من الوريد السري داخل البطن، قبل أي فروع مرئية. استخدام العادية B- وضع وتصور السفينة في زاوية عمودي عمودي لقياسات القطر والحفاظ على العديد من الإطارات المثلى للقياسات في وقت لاحق لتقليل تأثير التغيرات قطرها نابض.
- كرر القياسات خمس إلى عشر مرات 19 .
- في نفس الموقع، استخدم الموجات فوق الصوتية دوبلر وضبط المسبار للحصول على زاوية التجفير منخفضة قدر الإمكان (دائما <30 درجة) من أجل قياس متوسط السرعة القصوى (تامكس). الحصول على سرعة على مدى 3-5 سنوات (تدفق غير نابض).
- تصور الوريد السري في ترانزكتيون سهمي أو منحرف من بطن الجنين. قياس القطر الداخلي للسفينة في الجزء المستقيم من الوريد السري داخل البطن، قبل أي فروع مرئية. استخدام العادية B- وضع وتصور السفينة في زاوية عمودي عمودي لقياسات القطر والحفاظ على العديد من الإطارات المثلى للقياسات في وقت لاحق لتقليل تأثير التغيرات قطرها نابض.
- الشريان الرحمي
- استخدام دوبلرالموجات فوق الصوتية لتصور الشريان الرحمي كما يعبر الشريان الحرقفي الخارجي، مباشرة بعد فروعه من الشريان الحرقفي الداخلي. اضبط المسبار في هذا الموقع للحصول على زاوية انحناء منخفضة (دائما <30 °) وقياس تامكس. الحصول على سرعة وسرعة متوسطة من ثلاث دورات القلب.
- وبما أنه من غير المحتمل أن تحصل على زاوية عمودي في نفس الموقع الذي تقاس فيه تامكس، اتبع السفينة بشكل منفصل للحصول على زاوية صحيحة لقياسات القطر أقرب إلى مواقع قياسات القطر كما يمكن تحقيقه. استبعاد القياسات القطر إذا أي فروع مرئية قبالة قبالة هذا الموقع كما تم تقييمها من قبل الموجات فوق الصوتية دوبلر اللون.
- استخدام العادية B- وضع وتصور السفينة في زاوية عمودي عمودي لقياسات القطر والحفاظ على العديد من الإطارات المثلى للقياسات في وقت لاحق لتقليل تأثير التغيرات قطرها نابض.
- كرر القياسات خمس إلى عشر مرات 19 .
- لاحظ موقف المشيمة.
4. 4-سفينة الدم أخذ العينات
ملاحظة: يتم توضيح الجدول الزمني للإجراءات في الشكل 1 ويوضح لمحة عامة عن العينات في الشكل 2 .
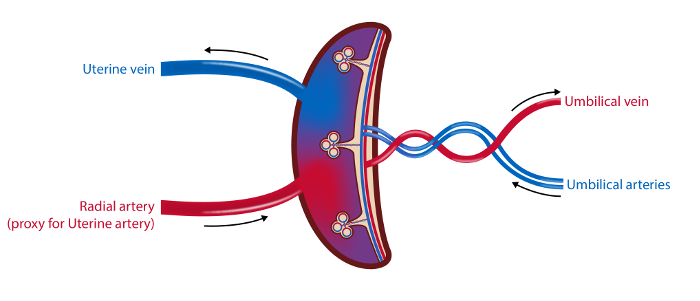
الشكل 2 : رسم تخطيطي من الأوعية الدموية المشيمة ومواقع أخذ العينات.
في طريقة أخذ العينات من 4 سفن يتم سحب عينات الدم من الوريد الرحمي، والشريان الكعبري (كبديل لشريان الرحم) والشرايين والوريد السري. يتم قياس تدفق الدم في الشريان الرحمي والوريد السري بالموجات فوق الصوتية. يتم جمع عينات الأنسجة من المشيمة. التوضيح: Øystein H. هورغمو، جامعة أوسلو.5847fig2large.jpg "تارجيت =" _ بلانك "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- إجراءات السلامة
- توفير جميع الموظفين في مسرح العمليات مع قفازات، الدعاوى فرك الجراحية، أقنعة وأغطية الرأس.
- توفير الجراحين وموظفي البحوث في اتصال مع حقل العملية مع الدعاوى فرك الجراحية، والأقنعة، وأغطية الرأس والعباءات والقفازات المزدوجة. النظارات اختيارية.
- توفير الموظفين التعامل مع عينات الدم مع القفازات.
- توفير الموظفين التعامل مع عينات المشيمة مع القفازات والقناع الجراحي. التجانس يتطلب استخدام اغطية.
- إعداد في مسرح العمليات
- إعطاء إحاطة وتسليم المعدات لجميع الموظفين الذين سيساعدون أخذ العينات قبل بدء الجراحة.
- معالجة طبيب التخدير وممرضة التخدير الذين سيساعدون على الوصول الطرفية والشرياني الطرفية اللازمة، وضمان أنلا يتم إعطاء السوائل عن طريق الوريد قبل أخذ العينات.
- إعطاء ثلاثة محاقن (10 مل) دون إبر إلى الشخص الذي يساعد في عينة الوريد أنتيكوبيتال واثنين من المحاقن (واحد 20 مل واحد 10 مل) وحقنة غازات الدم واحدة (مع الهيبارين) إلى الشخص الذي يساعد في الشريان الكعبري.
- إعداد محاقن معقمة (20 مل)، وخمسة محاقن معقمة (10 مل)، وثلاثة "إبرة فراشة" واثنين من محاقن غازات الدم لحقل العملية.
- الوصول إلى الأوعية الدموية.
- اتبع الإجراء القياسي قبل العملية القيصرية لضمان الطرفية عن طريق الوريد (الرابع) الوصول.
ملاحظة: الوريد أنتيكوبيتال هو الأفضل لأنه من الأسهل لرسم عينات من هذا الموقع. - توطين الشريان الكعبري في المعصم عن طريق الموجات فوق الصوتية أو عن طريق ملامسة. بعد 0.5 مل من تحت الجلد يدوكائين تسكين، وضع خط الشرايين في الشريان الكعبري. التخلي عن أخذ العينات من هذا الموقع في حالة ثلاثة إدراج فاشلة، أوإذا كانت المرأة تعاني من الألم أثناء الإدراج.
ملاحظة: إجراء الإجراء الجراحي من العملية القيصرية وفقا للإجراءات القياسية. ولا یبین أدناه سوى التعدیلات اللازمة لإجراء المعاینة.
- اتبع الإجراء القياسي قبل العملية القيصرية لضمان الطرفية عن طريق الوريد (الرابع) الوصول.
- عينات الدم الأم
ملاحظة: الحصول على جميع عينات الدم الأم ثلاثة (الوريد الرحمي، والشريان الكعبري والوريد أنتيكوبيتال) في وقت واحد قبل شق الرحم.- لورم الرحم، بعد فتح تجويف البطن، واستخدام ضام لرفع جدار البطن وفضح الفروع الرئيسية من الأوردة الرحمية على الجانبين الأمامي الوحشي للرحم. الحصول على الدم من فروع الوريد الرحمي في نفس الجانب كما المشيمة كلما كان ذلك ممكنا أو استخدام أبرز الضفيرة الوريد إذا كان المشيمة يقع في خط الوسط الرحم.
- إدراج إبرة فراشة على حقنة غازات الدم في الوريد الرحمي في زاوية من حوالي 30 درجة وجمع الدم من خلال طموح لطيف لتجنبانحلال الدم. في حين أن بعناية تأمين الموقف الرابع من إبرة الفراشة، استبدال محقنة غازات الدم مملوءة من قبل 20 مل و 10 مل حقنة على التوالي.
ملاحظة: أفضل ضمان الوصول الأمثل عند الوقوف على الجانب المقابل من الوريد الرحم المختار.
- إدراج إبرة فراشة على حقنة غازات الدم في الوريد الرحمي في زاوية من حوالي 30 درجة وجمع الدم من خلال طموح لطيف لتجنبانحلال الدم. في حين أن بعناية تأمين الموقف الرابع من إبرة الفراشة، استبدال محقنة غازات الدم مملوءة من قبل 20 مل و 10 مل حقنة على التوالي.
- للشريان الكعبري، نضح من خط داخل الشرايين. تجاهل أول 5 مل، ثم نضح 3 مل في حقنة الهيبارين لتحليل غازات الدم، تليها 3 مل في اثنين من المحاقن (20 + 10 مل).
- لالوريد أنتيكوبيتال، نضح بلطف من القسطرة في الوريد. تجاهل أول 5 مل، ثم نضح 30 مل في ثلاثة محاقن (10 مل).
- إجراء فحص نهائي لموقع أخذ العينات على الوريد الرحمي قبل البدء في إغلاق البطن.
- لورم الرحم، بعد فتح تجويف البطن، واستخدام ضام لرفع جدار البطن وفضح الفروع الرئيسية من الأوردة الرحمية على الجانبين الأمامي الوحشي للرحم. الحصول على الدم من فروع الوريد الرحمي في نفس الجانب كما المشيمة كلما كان ذلك ممكنا أو استخدام أبرز الضفيرة الوريد إذا كان المشيمة يقع في خط الوسط الرحم.
- عينات دم الجنين
- عندما يولد الطفل، على الفور نضح الدم من الشريان السري، دون لقط الحبل السري أو تسليم المشيمة. بدء الطرافةساعة المحقنة لتحليل غازات الدم، واتبع مع ثلاثة محاقن 10 مل إذا كان ذلك ممكنا.
- عندما يتم تأمين عينات الشرايين، المشبك الحبل وتسليم الطفل إلى القابلة قبل أخذ العينات من الوريد السري (غازات الدم و 20 + 10 مل المحاقن).
ملاحظة: الحصول على جميع العينات السري في غضون ثوان من الولادة ومع المشيمة في الموقع إلا إذا كان قد فصل تلقائيا. - اتبع التوصيات النرويجية على لقط الحبل في وقت متأخر. في حالة الطفل المضطرب، المشبك و قطع الحبل فورا و يد الطفل إلى القابلة و حديثي الولادة.
- معالجة عينات الدم
- وضع محاقن غازات الدم على الجليد أثناء إعداد بقية عينات الدم، وتحليلها في محلل غازات الدم في غضون 5 دقائق.
- نقل عينات الدم فورا إلى فاكوتينرز ووضع أنابيب البلازما على الروك لمدة 1-2 دقائق قبل وضعها على الجليد. ترك أنابيب المصل على العملأتوري مقاعد البدلاء لتسوية لمدة 30 دقيقة.
ملاحظة: هذه خطوة حاسمة في الإجراء الذي يحتاج إلى مزيد من الاهتمام لأن العينات من جميع المواقع الخمسة يجب أن تكون مستعدة في وقت واحد لضمان نوعية جيدة. - الطرد المركزي عينات البلازما في أقرب وقت ممكن، وضمن 30 دقيقة، في 6 درجات مئوية، 2500 x ج لمدة 20 دقيقة.
- بعد 30 دقيقة، الطرد المركزي عينات المصل في درجة حرارة الغرفة لمدة 10 دقيقة في 2500 × ز.
- قسامة سوبيرناتانتس بعناية إلى 2 مل أنابيب كريو، وترك 0.5 مل من طاف فوق بيليه لضمان البلازما الصفائح الدموية الحرة.
- تخزين العينات في -80 درجة مئوية.
5. مجموعة من الأنسجة المشيمة
- وضع شقة المشيمة أسفل على الجليد الجليد تشريح صينية في أقرب وقت ممكن بعد أن تم تسليمها. تصوير وقياس أطول قطر وقطرها في 90 درجة.
- تزن المشيمة.
- سجل الوزن، وهما أقطار، أي زروس علم الأمراض، وعدد من السفن في الحبل والفاصل الزمني من التسليم إلى متى وضعت المشيمة على الجليد.
ملاحظة: إرسال المشيمة إلى الفحص المرضي إذا أشار سريريا. - وضع المشيمة مع سطح الأم تواجه ما يصل وتحديد 4-5 مواقع أخذ العينات تقع عشوائيا في كل رباعي من المشيمة، وتجنب مجالات علم الأمراض الصريح. إزالة الساقط باستخدام مقص لخفض بعيدا 3-5 ملم من سطح الأمهات. جمع 1-2 سم 3 قطعة من الأنسجة الزغابة من كل موقع.
- غسل الأنسجة التي تم جمعها بلطف في 50 مل من 1M الباردة بس. تقسيم إلى عدة قطع من كل موقع أخذ العينات وقسامة.
ملاحظة: حجم قطع المشيمة يعتمد على التحليلات المخطط لها. - إضافة أليكوتس من 0.1 - 0.5 سم 3 عينات الأنسجة إلى 5 أنابيب كريو والتجميد المفاجئة في النيتروجين السائل.
- إضافة قطع صغيرة من 0.1 - 0.2 سم 3 إلى أنبوب مع 25 مل من الحمض النووي الريبي حل الاستقرار. تخزين في 46؛ C لمدة 24 ساعة، وتجاهل الحل استقرار الحمض النووي الريبي واستبدالها. تجميد.
- إضافة قطعة من 0.5 سم 3 إلى 5 أنابيب كريو مع 0.5 مل من أكتوبر، أعلى مع أكتوبر، مزيج وتجميد.
- تخزين العينات في -80 درجة مئوية حتى التحليل.
ملاحظة: بيرتون وآخرون. يوفر نظرة عامة ممتازة من الجوانب العملية لأخذ العينات المشيمة اعتمادا على التحليلات المخطط لها. 20 النظر في إعداد الأنسجة المتبقية لعزل الأغشية الصغيرة والأغشية القاعدية، وجمع الأنسجة الساقط عن طريق تقنية شفط فراغ. 21 ، 22
6. خصائص حديثي الولادة
- تسجيل خصائص حديثي الولادة، بما في ذلك أبغار النتيجة (1 و 5 و 10 دقيقة) والجنس والوزن والطول وعمر الحمل والقبول في وحدة العناية المركزة للمواليد (طول ونتائج الإقامة).
- النظر في قياس تكوين الجسم حديثي الولادة عن طريق قياسات أنثروبوميتريك، تهجير الهواءأو منحنى قياس الأشعة السينية المزدوجة. 23 ، 24
7 - الحسابات
- نفترض تكوين الدم مماثلة في الشريان الكعبري والرحمي وحساب ورتي بلاسنتال شرياني الفرق الفرق.
أوتيروبلاسنتال الشرياني تركيز الفرق = C A - C V
الوريدي السري - الفرق تركيز الشرايين = C الخامس - C أ
حيث C هو التركيز مع سوبسكريبتس: A، والشريان الكعبري. الخامس، الوريد الرحمي. v الوريد السري و، الشريان السري. - حساب حجم تدفق الدم، مل / دقيقة (س):
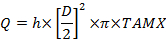
حيث D هو قطر السفينة (سم)، تامكس هو الوقت المتوسط السرعة القصوى و h هو معامل لملامح سرعة الدم المكانية. استخدام 0.5 كمعامل الوريد السري و0.6 للشريان الرحمي 25 ، 26 . - حساب امتصاص المشيمة والافراج وفقا لمبدأ فيك:
امتصاص أوتيروبلاسنتال = ( C A - C V ) x قم
امتصاص الجنين = ( C v - C a ) x Q f
سوبسكريبتس: m، الأم و f، الجنين.
النتائج
طريقة أخذ العينات من 4 سفن قابلة للتطبيق في الممارسة السريرية، وحصلنا بنجاح على عينات دم من 209 أم / رضيع. في 128 من هذه حققنا أيضا لقياس حجم تدفق الدم. تم الحصول على عينات كاملة 4-السفينة وقياسات تدفق نوعية جيدة من كل من الأم والجنين الأوعية في 70 أزواج الأ...
Discussion
طريقة أخذ العينات من 4 أوعية للمشيمة ذات صلة بثلاثة أغراض رئيسية. أولا، يمكن استخدامه لدراسة كيفية تناول المواد المحددة من قبل المشيمة على الجانب الأمهات وربما نقلها إلى الدورة الدموية السري والجنين، كما يتضح من الجلوكوز والدراسات الأحماض الأمينية لدينا. ثانيا، ...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
أولا وقبل كل شيء، نشكر بصدق الأمهات اللاتي شاركن في هذا المشروع. بعد ذلك، نعترف بجميع الموظفين الذين ساعدوا ويسهلوا إجراءات أخذ العينات، طبيب التخدير، طبيب التخدير ممرضة والممرضات الجراحية. ولم يكن ممكنا تحقيق هذا المشروع دون تمويل من هيئة الصحة الإقليمية في جنوب شرق النرويج والوحدة الاستشارية النرويجية المعنية بصحة المرأة، وجامعة أوسلو، والتمويل المحلي المقدم من مستشفى جامعة أوسلو.
Materials
| Name | Company | Catalog Number | Comments |
| Maternal body composition | |||
| Impedance scale | Tanita | or similar | |
| Ultrasound measurements | |||
| Sequoia 512 ultrasound machine | Acuson | equipped with a curved transducer with colour and pulsewave Doppler (frequency bandwidth 2-6 MHz) | |
| Blood samples | |||
| Arerial cannula | BD Medical | 682245 | or similar |
| 20cc Eccentric Luer Tip Syringe without Needle | Termo | SS-20ES | or similar. 3 needed. |
| 10cc Eccentric Luer Tip Syringe without Needle | Termo | SS-10ES | or similar. 9 needed. |
| 5cc 6% Luer Syringe without Needle | Termo | SS-05S1 | or similar. 2 needed. |
| Arterial blood gas syringe | Radiometer Medical | or similar. 4 needed. | |
| Sterile winged needle connected to flexible tubing, 21 gauge | Greiner Bio-One | 450081 | (intended for single use).3 needed. |
| Vacutainer tube 6 mL EDTA | Greiner Bio-One | 456043 | or similar. Label with sample site. 10 needed. |
| Vacutainer tube 5 ml LH Lithium Heparin Separator | Greiner Bio-One | 456305 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 6 mL Serum Clot Activator | Greiner Bio-One | 456089 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 3 ml 9NC Coagulation sodium citrate 3,2% | Greiner Bio-One | 454334 | or similar. Label with sample site. 5 needed. |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site, serum/type of plasma and ID. 90 needed. |
| Marked trays to transport the syringes | to transport the blood samples in the operation theatre | ||
| Rocker | for gentle mixing of the samples | ||
| Ice | in styrofoam box | ||
| Liquid nitrogen | in appropriate container | ||
| Placenta samples | |||
| Metal tray | |||
| Ice | in styrofoam box | ||
| Calibrated scale | |||
| Metal ruler | |||
| 1 M Phosphate buffered saline | Sigma | D1408 | or similar. Dilute 10 M to 1M before use |
| RNA stabilization solution | Sigma | R0901-500ML | or similar |
| Optimal Cutting Temperature (O.C.T.) compound | vwr | 361603E | or similar |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site. content and ID. 10 needed. |
| Centrifuge tubes, conical bottom 50 mL | Greiner Bio-One | 227,285 | or similar. Label with "RNA later", sample site and ID. 2 needed. |
| Liquid nitrogen | in appropriate container | ||
| Fetal body composition | |||
| Calibrated scale | |||
| Measuring tape |
References
- Jansson, T., Powell, T. L. Role of the placenta in fetal programming: underlying mechanisms and potential interventional approaches. Clin Sci (Lond). 113 (1), 1-13 (2007).
- Hanson, M. A., Gluckman, P. D. Early developmental conditioning of later health and disease: physiology or pathophysiology. Physiol Rev. 94 (4), 1027-1076 (2014).
- Guttmacher, A. E., Spong, C. Y. The human placenta project: it's time for real time. Am J Obstet Gynecol. 213, 3-5 (2015).
- Battaglia, F. C., Regnault, T. R. Placental transport and metabolism of amino acids. Placenta. 22 (2-3), 145-161 (2001).
- Hay, W. W. Placental-fetal glucose exchange and fetal glucose metabolism. Trans Am Clin Climatol Assoc. 117, 321-339 (2006).
- Woollett, L. A. Review: Transport of maternal cholesterol to the fetal circulation. Placenta. 32, 218-221 (2011).
- Prenton, M. A., Young, M. Umbilical vein-artery and uterine arterio-venous plasma amino acid differences (in the human subject). J Obstet Gynaecol Br Commonw. 76 (5), 404-411 (1969).
- Cetin, I., et al. Plasma and erythrocyte amino acids in mother and fetus. Biol Neonate. 60 (2), 83-91 (1991).
- Filshie, G. M., Anstey, M. D. The distribution of arachidonic acid in plasma and tissues of patients near term undergoing elective or emergency Caesarean section. Br J Obstet Gynaecol. 85 (2), 119-123 (1978).
- Haberey, P. P., Schaefer, A., Nisand, I., Dellenbach, P. The fate and importance of fetal lactate in the human placenta -a new hypothesis. J Perinat Med. 10 (2), 127-129 (1982).
- Prendergast, C. H., et al. Glucose production by the human placenta in vivo. Placenta. 20 (7), 591-598 (1999).
- Metzger, B. E., Rodeck, C., Freinkel, N., Price, J., Young, M. Transplacental arteriovenous gradients for glucose, insulin, glucagon and placental lactogen during normoglycaemia in human pregnancy at term. Placenta. 6 (4), 347-354 (1985).
- Zamudio, S., et al. Hypoglycemia and the origin of hypoxia-induced reduction in human fetal growth. PLoS One. 5 (1), 8551 (2010).
- Holme, A. M., Roland, M. C., Lorentzen, B., Michelsen, T. M., Henriksen, T. Placental glucose transfer: a human in vivo study. PLoS One. 10 (2), 0117084 (2015).
- Holme, A. M., Roland, M. C., Henriksen, T., Michelsen, T. M. In vivo uteroplacental release of placental growth factor and soluble Fms-like tyrosine kinase-1 in normal and preeclamptic pregnancies. Am J Obstet Gynecol. 215 (6), 781-782 (2016).
- Paasche Roland, M. C., Lorentzen, B., Godang, K., Henriksen, T. Uteroplacental arterio-venous difference in soluble VEGFR-1 (sFlt-1), but not in soluble endoglin concentrations in preeclampsia. Placenta. 33 (3), 224-226 (2012).
- Brar, H. S., et al. Uteroplacental unit as a source of elevated circulating prorenin levels in normal pregnancy. Am J Obstet Gynecol. 155 (6), 1223-1226 (1986).
- Myatt, L., et al. Strategy for standardization of preeclampsia research study design. Hypertension. 63 (6), 1293-1301 (2014).
- Kiserud, T., Rasmussen, S. How repeat measurements affect the mean diameter of the umbilical vein and the ductus venosus. Ultrasound Obstet Gynecol. 11 (6), 419-425 (1998).
- Burton, G. J., et al. Optimising sample collection for placental research. Placenta. 35 (1), 9-22 (2014).
- Illsley, N. P., Wang, Z. Q., Gray, A., Sellers, M. C., Jacobs, M. M. Simultaneous preparation of paired, syncytial, microvillous and basal membranes from human placenta. Biochim Biophys Acta. 1029 (2), 218-226 (1990).
- Staff, A. C., Ranheim, T., Khoury, J., Henriksen, T. Increased contents of phospholipids, cholesterol, and lipid peroxides in decidua basalis in women with preeclampsia. Am J Obstet Gynecol. 180 (3), 587-592 (1999).
- Catalano, P. M., Thomas, A. J., Avallone, D. A., Amini, S. B. Anthropometric estimation of neonatal body composition. Am J Obstet Gynecol. 173 (4), 1176-1181 (1995).
- Ellis, K. J., et al. Body-composition assessment in infancy: air-displacement plethysmography compared with a reference 4-compartment model. Am J Clin Nutr. 85 (1), 90-95 (2007).
- Haugen, G., Kiserud, T., Godfrey, K., Crozier, S., Hanson, M. Portal and umbilical venous blood supply to the liver in the human fetus near term. Ultrasound Obstet Gynecol. 24 (6), 599-605 (2004).
- Acharya, G., et al. Experimental validation of uterine artery volume blood flow measurement by Doppler ultrasonography in pregnant sheep. Ultrasound Obstet Gynecol. 29 (4), 401-406 (2007).
- Wu, X., et al. Glutamate-glutamine cycle and exchange in the placenta-fetus unit during late pregnancy. Amino Acids. 47 (1), 45-53 (2015).
- Tuckey, R. C. Progesterone synthesis by the human placenta. Placenta. 26 (4), 273-281 (2005).
- Simmons, M. A., Meschia, G., Makowski, E. L., Battaglia, F. C. Fetal metabolic response to maternal starvation. Pediatr Res. 8 (10), 830-836 (1974).
- Simmons, M. A., Jones, M. D., Battaglia, F. C., Meschia, G. Insulin effect on fetal glucose utilization. Pediatr Res. 12 (2), 90-92 (1978).
- Bujold, E., et al. Evidence supporting that the excess of the sVEGFR-1 concentration in maternal plasma in preeclampsia has a uterine origin. J Matern Fetal Neonatal Med. 18 (1), 9-16 (2005).
- Jansson, T., Aye, I. L., Goberdhan, D. C. The emerging role of mTORC1 signaling in placental nutrient-sensing. Placenta. 33, 23-29 (2012).
- Cetin, I. Placental transport of amino acids in normal and growth-restricted pregnancies. Eur J Obstet Gynecol Reprod Biol. 110, 50-54 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved