このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト胎盤生理学の統合研究への4容器サンプリングアプローチ
要約
我々は、期間中にインビボでヒト胎盤生理学を研究するための詳細な方法を提示する。本方法は、胎盤の母体側および胎児側の入ってくる血管および出る血管から採取した血液採取と、体積血流および胎盤組織サンプリングの超音波測定とを組み合わせる。
要約
人間の胎盤はまだ子宮内にある間、研究のために非常にアクセスすることができません。従って、インビボでのヒト胎盤生理学の現在の理解は、胎盤の解剖学的構造、血行力学および妊娠期間における種間の多様性にもかかわらず、主に動物研究に基づいている。ヒト胎盤研究の大部分は、 ex vivo灌流研究またはin vitro栄養膜研究である。 インビトロ研究および動物モデルは必須であるが、in vivoでのヒト胎盤へのそのような研究からの結果の外挿は不確実である。我々は、期間中にヒト胎盤生理学をインビボで研究し、その方法の詳細なプロトコールを提示することを目指した。計画された帝王切開期間中に子宮切開の直前に子宮静脈への腹腔内アクセスを利用して、我々は胎盤の母体および胎児側の入来および出血血管から血液サンプルを収集する。コンを組み合わせるとき血漿中の血中濃度を測定することにより、胎盤および胎児への取り込みおよび放出を定量化することができる。さらに、同じ母親 - 胎児対からの胎盤組織試料は、トランスポーター密度および活性ならびに胎盤機能の他の局面のインビボでの測定を提供することができる。この4容器サンプリング法のこの統合的な使用により、正常妊娠および病理学的妊娠の両方において、インビボでの胎盤栄養素移動および代謝の現在の概念のいくつかを試験することができる。さらに、この方法は、胎盤機能不全のバイオマーカーの探索に重要な貢献であり得る、胎盤によって分泌される物質の母体循環への同定を可能にする。
概要
健康、米国の国立研究所によると、胎盤は、人体1、2、3で最もよく理解器官です。進行中の妊娠に非倫理的リスクを課すことなく、インビボでヒト胎盤にアクセスして研究することは困難である。したがって、ヒトにおける胎盤機能の研究は、主に、インビトロおよびエクスビボモデルに基づく。胎盤輸送および代謝のインビボ研究において以前の大部分は、6匹の動物が 4、5で行われています。しかし、胎盤の構造や機能は種間でかなり異なるため、動物からヒトへの結果の外挿は慎重に行わなければなりません。ほんの少しのヒトのインビボ研究で、正常な生理学的条件下での胎盤および胎児の摂取および輸送を調べたら条件、及びどれがいくつかの化合物7、8、9、10、11、12、13の統合された転送を探求してきました。これらの基礎研究は、ヒト胎盤のin vivo研究が実現可能であり、それらがいくつかの目的に役立つことを示している。第1に、主にインビトロ 、 エクスビボおよび動物研究から得られる現在の胎盤機能の概念をヒトの環境で試験し、ヒトの胎盤に対する新規かつより特異的な洞察を提供することができる。第2に、異常な胎児の成長、子癇前症、母体糖尿病、メタボリックシンドロームおよび他の母体の代謝障害に関連する機能不全の胎盤の特性をよりよく特徴付けることができる。第三に、ヒトのインビボ研究は、診断を開発する機会を提供するチック、および胎盤機能の予測ツールである。
この背景で我々は、in vivoでのヒト胎盤機能を調査するための生理学的データの包括的なコレクションを確立することを目指した。計画された帝王切開期間中に、我々は子宮静脈への腹腔内アクセスを利用して、胎盤の母体および胎児側の入来および出血血管から血液サンプルを収集する(4血管サンプリング法)。これらの試料は、栄養素および他の物質の対の動静脈濃度差を計算するために使用される14 。さらに、我々は、超音波によって胎盤の両側のボリューム血流量を測定する。その結果、任意の化合物の胎盤および胎児への取り込みを定量化することができる。また、母体と胎児の循環15、16、17に胎盤によって放出される物質を決定することが可能です。結合するとき胎盤および他の関連組織の分析から、この方法は、同じ母親と胎児の対においてインビボでの胎盤機能の多くの局面を統合する潜在的可能性を有する。
プロトコル
研究はオスロ大学病院のデータ保護関係者と南ノルウェー南部ノルウェーの医療健康研究倫理委員会によって承認されました。すべての参加者は、包括的な書面による同意書に署名した。
1.準備
注:手順のタイムラインは図1に概説されています 。
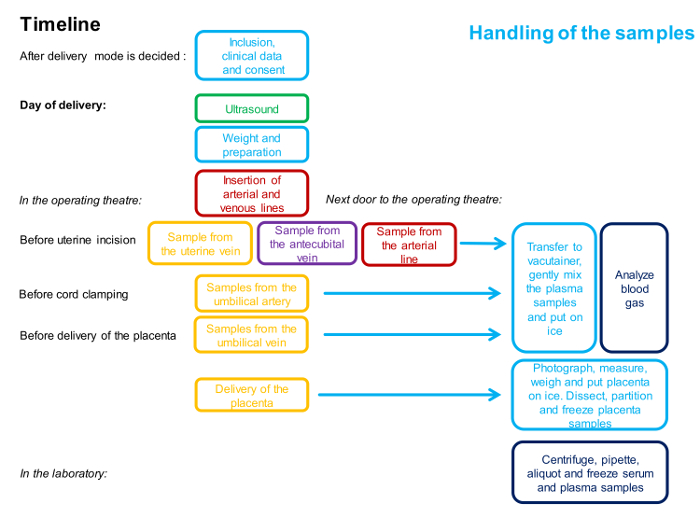
図1 : 4容器サンプリング手順に関わるタイミングと人員を説明するフローチャート。
1色は1人を表します。この方法の詳細な説明は、プロトコルに記載されている。 この図の拡大版を見るには、ここをクリックしてください。
- スタッフ
- 超音波測定を行う高度に熟練した胎児医学専門医、手術を行う産科医2名、産科医の1人、検体を採取する2名の看護師、血液ガス分析を担当する1名の助手、他のサンプルは連続して収集の直後に収集されます。
注:より高度な胎盤組織の収集の場合、追加の人が必要です。
- 超音波測定を行う高度に熟練した胎児医学専門医、手術を行う産科医2名、産科医の1人、検体を採取する2名の看護師、血液ガス分析を担当する1名の助手、他のサンプルは連続して収集の直後に収集されます。
- 装置
- 装置、氷冷1Mリン酸緩衝生理食塩水(PBS)50 mL、冷RNA安定化溶液25 mL、最適切削温度化合物(OCT)5 mLを5 mL準備する。 vacutainersとチューブにラベルを付けます。機器の仮一覧を参照してください。
2.母性
- 母親の臨床的および非臨床的特徴を包括的に記録し、関連する質問と私を繰り返す配送時には、重量を含む服薬基準を満たしていなければなりません。帝王切開前の絶食期間、および手術中に発生する低血圧のエピソードを記録する。
注:グローバル妊娠コラボレーション(COLAB)の最近の刊行物に報告されている母親の臨床データセットの最小値を含めてください。また、この記事では、研究集団を選択する際にいくつかの非常に重要な側面を有しており、研究18を計画する際に対処する必要があります。 - 民族性、年齢、体格指数(BMI)などの父性の特徴を記録することを検討する。
3.超音波
- 空腹状態の女性と一緒に、配達の日にドップラー超音波検査を行います。大動脈と大静脈の圧迫を避けるために、仰臥位の女性が胎児の静止期に検査を行い、関心領域に対してわずかに横方向に傾けた。の出力を監視するディスプレイ上の機械的および熱的指標による強度の変化。
- 臍静脈
- 臍の静脈を胎児の腹部の矢状または斜めの切開部で視覚化する。目に見える枝の前に、腹腔内臍静脈の直線部分の内部血管直径を測定する。定期的なBモードを使用し、直径測定のために垂直のインボネーション角度で血管を視覚化し、拍動性の直径変化の影響を最小限に抑えるために、後の測定のためにいくつかの最適なフレームを維持する。
- 測定を5〜10回繰り返す19 。
- 同じサイトで、ドップラー超音波を使用し、時間平均平均速度(TAMX)を測定するために、インボーション角ができるだけ小さい(常に<30°)ようにプローブを調整します。 3〜5秒間の速度を得る(非脈動流)。
- 臍の静脈を胎児の腹部の矢状または斜めの切開部で視覚化する。目に見える枝の前に、腹腔内臍静脈の直線部分の内部血管直径を測定する。定期的なBモードを使用し、直径測定のために垂直のインボネーション角度で血管を視覚化し、拍動性の直径変化の影響を最小限に抑えるために、後の測定のためにいくつかの最適なフレームを維持する。
- 子宮動脈
- ドップラーを使う子宮動脈が内腸骨動脈から分岐した直後に、それが外腸骨動脈を横切る際に子宮動脈を視覚化するための超音波を提供する。この部位のプローブを調整して低インポーション角(常に<30°)を得、TAMXを測定します。 3心拍の平均速度として速度を求める。
- TAMXが測定されるのと同じ部位で垂直角を得ることはまずないので、直径測定の部位に近い正しい角度を得るために遠位に血管を追跡する。カラードップラー超音波で評価したところで、この部位の前に目に見える血管が枝分かれする場合は、直径の測定値を除外する。
- 定期的なBモードを使用し、直径測定のために垂直のインボネーション角度で血管を視覚化し、拍動性の直径変化の影響を最小限に抑えるために、後の測定のためにいくつかの最適なフレームを維持する。
- 測定を5〜10回繰り返す19 。
- 胎盤の位置に注意してください。
4. 4血管血液サンプリング
注:手順のタイムラインは図1に概略が示されており、サンプルの概要は図2に示されています 。
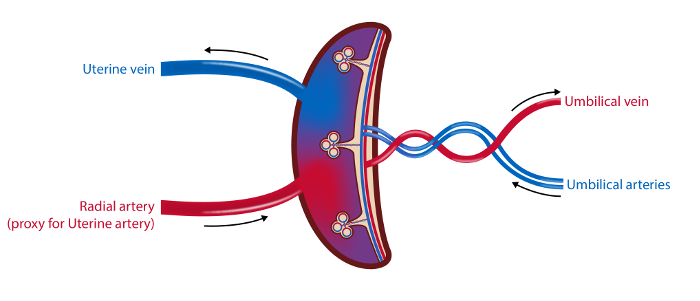
図2 : 胎盤脈管構造および採取部位の模式 図 。
4容器サンプリング法では、血液サンプルを子宮静脈、橈骨動脈(子宮動脈のプロキシとして)および臍動脈および静脈から採取する。子宮動脈および臍静脈の血流を超音波で測定する。胎盤由来の組織サンプルを収集する。イラスト:ØysteinH. Horgmo、オスロ大学。5847fig2large.jpg "target =" _ blank ">この図の拡大版を見るには、ここをクリックしてください。
- 安全手順
- 作業劇場のすべての要員に手袋、外科用スクラブスーツ、マスク、帽子を提供する。
- 外科医、研究スタッフに手術用スクラブスーツ、マスク、帽子、ガウン、ダブルグローブを提供する。メガネはオプションです。
- 血液サンプルを手袋で取り扱う人員を提供する。
- 胎盤試料を手袋と外科用マスクで取り扱う人員を提供する。均質化のためには、フードを使用する必要があります。
- オペレーションシアターでの準備
- ブリーフィングを行い、手術の開始前にサンプリングを補助するすべての要員に装置を渡す。
- 必要な末梢動脈および静脈アクセスを支援する麻酔科医および麻酔科看護婦に連絡し、サンプリング前に液体を静脈内に投与することはない。
- 橈骨動脈を補助する人に、前腕静脈サンプルを補助する人に2本のシリンジ(20mLと10mLの1つ)と1つの血液ガスシリンジ(ヘパリンを含む)を注射針で3本注射する。
- 2つの滅菌シリンジ(20 mL)、5つの滅菌シリンジ(10 mL)、3つの「バタフライニードル」および2つの血液ガスシリンジを操作領域用に準備する。
- 血管へのアクセス。
- 末梢静脈内(iv)アクセスを保証するために、帝王切開前の標準的な手順に従ってください。
注:このサイトからサンプルを抽出する方が簡単であるため、前胸静脈が好ましい。 - 超音波または触診によって橈骨動脈を手首に局在させる。 0.5mLの皮下リドカイン鎮痛の後、橈骨動脈に動脈ラインを配置する。挿入が3回失敗した場合は、このサイトからのサンプリングを中止するか、女性が挿入中に痛みを経験する場合。
注:標準的な手順に従って帝王切開の手術を行います。サンプリング手順に必要な調整だけが下に示されています。
- 末梢静脈内(iv)アクセスを保証するために、帝王切開前の標準的な手順に従ってください。
- 母体の血液サンプル
注:子宮切開の前に、3つの母体血液検体(子宮静脈、橈骨動脈および前胸静脈)を同時に採取する。- 子宮の静脈では、腹腔を開いた後、開創器を用いて腹壁を持ち上げ、子宮の主枝を子宮の前外側に露出させる。可能であれば、胎盤と同じ側の子宮静脈分枝から血液を採取するか、胎盤が子宮の正中線に位置する場合は最も顕著な静脈叢を使用する。
- 蝶静脈の血液ガスシリンジに約30度の角度でバタフライ針を挿入し、穏やかな吸引によって血液を採取しないでください溶血。バタフライ針の静脈の位置を注意深く確保しながら、充填した血液ガスシリンジを20mLシリンジと10mLシリンジで交互に交換します。
注:選択された子宮静脈の対側に立つとき、最適なアクセスが保証されます。
- 蝶静脈の血液ガスシリンジに約30度の角度でバタフライ針を挿入し、穏やかな吸引によって血液を採取しないでください溶血。バタフライ針の静脈の位置を注意深く確保しながら、充填した血液ガスシリンジを20mLシリンジと10mLシリンジで交互に交換します。
- 橈骨動脈については、動脈内ラインから吸引する。最初の5 mLを捨て、血液ガス分析のためにヘパリンシリンジで3 mLを吸引し、続いて2つのシリンジ(20 + 10 mL)で3 mLを吸引する。
- 前胸静脈については、静脈内カテーテルから静かに吸引する。最初の5 mLを捨て、3つのシリンジ(10 mL)で30 mLを吸引する。
- 腹部の閉鎖を開始する前に、子宮の静脈にある採取部位の最終検査を行います。
- 子宮の静脈では、腹腔を開いた後、開創器を用いて腹壁を持ち上げ、子宮の主枝を子宮の前外側に露出させる。可能であれば、胎盤と同じ側の子宮静脈分枝から血液を採取するか、胎盤が子宮の正中線に位置する場合は最も顕著な静脈叢を使用する。
- 胎児の血液サンプル
- 子供が生まれたときは、直ちに臍帯を締めたり、胎盤を娩出することなく、臍帯動脈から血液を吸引する。ウィットスタート血液ガス分析のためのシリンジを使用し、可能であれば3つの10mLシリンジに従ってください。
- 動脈検体が固定されたら、臍静脈からサンプリングする前に、コードをクランプして子供を助産師に渡す(血液ガスおよび20 + 10mLシリンジ)。
注:採取から数秒以内にすべての臍帯標本を採取し、自発的に分離しない限り、原位置で胎盤を採取する。 - レイトコードクランプに関するノルウェーの推奨事項に従ってください。悩んでいる子供の場合は、すぐにコードを締め付けて切断し、子供を助産師や新生児医に渡してください。
- 血液サンプルの取り扱い
- 残りの血液サンプルを調製しながら血液ガスシリンジを氷上に置き、5分以内に血液ガス分析装置で分析する。
- 血液検体をすぐにバキュテイナーに移し、氷上に置く前にロッカーに1〜2分間置く。血清チューブを労働に委ねるアトリエベンチを30分間安定させる。
注:これは5つのサイトすべてからのサンプルが良質を保証するために同時に準備されなければならないので、余分な注意が必要な手順の重要なステップです。 - できるだけ早く、30分以内に6℃、2,500 xgで20分間、血漿サンプルを遠心分離する。
- 30分後、血清サンプルを室温で2,500 x gで10分間遠心分離する。
- 上清を2mLの凍結チューブに慎重に分注し、血小板を含まない血漿を確保するためにペレットの上に0.5mLの上清を残す。
- 試料を-80℃で保存する。
5.胎盤組織の収集
- できるだけ早く、胎盤を氷冷した解剖皿に置いた後、胎盤を平らにします。 最長径と直径を90度で撮影して測定します。
- 胎盤を体重測定する。
- 重量、2つの直径、任意のgロスの病理、臍帯血管の数および送達から胎盤を氷上に置いた時までの時間間隔であった。
注:臨床的に示された場合、胎盤を病理学的検査に送る。 - 母体表面を上にして胎盤を置き、陽性病理の領域を避けて、胎盤の各象限にランダムに位置する4〜5個のサンプリング部位を同定する。ハサミを使って脱落膜を除去し、妊婦の表面から3〜5mmを切り取る。各サイトから1~2 cm 3の絨毛組織を採取する。
- 収集した組織を50mLの冷1M PBSで穏やかに洗浄する。各採取場所から数ピースに分け、アリコート。
注:胎盤の大きさは、計画された分析に依存します。 - 0.1~0.5cm 3の組織サンプルのアリコートを5本のクライオチューブに加え、液体窒素で急速に凍らせる。
- 0.1〜0.2 cm 3の小片を25 mLのRNA安定化溶液でチューブに加えます。 4時にストア6; Cで24時間、RNA安定化溶液を捨て、それを交換する。フリーズ。
- OCT 0.5 mLを含む5本の凍結チューブに0.5 cm 3のピースを加え、OCTで上にして混合し、凍結させる。
- 分析までサンプルを-80℃で保存する。
注:Burton et al。計画された分析に応じて、胎盤サンプリングの実用的な側面の優れた概要を提供する。 図20は、微絨毛および基底膜の単離のために残りの組織を調製し、そして真空吸引技術によって脱落膜組織を収集することを検討してください。 21、22
6.新生児の特徴
- Apgarスコア(1,5,10分)、性別、体重、長さ、妊娠期間、新生児集中治療室への入院(滞在の長さと結果)などの新生児の特徴を記録する。
- 新生児の体組成を人体測定、空気置換プレチスモグラフまたは二重X線吸光光度法を用いて測定した。 23、24
7.計算
- 動脈および子宮動脈において同様の血液組成を仮定し、子宮胎盤の動静脈濃度差を計算する。
子宮静脈内動静脈濃度差= C A - C V
臍静脈 - 動脈間濃度差= C v -C a
ここで、Cは下付き文字:A、橈骨動脈; V、子宮静脈; v臍静脈およびa、臍動脈。 - 容量血流量、mL /分(Q)を計算する:
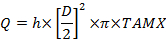
Dは血管の直径(cm)であり、TAMXは時間平均最大速度であり、hは空間的血液速度プロファイルの係数である。臍静脈の係数として0.5を使用し、子宮動脈25、26 0.6。 - フィックの原理に従って、胎盤摂取量と放出量を計算する:
子宮内摂取 =( C A - C V )× Qm
胎児取り込み=(C のV - CのA) x Q f
下付き文字:m、母体およびf、胎児。
結果
4血管サンプリング法は、臨床診療において適用可能であり、我々は209母/幼児対からの血液サンプルを首尾よく得た。これらのうち128件では、体血流量を測定することもできました。 70匹の母親と胎児のペアで、完全な4脈管サンプリングと母体と胎児の両方の血管の良好な流量測定が得られた( 図3 )。さらに、私たちは今までに30人の子癇前?...
ディスカッション
胎盤4血管サンプリング法は、主に3つの目的に関連する。第1に、特定の物質がどのように母体側の胎盤によって取り込まれ、臍帯血および胎児に移されたかを研究するために使用することができます。第2に、この方法は、プロゲステロンの結果によって示されるように、胎盤によって産生され、母体または胎児の循環系に放出される物質の研究に非常に関連している。第3に、急速な成?...
開示事項
著者は何も開示することはない。
謝辞
まず、このプロジェクトに参加した母親に心から感謝します。次に、サンプリング手続き、麻酔科医、看護師麻酔科医、外科看護師を援助し、手助けしたすべての人員を認めます。このプロジェクトは、南・東ノルウェー地方保健局とオスロ大学女性健康局のノルウェー諮問部とオスロ大学病院が提供する地方財政からの資金提供なしでは可能ではなかった。
資料
| Name | Company | Catalog Number | Comments |
| Maternal body composition | |||
| Impedance scale | Tanita | or similar | |
| Ultrasound measurements | |||
| Sequoia 512 ultrasound machine | Acuson | equipped with a curved transducer with colour and pulsewave Doppler (frequency bandwidth 2-6 MHz) | |
| Blood samples | |||
| Arerial cannula | BD Medical | 682245 | or similar |
| 20cc Eccentric Luer Tip Syringe without Needle | Termo | SS-20ES | or similar. 3 needed. |
| 10cc Eccentric Luer Tip Syringe without Needle | Termo | SS-10ES | or similar. 9 needed. |
| 5cc 6% Luer Syringe without Needle | Termo | SS-05S1 | or similar. 2 needed. |
| Arterial blood gas syringe | Radiometer Medical | or similar. 4 needed. | |
| Sterile winged needle connected to flexible tubing, 21 gauge | Greiner Bio-One | 450081 | (intended for single use).3 needed. |
| Vacutainer tube 6 mL EDTA | Greiner Bio-One | 456043 | or similar. Label with sample site. 10 needed. |
| Vacutainer tube 5 ml LH Lithium Heparin Separator | Greiner Bio-One | 456305 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 6 mL Serum Clot Activator | Greiner Bio-One | 456089 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 3 ml 9NC Coagulation sodium citrate 3,2% | Greiner Bio-One | 454334 | or similar. Label with sample site. 5 needed. |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site, serum/type of plasma and ID. 90 needed. |
| Marked trays to transport the syringes | to transport the blood samples in the operation theatre | ||
| Rocker | for gentle mixing of the samples | ||
| Ice | in styrofoam box | ||
| Liquid nitrogen | in appropriate container | ||
| Placenta samples | |||
| Metal tray | |||
| Ice | in styrofoam box | ||
| Calibrated scale | |||
| Metal ruler | |||
| 1 M Phosphate buffered saline | Sigma | D1408 | or similar. Dilute 10 M to 1M before use |
| RNA stabilization solution | Sigma | R0901-500ML | or similar |
| Optimal Cutting Temperature (O.C.T.) compound | vwr | 361603E | or similar |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site. content and ID. 10 needed. |
| Centrifuge tubes, conical bottom 50 mL | Greiner Bio-One | 227,285 | or similar. Label with "RNA later", sample site and ID. 2 needed. |
| Liquid nitrogen | in appropriate container | ||
| Fetal body composition | |||
| Calibrated scale | |||
| Measuring tape |
参考文献
- Jansson, T., Powell, T. L. Role of the placenta in fetal programming: underlying mechanisms and potential interventional approaches. Clin Sci (Lond). 113 (1), 1-13 (2007).
- Hanson, M. A., Gluckman, P. D. Early developmental conditioning of later health and disease: physiology or pathophysiology. Physiol Rev. 94 (4), 1027-1076 (2014).
- Guttmacher, A. E., Spong, C. Y. The human placenta project: it's time for real time. Am J Obstet Gynecol. 213, 3-5 (2015).
- Battaglia, F. C., Regnault, T. R. Placental transport and metabolism of amino acids. Placenta. 22 (2-3), 145-161 (2001).
- Hay, W. W. Placental-fetal glucose exchange and fetal glucose metabolism. Trans Am Clin Climatol Assoc. 117, 321-339 (2006).
- Woollett, L. A. Review: Transport of maternal cholesterol to the fetal circulation. Placenta. 32, 218-221 (2011).
- Prenton, M. A., Young, M. Umbilical vein-artery and uterine arterio-venous plasma amino acid differences (in the human subject). J Obstet Gynaecol Br Commonw. 76 (5), 404-411 (1969).
- Cetin, I., et al. Plasma and erythrocyte amino acids in mother and fetus. Biol Neonate. 60 (2), 83-91 (1991).
- Filshie, G. M., Anstey, M. D. The distribution of arachidonic acid in plasma and tissues of patients near term undergoing elective or emergency Caesarean section. Br J Obstet Gynaecol. 85 (2), 119-123 (1978).
- Haberey, P. P., Schaefer, A., Nisand, I., Dellenbach, P. The fate and importance of fetal lactate in the human placenta -a new hypothesis. J Perinat Med. 10 (2), 127-129 (1982).
- Prendergast, C. H., et al. Glucose production by the human placenta in vivo. Placenta. 20 (7), 591-598 (1999).
- Metzger, B. E., Rodeck, C., Freinkel, N., Price, J., Young, M. Transplacental arteriovenous gradients for glucose, insulin, glucagon and placental lactogen during normoglycaemia in human pregnancy at term. Placenta. 6 (4), 347-354 (1985).
- Zamudio, S., et al. Hypoglycemia and the origin of hypoxia-induced reduction in human fetal growth. PLoS One. 5 (1), 8551 (2010).
- Holme, A. M., Roland, M. C., Lorentzen, B., Michelsen, T. M., Henriksen, T. Placental glucose transfer: a human in vivo study. PLoS One. 10 (2), 0117084 (2015).
- Holme, A. M., Roland, M. C., Henriksen, T., Michelsen, T. M. In vivo uteroplacental release of placental growth factor and soluble Fms-like tyrosine kinase-1 in normal and preeclamptic pregnancies. Am J Obstet Gynecol. 215 (6), 781-782 (2016).
- Paasche Roland, M. C., Lorentzen, B., Godang, K., Henriksen, T. Uteroplacental arterio-venous difference in soluble VEGFR-1 (sFlt-1), but not in soluble endoglin concentrations in preeclampsia. Placenta. 33 (3), 224-226 (2012).
- Brar, H. S., et al. Uteroplacental unit as a source of elevated circulating prorenin levels in normal pregnancy. Am J Obstet Gynecol. 155 (6), 1223-1226 (1986).
- Myatt, L., et al. Strategy for standardization of preeclampsia research study design. Hypertension. 63 (6), 1293-1301 (2014).
- Kiserud, T., Rasmussen, S. How repeat measurements affect the mean diameter of the umbilical vein and the ductus venosus. Ultrasound Obstet Gynecol. 11 (6), 419-425 (1998).
- Burton, G. J., et al. Optimising sample collection for placental research. Placenta. 35 (1), 9-22 (2014).
- Illsley, N. P., Wang, Z. Q., Gray, A., Sellers, M. C., Jacobs, M. M. Simultaneous preparation of paired, syncytial, microvillous and basal membranes from human placenta. Biochim Biophys Acta. 1029 (2), 218-226 (1990).
- Staff, A. C., Ranheim, T., Khoury, J., Henriksen, T. Increased contents of phospholipids, cholesterol, and lipid peroxides in decidua basalis in women with preeclampsia. Am J Obstet Gynecol. 180 (3), 587-592 (1999).
- Catalano, P. M., Thomas, A. J., Avallone, D. A., Amini, S. B. Anthropometric estimation of neonatal body composition. Am J Obstet Gynecol. 173 (4), 1176-1181 (1995).
- Ellis, K. J., et al. Body-composition assessment in infancy: air-displacement plethysmography compared with a reference 4-compartment model. Am J Clin Nutr. 85 (1), 90-95 (2007).
- Haugen, G., Kiserud, T., Godfrey, K., Crozier, S., Hanson, M. Portal and umbilical venous blood supply to the liver in the human fetus near term. Ultrasound Obstet Gynecol. 24 (6), 599-605 (2004).
- Acharya, G., et al. Experimental validation of uterine artery volume blood flow measurement by Doppler ultrasonography in pregnant sheep. Ultrasound Obstet Gynecol. 29 (4), 401-406 (2007).
- Wu, X., et al. Glutamate-glutamine cycle and exchange in the placenta-fetus unit during late pregnancy. Amino Acids. 47 (1), 45-53 (2015).
- Tuckey, R. C. Progesterone synthesis by the human placenta. Placenta. 26 (4), 273-281 (2005).
- Simmons, M. A., Meschia, G., Makowski, E. L., Battaglia, F. C. Fetal metabolic response to maternal starvation. Pediatr Res. 8 (10), 830-836 (1974).
- Simmons, M. A., Jones, M. D., Battaglia, F. C., Meschia, G. Insulin effect on fetal glucose utilization. Pediatr Res. 12 (2), 90-92 (1978).
- Bujold, E., et al. Evidence supporting that the excess of the sVEGFR-1 concentration in maternal plasma in preeclampsia has a uterine origin. J Matern Fetal Neonatal Med. 18 (1), 9-16 (2005).
- Jansson, T., Aye, I. L., Goberdhan, D. C. The emerging role of mTORC1 signaling in placental nutrient-sensing. Placenta. 33, 23-29 (2012).
- Cetin, I. Placental transport of amino acids in normal and growth-restricted pregnancies. Eur J Obstet Gynecol Reprod Biol. 110, 50-54 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved