需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
人体胎盘生理学综合研究的4血管取样方法
摘要
我们提出了一种在体内研究人胎盘生理学的详细方法。该方法将来自胎盘和母胎侧的进出血管的血液采样与体积血流和胎盘组织取样的超声测量相结合。
摘要
人胎盘在子宫内仍然无法进行研究。因此,目前对人类胎盘生理学的了解在很大程度上取决于动物研究,尽管胎盘解剖学中物种的多样性,血液动力学和妊娠持续时间。绝大多数人胎盘研究是离体灌注研究或体外滋养层研究。虽然体外研究和动物模型是必不可少的,但是将这些研究结果外推到体内的人类胎盘是不确定的。我们的目的是在体内研究人胎盘生理学,并提出该方法的详细方案。在计划剖宫产期间,利用子宫内膜的子宫静脉进入子宫静脉,我们从胎盘母体和胎侧的进出血管中收集血样。组合时从体积血流测量的血液样本中心测量,我们能够量化胎盘和胎儿摄取和任何化合物的释放。此外,来自相同母胎胎系的胎盘组织样本可以提供运动员密度和活性以及体内胎盘功能的其它方面的测量。通过这种4血管采样方法的综合使用,我们能够在正常和病理性怀孕中测试体内胎盘营养转移和代谢的一些现有概念。此外,该方法能够将胎盘分泌的物质鉴定为母体循环,这可能是对胎盘功能障碍生物标志物的检索的重要贡献。
引言
根据卫生,美国全国学院,胎盘是在人体1,2,3中的至少理解器官。 在体内不易对正在进行的怀孕造成不道德的风险进行人体胎盘的访问和研究是困难的。因此,人体胎盘功能的研究主要是基于体外和离体模型。多数在胎盘转运和代谢的体内研究以前已经在动物4,5被执行,6。然而,由于胎盘结构和功能在物种间有很大差异,所以必须谨慎地将动物的结果外推至人体。只有少数较小的人体内研究已经调查了在正常生理学下的胎盘和胎儿摄取和运输人的条件下,并且没有已经探索几种化合物7,8,9,10,11,12,13的集成传输。这些基础研究表明,人胎盘的体内研究是可行的,并且它们可以用于多种目的。首先,主要来自体外 , 体外和动物研究的胎盘功能的现有概念可以在人的环境中进行测试,从而提供对人胎盘的新颖和更具体的洞察。其次,与异常胎儿生长,先兆子痫,母亲糖尿病,代谢综合征和其他母体代谢紊乱相关的功能障碍性胎盘的性质可以更好地表征。第三,人体内研究提供了开发诊断的机会tic和胎盘功能的预测工具。
在这个背景下,我们旨在建立一个全面的生理数据收集,以调查体内人胎盘功能。在计划剖宫产期间,我们利用腹腔内进入子宫静脉从胎盘的母胎和胎侧的进出血管收集血液样品(4血管采样方法)。这些样品用于计算营养物质和其他物质的成对动静脉浓度差异14 。此外,我们通过超声测量胎盘两侧的体积血流量。因此,可以量化任何化合物的胎盘和胎儿摄取。此外,能够确定由胎盘释放到母体和胎儿循环15,16,17的物质。结合时20d与母亲和儿童的临床参数,以及胎盘的分析和其他相关组织,这种方法具有令人兴奋的潜力,在同一个母亲,胎儿对胎盘功能的许多方面集成在体内 。
研究方案
该研究由奥斯陆大学医院数据保护官员和挪威南部卫生研究伦理学区域委员会2419/2011批准。所有参与者签署书面知情同意书。
准备工作
注意:程序的时间表如图1所示 。
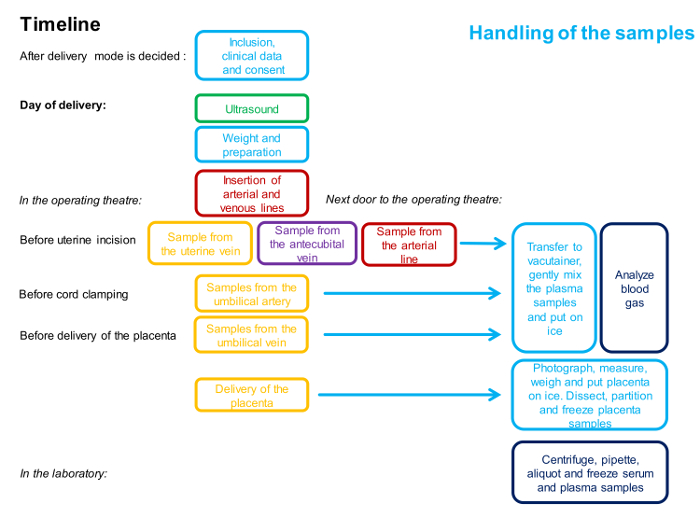
图1 : 描述涉及4血管采样程序的时间和人员的流程图。
一种颜色代表一个人。该方法的详细说明在协议中给出。 请点击此处查看此图的较大版本。
- 员工
- 确保所有必需的人员可用:高级技术的进行超声测量的胎儿医学专家,两名产科医生进行手术,其中一名产科医生和两名护士收集样品,一名助理处理血气分析和一名助理处理其他样品连续并立即收集。
注意:如果更高级的胎盘组织收集,需要额外的人。
- 确保所有必需的人员可用:高级技术的进行超声测量的胎儿医学专家,两名产科医生进行手术,其中一名产科医生和两名护士收集样品,一名助理处理血气分析和一名助理处理其他样品连续并立即收集。
- 设备
- 准备设备,冷冻冷冻的1M冰磷酸缓冲盐水(PBS),25mL冷RNA稳定溶液和5×0.5mL最佳切割温度化合物(OCT)。标记出真空管和管子。见临时设备清单。
2.产妇特征
- 记录产妇的临床和非临床特征,并重复相关问题和我发货时包括重量,包括重量。记录剖宫产前的禁食期,以及手术期间发生的任何低血压事件。
注意:包括最近在全球妊娠合并实验室(COLAB)出版的报告中提供的最小母亲临床数据。本文还包括选择学习人群的一些非常重要的方面,在规划研究时应予以解决18 。 - 考虑记录父系特征,包括种族,年龄和体重指数(BMI)。
超声波
- 在交付当天进行多普勒超声检查,女性处于禁食状态。在胎儿静止期间进行检查,女性处于半仰卧位,与感兴趣区域稍微横向倾斜,以避免压迫主动脉和腔静脉。监视输出显示器上的机械和热指数的张力。
- 脐静脉
- 在脐静脉中可以观察到胎腹的矢状或斜向横断。在任何可见的分支之前测量腹内脐静脉直线部分的内部血管直径。使用常规B模式,并以直径测量的垂直角度观察容器,并保留几个最佳框架用于以后的测量,以最小化脉动直径变化的影响。
- 重复测量五到十次19 。
- 在同一个位置,使用多普勒超声,并调整探头以获得尽可能低的声压角(始终<30°),以测量时间平均最大速度(TAMX)。在3 - 5秒(非脉动流量)的时间内获得速度。
- 在脐静脉中可以观察到胎腹的矢状或斜向横断。在任何可见的分支之前测量腹内脐静脉直线部分的内部血管直径。使用常规B模式,并以直径测量的垂直角度观察容器,并保留几个最佳框架用于以后的测量,以最小化脉动直径变化的影响。
- 子宫动脉
- 使用多普勒超声显示子宫动脉穿过髂外动脉后立即从髂内动脉分支。调整此位置的探头以获得较低的角度(始终<30°)并测量TAMX。获取速度为三个心脏周期的平均速度。
- 由于在与TAMX测量相同的位置处不太可能获得垂直的角度,所以沿着容器向远侧方向,以获得直径测量值的正确角度,使其尽可能接近直径测量点。如果任何可见的血管在该位置之前分支,则通过彩色多普勒超声评估,排除直径测量。
- 使用常规B模式,并以直径测量的垂直角度观察容器,并保留几个最佳框架用于以后的测量,以最小化脉动直径变化的影响。
- 重复测量五到十次19 。
- 注意胎盘的位置。
4血管采血
注意: 图1中概述了程序的时间表, 图2中显示了样品的概述。
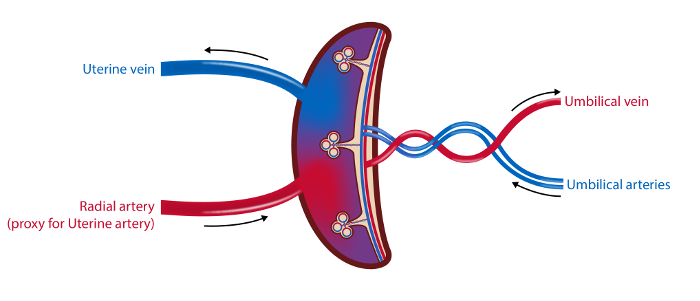
图2 : 胎盘脉管系统和采样部位的示意图。
在4血管采样方法中,血液样品从子宫静脉,桡动脉(作为子宫动脉的代理)和脐动脉和静脉抽取。通过超声测量子宫动脉和脐静脉血流量。收集来自胎盘的组织样品。插图:奥斯陆大学ØysteinH. Horgmo。5847fig2large.jpg"target ="_ blank">请点击此处查看此图的较大版本。
- 安全程序
- 向操作剧院的所有人员提供手套,手术擦洗套装,口罩和头饰。
- 提供外科医生和研究人员与手术护理套装,口罩,头饰,长袍和双手套接触手术领域。眼镜是可选的。
- 提供用手套处理血液样本的人员。
- 提供使用手套和手术口罩处理胎盘样品的人员。均质化需要使用罩。
- 准备在手术室
- 给予介绍,并将设备交给所有在手术开始前协助取样的人员。
- 解决麻醉师和麻醉护士谁将协助进行必要的外周动脉和静脉通路,并确保取样前不得静脉注射液体。
- 给辅助肘前静脉样本的人和两个注射器(一个20 mL和一个10 mL)和一个血液注射器(含肝素)的三个注射器(10 mL)无针对辅助桡动脉的人。
- 准备两个无菌注射器(20 mL),五个无菌注射器(10 mL),三个"蝴蝶针"和两个血液注射器进行操作。
- 进入血管。
- 按照剖宫产前的标准程序,以确保外周静脉(iv)进入。
注意:由于更容易从本地抽取样品,因此优选肘前静脉。 - 通过超声或触诊定位手腕上的桡动脉。在0.5mL皮下利多卡因镇痛后,将动脉线置于桡动脉。如果三次插入失败,请放弃此网站的抽样,或如果女人在插入期间经历疼痛。
注意:按照标准程序进行剖宫产手术。以下仅列出了抽样程序所需的调整。
- 按照剖宫产前的标准程序,以确保外周静脉(iv)进入。
- 产妇血液样本
注意:在子宫切口之前同时获得所有三种母体血液样本(子宫静脉,桡动脉和肘前静脉)。- 对于子宫静脉,打开腹腔后,使用牵开器抬起腹壁,将子宫静脉的主要分支暴露在子宫的前外侧。如果胎盘位于子宫中线,请尽可能在与胎盘同侧的子宫静脉分支处获取血液,或使用最突出的静脉丛。
- 在大约30度的角度将蝴蝶针插入子宫静脉血气注射器,并通过温和抽吸收集血液,以避免溶血。在小心地固定蝴蝶针的静脉位置的同时,将填充的血气注射器用20 mL和10 mL注射器连续更换。
注意:当站在所选子宫静脉的对侧时,最佳保证最佳。
- 在大约30度的角度将蝴蝶针插入子宫静脉血气注射器,并通过温和抽吸收集血液,以避免溶血。在小心地固定蝴蝶针的静脉位置的同时,将填充的血气注射器用20 mL和10 mL注射器连续更换。
- 对于桡动脉,从动脉内线吸出。弃去前5 mL,然后在肝素注射器中抽吸3 mL进行血气分析,然后在两个注射器(20 + 10 mL)中3 mL。
- 对于肘静脉,从静脉导管轻轻吸出。弃去前5 mL,然后在三只注射器(10 mL)中抽取30 mL。
- 在开始关闭腹部之前,先对子宫静脉采样点进行最终检查。
- 对于子宫静脉,打开腹腔后,使用牵开器抬起腹壁,将子宫静脉的主要分支暴露在子宫的前外侧。如果胎盘位于子宫中线,请尽可能在与胎盘同侧的子宫静脉分支处获取血液,或使用最突出的静脉丛。
- 胎儿血样
- 当孩子出生时,立即从脐动脉吸出血液,而不夹紧脐带或输送胎盘。开始机智h用于血气分析的注射器,如果可能的话,使用三个10mL注射器。
- 当固定动脉样本时,夹住绳索,并将脐带静脉(血气和20 + 10 mL注射器)取样前将儿童送到助产士。
注意:在分娩的几秒钟内和胎盘原位获得所有脐带样品,除非自发分离。 - 按照挪威关于延迟钳夹的建议。如果遇到困难的孩子,请立即夹紧并切断绳索,并将小孩的手交给助产士和新生儿学家。
- 处理血液样本
- 将血气注射器放在冰上,同时准备其余的血液样品,并在5分钟内在血气分析仪中分析。
- 将血液样品立即转移到真空器中,并将等离子管放置在摇杆上1-2分钟,然后放在冰上。离开血液管上的劳动atory长凳定居30分钟。
注意:这是程序中的关键步骤,需要额外的关注,因为所有五个站点的样品必须同时准备以确保良好的质量。 - 尽快离心血浆样品,30分钟内,6℃,2500×g离心20分钟。
- 30分钟后,将血清样品在室温下以2500×g离心10分钟。
- 将上清液小心地分装到2 mL冷冻管中,将0.5 mL上清液放在颗粒上方,以确保无血小板血浆。
- 将样品储存在-80°C。
5.胎盘组织收集
- 交付后,将胎盘平放在冰冷的夹层托盘上。拍摄并测量最长直径和直径在90度。
- 称重胎盘。
- 记录重量,两个直径,任何gross病理学,绳索中的血管数量以及从胎盘放置在冰上的时间间隔。
注意:如果临床指示,请将胎盘发送到病理检查。 - 将胎盘放置在母体表面上,并确定随机位于胎盘每个象限中的4 - 5个采样点,避免坦克病理区域。用剪刀取下蜕膜,从母体表面切出3-5毫米。从每个位点收集1 - 2 cm 3的绒毛组织。
- 将收集的组织轻轻洗涤在50mL冷1M PBS中。从每个采样点分割成几片,并分装。
注意:胎盘的尺寸将取决于计划的分析。 - 将0.1 - 0.5 cm 3组织样品的等分试样添加到5个低温管中,并在液氮中快速冷冻。
- 使用25 mL RNA稳定溶液将0.1〜0.2 cm 3的小块加入管中。存放于46; C 24小时,丢弃RNA稳定溶液并更换。冻结。
- 将0.5cm 3的片加入5个冷冻管中,加入0.5mL OCT,充满OCT,混合并冷冻。
- 将样品储存在-80°C直到分析。
注意:Burton et al。根据计划分析,对胎盘采样的实际情况进行了很好的概述。 20考虑到制备的剩余组织为微绒毛和基膜的分离,并收集通过真空抽吸技术蜕膜组织。 21,22
6.新生儿特征
- 记录新生儿特征,包括Apgar评分(1,5和10分钟),性别,体重,体重,胎龄和新生儿重症监护病房入院时间(住院时间和结局)。
- 考虑通过人体测量测量新生儿身体组成,进行排气体积描记法或双重X线吸收测定法。 23,24
7.计算
- 假设在径向和子宫动脉中血液成分相似,并计算子宫胎盘动静脉的浓度差异。
胎盘动静脉血压浓度差= C A - C V
脐静脉 - 动脉浓度差= C v -C a
其中C为下标浓度:A,桡动脉; V,子宫静脉;脐静脉和脐动脉。 - 计算体积血流量,mL / min(Q):
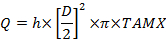
其中D是血管直径(cm),TAMX是时间平均最大速度,h是空间血液速度分布的系数。使用0.5作为脐静脉的系数0.6子宫动脉25,26。 - 根据Fick的原理计算胎盘摄取和释放:
子宫胎盘摄取 =( C A - C V )× Qm
胎儿吸收= ( C v -C a ) x Q f
下标:m,母亲和f,胎儿。
结果
4血管采样方法适用于临床实践,我们成功获得了209例母亲/婴儿对的血液样本。其中128个我们也实现了测量体积血流量。在70个母胎胎系中获得了完整的4血管采样和母体和胎儿血管的良好质量流量测量( 图3 )。此外,我们迄今已收集了30名先兆子痫患者的血液和胎盘样品。之前我们已经发表了关于营养成分的人胎盘转移,以及血管活性胎盘因素释?...
讨论
胎盘4血管采样方法有三个主要目的。首先,我们的葡萄糖和氨基酸研究证明,它可以用于研究胎盘在母体一侧如何摄取特定物质,并可能转移到脐带循环和胎儿。第二,该方法与研究胎盘产生的物质高度相关,并释放到母体或胎儿循环中,如黄体酮结果所示。第三,研究胎儿体内如何在快速生长和组织重塑过程中消除废物可能是有用的。
4血管方法的关键步...
披露声明
作者没有什么可以披露的。
致谢
首先,我们衷心感谢参与这个项目的母亲。接下来,我们承认协助和促进抽样程序的所有人员,麻醉医师,护士麻醉师和外科护士。如果没有挪威东南部挪威地区卫生局和挪威妇女健康问题咨询组,奥斯陆大学以及奥斯陆大学医院提供的当地资金,该项目就不可能实现。
材料
| Name | Company | Catalog Number | Comments |
| Maternal body composition | |||
| Impedance scale | Tanita | or similar | |
| Ultrasound measurements | |||
| Sequoia 512 ultrasound machine | Acuson | equipped with a curved transducer with colour and pulsewave Doppler (frequency bandwidth 2-6 MHz) | |
| Blood samples | |||
| Arerial cannula | BD Medical | 682245 | or similar |
| 20cc Eccentric Luer Tip Syringe without Needle | Termo | SS-20ES | or similar. 3 needed. |
| 10cc Eccentric Luer Tip Syringe without Needle | Termo | SS-10ES | or similar. 9 needed. |
| 5cc 6% Luer Syringe without Needle | Termo | SS-05S1 | or similar. 2 needed. |
| Arterial blood gas syringe | Radiometer Medical | or similar. 4 needed. | |
| Sterile winged needle connected to flexible tubing, 21 gauge | Greiner Bio-One | 450081 | (intended for single use).3 needed. |
| Vacutainer tube 6 mL EDTA | Greiner Bio-One | 456043 | or similar. Label with sample site. 10 needed. |
| Vacutainer tube 5 ml LH Lithium Heparin Separator | Greiner Bio-One | 456305 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 6 mL Serum Clot Activator | Greiner Bio-One | 456089 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 3 ml 9NC Coagulation sodium citrate 3,2% | Greiner Bio-One | 454334 | or similar. Label with sample site. 5 needed. |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site, serum/type of plasma and ID. 90 needed. |
| Marked trays to transport the syringes | to transport the blood samples in the operation theatre | ||
| Rocker | for gentle mixing of the samples | ||
| Ice | in styrofoam box | ||
| Liquid nitrogen | in appropriate container | ||
| Placenta samples | |||
| Metal tray | |||
| Ice | in styrofoam box | ||
| Calibrated scale | |||
| Metal ruler | |||
| 1 M Phosphate buffered saline | Sigma | D1408 | or similar. Dilute 10 M to 1M before use |
| RNA stabilization solution | Sigma | R0901-500ML | or similar |
| Optimal Cutting Temperature (O.C.T.) compound | vwr | 361603E | or similar |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site. content and ID. 10 needed. |
| Centrifuge tubes, conical bottom 50 mL | Greiner Bio-One | 227,285 | or similar. Label with "RNA later", sample site and ID. 2 needed. |
| Liquid nitrogen | in appropriate container | ||
| Fetal body composition | |||
| Calibrated scale | |||
| Measuring tape |
参考文献
- Jansson, T., Powell, T. L. Role of the placenta in fetal programming: underlying mechanisms and potential interventional approaches. Clin Sci (Lond). 113 (1), 1-13 (2007).
- Hanson, M. A., Gluckman, P. D. Early developmental conditioning of later health and disease: physiology or pathophysiology. Physiol Rev. 94 (4), 1027-1076 (2014).
- Guttmacher, A. E., Spong, C. Y. The human placenta project: it's time for real time. Am J Obstet Gynecol. 213, 3-5 (2015).
- Battaglia, F. C., Regnault, T. R. Placental transport and metabolism of amino acids. Placenta. 22 (2-3), 145-161 (2001).
- Hay, W. W. Placental-fetal glucose exchange and fetal glucose metabolism. Trans Am Clin Climatol Assoc. 117, 321-339 (2006).
- Woollett, L. A. Review: Transport of maternal cholesterol to the fetal circulation. Placenta. 32, 218-221 (2011).
- Prenton, M. A., Young, M. Umbilical vein-artery and uterine arterio-venous plasma amino acid differences (in the human subject). J Obstet Gynaecol Br Commonw. 76 (5), 404-411 (1969).
- Cetin, I., et al. Plasma and erythrocyte amino acids in mother and fetus. Biol Neonate. 60 (2), 83-91 (1991).
- Filshie, G. M., Anstey, M. D. The distribution of arachidonic acid in plasma and tissues of patients near term undergoing elective or emergency Caesarean section. Br J Obstet Gynaecol. 85 (2), 119-123 (1978).
- Haberey, P. P., Schaefer, A., Nisand, I., Dellenbach, P. The fate and importance of fetal lactate in the human placenta -a new hypothesis. J Perinat Med. 10 (2), 127-129 (1982).
- Prendergast, C. H., et al. Glucose production by the human placenta in vivo. Placenta. 20 (7), 591-598 (1999).
- Metzger, B. E., Rodeck, C., Freinkel, N., Price, J., Young, M. Transplacental arteriovenous gradients for glucose, insulin, glucagon and placental lactogen during normoglycaemia in human pregnancy at term. Placenta. 6 (4), 347-354 (1985).
- Zamudio, S., et al. Hypoglycemia and the origin of hypoxia-induced reduction in human fetal growth. PLoS One. 5 (1), 8551 (2010).
- Holme, A. M., Roland, M. C., Lorentzen, B., Michelsen, T. M., Henriksen, T. Placental glucose transfer: a human in vivo study. PLoS One. 10 (2), 0117084 (2015).
- Holme, A. M., Roland, M. C., Henriksen, T., Michelsen, T. M. In vivo uteroplacental release of placental growth factor and soluble Fms-like tyrosine kinase-1 in normal and preeclamptic pregnancies. Am J Obstet Gynecol. 215 (6), 781-782 (2016).
- Paasche Roland, M. C., Lorentzen, B., Godang, K., Henriksen, T. Uteroplacental arterio-venous difference in soluble VEGFR-1 (sFlt-1), but not in soluble endoglin concentrations in preeclampsia. Placenta. 33 (3), 224-226 (2012).
- Brar, H. S., et al. Uteroplacental unit as a source of elevated circulating prorenin levels in normal pregnancy. Am J Obstet Gynecol. 155 (6), 1223-1226 (1986).
- Myatt, L., et al. Strategy for standardization of preeclampsia research study design. Hypertension. 63 (6), 1293-1301 (2014).
- Kiserud, T., Rasmussen, S. How repeat measurements affect the mean diameter of the umbilical vein and the ductus venosus. Ultrasound Obstet Gynecol. 11 (6), 419-425 (1998).
- Burton, G. J., et al. Optimising sample collection for placental research. Placenta. 35 (1), 9-22 (2014).
- Illsley, N. P., Wang, Z. Q., Gray, A., Sellers, M. C., Jacobs, M. M. Simultaneous preparation of paired, syncytial, microvillous and basal membranes from human placenta. Biochim Biophys Acta. 1029 (2), 218-226 (1990).
- Staff, A. C., Ranheim, T., Khoury, J., Henriksen, T. Increased contents of phospholipids, cholesterol, and lipid peroxides in decidua basalis in women with preeclampsia. Am J Obstet Gynecol. 180 (3), 587-592 (1999).
- Catalano, P. M., Thomas, A. J., Avallone, D. A., Amini, S. B. Anthropometric estimation of neonatal body composition. Am J Obstet Gynecol. 173 (4), 1176-1181 (1995).
- Ellis, K. J., et al. Body-composition assessment in infancy: air-displacement plethysmography compared with a reference 4-compartment model. Am J Clin Nutr. 85 (1), 90-95 (2007).
- Haugen, G., Kiserud, T., Godfrey, K., Crozier, S., Hanson, M. Portal and umbilical venous blood supply to the liver in the human fetus near term. Ultrasound Obstet Gynecol. 24 (6), 599-605 (2004).
- Acharya, G., et al. Experimental validation of uterine artery volume blood flow measurement by Doppler ultrasonography in pregnant sheep. Ultrasound Obstet Gynecol. 29 (4), 401-406 (2007).
- Wu, X., et al. Glutamate-glutamine cycle and exchange in the placenta-fetus unit during late pregnancy. Amino Acids. 47 (1), 45-53 (2015).
- Tuckey, R. C. Progesterone synthesis by the human placenta. Placenta. 26 (4), 273-281 (2005).
- Simmons, M. A., Meschia, G., Makowski, E. L., Battaglia, F. C. Fetal metabolic response to maternal starvation. Pediatr Res. 8 (10), 830-836 (1974).
- Simmons, M. A., Jones, M. D., Battaglia, F. C., Meschia, G. Insulin effect on fetal glucose utilization. Pediatr Res. 12 (2), 90-92 (1978).
- Bujold, E., et al. Evidence supporting that the excess of the sVEGFR-1 concentration in maternal plasma in preeclampsia has a uterine origin. J Matern Fetal Neonatal Med. 18 (1), 9-16 (2005).
- Jansson, T., Aye, I. L., Goberdhan, D. C. The emerging role of mTORC1 signaling in placental nutrient-sensing. Placenta. 33, 23-29 (2012).
- Cetin, I. Placental transport of amino acids in normal and growth-restricted pregnancies. Eur J Obstet Gynecol Reprod Biol. 110, 50-54 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。