É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A abordagem de amostragem de 4 embarcações para estudos integrativos de fisiologia placentária humana
Neste Artigo
Resumo
Apresentamos um método detalhado para estudar a fisiologia placentária humana in vivo a termo. O método combina a amostragem de sangue dos vasos entrantes e de saída nos lados materno e fetal da placenta com medidas de ultra-som do fluxo sangüíneo do volume e amostragem do tecido placentário.
Resumo
A placenta humana é altamente inacessível à pesquisa enquanto ainda está no útero . A compreensão atual da fisiologia placentária humana in vivo é, portanto, baseada em grande parte em estudos com animais, apesar da alta diversidade entre espécies em anatomia placentária, hemodinâmica e duração da gravidez. A grande maioria dos estudos de placenta humana são estudos de perfusão ex vivo ou estudos de trofoblasto in vitro . Embora os estudos in vitro e os modelos animais sejam essenciais, a extrapolação dos resultados desses estudos para a placenta humana in vivo é incerta. Pretendemos estudar a fisiologia da placenta humana in vivo a termo e apresentar um protocolo detalhado do método. Explorando o acesso intraabdominal à veia uterina imediatamente antes da incisão uterina durante a cesariana planejada, recolhemos amostras de sangue dos vasos entrantes e de saída nos lados materno e fetal da placenta. Ao combinar conMedições de centragem a partir de amostras de sangue com medidas de fluxo sanguíneo volumétrico, podemos quantificar a absorção placentária e fetal e a liberação de qualquer composto. Além disso, amostras de tecido placentário dos mesmos pares mãe-feto podem fornecer medições da densidade e atividade do transportador e outros aspectos das funções placentárias in vivo . Através deste uso integrativo do método de amostragem de 4 embarcações, somos capazes de testar alguns dos conceitos atuais de transferência de nutrientes da placenta e metabolismo in vivo , tanto em gravidezes normais quanto patológicas. Além disso, este método permite a identificação de substâncias segregadas pela placenta para a circulação materna, o que pode ser um importante contributo para a busca de biomarcadores da disfunção placentária.
Introdução
De acordo com o National Institutes of Health, EUA, a placenta é o órgão menos entendido no corpo humano 1 , 2 , 3 . É difícil acessar e estudar a placenta humana in vivo sem impor riscos éticos na gravidez em curso. Os estudos da função placentária no ser humano são, portanto, amplamente baseados em modelos in vitro e ex vivo . A maioria dos estudos anteriores in vivo de transporte placentário e metabolismo foram realizados em animais 4 , 5 , 6 . No entanto, como a estrutura e as funções da placenta variam consideravelmente entre as espécies, a extrapolação dos resultados dos animais aos humanos deve ser feita com cautela. Apenas alguns estudos humanos menores in vivo investigaram a absorção placentária e fetal e o transporte sob condições fisiológicas normais.Todas as condições, e nenhuma explorou a transferência integrada de vários compostos 7 , 8 , 9 , 10 , 11 , 12 , 13 . Esses estudos fundamentais ilustram que os estudos in vivo da placenta humana são viáveis e que podem servir para vários propósitos. Em primeiro lugar, os conceitos atuais de funções placentárias derivadas principalmente de estudos in vitro , ex vivo e em animais podem ser testados em um ambiente humano e, portanto, fornecem uma visão nova e mais específica da placenta humana. Em segundo lugar, as propriedades da placenta disfuncional associada ao crescimento fetal aberrante, pré-eclâmpsia, diabetes materna, síndrome metabólica e outros distúrbios metabólicos maternos podem ser melhor caracterizados. Em terceiro lugar, os estudos humanos in vivo proporcionam uma oportunidade para desenvolver o diagnósticoFerramentas tic e preditivas de função placentária.
Neste contexto, buscamos estabelecer uma coleção abrangente de dados fisiológicos para investigar a função placentária humana in vivo. Durante uma cesariana planejada, exploramos o acesso intraabdominal à veia uterina para coletar amostras de sangue dos vasos entrantes e salientes nos lados materno e fetal da placenta (o método de amostragem de 4 vasos). Essas amostras são usadas para calcular as diferenças de concentração arteriovenosa pareadas de nutrientes e outras substâncias 14 . Além disso, medimos o fluxo sangüíneo de volume em ambos os lados da placenta por ultra-som. Conseqüentemente, a captação placentária e fetal de qualquer composto pode ser quantificada. Além disso, é possível determinar as substâncias liberadas pela placenta para as circulações materna e fetal 15 , 16 , 17 . Quando combinarD com parâmetros clínicos de mãe e filho e análises de tecidos placentários e outros tecidos relevantes, este método tem o potencial emocionante para integrar muitos aspectos das funções placentárias in vivo nos mesmos pares mãe-feto.
Protocolo
O estudo foi aprovado pelos funcionários de proteção de dados do Hospital Universitário de Oslo e do Comitê Regional de Ética em Pesquisa Médica e de Saúde, no sul da Noruega 2419/2011. Todos os participantes assinaram um consentimento informado e esclarecido na inclusão.
1. Preparações
NOTA: Uma linha de tempo para os procedimentos está descrita na Figura 1 .
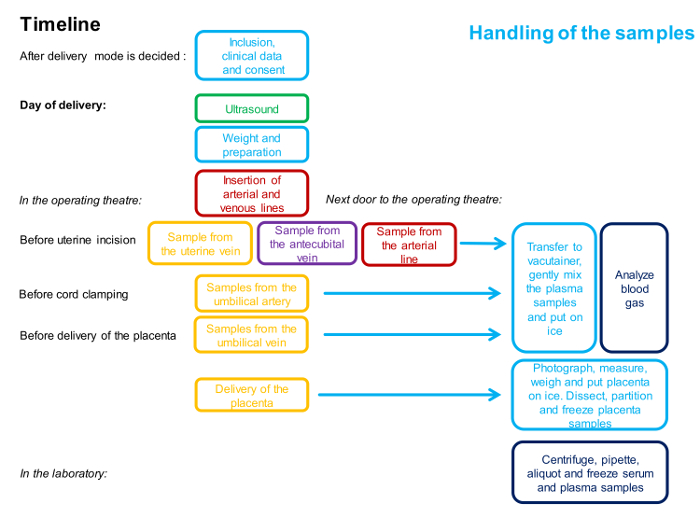
Figura 1 : Diagrama de fluxo descrevendo o tempo e o pessoal envolvido no procedimento de amostragem de 4 embarcações.
Uma cor representa uma pessoa. A descrição detalhada do método é dada no protocolo. Clique aqui para ver uma versão maior desta figura.
- Funcionários
- Certifique-se de que todos os funcionários necessários estão disponíveis: um especialista em medicina fetal altamente qualificado que realiza as medidas de ultra-som, dois obstetras que realizam a cirurgia, um dos obstetras e duas enfermeiras que coletam as amostras, um assistente que administra as análises de gases sangüíneos e um assistente que administra a Outras amostras de forma consecutiva e imediatamente após a coleta.
NOTA: Nos casos de coleção mais avançada de tecido placentário, é necessária uma pessoa adicional.
- Certifique-se de que todos os funcionários necessários estão disponíveis: um especialista em medicina fetal altamente qualificado que realiza as medidas de ultra-som, dois obstetras que realizam a cirurgia, um dos obstetras e duas enfermeiras que coletam as amostras, um assistente que administra as análises de gases sangüíneos e um assistente que administra a Outras amostras de forma consecutiva e imediatamente após a coleta.
- Equipamento
- Prepare o equipamento, 50 mL de solução salina tamponada com fosfato 1 M (PBS), 25 mL de solução estabilizadora de ARN frio e 5 x 0,5 mL de composto de temperatura de corte ideal (OCT). Rotule os aspiradores e tubos. Consulte a lista provisória de equipamentos.
2. Características maternas
- Registre as características clínicas e não clínicas maternas na inclusão e repita as questões relevantes e euAsurações, incluindo peso, no momento da entrega. Registre a duração do período de jejum antes da cesariana e quaisquer episódios hipotensivos que ocorram durante a cirurgia.
Nota: Inclua o conjunto de dados clínicos materno mínimo relatado em uma publicação recente do Laboratório Global de Gravidez (COLAB). Este artigo também inclui alguns aspectos muito importantes na escolha das populações estudadas e deve ser abordado ao planejar o estudo 18 . - Considere registrar características paternas, incluindo etnia, idade e índice de massa corporal (IMC).
3. Ultrassom
- Execute o exame de ultra-som Doppler no dia da entrega, com as mulheres em estado de jejum. Realizar o exame durante um período de quiescência fetal, com a mulher em posição semi-supina, inclinada ligeiramente lateralmente oposta à região de interesse, a fim de evitar a compressão da aorta e veia cava. Monitorar a saída emTensão pelos índices mecânico e térmico na tela.
- Veia umbilical
- Visualize a veia umbilical em uma transição sagital ou oblíqua do abdômen fetal. Meça o diâmetro interno do vaso na porção reta da veia umbilical intra-abdominal, antes de qualquer ramo visível. Use o modo B regular e visualize o vaso em um ângulo de insônia perpendicular para medições de diâmetro e mantenha vários quadros ótimos para medições posteriores para minimizar o efeito de mudanças de diâmetro pulsátil.
- Repita as medidas de cinco a dez vezes 19 .
- No mesmo local, use o ultra-som Doppler e ajuste a sonda para obter um ângulo de insonção tão baixo quanto possível (sempre <30 °) para medir a velocidade máxima calculada no tempo (TAMX). Obtenha a velocidade durante um período de 3 a 5 s (fluxo não pulsante).
- Visualize a veia umbilical em uma transição sagital ou oblíqua do abdômen fetal. Meça o diâmetro interno do vaso na porção reta da veia umbilical intra-abdominal, antes de qualquer ramo visível. Use o modo B regular e visualize o vaso em um ângulo de insônia perpendicular para medições de diâmetro e mantenha vários quadros ótimos para medições posteriores para minimizar o efeito de mudanças de diâmetro pulsátil.
- Artéria uterina
- Use DopplerUltra-som para visualizar a artéria uterina à medida que atravessa a artéria ilíaca externa, imediatamente depois dele se ramifica da artéria ilíaca interna. Ajuste a sonda neste site para obter um ângulo de insonação baixo (sempre <30 °) e medir TAMX. Obtenha a velocidade como a velocidade média de três ciclos de coração.
- Como é improvável que tenha um ângulo perpendicular no mesmo local que o TAMX é medido, siga o vaso distalmente para obter um ângulo correto para medições de diâmetro tão próximas dos locais de medidas de diâmetro quanto possível. Exclua as medidas do diâmetro se qualquer vaso visível se afastar antes deste site, conforme avaliado pelo ultra-som Doppler colorido.
- Use o modo B regular e visualize o vaso em um ângulo de insônia perpendicular para medições de diâmetro e mantenha vários quadros ótimos para medições posteriores para minimizar o efeito de mudanças de diâmetro pulsátil.
- Repita as medidas de cinco a dez vezes 19 .
- Observe a posição da placenta.
4. Amostragem de sangue de 4 vasos
NOTA: A linha de tempo para os procedimentos está descrita na Figura 1 e uma visão geral das amostras é ilustrada na Figura 2 .
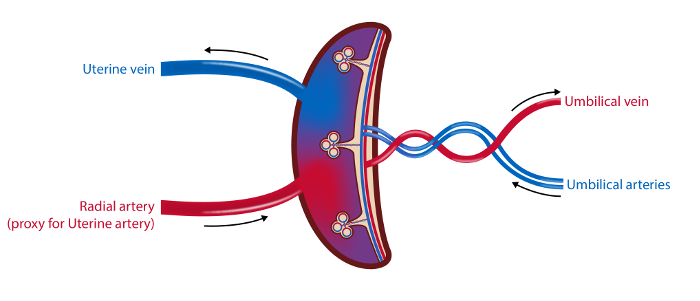
Figura 2 : Ilustração esquemática da Vasculatura Placentária e dos Sites de Amostragem.
No método de amostragem de 4 embarcações amostras de sangue são extraídas da veia uterina, a artéria radial (como um proxy para a artéria uterina) e as artérias e veias umbilicais. O fluxo sanguíneo na artéria uterina e a veia umbilical são medidos por ultra-som. As amostras de tecido da placenta são coletadas. Ilustração: Øystein H. Horgmo, Universidade de Oslo.5847fig2large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
- Procedimentos de segurança
- Forneça todo o pessoal na operação teatro com luvas, roupas cirúrgicas, máscaras e maquiagem.
- Fornecer aos cirurgiões e ao pessoal de pesquisa em contato com o campo de operação com trajes, máscaras, chapelaria, vestidos e luvas duplas cirúrgicas. Os óculos são opcionais.
- Forneça pessoal que manipule as amostras de sangue com luvas.
- Forneça pessoal que manipule as amostras de placenta com luvas e máscara cirúrgica. A homogeneização requer o uso de capuzes.
- Preparação no teatro de operações
- Dê um briefing e entregue o equipamento a todo o pessoal que ajudará a amostragem antes do início da cirurgia.
- Dirija-se ao enfermeiro de anestesiologista e anestesiologista que irá auxiliar no acesso arterial e venoso periférico necessário e assegurará queNenhum líquido é administrado por via intravenosa antes da amostragem.
- Dê três seringas (10 mL) sem agulhas para a pessoa que assiste com a amostra de veia antecubital e duas seringas (uma 20 mL e uma 10 mL) e uma seringa de sangue (com heparina) para a pessoa que auxilia na artéria radial.
- Prepare duas seringas estéreis (20 mL), cinco seringas estéreis (10 mL), três "agulhas de borboleta" e duas seringas de gás de sangue para o campo de operação.
- Acesso a vasos sanguíneos.
- Siga o procedimento padrão antes da cesariana para assegurar o acesso periférico intravenoso (iv).
NOTA: A veia antecubital é preferível porque é mais fácil extrair amostras deste site. - Localize a artéria radial no pulso por ultra-som ou por palpação. Após 0,5 mL de analgesia subcutânea de lidocaína, coloque uma linha arterial na artéria radial. Abandone a amostragem deste site em caso de três inserções com falha, ouSe a mulher experimentar dor durante a inserção.
NOTA: Realize o procedimento cirúrgico da cesariana de acordo com o procedimento padrão. Somente os ajustes necessários para o processo de amostragem são sublinhados abaixo.
- Siga o procedimento padrão antes da cesariana para assegurar o acesso periférico intravenoso (iv).
- Amostras de sangue materno
NOTA: Obtenha as três amostras de sangue materno (veia uterina, artéria radial e veia antecubital) simultaneamente antes da incisão uterina.- Para a veia uterina, depois de abrir a cavidade abdominal, use um retractor para levantar a parede abdominal e exponha os ramos principais das veias uterinas nos lados ântero-laterais do útero. Obtenha sangue dos ramos da veia uterina no mesmo lado da placenta sempre que possível ou use o plexo da veia mais proeminente se a placenta estiver localizada na linha média uterina.
- Insira uma agulha de borboleta em uma seringa de gás no sangue na veia uterina com um ângulo de aproximadamente 30 graus e coleça o sangue através de uma aspiração suave para evitarHemólise. Ao assegurar cuidadosamente a posição iv da agulha de borboleta, substitua a seringa de gás cheia de sangue por uma seringa de 20 mL e 10 mL consecutivamente.
NOTA: O melhor acesso é melhor assegurado quando se posiciona no lado contralateral da veia uterina escolhida.
- Insira uma agulha de borboleta em uma seringa de gás no sangue na veia uterina com um ângulo de aproximadamente 30 graus e coleça o sangue através de uma aspiração suave para evitarHemólise. Ao assegurar cuidadosamente a posição iv da agulha de borboleta, substitua a seringa de gás cheia de sangue por uma seringa de 20 mL e 10 mL consecutivamente.
- Para a artéria radial, aspirar da linha intra-arterial. Descarte os primeiros 5 mL e, em seguida, aspirar 3 mL em seringa de heparina para análises de gases no sangue, seguido de 3 mL em duas seringas (20 + 10 mL).
- Para a veia antecubital, aspirar gentilmente do cateter intravenoso. Descarte os primeiros 5 mL, e depois aspirar 30 mL em três seringas (10 mL).
- Realize uma inspeção final do local de amostragem na veia uterina antes de começar a fechar o abdômen.
- Para a veia uterina, depois de abrir a cavidade abdominal, use um retractor para levantar a parede abdominal e exponha os ramos principais das veias uterinas nos lados ântero-laterais do útero. Obtenha sangue dos ramos da veia uterina no mesmo lado da placenta sempre que possível ou use o plexo da veia mais proeminente se a placenta estiver localizada na linha média uterina.
- Amostras de sangue fetal
- Quando a criança nasce, imediatamente aspirar sangue da artéria umbilical, sem apertar o cordão umbilical ou entregar a placenta. Comece o conhecimentoH, a seringa para análises de gases sanguíneos, e siga com três seringas de 10 mL, se possível.
- Quando as amostras arteriais estiverem seguras, prenda o cordão e entregue a criança à parteira antes da amostragem da veia umbilical (gás de sangue e 20 + 10 mL de seringas).
NOTA: Obtenha todas as amostras umbilicais dentro de segundos do parto e com a placenta in situ, a menos que tenha desprendido espontaneamente. - Siga as recomendações norueguesas sobre o aperto do cordão tardio. Em caso de criança com dificuldades, abrace e corte o cordão imediatamente e entregue a criança à parteira e ao neonatologista.
- Manuseio de amostras de sangue
- Coloque as seringas de sangue no gelo enquanto prepara o resto das amostras de sangue e analise-as em um analisador de gases no sangue dentro de 5 min.
- Transfira as amostras de sangue imediatamente para vacutainers e coloque os tubos de plasma em um balancim por 1 a 2 minutos antes de colocá-los no gelo. Deixe os tubos de soro no trabalhoBanco de torres para se instalar por 30 minutos.
NOTA: Este é um passo crítico no procedimento que precisa de atenção extra porque amostras de todos os cinco sites devem ser preparadas simultaneamente para garantir boa qualidade. - Centrifugar as amostras de plasma o mais rápido possível e dentro de 30 min, a 6 ° C, 2.500 xg por 20 min.
- Após 30 min, centrifugar as amostras de soro à temperatura ambiente durante 10 min a 2.500 x g.
- Alíquota os sobrenadantes cuidadosamente para 2 mL de tubos de cryo, deixando 0,5 mL do sobrenadante acima do grânulo para garantir plasma livre de plaquetas.
- Armazene as amostras a -80 ° C.
5. Coleção de tecido placentário
- Coloque a placenta plana na bandeja de dissecação gelada o mais rápido possível após a entrega. Fotografar e medir o diâmetro mais longo e o diâmetro a 90 graus.
- Pesar a placenta.
- Registre o peso, os dois diâmetros, qualquer gPatologia ross, número de vasos no cordão e o intervalo de tempo desde a entrega até quando a placenta foi colocada no gelo.
NOTA: envie a placenta para o exame patológico se for clinicamente indicado. - Coloque a placenta com a superfície materna voltada para cima e identifique 4 a 5 locais de amostragem localizados aleatoriamente em cada quadrante da placenta, evitando áreas de patologia franca. Remova a decidua usando uma tesoura para cortar 3 a 5 mm da superfície materna. Colecione um tecido vilão de 1 a 2 cm 3 de cada local.
- Lave o tecido recolhido suavemente em 50 mL de PBS 1M frio. Divida em várias peças de cada local de amostragem e uma alíquota.
Nota: O tamanho das peças da placenta dependerá das análises planejadas. - Adicione alíquotas de amostras de tecido de 0,1 - 0,5 cm 3 a 5 tubos de cryo e congelamento instantâneo em nitrogênio líquido.
- Adicione pequenos pedaços de 0,1 - 0,2 cm 3 ao tubo com 25 mL de solução de estabilização de ARN. Loja às 46; C por 24 h, descarte a solução de estabilização de ARN e substitua-a. Congelar.
- Adicione pedaços de 0,5 cm 3 aos 5 tubos cryo com 0,5 mL de OCT, adicione-os com OCT, misture e congelem.
- Armazene as amostras a -80 ° C até a análise.
NOTA: Burton et al. Fornece uma excelente visão geral dos aspectos práticos da amostragem da placenta de acordo com as análises planejadas. 20 Considere preparar o tecido remanescente para o isolamento das membranas microvilas e basais e coletar o tecido decidual por técnica de sucção de vácuo. 21 , 22
6. Características neonatais
- Registre as características neonatais, incluindo Apgar-score (1, 5 e 10 min), sexo, peso, comprimento, idade gestacional e admissão na Unidade de Terapia Intensiva do Recém-Nascido (comprimento e resultado da estadia).
- Considere medir a composição do corpo neonatal por medidas antropométricas, deslocar o arPletismografia ou dupla absorciometria de raios-X. 23 , 24
7. Cálculos
- Assuma composição sanguínea semelhante na artéria radial e uterina e calcula a diferença de concentração arteriovenosa uteroplacentária.
Diferença de concentração arteriovenosa uteroplacentária = C A - C V
Diferença de concentração venosa-arterial umbilical - arterial = C v -C a
Onde C é concentração com subscritos: A, a artéria radial; V, a veia uterina; V a veia umbilical e a, a artéria umbilical. - Calcule o fluxo sanguíneo do volume, mL / min (Q):
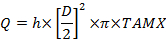
Onde D é o diâmetro do vaso (cm), TAMX é a velocidade máxima calculada no tempo e h é o coeficiente para o perfil espacial da velocidade do sangue. Use 0.5 como o coeficiente para a veia umbilical e0,6 para a artéria uterina 25 , 26 . - Calcule a aceitação e liberação da placenta de acordo com o princípio de Fick:
Captação uteroplacental = ( C A - C V ) x Qm
Captação fetal = ( C v - C a ) X Q f
Subscritos: m, materno e f, fetal.
Resultados
O método de amostragem de 4 vasos é aplicável na prática clínica e obtivemos amostras de sangue com sucesso de 209 pares de mãe / bebê. Em 128 destes, também conseguimos medir o fluxo sanguíneo do volume. A amostragem completa de 4 vasos e as medidas de fluxo de boa qualidade de vasos maternos e fetais foram obtidas em 70 pares mãe-feto ( Figura 3 ). Além disso, até agora, colhemos amostras de sangue e placenta de 30 pacientes pré-eclâmicos. N?...
Discussão
O método de amostragem de 4 vasos da placenta é relevante para três propósitos principais. Primeiro, pode ser usado para estudar como substâncias específicas são absorvidas pela placenta do lado materno e, possivelmente, transferidas para a circulação umbilical e para o feto, conforme demonstrado pelos estudos de glicose e aminoácidos. Em segundo lugar, o método é altamente relevante para estudar substâncias produzidas pela placenta e liberadas para a circulação materna ou fetal, conforme demonstrad...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Em primeiro lugar, agradecemos sinceramente as mães que participaram deste projeto. Em seguida, reconhecemos todo o pessoal que auxiliou e facilitou o procedimento de amostragem, o Anestesista, o enfermeiro anestesista e os enfermeiros cirúrgicos. O projeto não teria sido possível sem o financiamento da Autoridade Regional de Saúde do Sudeste da Noruega e da Unidade Norueguesa de Assessoria em Saúde da Mulher, Universidade de Oslo e financiamento local fornecido pelo Hospital Universitário de Oslo.
Materiais
| Name | Company | Catalog Number | Comments |
| Maternal body composition | |||
| Impedance scale | Tanita | or similar | |
| Ultrasound measurements | |||
| Sequoia 512 ultrasound machine | Acuson | equipped with a curved transducer with colour and pulsewave Doppler (frequency bandwidth 2-6 MHz) | |
| Blood samples | |||
| Arerial cannula | BD Medical | 682245 | or similar |
| 20cc Eccentric Luer Tip Syringe without Needle | Termo | SS-20ES | or similar. 3 needed. |
| 10cc Eccentric Luer Tip Syringe without Needle | Termo | SS-10ES | or similar. 9 needed. |
| 5cc 6% Luer Syringe without Needle | Termo | SS-05S1 | or similar. 2 needed. |
| Arterial blood gas syringe | Radiometer Medical | or similar. 4 needed. | |
| Sterile winged needle connected to flexible tubing, 21 gauge | Greiner Bio-One | 450081 | (intended for single use).3 needed. |
| Vacutainer tube 6 mL EDTA | Greiner Bio-One | 456043 | or similar. Label with sample site. 10 needed. |
| Vacutainer tube 5 ml LH Lithium Heparin Separator | Greiner Bio-One | 456305 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 6 mL Serum Clot Activator | Greiner Bio-One | 456089 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 3 ml 9NC Coagulation sodium citrate 3,2% | Greiner Bio-One | 454334 | or similar. Label with sample site. 5 needed. |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site, serum/type of plasma and ID. 90 needed. |
| Marked trays to transport the syringes | to transport the blood samples in the operation theatre | ||
| Rocker | for gentle mixing of the samples | ||
| Ice | in styrofoam box | ||
| Liquid nitrogen | in appropriate container | ||
| Placenta samples | |||
| Metal tray | |||
| Ice | in styrofoam box | ||
| Calibrated scale | |||
| Metal ruler | |||
| 1 M Phosphate buffered saline | Sigma | D1408 | or similar. Dilute 10 M to 1M before use |
| RNA stabilization solution | Sigma | R0901-500ML | or similar |
| Optimal Cutting Temperature (O.C.T.) compound | vwr | 361603E | or similar |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site. content and ID. 10 needed. |
| Centrifuge tubes, conical bottom 50 mL | Greiner Bio-One | 227,285 | or similar. Label with "RNA later", sample site and ID. 2 needed. |
| Liquid nitrogen | in appropriate container | ||
| Fetal body composition | |||
| Calibrated scale | |||
| Measuring tape |
Referências
- Jansson, T., Powell, T. L. Role of the placenta in fetal programming: underlying mechanisms and potential interventional approaches. Clin Sci (Lond). 113 (1), 1-13 (2007).
- Hanson, M. A., Gluckman, P. D. Early developmental conditioning of later health and disease: physiology or pathophysiology. Physiol Rev. 94 (4), 1027-1076 (2014).
- Guttmacher, A. E., Spong, C. Y. The human placenta project: it's time for real time. Am J Obstet Gynecol. 213, 3-5 (2015).
- Battaglia, F. C., Regnault, T. R. Placental transport and metabolism of amino acids. Placenta. 22 (2-3), 145-161 (2001).
- Hay, W. W. Placental-fetal glucose exchange and fetal glucose metabolism. Trans Am Clin Climatol Assoc. 117, 321-339 (2006).
- Woollett, L. A. Review: Transport of maternal cholesterol to the fetal circulation. Placenta. 32, 218-221 (2011).
- Prenton, M. A., Young, M. Umbilical vein-artery and uterine arterio-venous plasma amino acid differences (in the human subject). J Obstet Gynaecol Br Commonw. 76 (5), 404-411 (1969).
- Cetin, I., et al. Plasma and erythrocyte amino acids in mother and fetus. Biol Neonate. 60 (2), 83-91 (1991).
- Filshie, G. M., Anstey, M. D. The distribution of arachidonic acid in plasma and tissues of patients near term undergoing elective or emergency Caesarean section. Br J Obstet Gynaecol. 85 (2), 119-123 (1978).
- Haberey, P. P., Schaefer, A., Nisand, I., Dellenbach, P. The fate and importance of fetal lactate in the human placenta -a new hypothesis. J Perinat Med. 10 (2), 127-129 (1982).
- Prendergast, C. H., et al. Glucose production by the human placenta in vivo. Placenta. 20 (7), 591-598 (1999).
- Metzger, B. E., Rodeck, C., Freinkel, N., Price, J., Young, M. Transplacental arteriovenous gradients for glucose, insulin, glucagon and placental lactogen during normoglycaemia in human pregnancy at term. Placenta. 6 (4), 347-354 (1985).
- Zamudio, S., et al. Hypoglycemia and the origin of hypoxia-induced reduction in human fetal growth. PLoS One. 5 (1), 8551 (2010).
- Holme, A. M., Roland, M. C., Lorentzen, B., Michelsen, T. M., Henriksen, T. Placental glucose transfer: a human in vivo study. PLoS One. 10 (2), 0117084 (2015).
- Holme, A. M., Roland, M. C., Henriksen, T., Michelsen, T. M. In vivo uteroplacental release of placental growth factor and soluble Fms-like tyrosine kinase-1 in normal and preeclamptic pregnancies. Am J Obstet Gynecol. 215 (6), 781-782 (2016).
- Paasche Roland, M. C., Lorentzen, B., Godang, K., Henriksen, T. Uteroplacental arterio-venous difference in soluble VEGFR-1 (sFlt-1), but not in soluble endoglin concentrations in preeclampsia. Placenta. 33 (3), 224-226 (2012).
- Brar, H. S., et al. Uteroplacental unit as a source of elevated circulating prorenin levels in normal pregnancy. Am J Obstet Gynecol. 155 (6), 1223-1226 (1986).
- Myatt, L., et al. Strategy for standardization of preeclampsia research study design. Hypertension. 63 (6), 1293-1301 (2014).
- Kiserud, T., Rasmussen, S. How repeat measurements affect the mean diameter of the umbilical vein and the ductus venosus. Ultrasound Obstet Gynecol. 11 (6), 419-425 (1998).
- Burton, G. J., et al. Optimising sample collection for placental research. Placenta. 35 (1), 9-22 (2014).
- Illsley, N. P., Wang, Z. Q., Gray, A., Sellers, M. C., Jacobs, M. M. Simultaneous preparation of paired, syncytial, microvillous and basal membranes from human placenta. Biochim Biophys Acta. 1029 (2), 218-226 (1990).
- Staff, A. C., Ranheim, T., Khoury, J., Henriksen, T. Increased contents of phospholipids, cholesterol, and lipid peroxides in decidua basalis in women with preeclampsia. Am J Obstet Gynecol. 180 (3), 587-592 (1999).
- Catalano, P. M., Thomas, A. J., Avallone, D. A., Amini, S. B. Anthropometric estimation of neonatal body composition. Am J Obstet Gynecol. 173 (4), 1176-1181 (1995).
- Ellis, K. J., et al. Body-composition assessment in infancy: air-displacement plethysmography compared with a reference 4-compartment model. Am J Clin Nutr. 85 (1), 90-95 (2007).
- Haugen, G., Kiserud, T., Godfrey, K., Crozier, S., Hanson, M. Portal and umbilical venous blood supply to the liver in the human fetus near term. Ultrasound Obstet Gynecol. 24 (6), 599-605 (2004).
- Acharya, G., et al. Experimental validation of uterine artery volume blood flow measurement by Doppler ultrasonography in pregnant sheep. Ultrasound Obstet Gynecol. 29 (4), 401-406 (2007).
- Wu, X., et al. Glutamate-glutamine cycle and exchange in the placenta-fetus unit during late pregnancy. Amino Acids. 47 (1), 45-53 (2015).
- Tuckey, R. C. Progesterone synthesis by the human placenta. Placenta. 26 (4), 273-281 (2005).
- Simmons, M. A., Meschia, G., Makowski, E. L., Battaglia, F. C. Fetal metabolic response to maternal starvation. Pediatr Res. 8 (10), 830-836 (1974).
- Simmons, M. A., Jones, M. D., Battaglia, F. C., Meschia, G. Insulin effect on fetal glucose utilization. Pediatr Res. 12 (2), 90-92 (1978).
- Bujold, E., et al. Evidence supporting that the excess of the sVEGFR-1 concentration in maternal plasma in preeclampsia has a uterine origin. J Matern Fetal Neonatal Med. 18 (1), 9-16 (2005).
- Jansson, T., Aye, I. L., Goberdhan, D. C. The emerging role of mTORC1 signaling in placental nutrient-sensing. Placenta. 33, 23-29 (2012).
- Cetin, I. Placental transport of amino acids in normal and growth-restricted pregnancies. Eur J Obstet Gynecol Reprod Biol. 110, 50-54 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados