Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El Método de Muestreo de 4 Barcos para Estudios Integrativos de la Fisiología Placentaria Humana
En este artículo
Resumen
Presentamos un método detallado para estudiar la fisiología placentaria humana in vivo a término. El método combina el muestreo de sangre de los vasos entrantes y salientes en los lados materno y fetal de la placenta con medidas de ultrasonido del volumen de flujo sanguíneo y el muestreo de tejido placentario.
Resumen
La placenta humana es altamente inaccesible para la investigación mientras todavía en el útero . Por lo tanto, la comprensión actual de la fisiología placentaria humana in vivo se basa en gran medida en estudios con animales, a pesar de la alta diversidad entre las especies en anatomía placentaria, hemodinámica y duración del embarazo. La gran mayoría de los estudios de placenta humana son estudios de perfusión ex vivo o estudios de trofoblastos in vitro . Aunque los estudios in vitro y los modelos animales son esenciales, la extrapolación de los resultados de tales estudios a la placenta humana in vivo es incierta. Nuestro objetivo es estudiar la fisiología de la placenta humana in vivo a término, y presentar un protocolo detallado del método. Aprovechando el acceso intraabdominal a la vena uterina justo antes de la incisión uterina durante la cesárea planificada, recolectamos muestras de sangre de los vasos entrantes y salientes en los lados materno y fetal de la placenta. Cuando se combina conCentración de las muestras de sangre con el volumen de las mediciones de flujo sanguíneo, somos capaces de cuantificar la absorción placentaria y fetal y la liberación de cualquier compuesto. Además, las muestras de tejido placentario de los mismos pares madre-feto pueden proporcionar mediciones de la densidad y actividad del transportador y otros aspectos de las funciones placentarias in vivo . A través de este uso integrador del método de muestreo de 4 vasos podemos probar algunos de los conceptos actuales de transferencia de nutrientes placentarios y metabolismo in vivo , tanto en embarazos normales como patológicos. Además, este método permite la identificación de sustancias secretadas por la placenta a la circulación materna, lo que podría ser una importante contribución a la búsqueda de biomarcadores de disfunción placentaria.
Introducción
Según los Institutos Nacionales de Salud, Estados Unidos, la placenta es el órgano menos comprendido en el cuerpo humano 1 , 2 , 3 . Es difícil acceder y estudiar la placenta humana in vivo sin imponer riesgos no éticos en el embarazo en curso. Los estudios de la función placentaria en humanos se basan en gran medida en modelos in vitro y ex vivo . La mayoría de los estudios previos in vivo del transporte placentario y del metabolismo se han realizado en animales 4 , 5 , 6 . Sin embargo, como la estructura y las funciones de la placenta varían considerablemente entre las especies, la extrapolación de los resultados de los animales a los seres humanos debe hacerse con precaución. Sólo unos cuantos estudios humanos in vivo más pequeños han investigado la captación y el transporte fetal y placentario bajo condiciones fisiológicas normalesY ninguno ha explorado la transferencia integrada de varios compuestos 7 , 8 , 9 , 10 , 11 , 12 , 13 . Estos estudios fundamentales ilustran que los estudios in vivo de la placenta humana son factibles y que pueden servir a varios propósitos. En primer lugar, los conceptos actuales de las funciones placentarias derivadas principalmente de estudios in vitro , ex vivo y en animales pueden ser probados en un entorno humano y, por lo tanto, proporcionar una visión nueva y más específica de la placenta humana. En segundo lugar, se pueden caracterizar mejor las propiedades de la placenta disfuncional asociada con el crecimiento fetal aberrante, la preeclampsia, la diabetes materna, el síndrome metabólico y otras alteraciones metabólicas maternas. En tercer lugar, los estudios humanos in vivo ofrecen la oportunidad deTicas y predictivas de la función placentaria.
En este contexto nos propusimos establecer una colección completa de datos fisiológicos para investigar la función placentaria humana in vivo. Durante una cesárea planificada, explotamos el acceso intraabdominal a la vena uterina para recolectar muestras de sangre de los vasos entrantes y salientes en los lados materno y fetal de la placenta (el método de muestreo de 4 vasos). Estas muestras se utilizan para calcular las diferencias de la concentración arteriovenosa pareada de nutrientes y otras sustancias [ 14] . Además, medimos el flujo sanguíneo de volumen a ambos lados de la placenta por ultrasonido. En consecuencia, la cuantificación de la absorción placentaria y fetal de cualquier compuesto puede ser cuantificada. Además, es posible determinar las sustancias liberadas por la placenta a las circulaciones materna y fetal 15 , 16 , 17 . Cuando combineD con los parámetros clínicos de la madre y el niño, y análisis de placenta y otros tejidos relevantes, este método tiene el potencial emocionante para integrar muchos aspectos de las funciones placentarias in vivo en el mismo par madre-feto.
Protocolo
El estudio fue aprobado por los funcionarios de protección de datos del Hospital Universitario de Oslo y del Comité Regional de Ética en Investigación Médica y Sanitaria del sur de Noruega 2419/2011. Todos los participantes firmaron un consentimiento informado por escrito en la inclusión.
1. Preparaciones
NOTA: En la Figura 1 se describe un cronograma para los procedimientos.
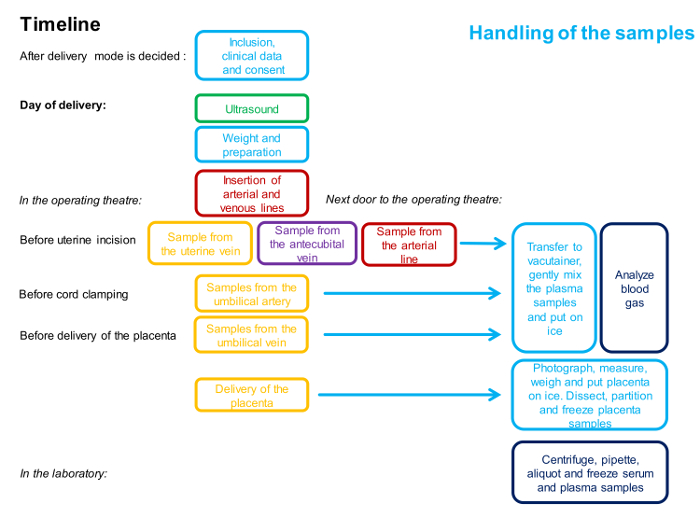
Figura 1 : Diagrama de flujo que describe el tiempo y el personal involucrado en el procedimiento de muestreo de 4 vasos.
Un color representa a una persona. La descripción detallada del método se da en el protocolo. Haga clic aquí para ver una versión más grande de esta figura.
- Personal
- Asegúrese de que todo el personal necesario esté disponible: un especialista en Medicina Fetal altamente cualificado que realiza las mediciones de ultrasonido, dos obstetras que realizan la cirugía, uno de los obstetras y dos enfermeras que recogen las muestras, un asistente que Otras muestras consecutivas e inmediatamente después de la recolección.
NOTA: En casos de recolección más avanzada de tejido placentario, se requiere una persona adicional.
- Asegúrese de que todo el personal necesario esté disponible: un especialista en Medicina Fetal altamente cualificado que realiza las mediciones de ultrasonido, dos obstetras que realizan la cirugía, uno de los obstetras y dos enfermeras que recogen las muestras, un asistente que Otras muestras consecutivas e inmediatamente después de la recolección.
- Equipo
- Preparar el equipo, 50 ml de solución salina tamponada con fosfato 1 M (PBS) helada, 25 ml de solución estabilizadora de ARN frío y 5 x 0,5 ml de compuesto óptimo de temperatura de corte (OCT). Etiquete los vacutainers y los tubos. Ver lista tentativa de equipos.
2. Características maternas
- Registre las características clínicas y no clínicas maternas en la inclusión y repita las preguntas pertinentes y yoPeso, en el momento de la entrega. Anote la duración del período de ayuno antes de la cesárea y cualquier episodio hipotensivo que ocurra durante la cirugía.
Nota: Incluya el conjunto de datos clínicos maternos mínimos reportados en una publicación reciente de Global Labour Pregnancy CoLaboratory (COLAB). Este artículo también incluye algunos aspectos muy importantes en la elección de las poblaciones de estudio y debe ser abordado durante la planificación del estudio [ 18] . - Considere la posibilidad de registrar características paternales, incluyendo etnicidad, edad e índice de masa corporal (IMC).
3. Ultrasonido
- Realizar el examen de ultrasonido Doppler el día del parto, con las mujeres en estado de ayuno. Realizar el examen durante un período de reposo fetal, con la mujer en posición semi-supina, inclinada ligeramente lateralmente opuesta a la región de interés para evitar la compresión de la aorta y la vena cava. Supervisar la salida enTensión por los índices mecánicos y térmicos en la pantalla.
- Vena umbilical
- Visualice la vena umbilical en una transección sagital u oblicua del abdomen fetal. Mida el diámetro interno del vaso en la porción recta de la vena umbilical intraabdominal, antes de cualquier rama visible. Utilice el modo B normal y visualice el vaso en un ángulo de insonación perpendicular para las mediciones de diámetro y mantenga varios marcos óptimos para mediciones posteriores para minimizar el efecto de los cambios de diámetro pulsátil.
- Repetir las mediciones de cinco a diez veces 19 .
- En el mismo sitio, use ultrasonido Doppler y ajuste la sonda para obtener un ángulo de insonación lo más bajo posible (siempre <30 °) para medir la velocidad máxima programada en el tiempo (TAMX). Obtener la velocidad durante un período de 3 - 5 s (flujo no pulsante).
- Visualice la vena umbilical en una transección sagital u oblicua del abdomen fetal. Mida el diámetro interno del vaso en la porción recta de la vena umbilical intraabdominal, antes de cualquier rama visible. Utilice el modo B normal y visualice el vaso en un ángulo de insonación perpendicular para las mediciones de diámetro y mantenga varios marcos óptimos para mediciones posteriores para minimizar el efecto de los cambios de diámetro pulsátil.
- Arteria uterina
- Utilizar DopplerUltrasonido para visualizar la arteria uterina al cruzar la arteria ilíaca externa, inmediatamente después de que se ramifica desde la arteria ilíaca interna. Ajuste la sonda en este sitio para obtener un ángulo de insonación bajo (siempre <30 °) y mida el TAMX. Obtener la velocidad como la velocidad media de tres ciclos del corazón.
- Como es poco probable que obtenga un ángulo perpendicular en el mismo sitio en que se mide TAMX, siga el vaso distalmente para obtener un ángulo correcto para las mediciones de diámetro tan cerca de los sitios de las mediciones de diámetro como sea posible. Excluya las mediciones de diámetro si algún vaso visible se ramifica antes de este sitio, evaluado por ecografía Doppler color.
- Utilice el modo B normal y visualice el vaso en un ángulo de insonación perpendicular para las mediciones de diámetro y mantenga varios marcos óptimos para mediciones posteriores para minimizar el efecto de los cambios de diámetro pulsátil.
- Repetir las mediciones de cinco a diez veces 19 .
- Observe la posición de la placenta.
4. Muestreo de sangre de 4 vasos
NOTA: La línea de tiempo para los procedimientos se describe en la Figura 1 y en la Figura 2 se ilustra un resumen de las muestras.
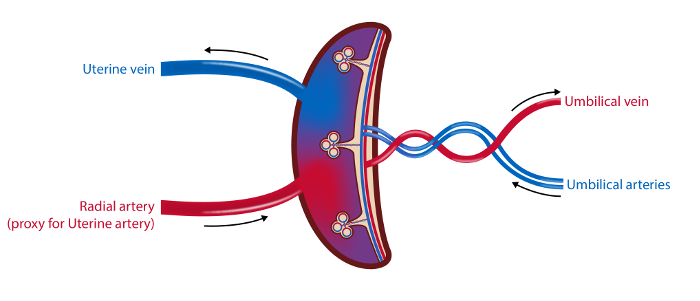
Figura 2 : Ilustración esquemática de la vasculatura placentaria y los sitios de muestreo.
En el método de muestreo de 4 vasos se extraen muestras de sangre de la vena uterina, la arteria radial (como un sustituto de la arteria uterina) y las arterias y venas umbilicales. El flujo sanguíneo en la arteria uterina y la vena umbilical se mide por ultrasonido. Se recogen muestras de tejidos de la placenta. Ilustración: Øystein H. Horgmo, Universidad de Oslo.5847fig2large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
- Procedimientos de seguridad
- Proporcionar a todo el personal en el teatro de operaciones con guantes, trajes quirúrgicos, máscaras y sombreros.
- Proporcionar a los cirujanos y personal de investigación en contacto con el campo de la operación con trajes quirúrgicos de fregado, máscaras, headwear, batas y guantes dobles. Las gafas son opcionales.
- Proporcionar al personal que manipula las muestras de sangre con guantes.
- Proporcionar al personal que maneja las muestras de placenta con guantes y máscara quirúrgica. La homogeneización requiere el uso de campanas.
- Preparación en el teatro de operaciones
- Dar un briefing y entregar el equipo a todo el personal que ayudará al muestreo antes del inicio de la cirugía.
- Dirigirse al anestesiólogo ya la enfermera de anestesiología que le ayudarán con el necesario acceso arterial y venoso periférico y asegurar queNo se administran líquidos por vía intravenosa antes del muestreo.
- Administre tres jeringas (10 ml) sin agujas a la persona que asiste con la muestra de vena antecubital y dos jeringas (una de 20 ml y una de 10 ml) y una jeringa de gas de sangre (con heparina) a la persona que asiste con la arteria radial.
- Prepare dos jeringuillas estériles (20 ml), cinco jeringas estériles (10 ml), tres "agujas de mariposa" y dos jeringas de gas en sangre para el campo de operación.
- Acceso a los vasos sanguíneos.
- Siga el procedimiento estándar antes de la cesárea para asegurar el acceso intravenoso periférico (iv).
NOTA: La vena antecubital es preferible porque es más fácil extraer muestras de este sitio. - Localizar la arteria radial en la muñeca por ultrasonido o por palpación. Después de 0,5 ml de analgesia subcutánea de lidocaína, coloque una línea arterial en la arteria radial. Abandone el muestreo de este sitio en caso de tres inserciones fallidas, oSi la mujer experimenta dolor durante la inserción.
NOTA: Realizar el procedimiento quirúrgico de la cesárea según el procedimiento estándar. Sólo los ajustes necesarios para el procedimiento de muestreo se subrayan a continuación.
- Siga el procedimiento estándar antes de la cesárea para asegurar el acceso intravenoso periférico (iv).
- Muestras de sangre materna
NOTA: Obtenga las tres muestras de sangre materna (vena uterina, arteria radial y vena antecubital) simultáneamente antes de la incisión uterina.- Para la vena uterina, después de abrir la cavidad abdominal, use un retractor para levantar la pared abdominal y exponer las ramas principales de las venas uterinas en los lados anterolaterales del útero. Obtenga sangre de las ramas de la vena uterina en el mismo lado que la placenta siempre que sea posible o use el plexo venoso más prominente si la placenta se encuentra en la línea media uterina.
- Inserte una aguja de mariposa en una jeringa de gas en la vena uterina en un ángulo de aproximadamente 30 grados y recoger sangre a través de la aspiración suave para evitarHemólisis Mientras asegura cuidadosamente la posición iv de la aguja de mariposa, reemplace la jeringa de gas de sangre llena por una jeringuilla de 20 ml y una de 10 ml consecutivamente.
NOTA: El mejor acceso se garantiza cuando se está de pie sobre el lado contralateral de la vena uterina elegida.
- Inserte una aguja de mariposa en una jeringa de gas en la vena uterina en un ángulo de aproximadamente 30 grados y recoger sangre a través de la aspiración suave para evitarHemólisis Mientras asegura cuidadosamente la posición iv de la aguja de mariposa, reemplace la jeringa de gas de sangre llena por una jeringuilla de 20 ml y una de 10 ml consecutivamente.
- Para la arteria radial, aspirar desde la línea intraarterial. Deseche los primeros 5 mL, y luego aspirar 3 mL en jeringa de heparina para análisis de gas en sangre, seguido de 3 mL en dos jeringas (20 + 10 mL).
- Para la vena antecubital, aspirar suavemente del catéter intravenoso. Deseche los primeros 5 mL, y luego aspirar 30 mL en tres jeringas (10 mL).
- Realizar una inspección final del sitio de muestreo en la vena uterina antes de comenzar a cerrar el abdomen.
- Para la vena uterina, después de abrir la cavidad abdominal, use un retractor para levantar la pared abdominal y exponer las ramas principales de las venas uterinas en los lados anterolaterales del útero. Obtenga sangre de las ramas de la vena uterina en el mismo lado que la placenta siempre que sea posible o use el plexo venoso más prominente si la placenta se encuentra en la línea media uterina.
- Muestras de sangre fetal
- Cuando el niño nace, aspire inmediatamente la sangre de la arteria umbilical, sin apretar el cordón umbilical ni entregar la placenta. Empezar ingenioH la jeringa para el análisis de gas en sangre, y siga con tres jeringas de 10 ml si es posible.
- Cuando las muestras arteriales estén aseguradas, sujete el cordón y entregue al niño a la partera antes de tomar muestras de la vena umbilical (gas en sangre y jeringas de 20 + 10 ml).
NOTA: Obtenga todas las muestras umbilicales dentro de los segundos del parto y con la placenta in situ a menos que se haya separado espontáneamente. - Siga las recomendaciones de Noruega sobre el pinzamiento tardío del cordón umbilical. En caso de un niño en dificultades, abrazadera y cortar el cordón inmediatamente y la mano del niño a la partera y neonatólogo.
- Manejo de muestras de sangre
- Coloque las jeringas de gas en el hielo mientras prepara el resto de las muestras de sangre, y analizarlas en un analizador de gases en 5 minutos.
- Transferir las muestras de sangre inmediatamente a vacutainers y colocar los tubos de plasma en un balancín de 1 - 2 min antes de ponerlos en el hielo. Dejar los tubos de suero en la mano de obraAtory banco para resolver durante 30 minutos.
NOTA: Este es un paso crítico en el procedimiento que necesita atención adicional porque las muestras de los cinco sitios deben prepararse simultáneamente para asegurar una buena calidad. - Centrifugar las muestras de plasma lo antes posible, y en 30 minutos, a 6 ° C, 2.500 xg durante 20 min.
- Después de 30 min, centrifugar las muestras de suero a temperatura ambiente durante 10 min a 2.500 x g.
- Alícuota de los sobrenadantes cuidadosamente a 2 ml de tubos cryo, dejando 0,5 ml del sobrenadante por encima del pellet para asegurar plasma libre de plaquetas.
- Almacenar las muestras a -80 ° C.
5. Recolección de tejido placentario
- Coloque la placenta plana sobre una bandeja de disección enfriada con hielo lo más pronto posible después de haber sido entregada. Fotografíe y mida el diámetro más largo y el diámetro a 90 grados.
- Pesar la placenta.
- Registre el peso, los dos diámetros, cualquier gRoss patología, el número de vasos en el cordón y el intervalo de tiempo desde la entrega a la placenta se colocó en hielo.
NOTA: Envíe la placenta al examen patológico si está clínicamente indicado. - Colocar la placenta con la superficie materna hacia arriba e identificar 4 - 5 sitios de muestreo situados aleatoriamente en cada cuadrante de la placenta, evitando áreas de patología franca. Retire la decidua con unas tijeras para cortar a 3 - 5 mm de la superficie materna. Recoger un pedazo de 1 - 2 cm 3 de tejido villoso de cada sitio.
- Lave el tejido recolectado suavemente en 50 mL de PBS 1M frío. Divida en varias piezas de cada sitio de muestreo y alícuota.
Nota: El tamaño de las piezas de placenta dependerá de los análisis planificados. - Añadir alícuotas de 0,1 - 0,5 cm 3 muestras de tejido a 5 tubos cryo y congelación rápida en nitrógeno líquido.
- Añadir pequeños trozos de 0,1 - 0,2 cm 3 al tubo con 25 ml de solución de estabilización de ARN. Tienda a las 46; C durante 24 h, desechar la solución de estabilización de ARN y reemplazarla. Congelar.
- Añadir trozos de 0,5 cm 3 a los 5 tubos cryo con 0,5 mL de OCT, rellenar con OCT, mezclar y congelar.
- Almacene las muestras a -80 ° C hasta su análisis.
NOTA: Burton et al. Proporciona una excelente visión general de los aspectos prácticos del muestreo placentario en función de los análisis previstos. 20 considerar para preparar el tejido restante para el aislamiento de las membranas de microvellosidades y basal, y para recoger el tejido decidual por la técnica de succión de vacío. 21 , 22
6. Características Neonatales
- Anote las características neonatales, incluyendo Apgar-score (1, 5 y 10 min), sexo, peso, longitud, edad gestacional y admisión a la Unidad de Cuidados Intensivos de Recién Nacidos (duración y resultado de la estancia).
- Considere la posibilidad de medir la composición corporal neonatal mediante medidas antropométricas, desplazamiento de airePletismógrafo o doble absorciometría de rayos X. 23 , 24
7. Cálculos
- Suponga una composición sanguínea similar en la arteria radial y uterina y calcule la diferencia de concentración arteriovenosa uteroplacentaria.
Diferencia de la concentración arteriovenosa uteroplacentaria = C A - C V
Diferencia de la diferencia venoso - arterial umbilical = C v - C a
Donde C es concentración con subíndices: A, la arteria radial; V, la vena uterina; V la vena umbilical y a, la arteria umbilical. - Calcular el volumen de flujo sanguíneo, ml / min (Q):
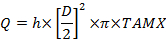
Donde D es el diámetro del recipiente (cm), TAMX es la velocidad máxima promediada en el tiempo y h es el coeficiente para el perfil espacial de la velocidad de la sangre. Utilizar 0,5 como coeficiente para la vena umbilical y0,6 para la arteria uterina 25 , 26 . - Calcular la captación y liberación placentaria según el principio de Fick:
Captación uteroplacentaria = ( C A - C V ) x Qm
Captación fetal = ( C v - C a ) X Q f
Subíndices: m, materna y f, fetal.
Resultados
El método de muestreo de 4 vasos es aplicable en la práctica clínica y hemos obtenido con éxito muestras de sangre de 209 pares madre / bebé. En 128 de estos también se logró medir el volumen de flujo sanguíneo. Se obtuvieron muestreos completos de 4 recipientes y mediciones de flujo de buena calidad de ambos vasos maternos y fetales en 70 pares madre-feto ( Figura 3 ). Además, hasta ahora hemos recogido sangre y muestras de placenta de 30 pacientes...
Discusión
El método de muestreo de 4 vasos de placenta es relevante para tres propósitos principales. En primer lugar, puede utilizarse para estudiar cómo las sustancias específicas son absorbidas por la placenta en el lado materno y posiblemente transferidas a la circulación umbilical y al feto, como lo demuestran nuestros estudios sobre glucosa y aminoácidos. En segundo lugar, el método es altamente relevante para estudiar las sustancias producidas por la placenta y liberadas a las circulaciones materna o fetal, co...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
En primer lugar, agradecemos sinceramente a las madres que participaron en este proyecto. A continuación, reconocemos todo el personal que asistió y facilitó el procedimiento de muestreo, el Anestesiólogo, la enfermera anestesióloga y las enfermeras quirúrgicas. El proyecto no habría sido posible sin el financiamiento de la Autoridad Regional de Salud de la Región Sudoriental de Noruega y de la Unidad Asesora Noruego de Salud de la Mujer, la Universidad de Oslo y el financiamiento local proporcionado por el Hospital Universitario de Oslo.
Materiales
| Name | Company | Catalog Number | Comments |
| Maternal body composition | |||
| Impedance scale | Tanita | or similar | |
| Ultrasound measurements | |||
| Sequoia 512 ultrasound machine | Acuson | equipped with a curved transducer with colour and pulsewave Doppler (frequency bandwidth 2-6 MHz) | |
| Blood samples | |||
| Arerial cannula | BD Medical | 682245 | or similar |
| 20cc Eccentric Luer Tip Syringe without Needle | Termo | SS-20ES | or similar. 3 needed. |
| 10cc Eccentric Luer Tip Syringe without Needle | Termo | SS-10ES | or similar. 9 needed. |
| 5cc 6% Luer Syringe without Needle | Termo | SS-05S1 | or similar. 2 needed. |
| Arterial blood gas syringe | Radiometer Medical | or similar. 4 needed. | |
| Sterile winged needle connected to flexible tubing, 21 gauge | Greiner Bio-One | 450081 | (intended for single use).3 needed. |
| Vacutainer tube 6 mL EDTA | Greiner Bio-One | 456043 | or similar. Label with sample site. 10 needed. |
| Vacutainer tube 5 ml LH Lithium Heparin Separator | Greiner Bio-One | 456305 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 6 mL Serum Clot Activator | Greiner Bio-One | 456089 | or similar. Label with sample site. 5 needed. |
| Vacutainer tube 3 ml 9NC Coagulation sodium citrate 3,2% | Greiner Bio-One | 454334 | or similar. Label with sample site. 5 needed. |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site, serum/type of plasma and ID. 90 needed. |
| Marked trays to transport the syringes | to transport the blood samples in the operation theatre | ||
| Rocker | for gentle mixing of the samples | ||
| Ice | in styrofoam box | ||
| Liquid nitrogen | in appropriate container | ||
| Placenta samples | |||
| Metal tray | |||
| Ice | in styrofoam box | ||
| Calibrated scale | |||
| Metal ruler | |||
| 1 M Phosphate buffered saline | Sigma | D1408 | or similar. Dilute 10 M to 1M before use |
| RNA stabilization solution | Sigma | R0901-500ML | or similar |
| Optimal Cutting Temperature (O.C.T.) compound | vwr | 361603E | or similar |
| Cryogenic vials, 2.0 mL | Corning | 430488 | or similar. Label with sample site. content and ID. 10 needed. |
| Centrifuge tubes, conical bottom 50 mL | Greiner Bio-One | 227,285 | or similar. Label with "RNA later", sample site and ID. 2 needed. |
| Liquid nitrogen | in appropriate container | ||
| Fetal body composition | |||
| Calibrated scale | |||
| Measuring tape |
Referencias
- Jansson, T., Powell, T. L. Role of the placenta in fetal programming: underlying mechanisms and potential interventional approaches. Clin Sci (Lond). 113 (1), 1-13 (2007).
- Hanson, M. A., Gluckman, P. D. Early developmental conditioning of later health and disease: physiology or pathophysiology. Physiol Rev. 94 (4), 1027-1076 (2014).
- Guttmacher, A. E., Spong, C. Y. The human placenta project: it's time for real time. Am J Obstet Gynecol. 213, 3-5 (2015).
- Battaglia, F. C., Regnault, T. R. Placental transport and metabolism of amino acids. Placenta. 22 (2-3), 145-161 (2001).
- Hay, W. W. Placental-fetal glucose exchange and fetal glucose metabolism. Trans Am Clin Climatol Assoc. 117, 321-339 (2006).
- Woollett, L. A. Review: Transport of maternal cholesterol to the fetal circulation. Placenta. 32, 218-221 (2011).
- Prenton, M. A., Young, M. Umbilical vein-artery and uterine arterio-venous plasma amino acid differences (in the human subject). J Obstet Gynaecol Br Commonw. 76 (5), 404-411 (1969).
- Cetin, I., et al. Plasma and erythrocyte amino acids in mother and fetus. Biol Neonate. 60 (2), 83-91 (1991).
- Filshie, G. M., Anstey, M. D. The distribution of arachidonic acid in plasma and tissues of patients near term undergoing elective or emergency Caesarean section. Br J Obstet Gynaecol. 85 (2), 119-123 (1978).
- Haberey, P. P., Schaefer, A., Nisand, I., Dellenbach, P. The fate and importance of fetal lactate in the human placenta -a new hypothesis. J Perinat Med. 10 (2), 127-129 (1982).
- Prendergast, C. H., et al. Glucose production by the human placenta in vivo. Placenta. 20 (7), 591-598 (1999).
- Metzger, B. E., Rodeck, C., Freinkel, N., Price, J., Young, M. Transplacental arteriovenous gradients for glucose, insulin, glucagon and placental lactogen during normoglycaemia in human pregnancy at term. Placenta. 6 (4), 347-354 (1985).
- Zamudio, S., et al. Hypoglycemia and the origin of hypoxia-induced reduction in human fetal growth. PLoS One. 5 (1), 8551 (2010).
- Holme, A. M., Roland, M. C., Lorentzen, B., Michelsen, T. M., Henriksen, T. Placental glucose transfer: a human in vivo study. PLoS One. 10 (2), 0117084 (2015).
- Holme, A. M., Roland, M. C., Henriksen, T., Michelsen, T. M. In vivo uteroplacental release of placental growth factor and soluble Fms-like tyrosine kinase-1 in normal and preeclamptic pregnancies. Am J Obstet Gynecol. 215 (6), 781-782 (2016).
- Paasche Roland, M. C., Lorentzen, B., Godang, K., Henriksen, T. Uteroplacental arterio-venous difference in soluble VEGFR-1 (sFlt-1), but not in soluble endoglin concentrations in preeclampsia. Placenta. 33 (3), 224-226 (2012).
- Brar, H. S., et al. Uteroplacental unit as a source of elevated circulating prorenin levels in normal pregnancy. Am J Obstet Gynecol. 155 (6), 1223-1226 (1986).
- Myatt, L., et al. Strategy for standardization of preeclampsia research study design. Hypertension. 63 (6), 1293-1301 (2014).
- Kiserud, T., Rasmussen, S. How repeat measurements affect the mean diameter of the umbilical vein and the ductus venosus. Ultrasound Obstet Gynecol. 11 (6), 419-425 (1998).
- Burton, G. J., et al. Optimising sample collection for placental research. Placenta. 35 (1), 9-22 (2014).
- Illsley, N. P., Wang, Z. Q., Gray, A., Sellers, M. C., Jacobs, M. M. Simultaneous preparation of paired, syncytial, microvillous and basal membranes from human placenta. Biochim Biophys Acta. 1029 (2), 218-226 (1990).
- Staff, A. C., Ranheim, T., Khoury, J., Henriksen, T. Increased contents of phospholipids, cholesterol, and lipid peroxides in decidua basalis in women with preeclampsia. Am J Obstet Gynecol. 180 (3), 587-592 (1999).
- Catalano, P. M., Thomas, A. J., Avallone, D. A., Amini, S. B. Anthropometric estimation of neonatal body composition. Am J Obstet Gynecol. 173 (4), 1176-1181 (1995).
- Ellis, K. J., et al. Body-composition assessment in infancy: air-displacement plethysmography compared with a reference 4-compartment model. Am J Clin Nutr. 85 (1), 90-95 (2007).
- Haugen, G., Kiserud, T., Godfrey, K., Crozier, S., Hanson, M. Portal and umbilical venous blood supply to the liver in the human fetus near term. Ultrasound Obstet Gynecol. 24 (6), 599-605 (2004).
- Acharya, G., et al. Experimental validation of uterine artery volume blood flow measurement by Doppler ultrasonography in pregnant sheep. Ultrasound Obstet Gynecol. 29 (4), 401-406 (2007).
- Wu, X., et al. Glutamate-glutamine cycle and exchange in the placenta-fetus unit during late pregnancy. Amino Acids. 47 (1), 45-53 (2015).
- Tuckey, R. C. Progesterone synthesis by the human placenta. Placenta. 26 (4), 273-281 (2005).
- Simmons, M. A., Meschia, G., Makowski, E. L., Battaglia, F. C. Fetal metabolic response to maternal starvation. Pediatr Res. 8 (10), 830-836 (1974).
- Simmons, M. A., Jones, M. D., Battaglia, F. C., Meschia, G. Insulin effect on fetal glucose utilization. Pediatr Res. 12 (2), 90-92 (1978).
- Bujold, E., et al. Evidence supporting that the excess of the sVEGFR-1 concentration in maternal plasma in preeclampsia has a uterine origin. J Matern Fetal Neonatal Med. 18 (1), 9-16 (2005).
- Jansson, T., Aye, I. L., Goberdhan, D. C. The emerging role of mTORC1 signaling in placental nutrient-sensing. Placenta. 33, 23-29 (2012).
- Cetin, I. Placental transport of amino acids in normal and growth-restricted pregnancies. Eur J Obstet Gynecol Reprod Biol. 110, 50-54 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados