A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بروتوكول لتجميع المرحلة الصلبة من أوليغوميرس من الحمض النووي الريبي تحتوي على 2'-
In This Article
Summary
توفر هذه المقالة إجراء مفصل على التوليف المرحلة الصلبة، وتنقية، وتوصيف دوديكامرز من الحمض النووي الريبي تعديلها في C2'- O -position. وتستخدم الأشعة فوق البنفسجية والدائرية تحلل ضوئي اللون الضوئية لتحديد وتوصيف الجوانب الهيكلية، أي أحادية أو خيوط مزدوجة.
Abstract
وقد تم استخدام توليف المرحلة الصلبة للحصول على البوليمرات الكنسي والمعدلة من الأحماض النووية، وتحديدا من الحمض النووي أو الحمض النووي الريبي، مما جعلها منهجية شعبية للتطبيقات في مختلف المجالات ولأغراض بحثية مختلفة. ويركز الإجراء الموصوف هنا على تخليق وتنقية وتوصيف دوديكامرز من الحمض النووي الريبي 5 '- [كوا كغغ أو كاو] -3' تحتوي على صفر، واحد، أو اثنين من التعديلات الموجودة في C2'- O- وضع. وتستند تحقيقات مجموعات 2-ثيوفينيل ميثيل، دمجها في النيوكليوتيدات رنا عن طريق التوليف العضوي القياسية وأدخلت في أوليغونوكلأوتيدس المقابلة عبر الفوسفوراميديت منها. يستعمل هذا التقرير كيمياء الفوسفوراميديت من خلال القواعد النووية الأساسية الأربعة (أوريدين (U)، سايتوسين (C)، غوانوسين (G)، أدينوسين (A))، فضلا عن النيوكليوتيدات 2-ثيوفينيل ميثيل فونكتيوناليزد تعديل في 2'- O- موضع؛ ومع ذلك، فإن منهجية قابلة للفارق كبيرآية من التعديلات التي تم تطويرها على مر السنين. تم تصنيع أوليغونوكلأوتيدس على دعم الزجاج المسام (كبغ) تليها الانقسام من الراتنج و ديبروتكتيون في ظل ظروف قياسية، أي خليط من الأمونيا وميثيل أمين (أما) تليها فلوريد الهيدروجين / ثلاثي إيثيل أمين / N- ميثيل بيروليدينون. تم تنقية أوليغونوكلأوتيدس المقابلة من خلال الكهربائي الكهربائي بولي أكريلاميد (20٪ تغيير طبيعة) تليها شطف، تحلية، والعزلة عبر كروماتوغرافي المرحلة عكس (سيب-باك، C 18 عمود). تم تقييم الكمي والبارامترات الهيكلية من خلال تحليل الأشعة فوق البنفسجية المرئية (أوف-فيس) والتحليل الضوئي ثنائي الأبعاد (سد) على التوالي. ويهدف هذا التقرير ليكون بمثابة مصدر ودليل للباحثين المبتدئين والخبراء المهتمين في الشروع في هذا المجال. ومن المتوقع أن تكون بمثابة عمل جار مع تطوير تكنولوجيات ومنهجيات جديدة. وصف المنهجيات والتقنيات داخل ثيق تتوافق مع المزج دنا / رنا (تجديدها وشرائها في عام 2013) الذي يستخدم الكيمياء الفوسفوراميديت.
Introduction
التوليف المرحلة الصلبة للحصول على أوليغونوكلأوتيدس من الحمض النووي / رنا هو أداة قوية التي خدمت العديد من التطبيقات في مختلف المجالات منذ 1970s 1 ، 2 ، 3 باستخدام اللبنات الفوسفوراميديت 4 . وتشمل الأمثلة على تأثيره الواسع ما يلي: تأثيره في وضع العلامات ( عن طريق تفاعلات الكيمياء النقية) 5 ، والتحقيق الهيكلي 6 ، والتكنولوجيات المضادة للعوامل 7 ، فضلا عن توضيح الآليات البيولوجية 8 و 9 والمصدر كمادة جينية 10 ، ودراسة مختلف التعديلات الطبيعية و / أو الكيميائية 11 ، 12 ، من بين العديد من الآخرين.التعديل الذي نستخدمه هنا يمثل الخطوة الأولى في جهودنا للحصول على أوليغونوكلأوتيدس الحمض النووي الريبي التي تحتوي علىتحقيقات فوتواكتيف لتمكين السيطرة الزمنية لهيكل ووظيفة هذا البوليمر الحيوي المهم.
تركيب دوديكامرات الحمض النووي الريبي مع تسلسل: 5 '- [كوا سغ G A أو كاو] -3' / 5 '- [أوج أو كغ واغ] -3' (تمثل المواقف تحتها خط إدراج تعديل C2'- O- ثيوفينيل ميثيل ) تشكل محور هذه الدراسة. تم اختيار تسلسل لتمكين القياس الكمي وقياس خيوط الحمض النووي الريبي كخيط واحد، أو على شكل الهياكل المزدوجة المقابلة لها (لم يتم توقع أي هياكل ثانوية أخرى مستقرة ثيرموديناميكيا). وقد استخدم القرص المضغوط لتحديد البارامترات الهيكلية، أي التشكيل المزدوج والتحولات الحرارية.
نتيجة الجمع بين الطريحة والنقيضة
الإجراء العام للحصول على هذه أوليغونوكلأوتيدس هو موضح في الشكل 1 ويتبع عملية متدرجة: الآلي الصلبة مرحلة التوليف → ديبرأوتكتيون → تنقية → الكمي → توصيف. الشكل 2 يعرض وحدات أحادية ضرورية في هذا الإجراء. تركيب المرحلة الصلبة من الحمض النووي الريبي مشابه لتلك التي من الحمض النووي في أنه يقوم على الكيمياء الفوسفوراميديت ( الشكل 2 ، اليسار) واستخدام مجموعات حماية قاعدة عاملة للأمينات الحلقي نيوكليوفيليك على G و A و C، على سبيل المثال ، أسيتيل، بنزويل، فينوكسياستيل، t- البوتيل أو N ، N- ثنائي ميثيل فورماميد ( الشكل 2 ، والحق). ومن الجوانب الأخرى التي يجب مراعاتها في الحمض النووي الريبي (رنا)، بسبب وجود مجموعة C2'-أوه (التي تفتقر إلى البوليمرات الحيوية ديوكسيوليغونوكليوتيد)، هي الخطوة الإضافية التي يجب إدراجها لحماية هذا الوضع النوكليوفيلي، وما يتبعه من حماية. في هذا الصدد، أصبحت مجموعات الحماية القائمة على السيليكون استراتيجية جذابة نظرا لقدراتها كما شذوذ بيورثوغونال (سبيسيفيكالdeprotected ذ في وجود الفلورايد)، مع -butyldimethylsilyl ثالثي (TBDMS) والجماعات triisopropylsilyloxymethyl (TOM) كخيارات شعبية (الشكل 2، أسفل اليسار).
في هذا العمل، تم إجراء التوليف الآلي على المزج الحمض النووي / الحمض النووي الريبي الذي يستخدم الكيمياء الفوسفوراميديت القياسية. وتشمل إعدادات المصنع على الصك خطوة التخفيف الآلي عند استخدام الإصدارات التجارية من الفوسفوراميديتس للحمض النووي، أو خيار لتخفيف في وحدات التخزين التي يحددها المستخدم. ومع ذلك، قررنا أن تزن الفوسفوراميديت الحمض النووي الريبي وتمييع يدويا نظرا لما يلي: 1) سعر الفوسفوراميديتس الكنسي من الحمض النووي الريبي هو أعلى (تصل إلى 50 مرات أكثر تكلفة في بعض الحالات). 2) غالبا ما يتم الحصول على الفوسفوراميديت المعدلة بكميات صغيرة. و 3) كمية المواد المهدرة عند استخدام خطوة التخفيف الآلي (التي وضعتها الشركة المصنعة) كبيرة. وبالإضافة إلى ذلك، استخدمنا: 1) المتاحة تجاريا الصلبة الدعم(على سبيل المثال ، كبغ) تحتوي على نوكليوباس المحمية لتكون بمثابة 3'نهاية. و 2) الفوسفوراميديتس التجارية (نوكليوباسيس الكنسي) محمية مع مجموعة تبدمس في C2'- O- الوضع. وترد قائمة مفصلة من خطوات التوليف في الشكل 3 والجدول 1 ، جنبا إلى جنب مع مزيد من الوصف والتعليقات للخطوات التي تم تعديلها لتوليف الحمض النووي الريبي. وعلاوة على ذلك، يوضح الشكل 4 غلة تدريجي التي لوحظت في كل خطوة بعد اختيار الخيار "تريتيل مراقب"، الذي كوانتيتاتس كاتيون تيتيل صدر من كل خطوة ديتريتيلاتيون.
ومن الجدير بالذكر أن عادة، في تجربتنا، وكان العامل المحدد الحصول على الفوسفوراميديت تحتوي على التعديل المطلوب. وهذا هو، وضع منهجية الاصطناعية التي تسمح لإدراج التعديلات في مواقع مختارة. في هذا التقرير، ونحن نركز علىدمج النيوكليوتيدات المعدلة التي أنشأنا المنهجية الاصطناعية المقابلة، ومجموعة C2'- O- ثيوفينيل ميثيل. هذه المجموعة صغيرة الحجم ولا تؤثر على تركيب المرحلة الصلبة بأي شكل من الأشكال. منذ إدراج هذه المجموعة في أوليغونوكلأوتيدس من الحمض النووي الريبي تم الإبلاغ، جنبا إلى جنب مع المعلمات الهيكلية والثيرموديناميكية 4 ، لن يتم وصف أي جوانب من التوليف العضوي يؤدي إلى الفوسفوراميديتس المعدلة هنا.
ديبروتكتيون، تنقية، والتوصيف
يحدث ديبروتكتيون من الأمينات إكسوسيكليك ومجموعات سي-سيانويثيل في نفس الخطوة التي انشقاق من كبغ الراتنج. طبقنا الشروط المستخدمة عادة لتسخين الراتنج التي تم الحصول عليها في وجود محلول مائي من أما، تليها انشقاق مجموعات C2'- O- سيليل في وجود أيونات الفلوريد، ومن ثم تنقية عن طريق هلامالكهربائي. في حين أن هذه قد أصبحت شروطا قياسية في كثير من الحالات، تعديلات قد تكون مؤهلة للظروف الأساسية أو أيونات الفلوريد قد تتطلب ظروف أكثر اعتدالا 13 ، 14 ، على سبيل المثال ، الميثانول / كربونات البوتاسيوم (ميوه / K 2 كو 3 )، أو بوتيلامين. وبالتالي، مجموعة مختلفة من مجموعات حماية على فسفوراميديتس المقابلة أمر ضروري. وعلاوة على ذلك، اخترنا الكهربائي كبديل مفضل لتنقية أوليغوميرس ديبروتكتد نظرا لتجربتنا السابقة مع هذه الطريقة وعدم وجود أجهزة أخرى. ومع ذلك، يمكن أن تستخدم هبلك بدلا من ذلك كوسيلة فعالة 15 . تم توصيف أوليغونوكلأوتيدس المنقى من خلال مطياف الكتلة، مصفوفة بمساعدة الليزر الامتزاز / التأين الوقت الرحلة (مالدي-توف)، وذلك باستخدام الإجراء المبلغ عنه من قبل مجموعتنا 16 .
التوصيف الهيكلي و تم إجراء الاستقرار المالي للدوبلكس التي تم الحصول عليها عن طريق سد. على وجه التحديد، ونحن الاستفادة من سد لتحديد التحولات تمسخ الحرارية من أوليغونوكلأوتيدس المعدلة وغير المعدلة من الحمض النووي الريبي عن طريق اتباع الانخفاض في إهليلجية الفرقة في كاليفورنيا. 270 نانومتر، فضلا عن اختفاء الفرقة (مع إهليلجية سلبية) مع λ كحد أقصى في 210 نانومتر. يتم توفير مقارنة الطيف قبل وبعد التهجين لتوضيح الاختلافات وتوفير التحقق من المنهجية المستخدمة. استخدام سد هو مقبول على نطاق واسع في تحديد الزخارف الهيكلية في الأحماض النووية و أمينواسيدس 17 ، وبالتالي يمكن استخدامها كأداة لتحديد مختلف المعلمات الهيكلية والحرارية الديناميكية 18 ؛ ومع ذلك، ليست هناك أمثلة كثيرة حيث يتم استخدام تقنية لتقييم التحولات الحرارية تمسخ. وتشمل بعض الحالات تحديد الثباتات الحرارية على الحمض النووي الذي يحتوي على G-كوادروبلكسسأس = "كريف"> 19 ، 20 أو في الدوبلكس ودبابيس رنا 21 .
ويهدف هذا التقرير إلى تزويد القارئ أو المشاهد غير الخبير بمجموعة من الأدوات التي تمكن من البدء بسلاسة في هذا النوع من البحوث. وسوف تعمل على تعزيز ومقارنتها مع المنهجيات والتقنيات في مختبرات البحوث الأخرى التي تشارك في هذا الفرع مثيرة من العلم. المحتوى في هذا التقرير يضيف إلى البروتوكولات الحالية من هذه التكنولوجيا من مصادر مختلفة، ويثري ويسهل تجربة مع المعونة البصرية لكل خطوة.
Protocol
1. الصلبة المرحلة توليف رنا أوليغونوكلأوتيدس
- إعداد الحلول التي تحتوي على كل الفوسفوراميديت (الجدول 1).
- حساب عدد النيوكليوتيدات وتناسب في المعادلة ن + 1 (حيث ن = عدد النيوكليوتيدات) المقابلة لكل قاعدة وملء الجدول مع القيم المفقودة. حجم = 0.15 مل لكل النيوكليوتيدات بتركيز 0.1 م، المذاب في أسيتونيتريل اللامائية.
- تزن كل فسفوراميديت في زجاجات العنبر 10 مل من الفرن المجففة (سيبتوم أعلى العنبر 394 أميديت 13 ملم إد × 20 ملم أود أعلى) ومكان فورا تحت فراغ باستخدام مجفف يحتوي على عامل التجفيف.
- ملء المجفف مع الأرجون الجاف، وإزالة الزجاجة وتمييع فورا مع المبلغ المقابل من أسيتونتريل (اللامائية) قبل تأمين على الصك.
ملاحظة: تأكد من استخدام المحاقن ضيقة للغاز والحفاظ على جو لامائي في جميع الأوقات. - إزالة الحاجز من زجاجة ومكان على مأشين، عن طريق وظيفة تغيير زجاجة.
ملاحظة: تتطلب هذه العملية إضافية 0.15 مل (وبالتالي حجم الزائد في المعادلة ن + 1 أعلاه) من كل حل لرئيس الخط قبل التوليف.
- إعداد تسلسل والتوليف المرحلة الصلبة باستخدام البرنامج ( الشكل 3 ).
- انقر على أيقونة البرنامج (على سبيل المثال ، أوليغونيت 1.0.1) وحدد اسم الأداة> موافق . إنشاء توليفة جديدة من ملف> توليف جديد> النظام .
- ملء في: التاريخ؛ RunID. حدد الصك؛ اسم التسلسل؛ تسلسل (5'إلى 3 'نهاية). تحت | دورة، تعيين الطريقة التي تم إنشاؤها مسبقا ( الشكل 3 ). اختيار الإجراء نهاية، ( يترك قليل النوكليوتيد ملزمة الراتنج كبغ)> دليل.
- اختر دمت معطلة> (تسا العلاج في الخطوة الأخيرة للحصول على 5-أوه المجموعة في نهاية التوليف) . حفظ ملف> حفظ باسموتقديم اسم للتجربة.
- إرسال الملف لبدء التوليف النظام> إرسال النظام إلى المزج وحدد العمود 1-4 . فتح نافذة المزج وحدد تريتيل رصد | اختيار وظيفة | تريتي> مراقبة كل خطوة .
- كرر الخطوات حسب الضرورة اعتمادا على عدد أوليغونوكلأوتيدس ليتم توليفها في آن واحد (لاحظ أن جميع الطلبات يجب أن يكون نفس الأسلوب، أي نفس أوقات الاقتران وتسلسل الأحداث).
- بدء تركيب المركب> الاستعداد للبدء . وضع الأعمدة مع المطلوب 3'-- نهاية على المواقف المشار إليها على الصك. على الجهاز انقر فوق ابدأ> لا (لإعداد أبي).
- وبمجرد الانتهاء من التوليف، وإزالة العمود من الصك ومكان في قارورة القاع جولة تليها التجفيف تحت ضغط منخفض لمدة حوالي 0.5 ساعة.
ملاحظة: فمن المستحسن للتحقق من أن لون برتقالي عميق لوحظ في راند(الخطوات 1.2.4 - 1.2.7) لتجنب الأخطاء المحتملة من وظيفة المراقبة تريتيل.
- ديبروتكتيون وتنقية أوليغونوكلأوتيدس الحمض النووي الريبي.
- فتح العمود عن طريق التواء قبعة سوداء ونقل كل (أو نصف، اعتمادا على الحاجة أو الغرض) من الراتنج الأبيض في أنبوب الطرد المركزي 1.6 مل. إضافة 0.5 مل من ميثيل أمين (40٪ في الماء) / الأمونيا (40٪ في الماء) في 1: 1.
- تأمين غطاء أنبوب الطرد المركزي مع بارافيلم، وذلك باستخدام كتلة الحرارة، الحرارة إلى 60 درجة مئوية لمدة 1.5 ساعة.
ملاحظة: يمكن وضع كائن ثقيل على رأس الأنبوب للتأكد من أن تركيز الأمونيا يبقى ثابتا داخل أنبوب التفاعل. - إزالة من كتلة الحرارة وتبريد ببطء إلى درجة حرارة الغرفة. طرد مركزي لفترة وجيزة العينة لتدور أسفل محتويات، ثم نقل طاف إلى أنبوب الطرد المركزي الجديد.
- تجميد العينات عن طريق غمر أنابيب في النيتروجين السائل (أو الجليد الجاف / حمام الإيثانول) والتركيز على جفاف بينما سبينفي جهاز طرد مركزي تحت ضغط منخفض.
- إعادة تعليق المواد الصلبة في 0.4 مل من ثلاثي إيثيل أمين / N- ميثيل بيروليدينون / ثلاثي إيثيل أمين ثلاثي هيدروفلوريد (2: 2: 3 نسبة) الحل. الحرارة إلى 60 درجة مئوية لمدة 1.5 ساعة تليها التبريد بطيئة لدرجة حرارة الغرفة.
- إضافة 0.04 مل من محلول ناواك (3M، ودرجة الحموضة 5.5 - تعديلها مع حمض الهيدروكلوريك) تليها خلط لطيف مع طرف ماصة. إضافة الإيثانول (1 مل) وباردة إلى كاليفورنيا. -70 ° C (الجليد الجاف / حمام الإيثانول) لمدة 15 دقيقة.
- أجهزة الطرد المركزي في 15،000 دورة في الدقيقة و 4 درجات مئوية لمدة 10 دقيقة. استخدام ماصة لاستخراج قسامة وتجفيف بيليه الناتجة تحت ضغط منخفض.
- إعادة تعليق الصلبة التي تم الحصول عليها في المخزن المؤقت التحميل (0.2 مل، 90٪ أق فورماميد، 1 ملي إدتا) وتخلط حتى خليط متجانس.
- تحميل التعليق على هلام بولي أكريلاميد أعدت مسبقا (20٪ تغيير طبيعة، أبعاد البئر: 30 سم × 1 ملم) 22 .
- تطبيق تيار من خلال هلام حتى علامة الأزرق بروموفينول يقع بين 1 / 2-2 / 3أسفل هلام (أبعاد هلام: ~ 21.5 سم × 30 سم).
- إزالة هلام من موقف ونقل محتويات هلام من الزجاج إلى غلاف بلاستيكي (مغطاة على كلا الجانبين)، ووضع على لوحة اللوني طبقة رقيقة (تلك) مغطاة السيليكا (التي تحتوي على صبغة الفلورسنت في 254 نانومتر) لتصور العصابات باستخدام مصباح الأشعة فوق البنفسجية (λ ماكس = 254 نانومتر).
- استخدم علامة لتحديد الموضع الذي يقع فيه الشريط العلوي وقطعه باستخدام شفرة حلاقة جديدة. مكان هلام يحتوي على الحمض النووي الريبي (دون التفاف البلاستيك) في أنبوب مخروطي 50 مل وسحق إلى قطع صغيرة باستخدام قضيب من الزجاج.
- تعليق بقايا هلام في كلوريد الصوديوم أق. حل (2 ملم، و 1 ملي إدتا) ويهز تعليق عند 37 درجة مئوية لمدة 12 ساعة. الطرد المركزي أنبوب مخروطي لمدة 10 دقيقة.
- ديسالت باستخدام خرطوشة C18 عكسي المرحلة.
- إعداد خرطوشة باستخدام حقنة 10 مل عن طريق الغسيل مع:
أسيتونتريل (10 مل)
H 2 O (مرتين، 10 مل)
5 ملي نه4 كل أق. محلول (3 مل)
الحل الذي يحتوي على الحمض النووي الريبي، مع الحرص على عدم صب أي من بقايا هلام. - يغسل مع H 2 O (ثلاث مرات، 10 مل).
- أزل من العمود باستخدام أق 60٪. محلول الميثانول (3 مل)
- إعداد خرطوشة باستخدام حقنة 10 مل عن طريق الغسيل مع:
- التركيز تحت الضغط المنخفض وإعادة حل في المياه خالية من ريبونوكلياز (0.3 مل)
- إعداد محلول مخفف (10 ميكرولتر) وإيداع 1 ميكرولتر على أداة الأشعة فوق البنفسجية فيس (على سبيل المثال ، نانودروب) لقياس الأشعة فوق البنفسجية فيس الطيف (200-450 نانومتر).
- استخدام قانون البيرة لامبرت لتحديد تركيز الحل التي تم الحصول عليها:
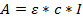
حيث A = تم الحصول عليها الامتصاصية. ε = معامل الانقراض المولي المحسوب. c = تركيز، و l = 0،1 لطول المسير 1 مم. - حساب معاملات الانقراض المولي ل أوليغونوكلأوتيدس. تحسب هنا مع آلة حاسبة على الخطيستخدم برنامج ديناملت (http://unafold.ra.albany.edu/؟q=dinamelt) 23
- تحديد تركيز وتوصيف عن طريق مالدي-توف.
- تحميل عينات على لوحة مالدي باستخدام طرف ماصة محملة طرف C18 إلى ديزالت، وبقعة كل قليل النوكليوتيد.
- غسل طرف مع 50٪ أسيتونتريل (10 ميكرولتر × 2). تتوازن طرف مع حمض تريفلوروسيتيك 0.1٪ (تفا؛ 10 ميكرولتر × 2). تحميل طرف مع عينة (عادة 100-150 بمول).
- غسل طرف مع 0.1٪ تفا (10 ميكرولتر × 2)، ثم مع الماء (10 ميكرولتر × 2).
- أزل العينة إلى حل يحتوي على المصفوفة المطلوبة. استخدمنا حلا من: 10 ميكرولتر 25 ملم -2،4،6-تريهيدروكسياسيتوفينون مونوهيدرات (ثاب)، 10 ملي سترات الأمونيوم، و 300 ملي فلوريد الأمونيوم في أسيتونتريل 50٪.
- بقعة مباشرة على لوحة مالدي عن طريق إيداع 0.9 ميكرولتر (تليها تجفيف الهواء) وتكرار الإجراء حسب الضرورة.
ملاحظة: تم الحصول على جميع الأطياف على عاكس إيجابي الوضع.
- تحميل عينات على لوحة مالدي باستخدام طرف ماصة محملة طرف C18 إلى ديزالت، وبقعة كل قليل النوكليوتيد.
2. رنا تحليل هيكل عبر سد
- إعداد حلول لمؤتمر نزع السلاح.
- إعداد 0.25 مل تحتوي على الحمض النووي الريبي المعدلة [3 ميكرومتر]، كلوريد الصوديوم [10 ملم]، الصوديوم الفوسفات العازلة [10 ملم، ودرجة الحموضة 7.2]، و مغكل 2 [5 ملم]. وتكون العينة جاهزة للتحليل كما هي، خاصة إذا كانت تمثل انتقالا غير الجزيئي.
- إذا كان الهدف هو تحليل الهياكل المزدوجة أو التحولات ثنائية الجزيئات، إضافة تكملة (1 المعادل المولي، إن وجدت) في هذا الوقت، أو الاستمرار مع الخطوة أدناه.
- وضع العينة على كتلة الحرارة، قبل تسخينها إلى 90 درجة مئوية، وإيقاف الحرارة للسيطرة على التبريد بطيئة لدرجة حرارة الغرفة (عادة 2 - 4 ح).
- اكتساب الأطياف
- إعداد محلول فارغ (كلوريد الصوديوم 10 ملي، فوسفات الصوديوم 10 ملي درجة الحموضة 7.3، مغكل 2 5 ملم)، نقل رأوا الصغرى كوفيت (1 سم طول المسار، 250 ميكرولتر الحد الأدنى لحجم)، ومكان على موقف حامل للمغير عينة داخل الصك.
- نقل العينة التي تحتوي على الحمض النووي الريبي إلى آخر كوفيت الصغرى وموقف في مغير العينة. إذا قياس الانتقال الحراري تمسخ، إضافة بعناية السرير من النفط دون تعطيل الطبقة المائية وتأمين غطاء من كوفيت باستخدام قطعة من الشريط تفلون.
- فتح خزان النيتروجين لتوفير تدفق الذي يتحرك العائمة الهواء الموجود على الصك إلى كاليفورنيا. قم بتشغيل جهاز التبريد.
- بدوره على الصك وفتح البرنامج مدير الأطياف رمز، ثم فتح نافذة الاستحواذ أطياف القياس .
- تطهير الصك مع النيتروجين لمدة 5 دقائق قبل الاستحواذ.
- الحصول على أطياف باستخدام المعلمات التالية قياس> المعلمات وضبط المعلمات على النحو التالي:
- تحت عام ، حدد: مسح 200-350 نانومتر. تشانلز سد أند هت: داتاالملعب في 0.1 نانومتر. سرعة المسح الضوئي في 100 نانومتر / دقيقة. عرض الفرقة في 1 نانومتر؛ عدد التراكمات عند 5.
- تحت وحدة الخلية ، اختر 20 درجة مئوية. تحت السيطرة ، حدد مصراع يتم فتح وإغلاق تلقائيا. تحت المعلومات ، اختر الاسم والتركيز والمشغل.
- تحت البيانات ، تصفح إلى المجلد المطلوب. انقر فوق موافق .
- الحصول على أطياف قياس> قياس العينة ، وتحديد موقف (ق) من كوفيتس في مغير العينة 1-6 وفقا لذلك، انقر فوق موافق .
- إذا أخذ التحول الحراري تمسخ:
- أغلق اكتساب ملف البرنامج > خروج وفتح برنامج جديد قياس درجة الحرارة المتغير> قياس> المعلمات .
- تطبيق المعلمات التالية لتسجيل الانتقال الحراري، والتي يمكن تعديلها على النحو المطلوب:
- تحت درجة الحرارة ، حدد بدء درجة الحرارة: 4 درجات مئوية؛ إنتيرفال: 0.2؛ تارجيت: 90 ° C؛ التدرج: 1 ° C / دقيقة. انتظر 0 ثانية. ضمن بدء / نهاية ، حدد بدء حالة الشرط & نهاية كما تريد.
- تحت عام ، حدد 3 قنوات، سد / هت / عبس. عرض النطاق الترددي: 1 نانومتر؛ الطول الموجي: 270 نانومتر (أو كما هو مطلوب). ضمن عنصر التحكم ، حدد لا شيء. تحت المعلومات ، حدد الاسم والتركيز والمشغل.
- تحت البيانات ، تصفح إلى المجلد المطلوب. انقر فوق موافق .
- عينات باردة إلى 4 درجة مئوية والانتظار 5 دقائق في هذه الدرجة قبل الحصول على قياس الطيف.
- بيانات العمل المتابعة للأطياف.
- باستخدام وظيفة على البرنامج، طرح الطيف فارغة من اكتساب الهدف لحساب إشارات الخلفية الناشئة عن نظام المخزن المؤقت في الاستخدام: تحليل الأطياف> ملف> فتح .
- مرة واحدة تم فتح ملف فارغ وملف أطياف، اسحب عرض 2 تحت عرض 1 (على الجانب الأيسر من الشاشة).
- انقر على بيأرأوسيسينغ> الطرح> موافق أو تبادل البيانات> موافق .
- استخراج البيانات كملف أسي: ملف> تصدير وحدد أسي .
- استخدام البرمجيات لرسم الطيف المقابل. تعد عملية تلطيف البيانات اختيارية في الحالات التي تكون فيها نسبة الإشارة إلى الضوضاء أقل من المتوقع. ويمكن تطبيق هذا التحول بتطبيق خيار بيانات التمهيد.
- البيانات العمل المتابعة للتحولات تمسخ الحرارية.
- استخراج البيانات من ملف جاسكو كملف أسي.
- رسم النقاط إهليلجية كدالة من درجة الحرارة. وعادة ما يكون تلطيف البيانات ضروريا تبعا لطول الموجة الذي يجري فحصه. في بعض الحالات، واستخدام الطول الموجي في 210 نانومتر عرض اختلافات أكبر بين المؤامرات التي تتطلب سلاسة. ومع ذلك، اعتمادا على العينة والتركيزات، تم إجراء عدد من الحسابات باستخدام البيانات الخام.
- لحساب الحرارية دنالتحولات التشبع (T م ) القيمة، والحصول على مشتق الأول من المنحنى. وكان الحد الأقصى أو الحد الأدنى مؤشرا على هذه المعلمة. وكما في الخطوة السابقة، تطلبت بعض الحالات تمهيد البيانات للحصول على القيمة الأكثر دقة.
ملاحظة: أجريت التجارب عادة في ثلاث نسخ، مما أدى إلى المتوسط المقابل والانحراف المعياري للقياس.
النتائج
يتم وصف تركيب دوديكامرز رنا التي تحتوي على صفر أو واحد أو اثنين من التعديلات ثيوفينيل ميثيل في C2'- O- وضع جنبا إلى جنب مع تنقية المقابلة وتوصيف. وعلاوة على ذلك، يتم تضمين وصف تفصيلي للتحليل الهيكلي التي أجريت عن طريق سد.
Discussion
القصد من هذه المخطوطة هو أن تكون بمثابة دليل للباحثين في الميدان، مبتدئا أو خبير، لتحقيق بنجاح أو تعزيز تخليق قليل النوكليوتيدات من الحمض النووي أو الحمض النووي الريبي. وتركز منهجية وصفها على استخدام التوليف المرحلة الصلبة باستخدام المزج الآلي / الحمض النووي الريبي...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
تم دعم إعداد هذه المخطوطة من خلال الأموال المبتدئة من جامعة كولورادو دنفر (جمر). أف ترغب في الاعتراف بدعم من البحوث والأنشطة الإبداعية جائزة (ركاس، سو دنفر). وتم الإقرار بتمويل من مكتب خدمات البحوث بجامعة كولورادو دنفر لتغطية رسوم النشر. نود أن نشكر أعضاء المختبر السيدة كاساندرا هربرت والسيد يانيك K. دزوو لمساهماتهم في جزء الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| AbsolveTM | PerkinElmer | 6NE9711 | |
| Acetonitrile 99.9%, HPLC Grade | Fisher Scientific | 75-05-8 | |
| Acetonitrile 99.9%, anhydrous for DNA sequencing | Fisher BioReagents | 75-05-8 | |
| Acrylamide, 99+% | ACROS Organics | 164850025 | |
| Ammonium chloride 98+% | Alfa Aesar | 12125-02-9 | |
| Ammonium citrate, dibasic 98% | Sigma Aldrich | 3012-65-5 | |
| Ammonium Fluoride 98.0%, ACS grade | Alfa Aesar | 12125-01-8 | |
| Ammonium hydroxide 28 - 30% in water, ACS Plus | Fisher Chemical | 1336-21-6 | |
| Ammonium persulfate | ACROS Organics | 1444 | |
| Argon-ultra high purity | Airgas | 7440-37-1 | |
| Bis-acrylamide Ultra pure | VWR-Amresco | 172 | |
| Boric Acid | Fisher Scientific | A73-1 | |
| Diethyl pyrocarbonate, 97% | ACROS Organics | A0368487 | |
| Ethanol, anhydrous, histological grade | Fisher Chemical | 64-17-5 | |
| Ethylenediamine tetraacetic acid, disodium salt dehydrate 100.2% | Fisher Chemical | 6381-92-6 | |
| Formamide | Thermo Scientific | 75-12-7 | |
| Hydrochloric acid, 36.5 - 38.0%, Certified ACS Plus | Fisher Chemical | 7647-01-0 | |
| Magnesium chloride hexahydrate, 99% | Fisher Scientific | 7786-30-3 | |
| Methanol, 99.9%, HPLC Grade | Fisher Chemical | 67-56-1 | |
| Methylamine 40% in water | Sigma Aldrich | 74-89-5 | |
| 1-Methyl-2-pyrrolidinone, andhydrous, 99.5% | Aldrich | 872-50-4 | |
| Opti-TOFTM 96 Well Insert (123 x 81 mm) | MDS SCIEX | 1020157 | |
| RNase Away | Molecular BioProducts | 7005-11 | |
| Sodium acetate, anhydrous 99.2%, Certified ACS | Fisher Chemical | 127-09-3 | |
| Sodium chloride, 100.5%, Certified ACS | Fisher Chemical | 7647-14-5 | |
| Sodium phosphate monobasic dihydrate 99.0% | Sigma | 13472-35-0 | |
| 2’,4’ Triethylamine, 99+% | Alfa Aesar | 121-44-8 | |
| TEMED | Amresco | 761 | |
| Triethylamine trihydrofluoride, 98% | Aldrich | 73602-61-6 | |
| Trifluoroacetic acid, 99% | Alfa Aesar | 76-05-1 | |
| 6’-Trihydroxyacetophenone monohydrate 98% | Sigma Aldrich | 480-66-0 | |
| Tris Base | Fisher Scientific | BP154-3 | |
| Urea | Fisher Scientific | U15-3 | |
| Reagents for the RNA synthesis: | |||
| Deblocking mix, 3% trichloroacetic acid in dichloromethane | Glen Research | 40-4140-57 | |
| Cap Mix A, THF/Pyridine/Acetic anhydride | Glen Research | 40-4110-52 | |
| Cap Mix B, 10% 1-methylimidazole in THF | Glen Research | 40-4120-52 | |
| Activator, 0.25 M 5-ethylthio-1H-tetrazole in anhydrous acetonitrile | Glen Research | 30-3140-52 | |
| Oxidizing Solution, 0.02 M iodine in THF/Pyridine/Water | Glen Research | 40-4330-52 | |
| U-RNA-CPG | Glen Research | 20-3330-xx | |
| Ac-G-RNA-CPG | Glen Research | 20-3324-xx | |
| Ac-G-CE Phosphoramidite | Glen Research | 10-3025-xx | |
| U-CE Phosphoramidite | Glen Research | 10-3030-xx | |
| Ac-C-CE Phosphoramidite | Glen Research | 10-3015-xx | |
| Bz-A-CE Phosphoramidite | Glen Research | 10-3003-xx |
References
- Matteucci, M. D., Caruthers, M. H. The synthesis of oligodeoxypyrimidines on a polymer support. Tetrahedron Lett. 21 (8), 719-722 (1980).
- Beaucage, S. L., Caruthers, M. H. Deoxynucleoside phosphoramidites-A new class of key intermediates for deoxypolynucleotides. Tetrahedron Lett. 22 (20), 1859-1862 (1981).
- Caruthers, M. H. Gene synthesis machines: DNA Chemistry and its uses. Science. 230 (4723), 281-285 (1985).
- Nguyen, J. C., et al. Synthesis, Thermal Stability, Biophysical Properties, and Molecular Modeling of Oligonucleotides of RNA Containing 2'-O-2-Thiophenylmethyl Groups. J Org Chem. 81 (19), 8947-8958 (2016).
- El-Sagheer, A. H., Brown, T. Click chemistry with DNA. Chem Soc Rev. 39, 1388-1405 (2010).
- Puffer, B., et al. 5-Fluoro pyrimidines: labels to probe DNA and RNA secondary structures by 1D 19F NMR spectroscopy. Nucleic Acids Res. 37 (22), 7728-7740 (2009).
- Wan, W. B., Seth, P. P. The medicinal chemistry of therapeutic oligonucleotides. J Med Chem. 59 (21), 9645-9667 (2016).
- Zhou, C., Greenberg, M. M. DNA Damage by histone radicals in nucleosome core particles. J Am Chem Soc. 136 (18), 6562-6565 (2014).
- Zhang, Y., et al. UV-Induced proton-coupled electron transfer in cyclic DNA miniduplexes. J Am Chem Soc. 138 (23), 7395-7401 (2016).
- Anosova, I., et al. The structural diversity of artificial genetic polymers. Nucleic Acids Res. 44 (3), 1007-1021 (2016).
- Riml, C., Micura, R. Synthesis of 5-Hydroxymethylcytidine- and 5-Hydroxymethyl-uridine-Modified RNA. Synthesis. 48, 1108-1116 (2016).
- Anderson, B. A., Hrdlicka, P. J. Merging Two Strategies for Mixed-Sequence Recognition of Double-Stranded DNA: Pseudocomplementary Invader Probes. J Org Chem. 81 (8), 3335-3346 (2016).
- Beaucage, S. L., Iyer, R. P. Synthesis of oligonucleotides by the phosphoramidite approach. Tetrahedron. 48 (12), 2223-2311 (1992).
- Gillet, L. C. J., Alzeer, J., Schärer, O. D. Site-specific incorporation of N-(deoxyguanosin-8-yl)-2-acetylaminofluorene (dG-AAF) into oligonucleotides using modified 'ultra-mild' DNA synthesis. Nucleic Acids Res. 33 (6), 1961-1969 (2005).
- Shiba, Y., et al. Chemical synthesis of a very long oligoribonucleotide with 2-cyanoethoxymethyl (CEM) as the 2'-O.-protecting group: structural identification and biological activity of a synthetic 110mer precursor-microRNA candidate. Nucleic Acids Res. 35 (10), 3287-3296 (2007).
- Choi, Y. J., Gibala, K. S., Ayele, T., Deventer, K. D., Resendiz, M. J. E. Biophysical properties, thermal stability and functional impact of 8-oxo-7,8-dihydroguanine on oligonucleotides of RNA - a study of duplex, hairpins and the aptamer for preQ1 as models. Nucleic Acids Res. 45 (4), 2099-2111 (2017).
- Ranjbar, B., Gill, P. Circular dichroism techniques: Biomolecular and nanostructural analyses - A review. Chem Biol Drug Des. 74 (2), 101-120 (2009).
- Mergny, J. -. L., Lacroix, L. Analysis of thermal melting curves. Oligonucleotides. 13 (6), 515-537 (2003).
- Jin, R., Breslauer, K. J., Jones, R. A., Gaffney, B. L. Tetraplex formation of a guanine-containing nonameric DNA fragment. Science. 250 (4980), 543-546 (1990).
- Virgilio, A., et al. 5-Hydroxymethyl-2'-deoxyuridine residues in the thrombin binding aptamer: Investigating anticoagulant activity by making a tiny chemical modification. CHEMBIOCHEM. 15 (16), 2427-2434 (2014).
- Chauca-Diaz, A. M., Choi, Y. J., Resendiz, M. J. E. Biophysical properties and thermal stability of oligonucleotides of RNA containing 7,8-dihydro-8-hydroxyadenosine. Biopolymers. 103 (3), 167-174 (2015).
- Maniatis, T., Fritsch, E. F., Sambrook, J. . Molecular cloning: a laboratory manual. 14, 173-185 (1987).
- Markham, N. R., Zuker, M. UNAFold: software for nucleic acid folding and hybridization. Methods Mol Biol. 453, 3-31 (2008).
- Breslow, R., Huang, D. -. L. Effects of metal ions including Mg2+ and lanthanides on the cleavage of ribonucleotides and RNA model compounds. Proc Natl Acad Sci U S A. 88 (10), 4080-4083 (1991).
- Blumberg, D. D. Creating a ribonuclease-free environment. Methods Enzymol. 152 (2), 20-24 (1987).
- AbouHaidar, M. G., Ivanov, I. G. Non-enzymatic RNA promoted by the combined catalytic activity of buffers and magnesium ions. Z Naturforsch C. 54 (7-8), 542-548 (1999).
- Farrell, R. E. . RNA Methodologies (4th Ed): A laboratory guide for isolation and characterization. 2, 45-80 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved