Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Protocolo para la síntesis en fase sólida de oligómeros de ARN que contiene un 2'-
En este artículo
Resumen
Este artículo proporciona un procedimiento detallado sobre la síntesis en fase sólida, purificación y caracterización de dodecámeros de ARN modificado en la posición C2'- O . Los análisis fotométricos del dicroísmo UV-vis y circular se usan para cuantificar y caracterizar aspectos estructurales, es decir , hebras simples o dobles.
Resumen
La síntesis en fase sólida se ha utilizado para obtener polímeros canónicos y modificados de ácidos nucleicos, específicamente de ADN o ARN, lo que la ha convertido en una metodología popular para aplicaciones en diversos campos y para diferentes propósitos de investigación. El procedimiento descrito en este documento se centra en la síntesis, purificación y caracterización de dodecámeros de ARN 5 '- [CUA CGG AAU CAU] -3' que contiene cero, una o dos modificaciones situadas en la posición C2'- O . Las sondas se basan en grupos 2-tiofenilmetilo, incorporados en nucleótidos de ARN mediante síntesis orgánica estándar y se introducen en los oligonucleótidos correspondientes a través de sus respectivas fosforamiditas. Este informe hace uso de la química de la fosforamidita mediante las cuatro nucleobases canónicas (uridina (U), citosina (C), guanosina (G), la adenosina (A)), así como 2-tiofenilmetilo nucleótidos funcionalizados modificados en la 2'- O - posición; Sin embargo, la metodología es susceptible para una var grandeUna serie de modificaciones que se han ido desarrollando a lo largo de los años. Los oligonucleótidos se sintetizaron sobre un soporte de vidrio de poro controlado (CPG) seguido por escisión de la resina y desprotección bajo condiciones estándar, es decir , una mezcla de amoníaco y metilamina (AMA) seguida de fluoruro de hidrógeno / trietilamina / N-metilpirrolidinona. Los oligonucleótidos correspondientes fueron purificados mediante electroforesis de poliacrilamida (20% de desnaturalización) seguido de la elución, la desalinización, y el aislamiento a través de cromatografía de fase inversa (Sep-pak, C 18 -column). La cuantificación y los parámetros estructurales se evaluaron mediante el análisis fotométrico del dicroísmo (UV) y del dicroísmo circular (CD), respectivamente. Este informe pretende servir como un recurso y una guía para los investigadores principiantes y expertos interesados en embarcarse en este campo. Se espera que sirva como un trabajo en progreso a medida que se desarrollan nuevas tecnologías y metodologías. La descripción de las metodologías y técnicas dentro deS documento corresponden a un ADN / ARN sintetizador (renovado y comprado en 2013) que utiliza phosphoramidite química.
Introducción
La síntesis en fase sólida para obtener oligonucleótidos de ADN / ARN es una poderosa herramienta que ha servido a varias aplicaciones en diversos campos desde los años setenta 1 , 2 , 3 utilizando bloques de construcción de fosforamidita 4 . Ejemplos de su amplia influencia son: su impacto en el etiquetado (a través de las reacciones químicas) 5 , el sondeo estructural 6 y las tecnologías antisentido 7 , así como su elucidación de los mecanismos biológicos 8 , 9 , fuente como material genético 10 , y el estudio de Diversas modificaciones naturales y / o químicas 11 , 12 , entre muchos otros. La modificación que usamos aquí representa el primer paso en nuestros esfuerzos para obtener oligonucleótidos de ARN que contienenFotoactivas para permitir el control temporal de la estructura y función de este importante biopolímero.
La síntesis de dodecamers de ARN con secuencias: 5 '- [CUA CG G A AU CAU] -3' / 5 '- [Agosto AUU CCG UAG] -3' (posiciones subrayadas representan la incorporación de una modificación -thiophenylmethyl C2'- O ) Constituye el foco de este estudio. Las secuencias se eligieron para permitir la cuantificación y medición de las cadenas de ARN como hebras individuales, o como sus correspondientes estructuras dúplex (no se predijeron otras estructuras secundarias como termodinámicamente estable). CD se utilizó para establecer los parámetros estructurales, es decir , la formación de dúplex y las transiciones de desnaturalización térmica.
Síntesis
El procedimiento general para obtener estos oligonucleótidos se ilustra en la Figura 1 y sigue el proceso escalonado: Síntesis de fase sólida automatizada → DeprOtección → Purificación → Cuantificación → Caracterización. La figura 2 muestra las unidades monoméricas que son necesarias en este procedimiento. La síntesis de ARN en fase sólida es similar a la del ADN en que se basa en la química de fosforamidita ( Figura 2 , izquierda) y el uso de grupos protectores lábil a bases para las aminas nucleófilas exocíclicas en G, A y C, por ejemplo , Acetilo, benzoilo, fenoxiacetilo, t - butilo o N , N - dimetilformamida ( Figura 2 , derecha). Un aspecto más a considerar en el ARN, debido a la presencia del grupo C2'-OH (carente de los biopolímeros desoxioligonucleótidos), es el paso adicional que ha de ser incorporado para la protección, y posterior desprotección, de esta posición nucleofílica. A este respecto, los grupos protectores basados en silicio se han convertido en una estrategia atractiva debido a su potencial como restos biortogonalesY desprotegidos en presencia de fluoruro), con los grupos tert- butildimetilsililo (TBDMS) y triisopropilsililoximetilo (TOM) como opciones populares ( Figura 2 , parte inferior izquierda).
En este trabajo, la síntesis automatizada se llevó a cabo en un sintetizador de ADN / ARN que utiliza química estándar de fosforamidita. Los ajustes del fabricante en el instrumento incluyen un paso de dilución automatizado cuando se usan las versiones comerciales de las fosforamiditas para el ADN, o la opción de diluir a volúmenes establecidos por el usuario. Sin embargo, decidimos pesar el ARN fosforamidita y diluir manualmente, dado que: 1) el precio de las fosforamiditas canónicas del ARN es más alto (hasta 50 veces más caro en algunos casos); 2) las fosforamiditas modificadas se obtienen a menudo en pequeñas cantidades; Y 3) la cantidad de material desperdiciado al usar una etapa de dilución automática (establecida por el fabricante) es grande. Además, utilizamos: 1) soportes sólidos disponibles comercialmente(Por ejemplo , CPG) que contiene una nucleobase protegida para funcionar como el extremo 3 '; Y 2) fosforamiditas comerciales (nucleobases canónicas) protegidas con un grupo TBDMS en la posición C2'- O . La lista detallada de las etapas de síntesis se proporciona en la Figura 3 y la Tabla 1 , junto con una descripción y comentarios adicionales para las etapas que se ajustaron para la síntesis de ARN. Además, la Figura 4 ilustra los rendimientos escalonados que se observan para cada paso después de seleccionar la opción 'Trityl Monitor', que cuantifica el catión trityl liberado de cada paso de detritylation.
Vale la pena señalar que típicamente, en nuestra experiencia, el factor limitante fue la obtención de la fosforamidita que contenía la modificación deseada. Es decir, el desarrollo de una metodología sintética que permita la incorporación de modificaciones en sitios selectos. En este informe, nos centramos en laIncorporación de un nucleótido modificado para el que hemos establecido la correspondiente metodología sintética, el grupo C2'- O- tiofenilmetilo. Este grupo es de pequeño tamaño y no afecta de ninguna manera a la síntesis en fase sólida. Dado que se ha descrito la incorporación de este grupo en oligonucleótidos de ARN, junto con parámetros estructurales y termodinámicos 4 , no se describirán en la presente memoria ningún aspecto de la síntesis orgánica que conduzca a las fosforamiditas modificadas.
Desprotección, purificación y caracterización
La desprotección de las aminas exocíclicas y grupos β-cianoetilo se produce en el mismo paso que el de la escisión de la resina CPG. Se aplicaron las condiciones comúnmente utilizadas para calentar la resina obtenida en presencia de una solución acuosa de AMA, seguido de escisión de los grupos C2'- O- sililo en presencia de iones fluoruro, y después purificación vía gelElectroforesis. Mientras que éstos se han convertido en condiciones estándar en muchos casos, modificaciones que son lábiles a las condiciones básicas o iones fluoruro pueden requerir condiciones más suaves 13, 14, por ejemplo, carbonato de metanol / potasio (MeOH / K 2 CO 3), o butilamina. Por lo tanto, es necesario un conjunto diferente de grupos protectores sobre las correspondientes fosforamiditas. Además, elegimos la electroforesis como la alternativa preferida para purificar los oligómeros desprotegidos, dada nuestra experiencia previa con este método y la falta de otra instrumentación. Sin embargo, la HPLC se puede utilizar alternativamente como un método eficaz 15 . La caracterización de los oligonucleótidos purificados se realizó mediante espectrometría de masas, desorción / ionización láser asistida por matriz-tiempo de vuelo (MALDI-TOF), utilizando un procedimiento informado por nuestro grupo 16 .
La caracterización estructural y La estabilidad de los dúplex obtenidos se realizó por CD. Específicamente, hacemos uso de CD para determinar las transiciones de desnaturalización térmica de oligonucleótidos modificados y no modificados de ARN siguiendo la disminución de la elipticidad de la banda a aprox. 270 nm, así como la desaparición de la banda (con elipticidad negativa) con una max λ a 210 nm. Se proporciona una comparación de espectros antes y después de la hibridación para ilustrar sus diferencias y proporcionar validación de la metodología empleada. El uso de CD es ampliamente aceptado en la determinación de motivos estructurales en ácidos nucleicos y aminoácidos 17 , y por lo tanto puede ser empleado como una herramienta para determinar diversos parámetros estructurales y termodinámicos 18 ; Sin embargo, no hay muchos ejemplos donde la técnica se utiliza para evaluar las transiciones de desnaturalización térmica. Algunos casos incluyen la determinación de la estabilidad térmica en el ADN que contiene G-quadruplexesAss = "xref"> 19 , 20 o en dúplex y horquillas de ARN 21 .
Este informe tiene la intención de proporcionar al lector no experto o espectador con un conjunto de herramientas que permiten un buen comienzo a este tipo de investigación. Servirá para mejorar y comparar con metodologías y técnicas en otros laboratorios de investigación que están involucrados en esta emocionante rama de la ciencia. El contenido de este informe se suma a los protocolos existentes de esta tecnología de diversas fuentes, y enriquece y facilita la experiencia con una ayuda visual para cada paso.
Protocolo
1. Síntesis en fase sólida de los oligonucleótidos de ARN
- Preparación de soluciones que contienen cada fosforamidita (Tabla 1).
- Contar el número de nucleótidos y ajustar en la ecuación n + 1 (donde n = número de nucleótidos) correspondiente a cada base y rellenar la tabla con los valores faltantes. Volumen = 0,15 ml por nucleótido a una concentración de 0,1 M, disuelto en acetonitrilo anhidro.
- Pesar cada fosforamidita en botellas ámbar de 10 ml secadas en horno (Septum Top Amber 394 Amidite 13 mm DI x 20 mm OD Top) y colocar inmediatamente bajo vacío usando un desecador que contenga un agente de secado.
- Llenar el desecador con argón seco, retirar el frasco y diluir inmediatamente con la cantidad correspondiente de acetonitrilo (anhidro) antes de sujetar el instrumento.
NOTA: Asegúrese de usar jeringas herméticas y mantener una atmósfera anhidra en todo momento. - Retire los septos de la botella y coloque en el mA través de una función de cambio de botella.
NOTA: Este proceso requiere una cantidad adicional de 0.15 ml (de ahí el exceso de volumen en la ecuación n + 1 anterior) de cada solución para cebar la línea antes de la síntesis.
- Configuración de la secuencia y la síntesis de fase sólida utilizando el software ( Figura 3 ].
- Haga clic en el icono del software ( por ejemplo , OligoNet 1.0.1) y seleccione Nombre del instrumento> Aceptar . Crear una nueva síntesis por Archivo> Nueva síntesis> Orden .
- Rellenar: Fecha; RunID; Instrumento selecto; Nombre de secuencia; Secuencia (extremo 5 'a 3'). Bajo ciclo, asigne el método previamente creado ( Figura 3 ). Elija el procedimiento final ( deja el oligonucleótido unido a la resina CPG)> manual.
- Seleccione DMT Off> (tratamiento con TCA en el último paso para obtener un grupo 5'-OH al final de la síntesis) ; Guardar Archivo> Guardar comoY proporcionar un nombre para el experimento.
- Enviar el archivo para comenzar la síntesis Orden> Enviar orden al sintetizador y seleccionar columna 1-4 . Abra la ventana del sintetizador y seleccione trityl monitor | choose function | trity> monitoree cada paso .
- Repita los pasos según sea necesario dependiendo del número de oligonucleótidos que se van a sintetizar a la vez (tenga en cuenta que todos los pedidos deben tener el mismo método, es decir , los mismos tiempos de acoplamiento y secuencia de eventos).
- Comience la síntesis Sintetizador> Prepárese para comenzar . Coloque las columnas con el extremo 3 'deseado en las posiciones indicadas en el instrumento. En el instrumento, haga clic en Inicio> No (para la preparación ABI).
- Una vez completada la síntesis, se retira la columna del instrumento y se coloca en un matraz de fondo redondo seguido de secado a presión reducida durante aproximadamente 0,5 h.
NOTA: Se recomienda comprobar que se observa un color naranja profundo en rand(Pasos 1.2.4 - 1.2.7) para evitar errores potenciales de la función de monitoreo trityl.
- Desprotección y purificación de oligonucleótidos de ARN.
- Abra la columna girando la tapa negra y transfiera todo (o la mitad, dependiendo de la necesidad o propósito) de la resina blanca en un tubo de centrífuga de 1,6 ml. Añadir 0,5 ml de una metilamina (40% en agua) / amoníaco (40% en agua) a 1: 1.
- Asegure la tapa del tubo de centrífuga con parafilm y, usando un bloque térmico, caliente a 60 ° C durante 1,5 h.
NOTA: Se puede colocar un objeto pesado encima del tubo para asegurar que la concentración de amoníaco permanezca constante dentro del tubo de reacción. - Retirar del bloque de calor y enfriar lentamente a temperatura ambiente. Centrifugar brevemente la muestra para centrifugar el contenido y luego transferir el sobrenadante a un nuevo tubo de centrífuga.
- Congele las muestras sumergiendo tubos en nitrógeno líquido (o baño de hielo seco / etanol) y concentre a sequedad mientras spinnEn una centrífuga bajo presión reducida.
- Se vuelven a suspender los sólidos en 0,4 ml de una solución de trietilamina / N-metilpirrolidinona / trietilamina-trihidrofluoruro (proporción 2: 2: 3). Calentar a 60 ° C durante 1,5 h seguido de enfriamiento lento a temperatura ambiente.
- Añadir 0,04 ml de una solución de NaOAc (3M, pH 5,5 - ajustado con HCl) seguido de una mezcla suave con una punta de pipeta. Se añade etanol (1 ml) y se enfría a aprox. -70ºC (baño de hielo seco / etanol) durante 15 min.
- Centrifugar a 15.000 rpm y 4 ° C durante 10 min. Utilizar una pipeta para extraer la alícuota y secar el gránulo resultante a presión reducida.
- Se vuelve a suspender el sólido obtenido en tampón de carga (0,2 ml, formamida acuosa al 90%, EDTA 1 mM) y se mezcla hasta que la mezcla sea homogénea.
- Cargar la suspensión en un gel de poliacrilamida previamente preparado (20% de desnaturalización, dimensiones del pocillo: 30 cm x 1 mm) 22 .
- Aplique una corriente a través del gel hasta que el marcador azul de bromofenol se encuentre entre 1 / 2-2 / 3Abajo del gel (dimensiones del gel: ~ 21.5 cm x 30 cm).
- Quitar el gel del soporte y transferir el contenido de gel del vidrio a envoltura de plástico (cubierto por ambos lados) y colocar sobre una placa de cromatografía de capa fina (TLC) cubierta con sílice (que contiene colorante fluorescente a 254 nm) para visualizar las bandas Usando una lámpara UV ( lambda _ { max } = 254 nm).
- Use un marcador para delinear la posición donde se encuentra la banda superior y corte con una nueva hoja de afeitar. Coloque el gel que contiene el ARN (sin envoltura de plástico) en un tubo cónico de 50 ml y apláselo a trozos pequeños usando una varilla de vidrio.
- Suspender los residuos de gel en NaCl aq. (2 mM y EDTA 1 mM) y agitar la suspensión a 37ºC durante 12 h. Centrifugar el tubo cónico durante 10 min.
- Desalt con un cartucho C18 de fase inversa.
- Prepare el cartucho con una jeringa de 10 ml lavando con:
Acetonitrilo (10 ml)
H $ ₂ $ O (dos veces, 10 ml)
5 mM de NH4 Cl aq. (3 ml)
Solución que contiene ARN, teniendo cuidado de no verter ninguno de los residuos de gel. - Lavar con H $ ₂ $ O (tres veces, 10 ml).
- Eluir de la columna usando un 60% de ac. Metanol (3 ml)
- Prepare el cartucho con una jeringa de 10 ml lavando con:
- Se concentra a presión reducida y se vuelve a disolver en agua libre de RNasa (0,3 ml)
- Preparar una solución diluida (10 μL) y depositar 1 μl en el instrumento UV-vis ( por ejemplo , Nanodrop) para medir el espectro UV-vis (200-450 nm).
- Utilice la Ley de Beer Lambert para determinar la concentración de la solución obtenida:
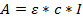
Donde A = absorbancia obtenida; Ε = coeficiente de extinción molar calculado; C = concentración, y l = 0,1 para una longitud de trayectoria de 1 mm. - Calcular los coeficientes de extinción molares de los oligonucleótidos; Calculado aquí con una calculadora en líneaQue utiliza el software DINAMelt (http://unafold.ra.albany.edu/?q=dinamelt) 23
- Determinación de concentración y caracterización vía MALDI-TOF.
- Cargar las muestras en una placa MALDI usando una punta de pipeta cargada con una punta C18 para desalar y colocar cada oligonucleótido.
- Lavar la punta con acetonitrilo al 50% (10 μl x 2). Equilibrar la punta con ácido trifluoroacético al 0,1% (TFA, 10 μL x 2). Cargar la punta con la muestra (típicamente 100-150 pmol).
- Lavar la punta con TFA al 0,1% (10 μl x 2), y luego con agua (10 μL x 2).
- Eluir la muestra en una solución que contenga la matriz deseada; Se utilizó una solución de: 10 μL de monohidrato de 25 mM-2,4,6-trihidroxiacetofenona (THAP), citrato de amonio 10 mM y fluoruro de amonio 300 mM en acetonitrilo al 50%.
- Localice directamente sobre la placa MALDI depositando 0,9 μL (seguido de secado al aire) y repitiendo el procedimiento según sea necesario.
NOTA: Todos los espectros se obtuvieron en el modo reflector positivo.
- Cargar las muestras en una placa MALDI usando una punta de pipeta cargada con una punta C18 para desalar y colocar cada oligonucleótido.
2. Estructura de RNA Análisis a través de CD
- Preparación de soluciones para CD.
- Preparar 0,25 ml que contenga el ARN modificado [3 μM], NaCl [10 mM], tampón fosfato de sodio [10 mM, pH 7,2] y MgCl 2 [5 mM]. La muestra está lista para su análisis tal como está, particularmente si representa una transición unimolecular.
- Si el objetivo es analizar estructuras dúplex o transiciones bimoleculares, añada complemento (equivalente molar 1, si corresponde) en este momento, o continúe con el paso a continuación.
- Coloque la muestra en un bloque de calor, precalentada a 90 ° C, y apague el calor para controlar el enfriamiento lento a temperatura ambiente (típicamente 2 - 4 h).
- Adquisición de Spectra
- Preparar una solución en blanco (NaCl 10 mM, fosfato sódico 10 mM pH 7,3, MgCl 2 5 mM), transferencia tO una microcubeta (longitud de la trayectoria de 1 cm, 250 μl de volumen mínimo) y colóquela en una posición de soporte del cambiador de muestras dentro del instrumento.
- Transferir la muestra que contiene el ARN en otra microcuva y colocarla en el cambiador de muestras. Si se mide una transición de desnaturalización térmica, añadir cuidadosamente un lecho de aceite sin interrumpir la capa acuosa y asegurar la tapa de la cubeta con un trozo de cinta de teflón.
- Abra el tanque de nitrógeno para proporcionar un flujo que mueve el flotador de aire ubicado en el instrumento a aprox. 40. Encienda el enfriador.
- Encienda el instrumento y abra el icono del software Spectra Manager , luego abra la ventana de adquisición Spectra Measurement .
- Purgar el instrumento con nitrógeno durante 5 minutos antes de la adquisición.
- Adquirir los espectros utilizando los siguientes parámetros Medir> Parámetros y ajustar los parámetros como sigue:
- En General , seleccione: Explorar 200-350 nm; Canales CD y HT: DatosPaso a 0,1 nm; Velocidad de exploración a 100 nm / min; Ancho de banda a 1 nm; Número de acumulaciones a 5.
- Bajo unidad de celda , elija 20 ° C. Bajo control , seleccione Obturador abierto y cerrado automáticamente. Bajo información , elija el nombre, la concentración, el operador.
- Bajo datos , vaya a la carpeta deseada. Haga clic en Aceptar .
- Adquisición de los espectros Medida> Medición de muestras , identifique la (s) posición (es) de las cubetas en el cambiador de muestras 1-6 en consecuencia, haga clic en Aceptar .
- Si se toma una transición de desnaturalización térmica:
- Cerrar Software de adquisición Archivo> Salir y abrir un nuevo programa Medición de temperatura variable> Medir> Parámetros .
- Aplique los siguientes parámetros para registrar una transición térmica, que se puede ajustar como se desee:
- Bajo Temperatura , seleccione temperatura de inicio: 4 ° C; Intervalo: 0,2; ejército de reservaTemperatura: 90 ° C; Gradiente: 1 ° C / min; Esperar 0 s. En Inicio / Fin , seleccione la condición de inicio y finalización como desee.
- En General , seleccione 3 Canales, CD / HT / Abs; Ancho de banda: 1 nm; Longitud de onda: 270 nm (o como se desee). En Control , seleccione ninguno. En Información , seleccione nombre, concentración, operador.
- Bajo datos , vaya a la carpeta deseada. Haga clic en Aceptar .
- Enfriar las muestras a 4 ° C y esperar 5 minutos a esta temperatura antes de obtener una medición del espectro.
- Tratamiento de datos para espectros.
- Utilizando la función del software, sustraiga el espectro blanco de la adquisición de destino para tener en cuenta las señales de fondo que surgen del sistema de búfer en uso: Análisis de espectros> Archivo> Abrir .
- Una vez que se ha abierto un archivo en blanco y un archivo de espectros, arrastre View 2 en View 1 (en el lado izquierdo de la pantalla).
- Haga clic en PrOcessing> resta> Aceptar o intercambiar datos> Aceptar .
- Extraiga datos como un archivo ASCII: Archivo> Exportar y seleccione ASCII .
- Utilice software para representar el espectro correspondiente. El ajuste de los datos es opcional en los casos en que la relación señal-ruido es menor de lo esperado. Esta transformación puede aplicarse aplicando la opción de datos de suavizado.
- Tratamiento de datos para transiciones de desnaturalización térmica.
- Extraiga los datos del archivo JASCO como un archivo ASCII.
- Trazar los puntos de elipticidad como una función de la temperatura. Típicamente, la suavización de los datos es necesaria dependiendo de la longitud de onda que se esté examinando. En algunos casos, el uso de la longitud de onda a 210 nm mostró variaciones más grandes entre las parcelas que requerían el suavizado. Sin embargo, dependiendo de la muestra y las concentraciones, se realizaron varios cálculos utilizando los datos brutos.
- Para calcular el den térmico(T m ), obtenga una primera derivada de la curva. Los máximos o mínimos fueron una indicación de este parámetro. Al igual que en el paso anterior, en algunos casos se requirió suavizar los datos para obtener el valor más preciso.
NOTA: Los experimentos se llevaron a cabo típicamente por triplicado, lo que dio como resultado el promedio correspondiente y la desviación estándar para la medición.
Resultados
La síntesis de dodecámeros de ARN que contienen cero, uno o dos modificaciones de 2-tiofenilmetilo en la posición C2'- O se describe junto con su correspondiente purificación y caracterización. Además, se incluye una descripción detallada del análisis estructural que se llevó a cabo a través de CD.
Las cuatro cadenas de ARN (incluyendo una cadena con una secuencia complementaria) se obtuvieron mediante s...
Discusión
La intención de este manuscrito es servir de guía a los investigadores en el campo, principiante o experto, para lograr con éxito o mejorar la síntesis de oligonucleótidos de ADN o ARN. La metodología descrita se centra en el uso de síntesis en fase sólida utilizando un sintetizador de ADN / ARN automatizado a través de la química estándar de fosforamidita. El informe describe una descripción paso a paso de la síntesis, purificación y caracterización de dodecámeros de ARN. Además, se utiliza el uso de C...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Preparación de este manuscrito fue apoyado a través de fondos de puesta en marcha de la Universidad de Colorado Denver (JMRE). AF quiere agradecer el apoyo de un premio de Investigación y Actividades Creativas (RaCAS, CU Denver). Se reconoce la financiación de la Oficina de Servicios de Investigación de la Universidad de Colorado Denver para cubrir los gastos de publicación. Nos gustaría agradecer a los miembros del laboratorio, la Sra. Cassandra Herbert y el Sr. Yannick K. Dzowo por sus contribuciones en la parte de video.
Materiales
| Name | Company | Catalog Number | Comments |
| AbsolveTM | PerkinElmer | 6NE9711 | |
| Acetonitrile 99.9%, HPLC Grade | Fisher Scientific | 75-05-8 | |
| Acetonitrile 99.9%, anhydrous for DNA sequencing | Fisher BioReagents | 75-05-8 | |
| Acrylamide, 99+% | ACROS Organics | 164850025 | |
| Ammonium chloride 98+% | Alfa Aesar | 12125-02-9 | |
| Ammonium citrate, dibasic 98% | Sigma Aldrich | 3012-65-5 | |
| Ammonium Fluoride 98.0%, ACS grade | Alfa Aesar | 12125-01-8 | |
| Ammonium hydroxide 28 - 30% in water, ACS Plus | Fisher Chemical | 1336-21-6 | |
| Ammonium persulfate | ACROS Organics | 1444 | |
| Argon-ultra high purity | Airgas | 7440-37-1 | |
| Bis-acrylamide Ultra pure | VWR-Amresco | 172 | |
| Boric Acid | Fisher Scientific | A73-1 | |
| Diethyl pyrocarbonate, 97% | ACROS Organics | A0368487 | |
| Ethanol, anhydrous, histological grade | Fisher Chemical | 64-17-5 | |
| Ethylenediamine tetraacetic acid, disodium salt dehydrate 100.2% | Fisher Chemical | 6381-92-6 | |
| Formamide | Thermo Scientific | 75-12-7 | |
| Hydrochloric acid, 36.5 - 38.0%, Certified ACS Plus | Fisher Chemical | 7647-01-0 | |
| Magnesium chloride hexahydrate, 99% | Fisher Scientific | 7786-30-3 | |
| Methanol, 99.9%, HPLC Grade | Fisher Chemical | 67-56-1 | |
| Methylamine 40% in water | Sigma Aldrich | 74-89-5 | |
| 1-Methyl-2-pyrrolidinone, andhydrous, 99.5% | Aldrich | 872-50-4 | |
| Opti-TOFTM 96 Well Insert (123 x 81 mm) | MDS SCIEX | 1020157 | |
| RNase Away | Molecular BioProducts | 7005-11 | |
| Sodium acetate, anhydrous 99.2%, Certified ACS | Fisher Chemical | 127-09-3 | |
| Sodium chloride, 100.5%, Certified ACS | Fisher Chemical | 7647-14-5 | |
| Sodium phosphate monobasic dihydrate 99.0% | Sigma | 13472-35-0 | |
| 2’,4’ Triethylamine, 99+% | Alfa Aesar | 121-44-8 | |
| TEMED | Amresco | 761 | |
| Triethylamine trihydrofluoride, 98% | Aldrich | 73602-61-6 | |
| Trifluoroacetic acid, 99% | Alfa Aesar | 76-05-1 | |
| 6’-Trihydroxyacetophenone monohydrate 98% | Sigma Aldrich | 480-66-0 | |
| Tris Base | Fisher Scientific | BP154-3 | |
| Urea | Fisher Scientific | U15-3 | |
| Reagents for the RNA synthesis: | |||
| Deblocking mix, 3% trichloroacetic acid in dichloromethane | Glen Research | 40-4140-57 | |
| Cap Mix A, THF/Pyridine/Acetic anhydride | Glen Research | 40-4110-52 | |
| Cap Mix B, 10% 1-methylimidazole in THF | Glen Research | 40-4120-52 | |
| Activator, 0.25 M 5-ethylthio-1H-tetrazole in anhydrous acetonitrile | Glen Research | 30-3140-52 | |
| Oxidizing Solution, 0.02 M iodine in THF/Pyridine/Water | Glen Research | 40-4330-52 | |
| U-RNA-CPG | Glen Research | 20-3330-xx | |
| Ac-G-RNA-CPG | Glen Research | 20-3324-xx | |
| Ac-G-CE Phosphoramidite | Glen Research | 10-3025-xx | |
| U-CE Phosphoramidite | Glen Research | 10-3030-xx | |
| Ac-C-CE Phosphoramidite | Glen Research | 10-3015-xx | |
| Bz-A-CE Phosphoramidite | Glen Research | 10-3003-xx |
Referencias
- Matteucci, M. D., Caruthers, M. H. The synthesis of oligodeoxypyrimidines on a polymer support. Tetrahedron Lett. 21 (8), 719-722 (1980).
- Beaucage, S. L., Caruthers, M. H. Deoxynucleoside phosphoramidites-A new class of key intermediates for deoxypolynucleotides. Tetrahedron Lett. 22 (20), 1859-1862 (1981).
- Caruthers, M. H. Gene synthesis machines: DNA Chemistry and its uses. Science. 230 (4723), 281-285 (1985).
- Nguyen, J. C., et al. Synthesis, Thermal Stability, Biophysical Properties, and Molecular Modeling of Oligonucleotides of RNA Containing 2'-O-2-Thiophenylmethyl Groups. J Org Chem. 81 (19), 8947-8958 (2016).
- El-Sagheer, A. H., Brown, T. Click chemistry with DNA. Chem Soc Rev. 39, 1388-1405 (2010).
- Puffer, B., et al. 5-Fluoro pyrimidines: labels to probe DNA and RNA secondary structures by 1D 19F NMR spectroscopy. Nucleic Acids Res. 37 (22), 7728-7740 (2009).
- Wan, W. B., Seth, P. P. The medicinal chemistry of therapeutic oligonucleotides. J Med Chem. 59 (21), 9645-9667 (2016).
- Zhou, C., Greenberg, M. M. DNA Damage by histone radicals in nucleosome core particles. J Am Chem Soc. 136 (18), 6562-6565 (2014).
- Zhang, Y., et al. UV-Induced proton-coupled electron transfer in cyclic DNA miniduplexes. J Am Chem Soc. 138 (23), 7395-7401 (2016).
- Anosova, I., et al. The structural diversity of artificial genetic polymers. Nucleic Acids Res. 44 (3), 1007-1021 (2016).
- Riml, C., Micura, R. Synthesis of 5-Hydroxymethylcytidine- and 5-Hydroxymethyl-uridine-Modified RNA. Synthesis. 48, 1108-1116 (2016).
- Anderson, B. A., Hrdlicka, P. J. Merging Two Strategies for Mixed-Sequence Recognition of Double-Stranded DNA: Pseudocomplementary Invader Probes. J Org Chem. 81 (8), 3335-3346 (2016).
- Beaucage, S. L., Iyer, R. P. Synthesis of oligonucleotides by the phosphoramidite approach. Tetrahedron. 48 (12), 2223-2311 (1992).
- Gillet, L. C. J., Alzeer, J., Schärer, O. D. Site-specific incorporation of N-(deoxyguanosin-8-yl)-2-acetylaminofluorene (dG-AAF) into oligonucleotides using modified 'ultra-mild' DNA synthesis. Nucleic Acids Res. 33 (6), 1961-1969 (2005).
- Shiba, Y., et al. Chemical synthesis of a very long oligoribonucleotide with 2-cyanoethoxymethyl (CEM) as the 2'-O.-protecting group: structural identification and biological activity of a synthetic 110mer precursor-microRNA candidate. Nucleic Acids Res. 35 (10), 3287-3296 (2007).
- Choi, Y. J., Gibala, K. S., Ayele, T., Deventer, K. D., Resendiz, M. J. E. Biophysical properties, thermal stability and functional impact of 8-oxo-7,8-dihydroguanine on oligonucleotides of RNA - a study of duplex, hairpins and the aptamer for preQ1 as models. Nucleic Acids Res. 45 (4), 2099-2111 (2017).
- Ranjbar, B., Gill, P. Circular dichroism techniques: Biomolecular and nanostructural analyses - A review. Chem Biol Drug Des. 74 (2), 101-120 (2009).
- Mergny, J. -. L., Lacroix, L. Analysis of thermal melting curves. Oligonucleotides. 13 (6), 515-537 (2003).
- Jin, R., Breslauer, K. J., Jones, R. A., Gaffney, B. L. Tetraplex formation of a guanine-containing nonameric DNA fragment. Science. 250 (4980), 543-546 (1990).
- Virgilio, A., et al. 5-Hydroxymethyl-2'-deoxyuridine residues in the thrombin binding aptamer: Investigating anticoagulant activity by making a tiny chemical modification. CHEMBIOCHEM. 15 (16), 2427-2434 (2014).
- Chauca-Diaz, A. M., Choi, Y. J., Resendiz, M. J. E. Biophysical properties and thermal stability of oligonucleotides of RNA containing 7,8-dihydro-8-hydroxyadenosine. Biopolymers. 103 (3), 167-174 (2015).
- Maniatis, T., Fritsch, E. F., Sambrook, J. . Molecular cloning: a laboratory manual. 14, 173-185 (1987).
- Markham, N. R., Zuker, M. UNAFold: software for nucleic acid folding and hybridization. Methods Mol Biol. 453, 3-31 (2008).
- Breslow, R., Huang, D. -. L. Effects of metal ions including Mg2+ and lanthanides on the cleavage of ribonucleotides and RNA model compounds. Proc Natl Acad Sci U S A. 88 (10), 4080-4083 (1991).
- Blumberg, D. D. Creating a ribonuclease-free environment. Methods Enzymol. 152 (2), 20-24 (1987).
- AbouHaidar, M. G., Ivanov, I. G. Non-enzymatic RNA promoted by the combined catalytic activity of buffers and magnesium ions. Z Naturforsch C. 54 (7-8), 542-548 (1999).
- Farrell, R. E. . RNA Methodologies (4th Ed): A laboratory guide for isolation and characterization. 2, 45-80 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados