A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Nanosensors للكشف عن حوزتي النشاط في فيفو لتشخيص موسع
In This Article
Summary
البروتياز بشكل محكم التنظيم الإنزيمات المشاركة في العمليات البيولوجية الأساسية، ومبطلات dysregulated النشاط محركات تطور الأمراض المعقدة مثل السرطان. هذا الأسلوب يهدف إلى إنشاء nanosensors التي تقيس حوزتي النشاط في فيفو بإنتاج إشارة انقسام وأن قابلاً للاكتشاف من البول المضيف وتميز المرض.
Abstract
البروتياز هي إنزيمات متعددة الوظائف التي تتخصص في التحلل المائي للسندات ببتيد والتحكم بالعمليات البيولوجية واسعة النطاق بما في ذلك التوازن واللوستاسيس. وعلاوة على ذلك، يدفع المرضية dysregulated حوزتي النشاط وهو العلامات البيولوجية وظيفية من الأمراض مثل السرطان؛ ولذلك، قد توفر القدرة على الكشف عن حوزتي النشاط في فيفو المعلومات ذات الصلة سريرياً للتشخيصات الطبية الحيوية. والهدف من هذا البروتوكول هو إنشاء nanosensors التحقيق مبطلات النشاط في فيفو بإنتاج إشارة قابلة للقياس في البول. Nanosensors مبطلات هذه تتكون من عنصرين هما: نانوحبيبات والركيزة. وظائف نانوحبيبات لزيادة تعميم التسليم نصف العمر والركيزة لمواقع الأمراض المستهدفة. الركيزة هو سلسلة ببتيد قصيرة (أ أ 6-8)، التي صممت لتكون محددة بحوزتي الهدف أو مجموعة من البروتياز. الركيزة هو مترافق على السطح نانوحبيبات وأنهى أحد الصحفيين، مثل علامة نيون، للكشف. كما البروتياز dysregulated تنشق الركيزة الببتيد، يتم تصفية المراسل في البول للتقدير الكمي كالعلامات البيولوجية لنشاط البروتياز. وهنا يصف لنا بناء نانوسينسور لمصفوفة أية 9 (MMP9)، الذي يرتبط بتقدم وتطور ورم خبيث، للكشف عن سرطان القولون والمستقيم في طراز ماوس.
Introduction
البروتياز هي إنزيمات متعددة الوظائف التي تتخصص في التحلل المائي للسندات ببتيد وسيطرة كبيرة على العديد من العمليات البيولوجية، بما في ذلك التوازن، اللوستاسيس، والمرض1. وقد تم يرتبط تغيير حالة نشاط البروتياز لمجموعة متنوعة من الأمراض، بما في ذلك السرطان وأمراض القلب والأوعية الدموية، مما يجعل المرشحين البروتياز جذابة للتنمية إلى المؤشرات الحيوية السريرية2،3. وعلاوة على ذلك، هو نشاط البروتياز باثوجينيسيس مرتبطة وظيفيا متميزة ونتائج المرضى وتشخيص المرض4. على نطاق واسع، وقد وضعت هذه الأجهزة للكشف عن مختلف الظواهر البيولوجية والأمراض، مثل السرطان وأمراض الأعصاب، ونقل الإلكترون العمليات5،،من67،8 , 9-وبشكل أكثر تحديداً، قد وضعت للكشف عن نشاط البروتياز، وتشمل تحقيقات فلوروجينيك للتشخيص التصوير10 أجهزة استشعار حوزتي المستندة إلى الركيزة ونظير المسمى الببتيد ركائز المختبر في الكشف بواسطة الكتلي11. وباﻹضافة إلى ذلك، وضعت التحقيقات على أساس النشاط، التي تحتوي على مناطق مثل الركيزة التي تربط أو تعديلها حوزتي الهدف12. باستخدام هذا الأسلوب، لا رجعة فيه تحول دون البروتياز الهدف عندما يتم تعديل الموقع النشط، ويتطلب تحليل الحصاد من الأنسجة، مما يحد من التطبيقات في فيفو . ومع ذلك، من المهم الشعور بحوزتي النشاط في فيفو، نظراً لتنظيم نشاط البروتياز يعتمد اعتماداً كبيرا على سياق الأنشطة البيولوجية الأخرى مثل وجود مثبطات الذاتية.
والهدف من هذا العمل هو لوصف وضع nanosensors على أساس النشاط التي تكشف عن حوزتي النشاط في فيفو بإنتاج إشارة قابلة لقياس في البول. هذا المنهاج كتشخيص موسع لتميز أمراض معقدة مثل السرطان باستخدام dysregulated حوزتي النشاط كالعلامات البيولوجية وظيفية. برنامجنا نانوسينسور يتكون من أكسيد الحديد جسيمات نانوية (إيونب) مترافق بحوزتي ركائز. يتم إنهاء هذه ركائز حسب مراسل فلورسنت الذي صدر عند البروتياز تنشق الركازة. هذه إيونبس تعمم في فيفو، ترجمة لمواقع المرض، وفضح ركائز لنشاط البروتياز المرتبط بالمرض. بعد انشقاق، الصحفيين الفلورسنت يتم إصدارها، ونظرا لصغر حجمها، يتم تصفيتها في البول، بينما تبقى ركائز أونكليافيد على إيونب في الجسم. ولذلك، سيؤدي إلى زيادة في حوزتي الأنشطة في فيفو في تركيزات أعلى من مراسل في البول (الشكل 1). أن برنامجنا اختبار بول، لا منصة التصوير مطلوب ويتم إثراء إشارات تشخيصية في البول.
يمكن تصميم هذا المنهاج للكشف عن مجموعة متنوعة من الأمراض بما فيها السرطان والتليف وتجلط الدم13،14. هنا يمكننا وصف تصميم nanosensors للكشف عن الارتفاعات في مصفوفة ميتالوبيبتيداسي 9 (MMP9) النشاط كالعلامات البيولوجية لسرطان القولون والمستقيم. سرطان القولون والمستقيم هو السبب الرئيسي الثاني للوفاة من السرطان في الولايات المتحدة، مع حدوث حالات جديدة 136,800 المقدرة والوفيات 50,300 في 2014 وحدها15. تنتج الخلايا السرطانية القولون MMP9، التي أظهرت أن محرك التقدم الخبيث، وتدهور مصفوفة، فضلا عن ورم خبيث16. بالإضافة إلى ذلك، حددنا الركازة ببتيد مناسبة (بلجفرجك) ل MMP9 من الأدب17. يمكن استخدام هذا البرنامج للكشف المبكر عن السرطان وتشخيص نقطة الرعاية المنخفضة التكلفة13،14،18،19،،من2021.
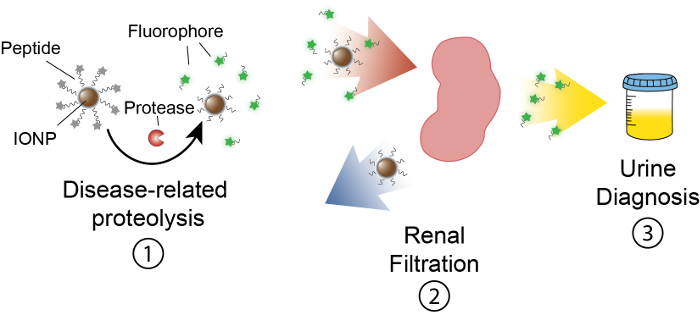
رقم 1: التخطيطي "النشاط نانوسينسور" في فيفو. Nanosensors تعمم عن طريق الهيئة وتعريب لمواقع مرض. ثم تنشق البروتياز المتعلقة بالمرض ركائز الببتيد التي قدمها إيونبس. حجم الشظايا ملصوق يسمح لتطهير الكلي، مما أدى إلى حصر في البول. بعد التبول الحيوان، يمكن تحليل هذه الشظايا الببتيد من جزيء مراسل بهم. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Access restricted. Please log in or start a trial to view this content.
Protocol
موافقة المؤسسية من "رعاية الحيوان المؤسسية" واستخدام اللجنة (إياكوك) في المؤسسة الباحث ضرورية للقيام بالتجارب الحيوانية التالية. بالإضافة إلى ذلك، مرافق الرعاية الحيوانية القياسية (مثل الإسكان الدوائر وأغطية الحيوانات العقيمة والدوائر إيسوفلوراني أنيسثيتيزيشن والدوائر2 CO لنقطة النهاية الأخلاقية يوثانيزيشن) اللازمة لتنفيذ هذه بشكل صحيح التجارب. يمكن توفير التدريب الخاص والمساعدة مع هذه التسهيلات بمختبر الأبحاث الفسيولوجية (PRL) في مؤسسة واحدة. وأقر جميع أعمال الحيوان إياكوك في جورجيا للتكنولوجيا (بروتوكول: A14100).
1-أكسيد الحديد توليف نانوحبيبات (إيونب)
ملاحظة: السلامة: توليف "أكسيد الحديد نانوحبيبات" كامل ينبغي أن يؤديها باستخدام معدات الحماية الشخصية وتحت مادة كيميائية الأبخرة هود.
- في أنبوب مخروطي 15 مل، البرد 1 مل هيدروكسيد الأمونيوم 30% في دلو الجليد مدة 30 دقيقة.
- أغسل 250 مل قارورة Erlenmeyer مع المياه. وإضافة 10 مل ماء مقطر مزدوجة (ddH2س). غمر خارج قارورة في حمام الثلج يستريح على طبق من إثارة/حرارة. استخدام ماصة بلاستيكية لتدفق ن2 الغاز في ddH2س في قارورة. فقاعة لمدة 15 دقيقة مع ن2 ديوكسيجيناتي.
- وزن µmol 224 (4.5 غرام) من ديكستران (الوزن الجزيئي (ميغاواط) = كاتشين 20) في أنبوب 50 مل مخروطية الشكل. إضافة ح2س يكون الحجم النهائي الخليط، بما في ذلك ديكستران، 20 مل. دوامة قوة ليحل في ديكستران.
- وزن µmol 290 (78.5 غرام) من سداسي هيدرات كلوريد الحديد الثلاثي، إضافة إلى حل ديكستران ودوامه حل.
- تصفية الحل الناتجة عن طريق فلتر 0.2 ميكرون.
- نقل هيدروكسيد الأمونيوم 1 مل مبردة إلى 9 مل الماء deoxygenated. العودة إلى 4 درجات مئوية.
- تزن µmol 367 (73.0 غراما) من رباعي هيدرات كلوريد الحديد الثنائي وتذوب في 1 مل من ddH خالية من الأوكسجين2س، وتصفية من خلال فلتر 0.2 ميكرون.
- نقل الحل dextran-iron(III) إلى 250 مل من قارورة Erlenmeyer وديوكسيجيناتي مع ن2 لمدة 15 دقيقة على الجليد. مزيج مع ضجة مغنطيسية شريط الغزل عند 1600 دورة في الدقيقة.
- لخلق جو من نيتروجين متجانسة، كاب قارورة مع الغشاء المطاطي. ثقب الحاجز مع 18 قياس الإبرة لتدفق ن2 إلى قارورة. أدخل إبرة قياس 18 منفصلة كمنفذ تدفق.
- إضافة ميليلتر 467 الحل الحديد الثنائي لحل dextran-iron(III) بحقنه 1 مل، إثارة مع شريط إثارة مغناطيسية عند 1600 دورة في الدقيقة. ينتج هذا نسبة الحديد إلى الحديد الثلاثي في رد فعل متوازن سوف ينتج أكسيد الحديد الأسود أو الحديد3س4.
- أضف برود تمييع هيدروكسيد الأمونيوم دروبويسي إلى الحل ديكستران الحديد (II)-الحديد (III)-لبدء عملية التنو21. تأكد من كل قطره يمزج جيدا قبل إسقاط في مكان آخر. الانتهاء من رد فعل بعد إضافة 1-2 مل من هيدروكسيد الأمونيوم.
- وقف تدفق ن2 وإزالة الغشاء المطاطي. إزالة حمام الثلج واستبدل بحمام ماء الدافئ، مع الاستمرار في تحريك الحل. التأكد من أن درجة حرارة الحل تصل إلى 75 درجة مئوية واحتضان لمدة 75 دقيقة.
- إزالة قارورة من لوحة الساخن/ضجة ومضاعفة تصفية الحل من خلال 0.2 ميكرون ثم 0.1 ميكرومتر مرشحات لإزالة الجسيمات الخشنة.
- المخزن المؤقت لتبادل قطع الجسيمات في ddH2س من الوزن الجزيئي كاتشين 100 باستخدام مركزات (m.w.c.o.) لإزالة ديكستران الزائدة من الحل، التي ينبغي أن تكون لزجة جداً. استبدال مرشحات إذا كان التدفق من خلال ما زالت مظلمة حتى بعد 2-3 يدور، مما يشير إلى أن عامل التصفية قد كسرت.
- المخزن المؤقت تبادل مع المرشحات تدور والطرد المركزي في 4 درجات مئوية في ز 4800 X لمدة 15 دقيقة، وتجاهل التدفق من خلال وإضافة المخزن المؤقت الجديد في حل إيونب. كرر 3-5 مرات.
- تحديد تركيز جسيمات نانوية استخدام جهاز المطياف الضوئي/لوحة قارئ. خذ قياسات امتصاص 400 نانومتر واستخدام أبسوربتيفيتي المولى من إيونب في هذا الطول الموجي (اليورو = 2.07 × 106 سم-1 م-1) لتحديد تركيز الجسيمات IO.
- ريسوسبيند إيونبس إلى 10 ملغ/مل في ddH2س (عادة ما يكون الحجم الإجمالي ~ 3 مل) وتأكد من أن استخدام أنابيب البولي بروبلين لهذه الخطوة من أجل التوافق الكيميائي. إضافة وحدات تخزين 1.6 من 5 م هيدروكسيد الصوديوم، ثم إضافة مجلدات 0.65 من ابيتشلوروهيدرين. مزيج صارم على شاكر لوحة في درجة حرارة الغرفة لمدة 12 ساعة إلى ديكستران التشعب.
- استخدم حقنه 20 مل مع إبرة عيار 18 لتحويل الحل إيونب إلى غشاء الديال m.w.c.o. كاتشين 50. ضع الغشاء الغسيل الكلوي إلى 4 لتر ddH2س واستبدال ح2س بضع مرات (كل 2-3 ساعات). تبني بين عشية وضحاها.
- قياس التركيز وجلب إيونبس إلى 5 ملغ/مل (راجع الخطوة 1، 15). إضافة هيدروكسيد الأمونيوم تصل إلى 20% (v/v) ويهز في درجة حرارة الغرفة > 12 ساعة إلى أمنات على سطح إيونبس. المخزن المؤقت exchange باستخدام 30 كاتشين m.w.c.o. المرشحات (انظر 1.14).
- ضبط مستوى الصوت وصولاً إلى 2.5-3.5 مل قبل التنقية النهائية "سرعة البروتين اللوني السائل" (فبلك) (انظر الجدول للمواد لعمود هلام الترشيح).
- استخدام تشتت الضوء الحيوي (DLS) لتحديد نصف قطر هيدرودينامية إيونبس (النطاق المتوقع 10-100 نانومتر، متوسط حجم 40-50 نانومتر). القيام بذلك قبل اليقوتينج 1 مل 100 × المخفف إيونب عينة في ومبومو ومكان في الجهاز واستخدام برامج الشركة المصنعة لأخذ القياس.
ملاحظة: سوف يكون العدد الإجمالي لسكان إيونبس بين 10 و 100 نانومتر بقياسات DLS، ولكن غالبية السكان من جميع أنحاء القطر المتوسط، التي تتراوح بين 40-50 نانومتر. إذا أراد المرء أن يحد من نطاق الحجم، واحد كذلك استخدام حجم الاستبعاد اللوني لعزل الكسور بأقطار مختلفة. يجب أن يتم تخزين إيونبس في 4 درجات مئوية.
2-الببتيد التصميم، التصريف إلى إيونب، و في المختبر التحقق من الصحة
- توليف الركازة ببتيد (مثلاً، بإنشاء مرفق أساسية أو تجارياً) حوزتي مستهدفة مع مراسل فلورسنت الطرفي ن مثل Fluorescein isothiocyanate (فيتك) وبقايا ج سيستين المحطة طرفية للسماح بوساطة ثيول اقتران.
ملاحظة: في حالة هذه الدراسة ل MMP9، الببتيد المستخدمة كانت فيتك-بلجفرجك-C، مع كالقط/Kم ~ 2.0 × 105 م s-1-1. - قاسمة 0.5 ملغ من إيونب (في 1 ملغ/مل)، وتبادل المخزن المؤقت إلى اقتران المخزن المؤقت (50 مم بورات الصوديوم مع 1 مم يدتا، pH = 8.5) استخدام تصفية تدور كاتشين m.w.c.o. 10 (راجع الخطوة 1، 14).
- حل سوكسينيميديل إيودواسيتاتي (سيا) في ديميثيلفورماميدي (DMF) للوصول إلى تركيز ~ 30 ملغ/مل، وإضافة الخطوط السنغافورية إلى إيونب بنسبة 500 SIA:IONP الخلد.
ملاحظة: سيا هيتيروبيفونكشونال عبر الرابط الذي يتوسط اقتران الأمينات في إيونبس إلى مجموعات سلفهيدريل في الركيزة الببتيد. - احتضان لمدة 1-2 ساعة في درجة حرارة الغرفة في الظلام. إذا ترك بين عشية وضحاها، احتضان عند 4 درجة مئوية.
- المخزن المؤقت exchange باستخدام عامل تصفية تدور m.w.c.o. كاتشين 10 إلى اقتران المخزن المؤقت لإزالة سيا الممتص (راجع الخطوة 1، 14).
- تحقيق الحل المنتج النهائي إلى 1 مغ/مل (0.5 مل الحل). مزيج ببتيد الفائدة بنسبة مولى من 90:1 (الببتيد: إيونب) مع 20 كاتشين منتهية ثيول البولي إثيلين غليكول (شماعة) مولى بنسبة 20:1 (شماعة: إيونب). يخلط هذا الحل الببتيد-شماعة إيونب.
- تبني بين عشية وضحاها في درجة حرارة الغرفة على شاكر لوحة على سرعة أعلى، وتغطي الأنابيب في إحباط لمنع فوتوبليتشينج جزيئات الفلورسنت.
- أضف L-سيستين بنسبة 500: 1 (C:IONP) لتحييد أي جزيئات سيا الممتص مولى. احتضان لمدة ساعة عند 25 درجة مئوية على شاكر سرعة أعلى في درجة حرارة الغرفة.
- تنقية عبر فبلك (انظر 1.1.19). استخدام جهاز المطياف الضوئي لقياس امتصاص الحل العينة وحساب نسبة الببتيد: إيونب وفقا لما يلي. بعد تنقية، تخزين المنتج في 1 ملغ/مل عند 4 درجة مئوية في برنامج تلفزيوني.
- استخدام جهاز المطياف الضوئي قياس امتصاص الحل عينة في 400 نانومتر (عينة، 400) والطول الموجي لامتصاص الحد الأقصى ل fluorophore المستخدمة، وهو 488 نانومتر فيتك (عينة، 488). قياس امتصاص لحل إيونب أمين المخزون في موجات هما نفس (400 نانومتر و 488 نانومتر)، التي تمثل على التواليNP، 400 ومنالحزب الوطني، 488.
- استخدام المعادلات 1 و 2 لحساب تطبيع أ400 وقيم488 .
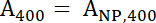 معادلة 1
معادلة 1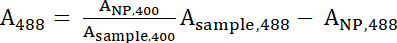 المعادلة 2
المعادلة 2 - 400 و488 تمثل قيم العينة تم تسويتها. استخدام هذه القيم لحساب نسبة الببتيد: إيونب مع المعادلة 3.
 المعادلة 3
المعادلة 3 - حيث
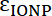 و
و 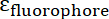 هي أبسوربتيفيتيس المولى في إيونب وفي فلوروفوري، على التوالي. لهذه الجسيمات
هي أبسوربتيفيتيس المولى في إيونب وفي فلوروفوري، على التوالي. لهذه الجسيمات 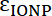 = 2.06 × 106 م-1سم-1 فيتك
= 2.06 × 106 م-1سم-1 فيتك 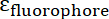 = 72,000 M-1سم-1، لذا القيمة
= 72,000 M-1سم-1، لذا القيمة  ينبغي أن يكون 28.75. ينبغي أن تكون نسب نموذجية الببتيد: إيونب في النطاق من 20:1 إلى 50: 1.
ينبغي أن يكون 28.75. ينبغي أن تكون نسب نموذجية الببتيد: إيونب في النطاق من 20:1 إلى 50: 1.
- التحقق من صحة وظيفة التحقيقات عن طريق إجراء مقايسة انقسام في المختبر .
- مع برنامج تلفزيوني (1% جيش صرب البوسنة)، جعل حلاً نانوحبيبات ميليلتر 18 بتركيز 200 نانومتر من الببتيد. يخلط 2 ميليلتر من مبطلات للفائدة (MMP9؛ 0.1-1 ملغ/مل).
- احتضانها في قارئ لوحة عند 37 درجة مئوية لمدة ساعة واحدة، أخذ القياسات الفلورية (باستخدام الإثارة المناسبة وأطوال موجية الانبعاثات، التي هي 485 نانومتر و 528 نانومتر فيتك، على التوالي) كل 1-2 دقيقة لرصد الانقسام.
3-إقامة Nanosensors والبول في الكشف عن السرطان
ملاحظة: لمزيد من التفاصيل حول هذا النموذج المثال، انظر بنا التقرير السابق13.
- إنشاء قفص ايضية لجمع البول بتأمين الأكمام أسطواني إلى الجزء العلوي من لوحة جيدا 96. أثناء جمع البول، ضع ماوس داخل الأكمام وتغطية بغطاء صحن بيتري لمنع هروب الحيوان.
- تعد حلاً حقن (حجم أقصى 200 ميليلتر) التي تحتوي على nanosensors بتركيز 3000 مغ/كغ (~ 50 µmol) من الببتيد في المحلول الملحي المعقم.
- في الفئران الإناث، 8-الأسبوع القديمة، عارية تحمل إكسينوجرافت LS174T أورام القولون والمستقيم في عبء ~ 100-300 ملم3، التي ينبغي أن تحدث في حوالي يوم 10، إدارة حل نانوسينسور عن طريق حقن الوريد الذيل. فورا بعد الحقن، وضع الفئران في أقفاص الأيضية وملاحظة وقت حقن لكل الماوس.
- 60-90 دقيقة بعد الحقن، إزالة الأكمام أسطواني من صفيحة 96-جيدا. كبح جماح الماوس وتطبيق ضغط طفيف على المثانة للحث على الفئران إفراغ أي البول المتبقية على اللوحة. جمع جميع البول (200-500 ميليلتر).
- تحليل عينات البول من خلال إيمونوبريسيبيتيشن لتنقية فيتك من البول وزيادة الحساسية. استخدم الخرز المغناطيسية مقترنة بالأجسام المضادة-فيتك.
- أولاً، أغسل 25 ملغ الخرز المغناطيسي 3 مرات مع المخزن المؤقت لطلاء، وإحضار وحدة التخزين النهائي إلى 225 ميليلتر.
ملاحظة: من المهم جعل الطلاء العازلة (بورات الصوديوم 0.1 M، pH 9.5)، وحظر المخزن المؤقت (برنامج تلفزيوني، 0.5% جيش صرب البوسنة، 0.05 توين-20%، ودرجة الحموضة 7.4)، والغسيل المخزن المؤقت (برنامج تلفزيوني، 0.1% جيش صرب البوسنة، 0.05 توين-20%، ودرجة الحموضة 7.4) جديدة كل مرة، وما يقرب من 20 مل من كل أمر ضروري. - إضافة 200 ميليلتر لمكافحة--فيتك (5 ملغ/مل) و 200 ميليلتر من كبريتات الأمونيوم (م 3). احتضانها ل 16-24 ساعة عند 37 درجة مئوية في دوار.
- إضافة الحل إلى فاصل مغناطيسي، إزالة المادة طافية، واستبدال مع 625
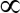 Λ حجب المخزن المؤقت، واحتضان على 37 درجة مئوية بين عشية وضحاها. ثم تغسل 3 مرات مع المخزن المؤقت للمياه والصرف الصحي وتخزين في المخزن المؤقت ليغسل 1.25 مل.
Λ حجب المخزن المؤقت، واحتضان على 37 درجة مئوية بين عشية وضحاها. ثم تغسل 3 مرات مع المخزن المؤقت للمياه والصرف الصحي وتخزين في المخزن المؤقت ليغسل 1.25 مل. - احتضان 2 ميليلتر من البول مع 5 ميليلتر من حبات مغناطيسية (20 ملغ/مل) وإلى وحدة تخزين إجمالي إلى 50 ميليلتر مع برنامج تلفزيوني (0.01 ٪ 20 توين). احتضان لمدة 60 دقيقة.
- أغسل مرتين مع 50 ميليلتر PBS (0.01 ٪ 20 توين) باستخدام فاصل مغناطيسي لجمع الخرز المغناطيسي بعد كل غسل.
- الوت مرتين مع 32.5 ميليلتر من 5% حمض الخليك الجليدية. تحييد شطف المجمعة (70 ميليلتر) مع 35 ميليلتر من "تريس م" 2 لتحقيق الرقم الهيدروجيني نهائي من ~ 7.
- القراءة على قارئ لوحة (انظر الجدول للمواد) عند أطوال موجية الإثارة والانبعاثات المناسبة تحديد كمية البول الأسفار. حساب تركيز مراسل الفلورسنت ضد سلم لتركيزات معروفة من فلوروفوري الحرة.
- أولاً، أغسل 25 ملغ الخرز المغناطيسي 3 مرات مع المخزن المؤقت لطلاء، وإحضار وحدة التخزين النهائي إلى 225 ميليلتر.
Access restricted. Please log in or start a trial to view this content.
النتائج
غالبية السكان إيونبس من جميع أنحاء القطر المتوسط، التي تتراوح بين 40-50 نانومتر. بعد بيجيليشن، قد هذا النطاق حجم نصف عمر الدورة الدموية لحوالي 6 ساعات13 في فيفو (انظر الشكل 2 أ). إذا كان أحد يرغب في تحديد نطاق حجم معين، واحد استخدام حجم الاستب...
Access restricted. Please log in or start a trial to view this content.
Discussion
ويصف هذا الأسلوب تطور nanosensors على أساس النشاط تتكون من ركائز حوزتي مترافق لنواة نانوحبيبات. حدث انشقاق بروتيوليتيك أطلق عليها اسم "التبديل الحرائك الدوائية"، نظراً لأن المنتجات الببتيد ملصوق أصغر من حد الحجم الكلي الترشيح من 5 نانومتر23 والتصفية في البول لإنتاج إشارة موسع. ولذل...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الدكتور كوونغ هو المؤسس المشارك ويعمل كاستشاري بيو جليمبسي، الذي يقوم بتطوير المنتجات ذات الصلة بالبحث المبينة في هذه الورقة. هذه الدراسة يمكن أن يؤثر على حالته المالية الشخصية. شروط هذا الترتيب قد تم استعراضها والموافقة عليها جورجيا للتكنولوجيا وفقا لسياساته تضارب المصالح
Acknowledgements
تم تمويل هذا العمل "جائزة ابتكار جديدة" لمدير المعاهد الوطنية للصحة (رقم الجائزة DP2HD091793). Q.D.M. معتمد من قبل "جبهة الخلاص الوطني الدراسات العليا البحوث برنامج الزمالات" (رقم المنحة DGE-1650044). B.A.H معتمد من قبل الوطنية معاهد للصحة GT BioMAT التدريب المنحة تحت "رقم جائزة" 5T32EB006343 فضلا عن الزمالات لرئيس جورجيا تك. G.A.K. حاصل على جائزة الوظيفي الواجهة العلمية من "صندوق بوروز الترحيب". المحتوى هي المسؤولة الوحيدة عن المؤلفين ولا تمثل بالضرورة وجهات النظر الرسمية "المعاهد الوطنية للصحة".
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
References
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140(2013).
- Ma, W., Liu, H. -T., Long, Y. -T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -H., Ma, W., Long, Y. -T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. AMAG Pharmaceuticals Inc. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , 5,262,176 (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved