Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Наносенсоры обнаружить протеазы активность In Vivo для неинвазивной диагностики
В этой статье
Резюме
Протеаз являются жестко регулируемых ферментов, участвующих в основных биологических процессов и dysregulated протеазы активности дисков прогрессирование таких сложных заболеваний, как рак. Цель этого метода заключается в создании Наносенсоры, измерить протеазы активность в естественных условиях , производя расщепления сигнал, который выявляется от принимающей мочи и дискриминирует болезни.
Аннотация
Многофункциональный ферменты, которые специализируются в гидролиза пептидных связей и управления широкие биологические процессы, включая гомеостаза и аллостазии протеаз. Кроме того dysregulated протеазы активность диски патогенеза и функциональной биомаркеров таких заболеваний, как рак; Таким образом способность обнаруживать протеазы активность в естественных условиях может обеспечить клинически соответствующую информацию для биомедицинской диагностики. Целью настоящего Протокола является создание Наносенсоры, что зонд для протеазы деятельность в естественных условиях , производя сигнал количественно в моче. Эти протеазы Наносенсоры состоят из двух компонентов: наночастиц и субстрата. Наночастицы функций увеличить тираж half-life и субстрат доставки целевых болезней сайтов. Подложка является последовательность коротких пептида (6-8 АА), который предназначен для определенного целевого протеазы или группе протеаз. Субстрат конъюгированных на поверхности наночастиц и прекращается по репортер, например флуоресцентного маркера, для обнаружения. Как dysregulated протеазами расщеплять пептид субстрата, репортер фильтруется в мочи для количественной оценки в качестве биомаркера активности протеаз. Здесь мы описываем строительство нано для матрицы металлопротеиназы 9 (MMP9), который связан с прогрессии опухоли и метастазов, для выявления колоректального рака в мышиной модели.
Введение
Протеаз являются многофункциональный ферменты, которые специализируются в гидролиза пептидных связей и имеют значительный контроль над много биологических процессов, включая гомеостаза, аллостазии и болезни1. Измененное состояние активности протеаз было увязать для различных заболеваний, включая рак и сердечно-сосудистые заболевания, что делает привлекательным протеаз кандидатов для развития клинических биомаркеров2,3. Кроме того протеазы деятельность является функционально связан с собственный патогенезы, исходы и прогноз заболевания4. Широко обнаружить различные биологические явления были разработаны Биосенсоры и заболеваний, как рак, нейродегенеративные заболевания и перенос электрона обрабатывает5,6,,78 , 9. Говоря более конкретно, на основе субстрат протеазы датчики разработаны для выявления активности протеаз и включают в себя fluorogenic зонды для диагностических изображений10 и гетерогенны помечены пептидных субстратов для в пробирке Обнаружение массового спектрометрирования11. Кроме того были разработаны на основе активности зондами, которые содержат субстрата как регионы, которые связывают или изменить целевой протеазы12. С помощью этого метода протеазы целевой необратимо ингибируется, когда изменяется на активном узле, и анализ требует уборки из ткани, которая ограничивает в vivo приложений. Однако важно чувство протеазы активность в естественных условиях, потому что регулирование деятельности протеазы сильно зависит от контекста других биологической деятельности, таких как наличие эндогенных ингибиторов.
Целью этой работы является описание разработки на основе деятельности Наносенсоры, что обнаружить протеазы активность в естественных условиях , производя измеримые сигнал в моче. Эта платформа используется как неинвазивный диагностический различать сложных заболеваний, как рак, используя dysregulated протеазы деятельность как функциональный биомаркеров. Наша платформа нано состоит наночастиц оксида железа (IONP), конъюгированных протеазы субстратов. Эти субстраты завершенны флуоресцентные репортер, который высвобождается, когда протеаз прилепится субстрата. Эти IONPs циркулируют в vivo, локализации болезни сайтов и разоблачить субстратов для активной болезни связанные протеаз. После расщепления флуоресцентный Репортеры выпускаются и, из-за их малого размера, фильтруются в моче, в то время как uncleaved субстратов на IONP остаются в организме. Таким образом увеличение протеазы мероприятия в естественных условиях приведет к повышению концентрации репортер в моче (рис. 1). Поскольку наша платформа является тест мочи, не платформа отображения информации является обязательным и диагностические сигналы обогащаются в моче.
Эта платформа могут быть спроектированы для обнаружения различных заболеваний, включая рак, фиброза и тромбоз13,14. Здесь мы описываем дизайн Наносенсоры обнаружить фасады в матрице metallopeptidase 9 (MMP9) деятельность как биомаркер рака прямой кишки. Колоректальный рак является второй ведущей причиной смерти от рака в Соединенных Штатах, с приблизительно 136,800 новых случаев и 50,300 смертей в 2014 только15. Колоректальные опухоли клетки производят MMP9, который был показан диск злокачественные прогрессии, матрица деградации, а также метастазов16. Кроме того мы определили подложке подходящий пептида (PLGVRGK) для MMP9 из литературы17. Эта платформа может использоваться для раннего обнаружения рака и низкой стоимости обслуживания точки диагностики13,14,18,19,,2021.
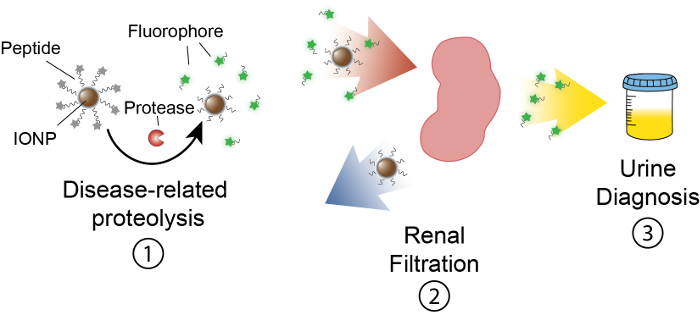
Рисунок 1: Схема активности нано в vivo. Наносенсоры циркулируют через тело и локализации сайтов заболеваний. Затем связанные с болезнью протеаз прилепится пептидных субстратов, представленный IONPs. Размер рассеченного фрагментов позволяет почечного клиренса, заставляя их локализовать в моче. После того, как животное мочится, эти терпеноидные фрагменты могут быть проанализированы их молекулы репортер. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
протокол
Институциональные одобрение в заведении исследователя от институциональный уход животных и использование Комитет (IACUC) необходимо провести следующие эксперименты на животных. Кроме того необходимо должным образом выполнять эти стандартные животных ухода (например, корпус камеры, стерильные животные вытяжки, isofluorane камеры для анестезии и CO2 камер для этических конечной точки euthanization) эксперименты. Специальную подготовку и помощь с этих объектов могут быть предоставлены физиологических исследований лаборатории (PRL) в его учреждении. Все животные работы был одобрен IACUC в Georgia Tech (протокол: A14100).
1. оксид железа синтез наночастиц (IONP)
Примечание: Безопасность: весь синтеза наночастиц оксида железа должно выполняться с использованием средств индивидуальной защиты и под химического дыма капот.
- В 15 мл Конические трубки холод 1 мл 30% Окисоводопод аммония в ведёрке со льдом на 30 мин.
- Вымойте 250 мл колбу Эрленмейера деионизированной водой и добавить двойной 10 мл дистиллированной воды (ddH2O). Опускайте внешней колбы в ледяной ванне, покоится на тарелку перемешать/тепла. Используйте Пластиковые пипетки для потока N2 газ в ddH2O в колбу. Пузырь на 15 минут с N2 по deoxygenate.
- Вес 224 мкмоль (4,5 грамма) декстрана (молекулярный вес (МВт) = 20 кДа) в 50 мл Конические трубки. Добавление H2O, что окончательный объем смеси, включая декстрана, 20 мл. Вихрь энергично распустить декстрана.
- Вес 290 мкмоль (78.5 грамм) iron(III) гексагидрат хлорида, добавьте в решение декстрана и вихревой распустить.
- Полученный раствор отфильтровать через фильтр 0.2 мкм.
- Передача 1 мл охлажденной аммония Гидроксид 9 мл венозная воды. Возвращение в 4 ° C.
- Вес железа хлорид тетрагидрат 367 мкмоль (73,0 грамм), растворяют в 1 мл бескислородной ddH2O и процеживают через фильтр 0.2 мкм.
- Передача dextran-iron(III) решение в 250 мл колбу Эрленмейера и deoxygenate с N2 по 15 минут на льду. Смешать с магнитной перемешать бар спиннинг на 1600 об/мин.
- Для создания однородной азота атмосферы, крышка колбу с резиновой перегородки. Прокол перегородки с 18 манометра для потока N2 в колбу. Вставка отдельных 18 иглы как поток выходе.
- Мкл 467 раствора железа в dextran-iron(III) решение с 1 мл шприц, помешивая магнитной перемешать бар при 1600 об/мин. Это соотношение железа в iron(III) приводит к сбалансированной реакции, которая будет производить магнетит, или Fe3O4.
- Добавьте что охлажденные разбавить Гидроксид аммония каплям в решение декстран железа (II) - железа (III) - для начала процесса нуклеации21. Убедитесь, что каждой капли смеси задолго до падения в другой. Закончите реакции после добавления 1-2 мл гидроксида аммония.
- Остановить поток N2 и удалить резиновые перегородки. Удаление ледяной ванне и заменить ванну теплой воды, продолжая размешивать раствор. Убедитесь, что температура раствора достигает 75 ° C и проинкубируйте 75 минут.
- Удаление фляга из перемешать горячей плиты и вдвойне фильтр решение через 0,2 мкм затем 0,1 мкм фильтры для удаления грубых частиц.
- Буфер обмена частиц в ddH2O, с помощью 100 кДа молекулярного веса отрезали концентраторы (m.w.c.o.) для удаления избыточных декстрана от решения, которое должно быть очень вязкой. Если через поток остается темным даже после 2-3 спинов, который указывает, что фильтр может сломанной, замените фильтры.
- Для буфера обмена с спин фильтры, центрифуги на 4 ° C на 4800 X g на 15 минут, отменить потока через и добавить новый буфер IONP решение. Повторите 3 - 5 раз.
- Определите концентрацию наночастиц с помощью читатель спектрофотометр/плита. Выполняйте измерения оптической плотности в 400 Нм и использования Молярная поглощаемость IONP на этой длине волны (ε = 2,07 x 106 см-1 M-1) для определения концентрации частиц IO.
- Ресуспензируйте IONPs до 10 мг/мл в ddH2O (обычно общий объем составляет ~ 3 мл) и убедитесь в том использовать полипропиленовые трубы для этого шага для химической совместимости. Добавьте 1.6 тома 5 M NaOH, а затем добавить 0,65 томов эпихлоргидрина. Строго mix на шейкере пластины при комнатной температуре на 12 часов, чтобы crosslink декстрана.
- Используйте 20 мл шприц с 18-калибровочного иглы для передачи IONP решение в мембрану диализа m.w.c.o. 50 kDa. Поместите диализа мембраны в 4 Л ddH2O и заменить H2O несколько раз (каждые 2-3 часа). Инкубируйте на ночь.
- Измерить концентрацию и довести IONPs до 5 мг/мл (см. шаг 1.15). Добавьте Гидроксид аммония достичь 20% (v/v) и поколебать при комнатной температуре > 12 часов на aminate поверхности IONPs. Буфер обмена с помощью 30 кДа m.w.c.o. фильтров (см. 1.14).
- Отрегулируйте громкость до 2,5-3,5 мл перед окончательной очистки, быстро белок жидкостной хроматографии (ПСОК; см. Таблицу материалы для фильтрации столбца гель).
- Используйте динамическое рассеяние света (DLS) чтобы определить гидродинамические радиус IONPs (ожидаемый диапазон 10-100 Нм, средний размер 40-50 Нм). Сделать это путем aliquoting 1 мл 100 X разреженных образец IONP в кювет, место в машине и использовать программное обеспечение производителя взять измерения.
Примечание: Общая численность населения IONPs будет между 10 и 100 Нм DLS измерениями, но большинство населения вокруг средний диаметр, которая колеблется от 40-50 Нм. Если один хочет, чтобы ограничить размер диапазона, далее можно использовать гель-проникающей хроматографии размер изолировать дробей с разными диаметрами. IONPs следует хранить при 4 ° C.
2. пептидные дизайн, спряжение IONP, и в пробирке проверки
- Синтезировать пептидный субстрат (например, основные средства или коммерчески) для целевого протеазы с N-терминальный флуоресцентные репортер например флуоресцеин Изотиоцианаты (FITC) и остатков цистеина терминала C позволить тиоловых опосредованной муфты.
Примечание: В случае данного исследования для MMP9, пептид используется был FITC-PLGVRGK-C, с kкошка/km ~ 2.0 x 105 M-1s-1. - Алиготе 0,5 мг IONP (в 1 мг/мл), и буфер обмена в муфты буфера (50 мм Борат натрия с 1 мм ЭДТА, pH = 8.5) с помощью 10 кДа m.w.c.o. спина фильтр (см. шаг 1.14).
- Растворить в диметилформамиде (DMF) достичь концентрации ~ 30 мг/мл Succinimidyl йодацетатом (SIA) и добавьте SIA IONP в соотношении моль 500 SIA:IONP.
Примечание: SIA является heterobifunctional крест компоновщика, которая опосредует муфта аминов на IONPs сульфгидрильных групп на пептидный субстрат. - Инкубируйте 1-2 часа при комнатной температуре в темноте. Если оставить на ночь, Инкубируйте на 4 ° C.
- Буфер обмена, используя фильтр 10 кДа m.w.c.o. спина в муфты буфера для удаления непрореагировавшего SIA (см. шаг 1.14).
- Привести решения конечного продукта до 1 мг/мл (0,5 мл раствора). Смешайте пептид интерес в молярное соотношение 90:1 (пептид: IONP) с 20 кДа тиоловых завершенной полиэтиленгликоля (PEG) на молярное соотношение 20:1 (PEG: IONP). Смешайте это пептид PEG решение с IONP.
- Инкубируйте на ночь при комнатной температуре на тарелку шейкер на высокой скорости, охватывающие трубы в фольгу для предотвращения Фотообесцвечивание флуоресцентных молекул.
- Добавьте L-цистеина в молярное соотношение 500: 1 (C:IONP) для нейтрализации любых непрореагировавшего SIA молекул. Инкубируйте 1 час при температуре 25 ° C на шейкер на высокой скорости при комнатной температуре.
- Очищают через ПСОК (см. 1.1.19). Используйте спектрофотометр для измерения оптической плотности образец решения и рассчитать коэффициент пептида: IONP по словам следующее. После очистки Храните продукт в 1 мг/мл при температуре 4 ° C в PBS.
- Использовать спектрофотометр для измерения оптической плотности образца раствора на 400 Нм (образец, 400) и длина волны максимального поглощения для Флюорофор использовано, который 488 нм для FITC (образец, 488). Измерение оптической плотности запасов Амин IONP раствора на же двух длинах волн (400 Нм и 488 нм), которые соответственно представлены какNP, 400 иNP, 488.
- Использовать 1 и 2 для вычисления нормализованных уравнений A400 и488 значения.
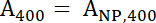 Уравнение 1
Уравнение 1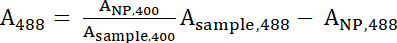 Уравнение 2
Уравнение 2 - 400 и488 представляют нормализованных значений выборки. Используйте эти значения для вычисления соотношения пептида: IONP с уравнением 3.
 Уравнение 3
Уравнение 3 - Где
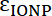 и
и 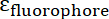 , Молярная absorptivities IONP и Флюорофор, соответственно. Для этих частиц
, Молярная absorptivities IONP и Флюорофор, соответственно. Для этих частиц 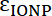 = 2,06 x 106 M-1см-1 и для FITC
= 2,06 x 106 M-1см-1 и для FITC 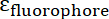 = 72000 М-1см-1, поэтому значение
= 72000 М-1см-1, поэтому значение  должно быть 28,75. Типичные пептида: IONP соотношение должно быть в диапазоне от 20:1 до 50: 1.
должно быть 28,75. Типичные пептида: IONP соотношение должно быть в диапазоне от 20:1 до 50: 1.
- Проверка функциональности зондов, выполняя assay расщепления в пробирке .
- С PBS (1% BSA), сделать 18 мкл раствора наночастиц с 200 Нм концентрация пептидный. Смешать с 2 мкл протеазы интерес (MMP9; 0,1 - 1 мг/мл).
- Инкубируйте 1 часа, измерений флуоресценции в тарелку читателя при 37 ° C (с помощью соответствующих возбуждения и выбросов длин волн, которые являются 485 Нм и 528 Нм для FITC, соответственно) каждые 1-2 минуты для мониторинга расщепления.
3. Администрация Наносенсоры и мочи обнаружения рака
Примечание: Для более подробной информации на примере модели, видите наш предыдущий доклад13.
- Создайте метаболические каркас для забора мочи путем обеспечения цилиндрическую гильзу в верхней части 96 пластины хорошо. Во время сбора мочи поместите мышь внутри рукава и накрыть крышкой Петри для предотвращения побега животного.
- Подготовьте инъекционного раствора (200 мкл максимальный объем), содержащий Наносенсоры в концентрации 3000 мг/кг (~ 50 мкмоль), пептид в стерильного физиологического раствора.
- Женщина, 8 - неделя старый, обнаженная мышей, принимая ксенотрансплантата Колоректальные опухоли LS174T на себе бремя ~ 100-300 мм3, которое должно произойти приблизительно на день 10, управлять Нано решение через инъекции Вену хвост. Сразу же после инъекции место мышей в метаболизм клетки и обратите внимание на время инъекции для каждой мыши.
- В 60-90 минут после инъекции удалите цилиндрическую гильзу с 96-луночных пластины. Сдерживать мыши и применить небольшое давление на мочевой пузырь побудить мышей аннулировать любые оставшиеся мочи на пластину. Соберите все мочи (200-500 мкл).
- Анализ мочи по иммунопреципитации очищают FITC из мочи и увеличить чувствительность. Использование магнитной бусины в сочетании с анти FITC антител.
- Во-первых мыть 25 мг в магнитные бусы 3 раза с буфером покрытия и довести окончательный объем до 225 мкл.
Примечание: Важно сделать буфер покрытия (Борат натрия 0,1 М, pH 9.5), блокирующий буфер (PBS, 0,5% BSA, 0,05% Tween-20, рН 7,4) и Отмывающий буфер (PBS, 0.1% BSA, 0,05% Tween-20, рН 7,4) свежий каждый раз и примерно в 20 мл каждого необходимости. - Добавьте 200 мкл анти FITC (5 мг/мл) и 200 мкл сульфата аммония (3 М). Инкубируйте на 16-24 часа при 37 C на ротатора.
- Добавить решение в магнитный сепаратор, удалить супернатант, замените 625
 Λ блокирует буфер и Инкубируйте на 37 C на ночь. Затем вымойте 3 раза с буфером мыть и хранить в 1,25 мл мыть буфера.
Λ блокирует буфер и Инкубируйте на 37 C на ночь. Затем вымойте 3 раза с буфером мыть и хранить в 1,25 мл мыть буфера. - Проинкубируйте 2 мкл мочи с 5 мкл магнитных шариков (20 мг/мл) и довести до общего объема до 50 мкл с PBS (0.01% 20 анимации). Инкубируйте 60 мин.
- Мыть дважды с 50 мкл PBS (0.01% 20 анимации) с помощью магнитный сепаратор для сбора магнитные бусы после каждой стирки.
- Элюировать дважды с 32,5 мкл 5% уксусной кислоты кристаллизированной. Нейтрализовать пуле элюции (70 мкл) с 35 мкл 2 М трис для достижения окончательного рН ~ 7.
- Читайте на тарелку читателя (см. Таблицу материалы) на соответствующие возбуждения и выбросов длинах волн для количественного определения мочи флуоресценции. Рассчитайте концентрацию флуоресцентные репортер против лестница известной концентрации свободного Флюорофор.
- Во-первых мыть 25 мг в магнитные бусы 3 раза с буфером покрытия и довести окончательный объем до 225 мкл.
Результаты
Большинство населения IONPs, вокруг средний диаметр, которая колеблется от 40-50 Нм. После ПЭГилирование, этот диапазон размеров имеет тираж период полураспада примерно 6 часов13 в естественных условиях (см. рис. 2а). Если один хочет, чтобы вы...
Обсуждение
Этот метод описывает развитие деятельности на основе Наносенсоры, состоящий из протеазы субстратов, конъюгированных наночастиц ядро. Событие протеолитического расщепления называют «фармакокинетические переключатель», потому что рассеченного пептидных продуктов меньше, чем почечн?...
Раскрытие информации
Д-р Квонг является соучредителем и выступает в качестве консультанта Glympse био, который разрабатывает продукты, относящиеся к исследования, описанных в данном документе. Это исследование может повлиять на его личный финансовый статус. Условия этого соглашения были рассмотрены и одобрены Georgia Tech в соответствии со своей политикой конфликта интересов
Благодарности
Эта работа финансировалась NIH директор новой новатор Award (премия No. DP2HD091793). Q.D.M. поддерживается выпускников стипендии программы исследований NSF (Грант № DGE-1650044). B.A.H поддерживается национальных институтов из здравоохранения GT BioMAT обучения Грант под награду номер 5T32EB006343, а также стипендий Президента Грузии Tech. G.A.K. проводит Career Award в интерфейсе научного фонда Добро Берроуз. Содержание является исключительно ответственности авторов и не обязательно отражают официальную точку зрения национальных институтов здоровья.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
Ссылки
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены