Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Nanosensors için noninvaziv tanı koyma proteaz aktivitesi Vivo tespit
Bu Makalede
Özet
Proteaz sıkıca düzenlenmiş temel biyolojik süreçlerin ve dysregulated proteaz aktivitesi sürücüler ilerleme kanser gibi karmaşık hastalıkların katılan enzimlerdir. Bu yöntemin hedef ana bilgisayar idrardan algılanabilir ve hastalık ayrımcılık bir bölünme sinyal üreterek proteaz aktivitesi in vivo ölçmek nanosensors oluşturmaktır.
Özet
Proteaz peptid bağları hidroliz içinde uzmanlaşmak ve homeostasis ve allostasis dahil olmak üzere geniş biyolojik süreçleri kontrol çok fonksiyonlu enzimlerdir. Ayrıca, dysregulated proteaz aktivitesi Patogenez sürücüler ve kanser gibi hastalıkların işlevsel bir biyomarker olduğunu; Bu nedenle, proteaz aktivitesi in vivo algılama yeteneğini Biyomedikal teşhis için klinik olarak ilgili bilgi sağlayabilir. İdrarda ölçülebilir bir sinyal üreterek proteaz aktivitesi in vivo için yoklama nanosensors oluşturmak için bu iletişim kuralını hedefidir. Bu proteaz nanosensors iki bileşenden oluşur: bir nanopartikül ve substrat. Hedef hastalığı sitelere dolaşım yarılanma ömrü ve substrat teslimat artırmak için nanopartikül işlevleri. Belgili tanımlık substrate belirli bir hedef proteaz veya proteaz grubu olmak üzere tasarlanmış bir kısa peptid (6-8 AA), sırasıdır. Belgili tanımlık substrate nanopartikül yüzeye Birleşik ve algılama için floresan bir işaret gibi bir gazeteci tarafından sonlandırıldı. Dysregulated proteaz peptid substrat ayırmak gibi muhabir proteaz aktivitesinin bir biyomarker olarak miktar için idrar içine süzülür. Burada bir nanosensor matriks metalloproteinaz 9 (MMP9), tümör ilerleme ve metastaz, bir fare modeli kolorektal kanseri tespiti ile ilişkili için inşaatı tarif.
Giriş
Proteaz peptid bağları hidroliz içinde uzmanlaşmak ve önemli homeostazı, allostasis ve hastalık1de dahil olmak üzere birçok biyolojik süreçlerin kontrole sahip çok fonksiyonlu enzimlerdir. Bir değişmiş devlet proteaz aktivitesinin hastalıkları, kanser ve kardiyovasküler hastalık, proteaz çekici adaylar için geliştirme klinik biyolojik2,3içine yapım da dahil olmak üzere çeşitli korelasyon. Ayrıca, proteaz işlevsel olarak bağlantılı ayrı pathogeneses, hasta sonuçları ve hastalık4prognozunda faaliyettir. Geniş, biyosensörler çeşitli biyolojik olayları algılamak için geliştirilmiştir ve hastalıklar, kanser, nörodejeneratif hastalık ve Elektron transferi gibi işler5,6,7,8 , 9. daha ayrıntılı olarak, substrat tabanlı proteaz sensörler proteaz bir etkinlik tespit ve fluorogenic sondalar10 görüntüleme tanı için eklemek için geliştirilen edilmiş ve isotopically peptid yüzeylerde içinde vitro için etiketli Algılama işlemi, kütle spektrometresi11tarafından. Buna ek olarak, hangi bağlamak veya değiştirme hedef proteaz12substrat benzeri bölgeleri içeren etkinlik tabanlı probları geliştirilmiştir. Bu yöntemde, hedef proteaz geri dönüşümsüz aktif değiştirilir ve in vivo uygulamaları sınırlayan dokusunun hasat analiz gerektirir engellenir. Ancak, yönetmelik proteaz aktivitesinin ağır endojen inhibitörleri varlığı gibi diğer biyolojik etkinlikler kapsamında bağlı olduğundan proteaz aktivitesi in vivo, anlamda önemlidir.
Amaç bu eserin idrarda ölçülebilir bir sinyal üreterek proteaz aktivitesi vivo içinde algılamak etkinlik tabanlı nanosensors formülasyonu tarif etmektir. Bu platform bir noninvaziv tanı dysregulated proteaz aktivitesi işlevsel bir biyomarker kullanarak karmaşık hastalıklar kanser gibi ayrımcılık için kullanılır. Nanosensor platformumuz proteaz yüzeyler için Birleşik demir oksit nano tanecikleri (IONP) oluşur. Bu yüzeylerde proteaz substrat ayırmak bağlandığınızda serbest floresan bir muhabir tarafından sonlandırılır. Bu IONPs vivodolaşımını, hastalık sitelere yerelleştirilmesine ve yüzeylerde aktif hastalık ilişkili proteaz için maruz. Bölünme sonra floresan gazetecilere serbest bırakılır ve IONP üzerinde uncleaved yüzeylerde vücutta kalır kendi küçük boyutu nedeniyle idrar içine, filtre uygulanır. Bu nedenle, proteaz faaliyetleri vivo içinde artış bir muhabir için idrar (Şekil 1) daha yüksek konsantrasyonlarda neden olur. Bizim idrar testi platformdur, hiçbir görüntüleme platformu gereklidir ve tanılama sinyalleri idrarda zenginleştirilmiş.
Bu platform hastalıkları kanser, fibrozis ve tromboz13,14dahil olmak üzere çeşitli algılamak için tasarlanmış. Burada yükselmeler matris metallopeptidaz 9 (MMP9) tespit etmek için nanosensors tasarımını açıklamak bir biyomarker kolorektal kanser olarak faaliyet. Kolorektal kanser kanser ölüm ikinci önde gelen nedenidir bir tahmini 136,800 Yeni olgu ve 2014 yalnız15dakika sonra 50,300 ölümlerini ile Amerika Birleşik Devletleri olduğunu. Kolorektal tümör hücreleri malign ilerleme, matris bozulması gibi metastaz16sürücü için gösterilen MMP9 üretmek. Ayrıca, biz edebiyat17MMP9 için uygun peptid substrat (PLGVRGK) tespit. Bu platform erken kanser teşhis ve düşük maliyetli bakım noktası tanılama13,14,18,19,20,21için kullanılabilir.
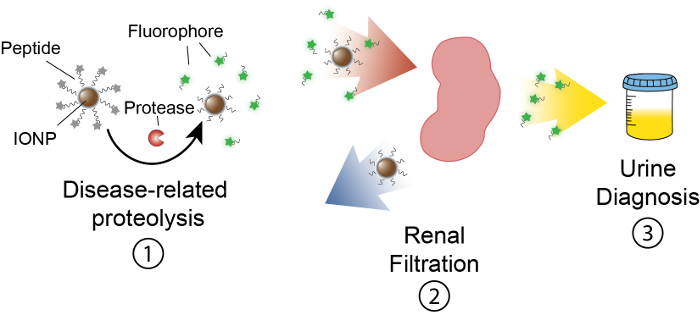
Şekil 1: Nanosensor aktivite içinde vivoşematik. Nanosensors vücuda geçirilip yorumlanması için dolaştırmak ve hastalık sitelere yerelleştirilmesine. O zaman, proteaz hastalığı ile ilgili IONPs tarafından sunulan peptid yüzeylerde ayırmak. Renal izni, onları idrarda yerelleştirmek neden i ciddi parçaları boyutunu sağlar. Hayvan idrara sonra bu peptid parçaları kendi muhabir molekül tarafından çözümlenebilir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Protokol
Kurumsal hayvan bakım ve kullanım Komitesi (IACUC) Kurumsal onayını araştırmacı kurumu aşağıdaki hayvan deneyleri yapmak gereklidir. Ayrıca, standart hayvan bakım tesisleri (konut chambers, steril hayvan davlumbaz, isofluorane salonları için anesthetization ve CO2 salonları etik bitiş noktası euthanization içinÖrneğin, ) düzgün bunları gerçekleştirmek için gereken deneyler. Özel eğitim ve yardım bu tesisler ile kişinin Kurumu fizyolojik Araştırma Laboratuvarı (PRL) tarafından sağlanabilir. Tüm hayvan iş IACUC Georgia Tech tarafından kabul edildi (protokol: A14100).
1. demir oksit nanoparçacık (IONP) sentezi
Not: Emanet: tüm demir oksit nanoparçacık sentezi kişisel koruyucu donanımları kullanarak yapılmalıdır ve kaputun altında bir kimyasal duman.
- 15 mL konik tüp buz kovası 30 dk için % 30 amonyum hidroksit 1 mL soğuk.
- 250 mL Erlenmeyer flask deiyonize su ile yıkama ve 10 mL Çift Kişilik distile su (GKD2O) ekleyin. Bir heyecan/ısı plaka üzerinde dinlenme bir buz banyosu şişeye dýþýna daldırın. GKD2O balonun içinde içine akış N2 gaz için plastik bir pipet kullanın. Kabarcık deoxygenate N-2 ile 15 dakika.
- 224 µmol (4.5 gram) dextran tartmak (Moleküler ağırlığı (MW) = 20 kDa) 50 mL konik tüp içine. Öyle ki son hacim karışımı dextran dahil olmak üzere 20 mL H2O ekleyin. Girdap şiddetle dextran geçiyoruz.
- 290 µmol (78.5 gram) demir(III) klorür hekzahidrat tartmak, dextran çözüm ve çözülmeye girdap için ekleyin.
- Elde edilen çözüm 0.2 µm filtreden filtre.
- 1 soğutulmuş mL amonyum hidroksit 9 mL deoxygenated su aktarın. 4 ° C'ye dön
- İron(II) klorür tetrahydrate 367 µmol (73,0 gram) tartmak, 1 mL oksijensiz GKD2O geçiyoruz ve 0.2 µm filtreden filtre.
- Dextran-iron(III) çözüm 250 mL Erlenmeyer şişesi aktarmak ve N2 ile 15 dakika boyunca buzda deoxygenate. 1600 devir/dakika, iplik bar manyetik bir heyecan ile karıştırın.
- Homojen azot atmosfer yaratmak için balon lastik septum ile kap. Ponksiyon bir 18 ile septum balonun iğne akış N2 için ölçmek. Ayrı 18 gauge iğne bir akış çıkış gibi ekleyin.
- 467 µL iron(II) çözüm dextran-iron(III) 1600 devir/dakika bir manyetik heyecan çizgiyle karıştırarak 1 mL şırınga ile ekleyin. Bu oran demir(III) iron(II) manyetit veya Fe3O4üretecek dengeli bir tepki olarak sonuçlanır.
- Soğutulmuş amonyum hidroksit dropwise çekirdekleşme süreci21başlatmak için demir (II) - demir (III) - dextran çözümde seyreltik ekleyin. Emin olun her damlacık de diğerinde silmeden önce karışımları. Amonyum hidroksit 1-2 mL ilavesi sonra reaksiyon bitirmek.
- N2 akışını durdurmak ve kauçuk septum kaldırın. Buz banyosu kaldırın ve çözüm karıştırmaya devam ederken sıcak su, banyo ile değiştirin. Çözüm sıcaklığını 75 ° C ulaştığından emin olmak ve 75 dakika boyunca kuluçkaya.
- Şişeye heyecan/sıcak plaka kaldırmak ve iki kat iri parçacıklar kaldırmak için 0.2 µm sonra 0,1 µm filtreleri yoluyla çözüm filtre.
- Arabellek Döviz aşırı dextran çok yapışkan olması gereken çözümden kaldırmak için (m.w.c.o.) yoğunlaştırıcıları parçacıklar halinde GKD2100 kDa moleküler ağırlık kullanarak O kesti. Aracılığıyla akış bile 2-3 tur sonra filtre kırık gösterir karanlık kalırsa filtreler yerini alır.
- Exchange spin filtreleri ile tampon, 4800 X g de 4 ° C'de 15 dakika santrifüj kapasitesi, akış yoluyla atmak ve yeni tampon IONP çözüm için. 3 - 5 kez tekrarlayın.
- Spektrofotometre/plaka okuyucu kullanarak nano tanecikleri konsantrasyonu belirlemek. Almak absorbans ölçümleri 400 nm ve kullanım IONP molar absorptivity, bu dalga boyu (ε 2,07 106 cm-1 M-1x =) g/ç parçacıklar konsantrasyonu belirlemek için.
- IONPs 10 mg/ml GKD2içinde (genellikle toplam ~ 3 mL birimdir) O resuspend ve kimyasal uyumluluk için bu adım için polipropilen borular kullandığınızdan emin olun. 5 M NaOH 1.6 birimleri ekleyin, sonra hidrin 0.65 hacimleri ekleyin. Titizlikle crosslink dextran için 12 saat üzerinde oda sıcaklığında bir plaka shaker karıştırın.
- 20 mL şırınga bir 18'lik iğne ile IONP çözüm 50 kDa m.w.c.o. diyaliz membran aktarmak için kullanın. Diyaliz membran 4 L GKD2O yerleştirin ve H2O bir kaç kez (her 2-3 saat) değiştirin. Gecede kuluçkaya.
- Konsantrasyonu ölçümü ve IONPs 5 mg/mL (bkz. Adım 1,15) getirin. Amonyum hidroksit %20 (v/v) ulaşmak ve IONPs yüzey aminate için > 12 saat oda sıcaklığında sallamak için ekleyin. (Bkz: 1.14) 30 kDa m.w.c.o. filtreleri kullanarak exchange tampon.
- Ses seviyesini aşağı 2,5-3,5 mL hızlı Protein sıvı kromatografi (FPLC; jel filtrasyon sütun için bkz: Tablo reçetesi ) tarafından son arıtma önce.
- Dinamik ışık saçılma (DL) IONPs (beklenen aralığı 10-100 nm, ortalama boyutu 40-50 nm) hidrodinamik çapını belirlemek için kullanın. Aliquoting 1 mL 100 X seyreltilmiş IONP örnek bir küvet içinde bunu, içinde belgili tanımlık makine yerleştirin ve ölçüm almak için üreticinin yazılımını kullanın.
Not: IONPs toplam nüfusu DLS ölçümleri tarafından 10 ve 100 nm arasında olacak, ama 40-50 nm aralıkları ortalama çapı nüfusun çoğunluğu civarındadır. Bir boyut aralığı sınırlamak istiyorsa, bir daha da farklı çaplarda kesirler yalıtmak için boyut dışlama Kromatografi kullanabilirsiniz. IONPs 4 ° C'de muhafaza edilmelidir
2. peptid tasarım, konjugasyon IONP ve Vitro doğrulama
- Bir hedef proteaz için (Örneğin, bir çekirdek tesis veya ticari olarak) peptid substrat thiol aracılı bağlantı izin veren bir N-terminal floresan muhabir floresein isothiocyanate (FITC) gibi ve C terminal sistein kalıntıları ile sentez.
Not: MMP9 Bu çalışmada söz konusu olduğunda, kullanılan peptid FITC-PLGVRGK-C, kkedi/Km ile oldu ~ 2.0 x 105 M-1s-1. - Aliquot IONP (, 1 mg/mL) ve arabellek kaplin içine arabellek Döviz 0.5 mg (1 mM EDTA ile 50 mM sodyum borat, pH 8,5 =) 10 kDa m.w.c.o. spin filtre (bkz. Adım 1.14) kullanarak.
- Dimethylformamide (DMF) ~ 30 mg/mL bir konsantrasyon ulaşmak için Succinimidyl iodoacetate (SIA) dağıtılması ve SIA IONP için 500 SIA:IONP bir köstebek oranında ekleyin.
Not: SIA bir heterobifunctional olduğunu çapraz bağlayıcı kaplin peptid substrat sulfhydryl gruplara IONPs üzerinde aminlerin aracılık eder. - 1-2 saat içinde belgili tanımlık karanlık oda sıcaklığında kuluçkaya. Gecede bırakarak, 4 ° C'de kuluçkaya
- Tampon unreacted SIA kaldırmak için arabellek kaplin içine 10 kDa m.w.c.o. spin filtresi kullanma exchange (bkz. Adım 1.14).
- Nihai ürün çözüm 1 mg/mL (0.5 mL solüsyon) getirin. 20 kDa thiol sonlandırılmış Polietilen glikol (PEG) molar oranını 20:1 (PEG: IONP), 90:1 (peptid: IONP) molar oranında faiz peptid karıştırın. Bu peptid-PEG çözüm IONP ile karıştırın.
- Gecede, oda sıcaklığında en yüksek hız, floresan moleküllerin photobleaching önlemek için folyo tüplerde kapsayan bir plaka shaker üzerinde kuluçkaya.
- L-sistein herhangi bir unreacted SIA molekülleri etkisiz hale getirmek için 500:1 (C:IONP) bir molar oranı ekleyin. Bir shaker, oda sıcaklığında en yüksek hızda üzerinde 25 ° C'de 1 saat kuluçkaya.
- Via FPLC arındırmak (bkz. 1.1.19). Bir spektrofotometre örnek çözümü absorbans ölçümü ve peptid: IONP oranı aşağıdaki göre hesaplamak için kullanın. Arıtma sonra ürün 1 mg/mL 4 ° C'de, PBS içinde saklayın.
- Örnek çözüm 400 absorbans ölçmek için bir spektrofotometre kullanın nm (birörnek, 400) ve dalga boyu 488 olan maksimum absorbans için kullanılan, fluorophore nm FITC (birörnek, 488) için. Aynı iki dalga boylarında bir hisse senedi Amin IONP çözüme absorbans ölçmek (400 nm ve 488 nm), hangi sırasıylaNP, 400 veNP, 488gösterilir.
- Denklemler normalleştirilmiş hesaplamak için 1 ve 2 A400 ile488 değerlerini kullanın.
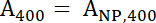 Denklem 1
Denklem 1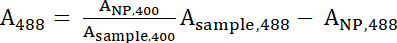 Denklem 2
Denklem 2 - Bir400 ve488 örnek normalleştirilmiş değerini temsil eder. Peptid: IONP Denklem 3 ile oranını hesaplamak için bu değerleri kullanın.
 Denklem 3
Denklem 3 - Nerede
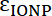 ve
ve 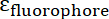 IONP ve fluorophore molar absorptivities sırasıyla vardır. Bu parçacıklar için
IONP ve fluorophore molar absorptivities sırasıyla vardır. Bu parçacıklar için 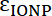 2,06 106 M-1cm-1 x ve FITC için =
2,06 106 M-1cm-1 x ve FITC için = 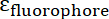 = 72.000 M-1cm-1, yani değerini
= 72.000 M-1cm-1, yani değerini  28,75 olmalıdır. Tipik peptid: IONP oranları 20:1-50: 1 aralığında olmalıdır.
28,75 olmalıdır. Tipik peptid: IONP oranları 20:1-50: 1 aralığında olmalıdır.
- Bir vitro bölünme tahlil gerçekleştirerek sondalar işlevselliğini doğrulayın.
- PBS ile (% 1 BSA), 18 µL nanopartikül çözümünü peptid 200 nM konsantrasyon ile yapmak. Mix proteaz ilgi 2 µL ile (MMP9; 0.1 - 1 mg/mL).
- Bir plaka okuyucu 37 ° C'de 1 saattir floresans ölçümleri alarak, kuluçkaya (485 olan uygun uyarma ve emisyon dalga boylarında kullanarak, nm ve 528 nm FITC için sırasıyla) bölünme izlemek için her 1-2 dakika.
3. Nanosensors ve idrar algılama kanser İdaresi
Not: bizim önceki rapor13örnek modeli hakkında daha fazla bilgi için bkz:.
- İdrar koleksiyonu için metabolik bir kafes 96 iyi plaka tepesine silindirik bir kol güvence tarafından oluşturun. İdrar toplama sırasında bir fare iç kol ve hayvan kaçış önlemek için bir Petri kabına kapaklı kapağı yerleştirin.
- Nanosensors, 3000 mg/kg (~ 50 µmol) bir konsantrasyon içeren bir enjeksiyon çözüm (200 µL maksimum ses) steril serum fizyolojik içinde peptid hazırlayın.
- Xenograft LS174T Kolorektal tümörler ~ 100-300 bir yük taşıyan kadın, 8 - hafta eski, çıplak farelerde mm3üzerinde yaklaşık oluşması, gün 10, nanosensor eriyik yolu ile kuyruk ven enjeksiyon yönetmek. Hemen sonra enjeksiyon, fareler metabolik kafesler yerleştirin ve enjeksiyon zaman her fare için unutmayın.
- 60-90 dakika sonra enjeksiyon, silindirik kol 96-şey tabaktan kaldırın. Fare dizginlemek ve fareler plaka üzerine kalan herhangi bir idrar geçersiz kılmak için ikna etmek için mesane hafif basınç uygulayın. Tüm idrar (200-500 µL) toplamak.
- İdrar numuneleri FITC idrardan arındırmak ve duyarlılığı artırmak için immunoprecipitation tarafından analiz. Manyetik boncuklar Anti-FITC antikorlar ile birleştiğinde kullanın.
- İlk olarak, 25 mg 3 kez ile kaplama arabellek manyetik boncuklar yıkama ve son hacim için 225 µL getir.
Not: Kaplama tampon (0.1 M sodyum borat, pH 9,5), engelleme arabellek (PBS, % 0.5 BSA, %0.05 Ara 20, pH 7,4) ve çamaşır tampon (PBS, % 0,1 BSA, %0.05 Ara 20, pH 7,4) taze her zaman ve her yaklaşık 20 mL gereklidir yapmak önemlidir. - 200 µL anti-FITC (5 mg/mL) ve amonyum sülfat (3 M) 200 µL ekleyin. 16-24 saat 37 c bir rotator üzerinde kuluçkaya.
- Çözüm için manyetik ayırıcı eklemek, süpernatant kaldırmak, 625 ile yerine
 tampon ve 37 C gecede kuluçkaya Λ engelleme. Sonra 3 kez yıkama arabellek ile yıkayın ve 1,25 mL yıkama arabelleğinde depolar.
tampon ve 37 C gecede kuluçkaya Λ engelleme. Sonra 3 kez yıkama arabellek ile yıkayın ve 1,25 mL yıkama arabelleğinde depolar. - İdrar 2 µL 5 µL manyetik boncuklar (20 mg/mL) ile kuluçkaya ve PBS ile 50 µL toplam bir birime getirmek (% 0.01 arası 20). 60 dk için kuluçkaya.
- İki kez 50 µL PBS ile yıkama (% 0.01 arası 20) manyetik ayırıcı her yıkama sonra manyetik boncuklar toplamak için kullanıyor.
- İki kez 32,5 µL % 5 buzul asetik asit ile elute. Havuza alınan elüsyon (70 µL) 2 M ~ 7 son pH elde etmek için Tris 35 µL ile etkisiz hale getirin.
- Bir plaka okuyucu okumak ( Tablo malzemelerigörmek), idrar floresans ölçmek için uygun uyarma ve emisyon dalga boylarında. Ücretsiz fluorophore bilinen konsantrasyonları merdivenden karşı Floresan muhabir konsantrasyonu hesaplayın.
- İlk olarak, 25 mg 3 kez ile kaplama arabellek manyetik boncuklar yıkama ve son hacim için 225 µL getir.
Sonuçlar
IONPs nüfusun çoğunluğu 40-50 nm aralıkları ortalama çapı civarındadır. Pegylation sonra bu boyut aralığı yaklaşık 6 saat13 vivo dolaşımını yarı ömrü vardır (bkz. Şekil 2a). Bir belirli boyut aralığı için seçin istiyorsa, bir boyut dışlama Kromatografi IONP kesirler farklı çaplarda yalıtmak için kullanabilirsiniz. Nano tanecikleri TEM tarafından bireysel küresel demir oksit nano tanecikler...
Tartışmalar
Bu yöntem bir nanopartikül çekirdek Birleşik proteaz yüzeylerde oluşan etkinlik tabanlı nanosensors gelişimi anlatılmaktadır. Çünkü i ciddi peptid ürünleri böbrek filtrasyon boyutunda 5 nm23 ve noninvaziv bir sinyal üretmek için idrar içine filtre daha küçük olay proteolitik dekolte "farmakokinetik anahtarı" lakaplı. Bu nedenle, 5'ten daha büyük bir hidrodinamik RADIUS içeren nano tanecikleri veya taşıyıcıları kullanmak önemlidir nm, daha küçük bir şey gibi hı...
Açıklamalar
Dr. Kwong kurucularından ve danışman Glympse Bio, ürün geliştirme için bu makalede açıklanan araştırma ile ilgili olarak hizmet vermektedir. Bu çalışmada kişisel finansal durumu etkileyebilir. Bu düzenleme şartları gözden geçirilmiş ve Georgia Tech tarafından kendi çıkar çatışması ilkelerine uygun olarak onaylanmış
Teşekkürler
Bu eser bir NIH yönetmenin yeni yenilikçi Ödülü (Ödülü No tarafından finanse edildi DP2HD091793). Q.D.M. NSF yüksek lisans araştırma bursu Program tarafından (Grant No desteklenir DGE-1650044). B.A.H Georgia Tech Başkan'ın bursu yanı sıra ulusal kurumları sağlık GT BioMAT eğitim Grant'ın ödülü numarası 5T32EB006343 altında tarafından desteklenir. G.A.K. tutar bir kariyer Ödülü Burroughs hoş geldiniz fondan bilimsel arayüz. İçeriği yalnızca yazarlar sorumludur ve mutlaka Ulusal Sağlık Enstitüleri resmi görüşlerini temsil etmiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
Referanslar
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır