Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Nanosensores para detectar actividad proteasa en Vivo para el diagnóstico no invasivo
En este artículo
Resumen
Las proteasas son fuertemente reguladas las enzimas implicadas en procesos biológicos fundamentales y desajuste proteasa actividad unidades progresión de enfermedades complejas como el cáncer. Este método pretende crear nanosensores que miden actividad proteasa en vivo produciendo una señal de escote que es detectable de la orina de host y discrimina la enfermedad.
Resumen
Las proteasas son enzimas multifuncionales que se especializan en la hidrólisis de enlaces peptídicos y controlan amplios procesos biológicos incluyendo homeostasis y Alostasis. Por otra parte, actividad de las proteasas altera unidades patogenesia y es un biomarcador funcional de enfermedades como el cáncer; por lo tanto, la capacidad de detectar actividad proteasa en vivo puede proporcionar información clínicamente relevante para el diagnóstico biomédico. El objetivo de este protocolo es crear nanosensores que probe para actividad proteasa en vivo produciendo una señal cuantificable en la orina. Estos nanosensores de proteasa consisten en dos componentes: una nanopartícula y sustrato. Las funciones de nanopartículas para aumentar la entrega de Half-Life y el substrato de la circulación a sitios de enfermedad de destino. El sustrato es una secuencia de péptido corto (6-8 AA), que está diseñada para ser específicos de una proteasa de destino o grupo de las proteasas. El substrato se conjuga a la superficie de la nanopartícula y se termina por un reportero, como un marcador fluorescente para la detección. Como existen proteasas desdoblan el sustrato del péptido, el reportero se filtra en orina para cuantificación como un biomarcador de actividad de la proteasa. Adjunto describimos la construcción de un nanosensor de matriz metaloproteinasa 9 (MMP9), que se asocia con progresión del tumor y la metástasis, para detección de cáncer colorrectal en un modelo murino.
Introducción
Las proteasas son enzimas multifuncionales que se especializan en la hidrólisis de enlaces peptídicos y tener un control significativo sobre muchos procesos biológicos, incluyendo homeostasis, Alostasis y enfermedad1. Un estado alterado de la actividad de la proteasa se ha correlacionado a una variedad de enfermedades, incluyendo cáncer y enfermedades cardiovasculares, que los candidatos atractivos proteasas para desarrollo de biomarcadores clínicos2,3. Por otra parte, actividad de las proteasas es pathogeneses funcionalmente vinculados a distintas, los resultados del paciente y pronóstico de la enfermedad4. En términos generales, se han desarrollado biosensores para detectar varios fenómenos biológicos y procesos de enfermedades, como cáncer, enfermedades neurodegenerativas y transferencia de electrones5,6,7,8 , 9. más específicamente, sensores basados en el sustrato de la proteasa se han desarrollado para detectar la actividad de la proteasa e incluyen sondas fluorógenos para diagnóstico proyección de imagen10 y etiquetados isotópicamente sustratos péptido para in vitro detección por espectrometría de masas11. Además, se han desarrollado sondas basadas en la actividad, que contienen sustrato-como regiones que unen o modificar el destino proteasa12. Con este método, la proteasa destino irreversible es inhibida cuando se modifica el sitio activo, y el análisis requiere la cosecha de tejido, que se limita a aplicaciones en vivo . Sin embargo, es importante sentir proteasa actividad en vivo, porque la regulación de la actividad de las proteasas es pesadamente dependiente en el contexto de otras actividades biológicas como la presencia de inhibidores endógenos.
El objetivo de este trabajo es describir la formulación de nanosensores basados en actividades que detectan actividad proteasa en vivo produciendo una señal medible en orina. Esta plataforma se utiliza como un diagnóstico no invasivo para diferenciar enfermedades complejas como el cáncer mediante el uso de actividad de las proteasas altera como un biomarcador funcional. Nuestra plataforma de nanosensor consiste en óxido de hierro nanopartículas (IONP) conjugadas con sustratos de la proteasa. Estos sustratos son terminados por un reportero fluorescente que se libera cuando las proteasas desdoblan el sustrato. Estos IONPs circulan en vivo, localización sitios de enfermedad y exponen sustratos activos proteasas asociadas a la enfermedad. Después de hendidura, reporteros fluorescentes son liberados y, debido a su pequeño tamaño, se filtran en orina, mientras que sustratos uncleaved en el IONP permanecen en el cuerpo. Por lo tanto, un aumento en las actividades de proteasa en vivo dará como resultado concentraciones más altas del reportero en orina (figura 1). Puesto que nuestra plataforma es una prueba de orina, es necesario no hay plataforma de proyección de imagen y señales de diagnóstico están enriquecidas en la orina.
Esta plataforma puede ser diseñada para detectar una variedad de enfermedades incluyendo cáncer, fibrosis y trombosis13,14. Aquí describimos el diseño de nanosensores para detectar elevaciones en curación de matriz 9 (MMP9) actividad como un biomarcador del cáncer colorrectal. El cáncer colorrectal es la segunda causa de muerte por cáncer en los Estados Unidos, con un estimado 136.800 nuevos casos y 50.300 muertes en 2014 solo15. Las células del tumor colorrectal producen MMP9, que se ha demostrado para conducir la progresión maligna, degradación de la matriz, así como metástasis16. Además, identificamos un substrato conveniente péptido (PLGVRGK) para MMP9 de la literatura17. Esta plataforma puede usarse para detección temprana de cáncer y el diagnóstico de punto de atención de bajo costo13,14,18,19,20,21.
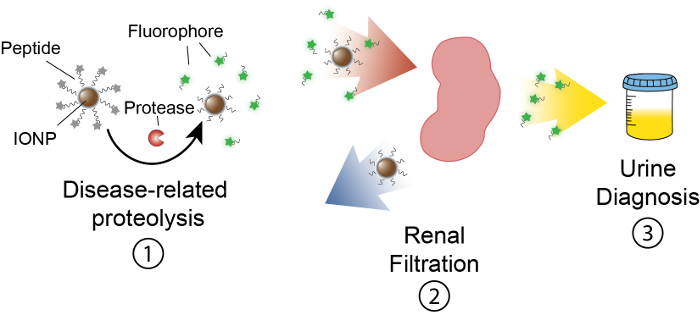
Figura 1: esquema de Nanosensor actividad en vivo. Nanosensores circulan a través del cuerpo y localización a los sitios de la enfermedad. Entonces, las proteasas relacionadas con la enfermedad cleave sustratos péptido presentados por IONPs. El tamaño de los fragmentos exfoliados permite depuración renal, haciendo que se localiza en la orina. Después de que el animal orina, estos fragmentos de péptido pueden analizarse por su molécula reporter. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Aprobación institucional institucional cuidado Animal y el Comité uso (IACUC) en la institución del investigador es necesaria llevar a cabo los siguientes experimentos animales. Además, son necesarios adecuadamente para llevar a cabo estos centros de atención animal estándar (por ejemplo, cámaras, campanas animales estériles, cámaras de isofluorane para anestesia y CO2 cámaras para euthanization ético extremo de la vivienda) experimentos. Entrenamiento especial y ayuda con estas instalaciones se pueden proporcionar por el laboratorio de investigación fisiológica (PRL) en la institución. Todos los trabajos de animales fue aprobado por el IACUC en Georgia Tech (Protocolo: A14100).
1. óxido de hierro (IONP) síntesis
Nota: Seguridad: la síntesis de nanopartículas de óxido de hierro toda debajo de un producto químico de humos campana y debe realizarse con equipo de protección personal.
- En un tubo cónico de 15 mL, enfriar 1 mL de hidróxido de amonio 30% en un cubo de hielo durante 30 minutos.
- Lavar un erlenmeyer con agua desionizada de 250 mL y añadir 10 mL de agua destilada doble (ddH2O). Sumerja la parte exterior del matraz en un baño de hielo descansa sobre una placa de agitación y calefacción. Utilice una pipeta de plástico a gas de flujo N2 en el ddH2O en el frasco. Burbujas durante 15 minutos con N2 al deoxygenate.
- Peso 224 μmol (4,5 gramos) de dextrano (Peso Molecular (MW) = 20 kDa) en un tubo cónico de 50 mL. Agregar H2O que el volumen final de la mezcla, incluyendo el dextrano es 20 mL. Vortex vigorosamente para disolver el dextrano.
- Pesa 290 μmol (78,5 gramos) de hierro (III) cloruro hexahidrato, añadir solución de dextrano y agitar para disolver.
- Filtrar la solución resultante con un filtro de 0.2 μm.
- Transferir 1 mL enfriada hidróxido de amonio en 9 mL de agua desoxigenado. Volver a 4 ° C.
- Peso 367 μmol (73,0 gramos) de hierro (II) cloruro tetrahidrato, disolver en 1 mL de ddH libre de oxígeno2O y filtrar con un filtro de 0.2 μm.
- Transferir la solución de dextran-iron(III) en el matraz de Erlenmeyer de 250 mL y deoxygenate con N2 durante 15 minutos en hielo. Mezclar con una agitación magnética la barra gira a 1600 rpm.
- Para crear una atmósfera de nitrógeno homogénea, tapar el frasco con un septo de goma. Punción del tabique con un 18 calibre de aguja a flujo N2 en el matraz. Inserte una aguja 18 calibre independiente como una salida de flujo.
- Añadir 467 μl de la solución de hierro (II) a la solución de dextran-iron(III) con una jeringa de 1 mL, revolviendo con una barra de agitación magnética en 1600 rpm. Esta proporción de hierro (II) a hierro (III) resulta en una reacción balanceada que produce magnetita o Fe3O4.
- Añadir que la fría diluir hidróxido de amonio gota a gota en la solución de dextrano de hierro (II) - hierro (III) - para iniciar el proceso de nucleación21. Asegúrese de que cada gota de la mezcla bien antes de caer en otro. Final de la reacción después de la adición de 1-2 mL de hidróxido de amonio.
- Detener el flujo de N2 y quite la membrana de goma. Retirar del baño de hielo y reemplazar con un baño de agua tibia, sin dejar de agitar la solución. Asegurar que la temperatura de la solución alcanza los 75 ° C e incubar durante 75 minutos.
- Retirar el matraz de la placa caliente revuelva y doblemente filtrar la solución con 0,2 μm entonces 0.1 μm filtros para eliminar las partículas gruesas.
- Cambio de tampón las partículas en ddH2O, utilizando 100 kDa de peso molecular cortadas (m.w.c.o.) concentradores para quitar dextrano exceso de la solución, que debe ser muy viscosa. Cambiar los filtros si el flujo a través de permanece oscuro incluso después de 2-3 vueltas, que indica que el filtro puede haber infringido.
- Intercambio del almacenador intermediario con filtros de spin, centrifugar a 4 ° C a 4800 X g durante 15 minutos, descartar el flujo a través y añadir nuevo buffer a la solución IONP. Repita 3 - 5 veces.
- Determinar la concentración de las nanopartículas con un espectrofotómetro/lector. Tomar las medidas de absorbancia a 400 nm y uso la absortividad molar de IONP a esta longitud de onda (ε = 2.07 x 106 cm-1 M-1) para determinar la concentración de partículas de IO.
- Suspender las IONPs a 10 mg/mL en ddH2O (volumen total suele ~ 3 mL) y asegúrese de que utilizar tubos de polipropileno para este paso de compatibilidad química. Añadir 1,6 volúmenes de 5 M NaOH y añadir volúmenes 0,65 de Epiclorhidrina. Rigurosamente la mezcla en un agitador de la placa a temperatura ambiente durante 12 horas a reticulación dextrano.
- Utilizar una jeringa de 20 mL con una aguja de calibre 18 para transferir la solución IONP en la membrana de diálisis de m.w.c.o. de 50 kDa. Coloque la membrana de diálisis en 4 L Dec2O y vuelva a H2O algunas veces (cada 2-3 horas). Incubar durante una noche.
- Medir la concentración y IONPs a 5 mg/mL (ver paso 1.15). Añadir hidróxido de amonio para alcanzar el 20% (v/v) y agitar a temperatura ambiente por > 12 horas a laminado la superficie del IONPs. Cambio de tampón 30 kDa m.w.c.o. filtros (véase 1.14).
- Ajustar el volumen hasta 2.5-3.5 mL antes de purificación final por rápido proteína cromatografía líquida (FPLC; véase Tabla de materiales para la columna de gel filtración).
- Utilice dispersión ligera dinámica (DLS) para determinar el radio hidrodinámico de IONPs (rango 10-100 nm, tamaño promedio 40-50 nm). Para ello tomar 1 mL de 100 X muestra IONP diluida en una cubeta, colocar en la máquina y utilizar software del fabricante para realizar la medición.
Nota: La población total de IONPs entre 10 y 100 nm por medidas de DLS, pero la mayoría de la población es alrededor del media de diámetro, que oscila entre 40-50 nm. Si quiere limitar el rango de tamaño, se puede utilizar más cromatografía por exclusión de tamaño para aislar fracciones de diferentes diámetros. IONPs deben almacenarse a 4 ° C.
2. péptido diseño, verbal IONP y validación In Vitro
- Sintetizar un sustrato de péptido (por ejemplo, por un centro base o comerciales) para una proteasa de destino con un reportero fluorescente del N-terminal como el isotiocianato de fluoresceína (FITC) y un residuo de cisteina terminal C para permitir el acoplamiento de tiol-mediada.
Nota: En el caso de este estudio de MMP9, el péptido utilizado fue FITC-PLGVRGK-C, con kgatokm ~ 2.0 x 105 M-1s-1. - Alícuota 0,5 mg de IONP (a 1 mg/mL) y el intercambio de búfer en tampón de unión (50 m m de borato de sodio con 1 mM EDTA, pH = 8.5) utilizando un 10 kDa m.w.c.o. spin filtro (ver paso 1.14).
- Disolver Succinimidyl yodoacetato (SIA) en dimetilformamida (DMF) para alcanzar una concentración de 30 mg/mL y añadir SIA a IONP en un ratio molar de 500 SIA:IONP.
Nota: SIA es una heterobifunctional Cruz vinculador que media el acoplamiento de aminas en IONPs a los grupos sulfidrilo en el substrato del péptido. - Incubar durante 1-2 horas a temperatura ambiente en la oscuridad. Si salir de noche a la mañana, incubar a 4 ° C.
- Intercambio usando un filtro de centrifugado de 10 kDa m.w.c.o. en tampón de Unión para quitar SIA del almacenador intermediario (ver paso 1.14).
- Traer la solución de producto final a 1 mg/mL (0,5 mL de solución). El péptido de interés en una relación molar de 90:1 (péptido: IONP) se mezclan con 20 kDa terminada en tiol polietilenglicol (PEG) en una proporción molar de 1:20 (PEG: IONP). Mezcle esta solución de péptido-PEG con IONP.
- Incubar durante una noche a temperatura ambiente en un agitador de placa en la velocidad más alta, cubriendo los tubos en papel para evitar fotoblanqueo de moléculas fluorescentes.
- Añadir L-cisteína en un cociente molar de 500: 1 (C:IONP) para neutralizar cualquier sin reaccionar moléculas SIA. Incubar 1 hora a 25 ° C en un agitador a una velocidad más alta a temperatura ambiente.
- Purificar mediante FPLC (véase 1.1.19). Use un espectrofotómetro para medir la absorbancia de la solución de la muestra y calcular la proporción de péptidos: IONP según el siguiente. Después de la purificación, almacenar producto en 1 mg/mL a 4 ° C en PBS.
- Use un espectrofotómetro para medir la absorbancia de la solución de la muestra a 400 nm (unamuestra, 400) y la longitud de onda de máxima absorbancia para el fluoróforo utilizado, que es de 488 nm para FITC (unamuestra, 488). Medir la absorbancia de una solución de Amina stock IONP en el mismo dos longitudes de onda (400 nm y 488 nm), que se representan respectivamente como unNP, 400 y unNP, 488.
- Uso de las ecuaciones 1 y 2 para calcular el normalizado A400 y un valores de488 .
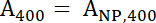 Ecuación 1
Ecuación 1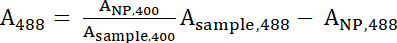 Ecuación 2
Ecuación 2 - Un400 y un488 representan los valores normalizados de la muestra. Use estos valores para calcular la proporción de péptidos: IONP con la ecuación 3.
 Ecuación 3
Ecuación 3 - Donde
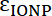 y
y 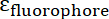 son las absortividades molares de la IONP y el fluoróforo, respectivamente. Para estas partículas
son las absortividades molares de la IONP y el fluoróforo, respectivamente. Para estas partículas 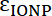 = 2.06 x 106 M-1cm-1 y para FITC
= 2.06 x 106 M-1cm-1 y para FITC 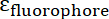 = 72.000 M-1cm-1, así que el valor de
= 72.000 M-1cm-1, así que el valor de  debe ser 28.75. Proporciones típicas péptido: IONP deben ser en la gama de 20:1 a 50: 1.
debe ser 28.75. Proporciones típicas péptido: IONP deben ser en la gama de 20:1 a 50: 1.
- Validar la funcionalidad de las puntas de prueba mediante la realización de un ensayo de clivaje en vitro .
- Con PBS (1% BSA), preparar una solución de nanopartículas 18 μL con una concentración de nM 200 de péptido. Mezclar con 2 μl de proteasa de interés (MMP9; 0.1 - 1 mg/mL).
- Incubar en un lector de placas a 37 ° C durante 1 hora, tomando las mediciones de fluorescencia (con la adecuada excitación y longitudes de onda de emisión, que son 485 nm y 528 nm para FITC, respectivamente) cada 1-2 minutos para monitorear el escote.
3. administración de nanosensores y orina detección de cáncer
Nota: Para más detalles sobre el modelo de ejemplo, véase nuestro anterior informe13.
- Crear una jaula metabólica para recolección de orina asegurando un manguito cilíndrico en la parte superior de una placa bien 96. Durante la recogida de orina, colocar un ratón dentro de la manga y cubierta con una tapa de caja de Petri para evitar fuga del animal.
- Preparar una solución de la inyección (volumen máximo de 200 μL) que contiene nanosensores en una concentración de 3000 mg/kg (~ 50 μmol) de péptidos en solución salina estéril.
- En femenino, 8 semanas de edad, desnudas ratones xenoinjerto LS174T tumores colorrectales en una carga de ~ 100-300 mm3, que debe ocurrir en aproximadamente el día 10, administrar solución de nanosensor vía la inyección de la vena de la cola. Inmediatamente después de la inyección, coloque ratones en jaulas metabólicas y tenga en cuenta el tiempo de inyección para cada ratón.
- En 60-90 minutos después de la inyección, retire el manguito cilíndrico de placa de 96 pocillos. Refrenar la ratón y aplique una ligera presión en la vejiga para inducir ratones anular cualquier orina restante en la placa. Recoger toda la orina (200-500 μl).
- Analizar las muestras de orina por la inmunoprecipitación para purificar FITC de la orina y aumentar la sensibilidad. Bolas magnéticas de uso junto con anti-FITC anticuerpos.
- En primer lugar, lavar 25 mg de los granos magnéticos 3 veces con tampón de recubrimiento y llevar el volumen final a 225 μL.
Nota: Es importante que la de tampón con revestimiento (borato de sodio de 0.1 M, pH 9.5), amortiguador de bloqueo (PBS, 0,5% BSA, 0,05% Tween 20, pH 7,4) y tampón de lavado (PBS, 0,1% BSA, 0,05% Tween 20, pH 7.4) fresca que cada vez y aproximadamente 20 mL de cada uno son necesario. - Añadir 200 μL de anti-FITC (5 mg/mL) y 200 μL de sulfato de amonio (3 M). Incubar durante 16-24 horas a 37 ° C en un agitador.
- Añadir la solución a un separador magnético, eliminar el sobrenadante, reemplazar con 625
 Λ bloqueo del almacenador intermediario e incubar a 37 ° C durante la noche. Luego lavar 3 veces con tampón de lavado y almacén en 1,25 mL de tampón de lavado.
Λ bloqueo del almacenador intermediario e incubar a 37 ° C durante la noche. Luego lavar 3 veces con tampón de lavado y almacén en 1,25 mL de tampón de lavado. - Incubar 2 μl de orina con 5 μl de granos magnéticos (20 mg/mL) y llevar a un volumen total de 50 μL con PBS (0.01% Tween 20). Incubar durante 60 minutos.
- Lave dos veces con 50 μl PBS (0.01% Tween 20) usando un separador magnético para recoger bolas magnéticas después de cada lavado.
- Responsables dos veces con 32,5 μl de ácido acético glacial al 5%. Neutralizar los elución (70 μl) con 35 μl de 2 M Tris para alcanzar un pH final de ~ 7.
- Leer en un lector de placas (véase Tabla de materiales) a longitudes de onda de excitación y emisión apropiados para cuantificar la fluorescencia de la orina. Calcular la concentración del reportero fluorescente contra una escala de concentraciones conocidas de fluoróforo gratis.
- En primer lugar, lavar 25 mg de los granos magnéticos 3 veces con tampón de recubrimiento y llevar el volumen final a 225 μL.
Access restricted. Please log in or start a trial to view this content.
Resultados
La mayoría de la población de las IONPs es alrededor del media de diámetro, que oscila entre 40-50 nm. Después de la pegilación, esta gama del tamaño tiene una vida media de circulación de aproximadamente 6 horas13 en vivo (ver Figura 2a). Si quiere seleccionar un rango de tamaño especial, uno puede utilizar cromatografía por exclusión de tamaño para aislar fracciones IONP con diferentes diámetros. Las nanopartíc...
Access restricted. Please log in or start a trial to view this content.
Discusión
Este método describe el desarrollo de nanosensores basados en la actividad de proteasa sustratos conjugados a un núcleo de nanopartículas. El evento de clivaje proteolítico es apodado el interruptor"farmacocinético", porque los productos de peptide hendido son más pequeños que el límite de tamaño renal filtración de 5 nm23 y filtro en orina para producir una señal no invasiva. Por lo tanto, es importante utilizar nanopartículas o portadores con un radio hidrodinámico que es más grand...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Dr. Kwong es co-fundador y sirve como consultor para otras Bio, que está desarrollando productos relacionados con la investigación descrita en este artículo. Este estudio podría afectar su situación financiera personal. Los términos de este acuerdo han sido revisados y aprobadas por Georgia Tech conforme a sus políticas de conflicto de intereses
Agradecimientos
Este trabajo fue financiado por un Director de NIH nuevo innovador Award (premio no. DP2HD091793). Q.D.M. es apoyado por la NSF investigación becas postgrado (Grant no. DGE-1650044). B.A.H es apoyado por el nacional institutos de salud GT BioMAT beca de formación bajo la concesión número 5T32EB006343, así como la beca del Presidente de Tech de Georgia. G.A.K. tiene un premio de carrera en la interfaz científica desde el fondo de la recepción de Burroughs. El contenido es responsabilidad exclusiva de los autores y no representan necesariamente las opiniones oficiales de los institutos nacionales de salud.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
Referencias
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140(2013).
- Ma, W., Liu, H. -T., Long, Y. -T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -H., Ma, W., Long, Y. -T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. AMAG Pharmaceuticals Inc. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , 5,262,176 (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados