A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل وإدماج هوائيات حصاد الضوء من دياتوم مينيغينيانا سيكلوتيلا في الدهنية مع الدهون ثايلاكويد
In This Article
Summary
نقدم هنا، بروتوكولا لعزل فوكوكسانثين الكلوروفيل المكيفات ملزم البروتينات (FCP) من الدياتومات ودمجها في الدهنية مع التراكيب الدهن الطبيعي لدراسة نقل الطاقة الإثارة على تغييرات تكوين أيون.
Abstract
أداء التمثيل الضوئي للنباتات والطحالب والدياتومات يعتمد بشدة على اللائحة بسرعة وكفاءة لحصاد الضوء والطاقة عمليات نقل في غشاء ثايلاكويد المعايشة. على ضوء حصاد هوائي الدياتومات، ما يسمى فوكوكسانثين الكلوروفيل المكيفات ملزم البروتينات (FCP)، المطلوبة لامتصاص الضوء ونقل تتسم بالكفاءة لرد فعل التمثيل الضوئي المراكز كذلك أما بالنسبة لصور--الحماية من الضوء المفرط. التبديل بين هاتين الوظيفتين مسألة طويلة الأمد للبحوث. العديد من هذه الدراسات قد أجريت مع FCP في المذيلات المنظفات. دراسات التفاعل، أزيلت المنظفات، مما أدى إلى تجميع غير محدد لمجمعات FCP. وفي هذا النهج، من الصعب أن تميز بين القطع الأثرية والبيانات ذات الصلة فسيولوجيا. ومن ثم، يمكن الحصول على أكثر قيمة من المعلومات حول FCP والضوء غشاء ملزمة أخرى حصاد المجمعات بدراسة تفاعلات البروتين البروتين، ونقل الطاقة والخصائص الطيفية الأخرى إذا كانت متأصلة في بيئتها الأصلية في الدهون. والميزة الرئيسية هي أن الدهنية لها حجم محدد ونسبة محددة بدهن/بروتين الذي يتم التحكم في مدى تجميع FCP. علاوة على ذلك، يمكن بسهولة محاكاة التغييرات في تكوين الحموضة وأيون التي تنظم الضوء الحصاد في فيفو . بالمقارنة مع الغشاء ثايلاكويد، الدهنية أكثر تجانساً وأقل تعقيداً، مما يجعل من الأسهل للحصول على وفهم البيانات الطيفية. البروتوكول يصف إجراءات عزل FCP وتنقية وإعداد الحويصلية وإدماج FCP في الدهنية مع تكوين الدهن الطبيعي. ينتج عن تطبيق نموذجي يجري النظر ومناقشتها.
Introduction
الكائنات التمثيل الضوئي مثل الدياتومات ويجب التعامل مع ظروف الإضاءة المتغيرة والاستجابة مع آليات التأقلم متطورة للحفاظ على كفاءة التمثيل الضوئي عالية وحماية من التلف صور الأكسدة بالضوء المفرط. هو عملية كبيرة واقية من الضوء في التمثيل الضوئي حقيقيات النوى الطاقة عالية التبريد (ه) يمتص الضوء الذي يحدث كمساهمة رئيسية غير الضوئية التبريد (نبق) تحت ظروف الإجهاد الخفيفة1،2 ،3. مجمعات الهوائي الحصاد الخفيفة (LHC) تشارك في تنظيم مسارات نقل الطاقة الإثارة. في استجابة للضوء العالي الناجم عن انخفاض درجة الحموضة في التجويف بلاستيدات الخضراء، مفاتيح نظام الهوائي من ضوء حصاد الدولة إلى الدولة التبريد. وتحمي هذه الدولة المسرف الطاقة فوتوسيستيمس (PS) والمجمعات الأخرى في غشاء ثايلاكويد من التأكسد. في حقيقيات النوى التمثيل الضوئي، فعله عادة اثنين العوامل1،،من23. عامل واحد هو الضوء المتخصصة حصاد البروتين الذي يستجيب لانخفاض درجة الحموضة. يستحث البروتين الهيئاته في أعلى النباتات4. لهكسرس5، عن طريق نشاط الهيئات الفرعية الرئيسية، والتضمين الحث سه في الطحالب الخضراء6. الدياتومات تمتلك لك مثل البروتينات التي هيكلياً المتصلة لهكسرس7،،من89،10.
والعامل الثاني من سه هو دورة كزانتوفيل حيث تحويلها إلى نموذج واقية من الصور بواسطة إبوكسدة دي الكاروتينات الهوائي وعادت قبل إبوكسدة. وفي النباتات والطحالب الخضراء، يتم تحويل فيولاكسانثين إلى تين وزياكسانثين. في الدياتومات، يتم تحويل ديادينوكسانثين إلى دياتوكسانثين، الذي ثم يرتبط بمدى نبق11. ضوء دياتوم حصاد هوائي تمتلك بعض الخصائص المميزة على الرغم من أنها التطورية المتعلقة بالنباتات والطحالب لهكس. التبديل من الضوء الحصاد لحماية الصور بسرعة هائلة وقدرة نبق أعلى بالمقارنة بالنباتات12. قد يكون هذا أحد الأسباب لماذا الدياتومات ناجحة جداً في مختلف المنافذ الإيكولوجية في طريقة التي هم مسؤولون عنها ليصل إلى 45 في المائة من المحيطات صافي الإنتاج الأولى13. ومن ثم، دياتوم الخفيفة نظم الحصاد كائن مثيرة لاهتمام لبحوث عملية التمثيل الضوئي.
الدياتومات، مثل الأنواع التي تركز على مينيغينيانا سيكلوتيلا، تمتلك ثايلاكويد الخفيفة الأصيلة سميت الأصباغ أنها نظم الحصاد ربط-فوكوكسانثين، الكلوروفيل (شيلي) وج، ومن ثم الضوء FCP. حصاد البروتينات، مثل فيرفااس، هي جزءا لا يتجزأ من نظام غشاء ثايلاكويد تتألف من عدة طبقات الغشاء. الدياتومات تشكيل عصابات من ثلاث ثيلاكويدس. هذا المجمع الوضع يجعل من الصعب على دراستها على المستوى الجزيئي في غشاء ثايلاكويد. وبالإضافة إلى ذلك، العديد من العناصر المساهمة في تنظيم الضوء الحصاد (انظر أعلاه). ولذلك، في العديد من النهج، كانت المجمعات المعزولة من الغشاء باستخدام المنظفات معتدل، مثل ن-دوديسيل-β-د-مالتوبيرانوسيدي (β-DDM)، الذي جعل الغشاء ولكن الاحتفاظ مجمعات FCP سليمة. أجريت العديد من الدراسات الطيفية باستخدام solubilized FCP للتحقيق في الطاقة إينتراموليكولار نقل14،15،،من1617. غير أن هذا النهج السابق كان محدودا نظراً لتنظيم نقل الطاقة يحتاج تفاعل اكسسيتونيك مع مجمعات الهوائي أو فوتوسيستيمس أخرى. ومن ثم فهذه الأنواع من الدراسات لا تنفذ مع مجمعات solubilized نظراً للتفاعل بين المجمعات يتم فقدان.
هو سمة هامة في التنظيم هوائي "الزحام الجزيئي" هوائي وفوتوسيستيمس بغشاء ثايلاكويد18. التي أجريت سابقا، نهج بسيط لمحاكاة هذا التأثير في المختبر. تمت إزالة مواد التنظيف، مما يؤدي إلى تجميع عشوائي لمجمعات الهوائي. على الرغم من أن تم الحصول على بعض البيانات معقولة بهذا النهج،من1719، إزالة المنظفات لا تعكس الحالة في فيفو ولديها بعض القيود نظراً للمجمعات لا تتفاعل في تلك المرحلة الجامعية العادية الهيكل.
استخدام الدهنية ويتغلب على العديد من القيود السابقة. بنية التعليم العالي لا تزال سليمة تماما. غشاء الحويصلية يوفر بيئة شبه أصلية لمجمعات الهوائي. الغشاء الذي يفصل داخل الحويصلية البيئة الخارجية. بهذه الوسائل، توفر الدهنية المقصورات رد فعل اثنين للدراسات من التدرجات أيون ودرجة الحموضة، وكذلك فيما يتعلق بعمليات النقل. علاوة على ذلك، يمكن التحكم معلمات النظام التجريبي أكثر سهولة لدراسات في غشاء ثايلاكويد. وعرضت الدهنية أصلاً لتكون أداة ممتازة لدراسة المجمعات التمثيل الضوئي. وكان محورا رئيسيا في الماضي على مصنع LHC حيث تم اختبار تأثير الدهن غيرت تركيبة على الثاني LHC20. في نهج أخرى، كانت البروتين-بروتين التفاعل بين مختلف LHC ثانيا التحقيق21. أيضا، بعض الدراسات في الطحالب الخضراء نفذت تصف تجميع عفوية بين LHC22. وبالنظر إلى أهمية الدياتومات للنظم الإيكولوجية المائية، أجريت دراسات قليلة نسبيا مع مجمعات الهوائي من الدياتومات. دراستان التحقيق مجمعات الهوائي لمركزية مينيغينيانا سيكلوتيلا، وعرضت فيها تجميع الهوائي FCP23 والاستجابة من FCP للتدرجات الكهروكيميائية24 . وهكذا، الدهنية أداة ممتازة لدراسة الهوائيات دياتوم والتفاعل والتنظيم في الشروط الأصلية تقريبا. الدهنية تنوعاً منذ العديد من الشروط مثل تكوين الدهن والحويصليه حجم وكثافة البروتين ويمكن التحكم في المرحلة المائية المحيطة بها. وعلاوة على ذلك، يتطلب الأسلوب كميات قليلة من العينات. النظام التجريبي أقوى واستنساخه بدرجة عالية. تجزئة الدهنية يسمح لدراسة درجة الحموضة وأيون التدرجات، التي تتسم بأهمية العوامل في تنظيم مجمعات الهوائي.
وهنا يصف لنا عزل مجمعات الهوائي FCP من مينيغينيانا جيم وإدماجها في الدهنية مع تكوين الدهن ثايلاكويد الطبيعية. أيضا، ونحن تقديم بيانات نموذجية لتوصيف solubilized FCP الطيفية ومقارنتها مع FCP في الدهنية. ويلخص الأسلوب المعرفة والبروتوكولات الموحدة التي تم الحصول عليها من التحسينات التي غوندرومان و 2012 بوشل23وناتالي et al. عام 201622، و أحمد و 2017 ديتزيل24.

رقم 1: التمثيل التخطيطي لسير العمل. (1) يشير إلى الفقرة 1 التي تصف نمو الخلايا، واضطراب والعزلة ثايلاكويد مع عقب الانفصال FCP على السكروز كثافة التدرجات؛ جيم-م. -مينيغينيانا سيكلوتيلا الخلايا. (2) إعداد خليط دهن ثايلاكويد الطبيعية (مجدج ودجدج وسقدج) الوارد وصفها في الفقرة 2، وإنشاء المذيلات المنظفات الدهنية مع أوكتيلجليكوسيدي (الجريدة الرسمية). حجم مذيل دهن محددة يتحقق عن طريق البثق استخدام الأغشية لقطر المسام محددة. FCP والدهن-المذيلات هي موحدة في دهن مسبقاً: نسبة البروتين والمنظفات OG و β-DDM يتم إزالتها عن طريق التحكم في الغسيل الكلوي تشكيل بروتيوليبوسوميس FCP. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Protocol
ملاحظة: المجمعات التمثيل الضوئي مثل فيرفااس معرضة بشدة للضوء والحرارة. تعمل دائماً على الجليد وتحت ضوء خافت جداً.
1-عزل FCP من الخلايا
-
عزل ثايلاكويد من الخلايا مينيغينيانا جيم
- تنمو مينيغينيانا جيم في خمس قوارير 500 مل كل مليئة 300 مل من آسيا والمحيط الهادئ-المتوسطة23،25 و 50 مليون من الخلايا. قم بتوصيل قوارير مع سداده القطن وتسمح للخلايا أن تنمو إلى مرحلة النمو الأسى لمدة أسبوع تقريبا على شاكر 120 لفة في الدقيقة مع ح 16 خفيفة وح 8 المرحلة المظلمة في 40 µmol photons/(m²s) الأبيض الضوء ودرجة حرارة بين 15-18 درجة مئوية. تحقق من أن عدد الخلايا بين 1.5 مليون خلايا/مل مع دائرة عداد خلية.
- الطرد المركزي الخلايا في 4,000 س ز في دوار بريكوليد مع قارورة 500 مل من أجهزة الطرد المركزي (4 درجة مئوية) لمدة 15 دقيقة في أجهزة الطرد مركزي عالية السرعة. إعادة تعليق الكريات الخلية في 12 مل من المخزن المؤقت التجانس (HB، الجدول 1) قبل بيبيتينج.
- نقل التعليق إلى أنبوب بلاستيكي واحد 50 مل. تخزين العينات في-80 درجة مئوية، أو المضي قدما إلى الخطوة 1-1-3.
- قبل بارد طاحونة حبة والمعدات. أملا الكأس 50 مل طاحونة حبة إلى 75% مع خليط حبة زجاج وإضافة تعليق خلية. لتعطيل الخلية، استخدم البقول s 7 × 45 بأقصى سرعة مع 30 ثانية للتبريد بين كل نبضة. تأخذ 20 ميليلتر من تعطل الخلايا للتحقق من جودة في خطوة 1.1.6.
- تصفية الخلايا تعطل أكثر من القمع مرشح الزجاج والمياه والصرف الصحي التي تتدفق غبطة عبر الزجاج الخرز حتى تظهر واضحة. تجمع الكسر يغسل مع فيلتراتي. تبقى وحدة التخزين النهائي أقل من 150 مل.
- الطرد المركزي العينة لمدة 15 دقيقة على 140 x ز استخدام أنابيب بلاستيكية 50 مل ثلاث إلى بيليه الحطام خلية. نقل المادة طافية إلى 20 مل البولي تنبيذ فائق القنينات وتجاهل بيليه بعناية.
- تعبئة القنينات بغبطة وحجته الوزن الطرد المركزي في دوار مناسبة ح 1 في 300000 × g و 4 درجات مئوية بيليه الأغشية ثايلاكويد.
- استخدام وقت الطرد المركزي لفحص نسبة تعطل الخلايا بواسطة الفحص المجهري في 400 X التكبير مع العينة 20 ميليلتر في 1.1.3. حساب النسبة بين بلاستيدات الخضراء الحرة وبلاستيدات الخضراء التي تحتوي على فروستوليس (قذائف السليكا).
ملاحظة: دياتوم خلايا جدران مصنوعة من السليكا، الذي يكون مرئياً بدرجة عالية ديفراكتينج مادة في المجهر. الجبيلة التي تحدث النقاط الخضراء كما ينبغي أن أطلق سراحهم من الخلايا إذا عملت تعطيل الخلية. - تعليق إعادة بيليه الغشاء مع كمخزن الغسيل قليلاً قدر الإمكان (0.5-1 مل) باستخدام فرشاة رسام الصغيرة. ملء قنينات تنبيذ فائق البولي مع الغسيل المخزن المؤقت (الجدول 1)، وحجته بالوزن وجهاز الطرد المركزي لمدة 20 دقيقة في 200,000 x ز و 4 درجات مئوية.
- إعادة تعليق الأغشية غسلها بالفرشاة هو رسام. إضافة المخزن المؤقت للغسيل فقط إذا كان هناك حاجة إلى الحفاظ على تركيز ثايلاكويد على أعلى مستوى ممكن. تجمع جميع ثيلاكويدس في عينة واحدة قنينة (15 مل).
- قبل تمييع العينات باستخدام 10 ميليلتر من العينة مع ميليلتر 90 100% الأسيتون. الطرد المركزي أنه في س 12,000 ز لمدة 5 دقائق بيليه بروتين سرع. تأخذ 10 ميليلتر من بريديلوشن ومزجها مع ميليلتر 990 الأسيتون 90%.
- قياس امتصاص (ABS) من الكلوروفيل أ وج في 664 نانومتر و 630 نيوتن متر في الأسيتون 90%. طرح إس750nm من كل القيم. تحديد محتوى الكلوروفيل الكلي باستخدام الصيغة التالية:24
1)
2)
- قياس امتصاص (ABS) من الكلوروفيل أ وج في 664 نانومتر و 630 نيوتن متر في الأسيتون 90%. طرح إس750nm من كل القيم. تحديد محتوى الكلوروفيل الكلي باستخدام الصيغة التالية:24
- تجميدها في نيتروجين سائل ثيلاكويدس الكوة في أجزاء من 0.5 ملغ من مجموع الكلوروفيل في أنابيب 1.5 مل رد فعل، وتخزينها في-80 درجة مئوية حتى استخدامها مرة أخرى.
-
فصل وتركيز مجمعات FCP
- تعد حلاً تدرج سكروز وملء أنابيب ultracentrifuge حتى الأعلى ناقص تحميل وحدة التخزين (300 – 500 ميليلتر). تجميد هذه الأنابيب في-20 درجة مئوية إلى أنها مجمدة تماما. تسمح هذه الأنابيب لذوبان الجليد في + 4 درجة مئوية، ويأخذ 3-4 ح لأنبوب مل 17.
- تكرار دورة تجميد أذاب مرتين لصقل التدرج لقرار أفضل.
- استخدام العينات التي تم الحصول عليها في 1.1.9 المقابلة إلى 0.5 ملغ الكلوروفيل، وضبط مع المخزن المؤقت B1 (الجدول 1) إلى وحدة تخزين نهائي من 2 مل. ل solubilization، إضافة n-دوديسيل-β-د-مالتوبيرانوسيدي (ب-DDM) بتركيز نهائي من عيار 20 ملم.
- عكس الأنبوب 3 مرات ووضعه على الجليد لمدة 20 دقيقة مع الهز لطيف لتجنب الرغوة. أجهزة الطرد المركزي لمدة 5 دقائق، في س 12,000 ز في يبرد قبل جدول أعلى أجهزة الطرد مركزي في + 4 درجة مئوية.
- تحميل المادة طافية على التدرج. لا تقم بتحميل أكثر من 125 ميكروغرام للكلوروفيل الكلي الواحدة والتدرج إذا استخدمت قارورة مل 17. أجهزة الطرد المركزي ح 22 100000 × ز و + 4 درجة مئوية.
- استرداد الكسور FCP براون المرجوة من التدرج استخدام المحاقن (الشكل 2A). أن 5 ميليلتر الكوة وتمييع مع 995 ميليلتر من B1a.
- قياس طيف امتصاص (ABS) بين 370-750 نانومتر في جهاز الأشعة فوق البنفسجية-VIS-المطياف الضوئي. استخدام الترعة الصغيرة شبه الزجاج البصري.
- فتح برنامج إدارة الأطياف، انتقل إلى وضع الطيف وتسجيل خط أساس من 370 إلى 750 نانومتر متبوعاً بقياسات العينات. استخدم الإعدادات التالية: مسح السرعة، 200 نيوتن متر/دقيقة؛ بيانات الملعب، 0.5 نانومتر؛ استجابة، متوسطة.
- قياس حجم العينة المسترجعة مع ميكروبيبيتي. أغسل مجمعات FCP بإضافة وحدة التخزين المستردة مرتين مع B1 المخزن المؤقت (الجدول 1). وتركز في مركز غشاء مع كاتشين 30 الانقطاع في 1,000 س ز و + 4 درجة مئوية إلى إس672nm على الأقل 20.
ملاحظة: قد يرتفع تركيز DDM ب سبب الإثراء مذيل في حجرة العينة. وهذا يمكن أن يؤدي إلى سولوبيليزيشن المزيد من المجمعات FCP! تجنب الإفراط سولوبيليزيشن عن طريق إضافة المخزن المؤقت الحرة المنظفات B1 إذا الغسيل كذلك الخطوات المطلوبة لإزالة بقايا السكروز. - تأخذ من 20 ميليلتر الكوة لعناصر التحكم. صدمة تجميد العينات في النتروجين السائل وتخزينها في-80 درجة مئوية.
- تعد حلاً تدرج سكروز وملء أنابيب ultracentrifuge حتى الأعلى ناقص تحميل وحدة التخزين (300 – 500 ميليلتر). تجميد هذه الأنابيب في-20 درجة مئوية إلى أنها مجمدة تماما. تسمح هذه الأنابيب لذوبان الجليد في + 4 درجة مئوية، ويأخذ 3-4 ح لأنبوب مل 17.

رقم 2: تنقية FCP وضوابط الطيفية ونقاء الاختيار. (أ) مظهر نموذجي التدرج كثافة السكروز بعد الطرد المركزي بين عشية وضحاها. تحتوي على جميع العصابات براون تجمع FCP تتألف من بيجم القانون المذكور وفكبب..--غير منضم أصباغ، PS-فوتوسيستيمس (ب) امتصاص الأطياف من FCP قبل (الخط الأزرق) وبعد تركيز (خط متقطع البرتقالي) باستخدام أجهزة الطرد المركزي تصفية مع استقطاع 30 كاتشين . وبخاصة، الكاروتينات عرضه لفقدان من FCP، مما سيؤدي إلى انخفاض امتصاص في المنطقة الواقعة بين 500-550 نانومتر. يتم تطبيع الرسومات البيانية ل الكلوروفيل فذ الحد الأقصى في ~ 670 نانومتر. (ج) أطياف الانبعاث الكلوروفيل مع الإثارة من شيلي ج (465 nm) لاختبار نقل الطاقة الإثارة الفنية. إذا نقل الطاقة إلى شيلي شيلي ج يعوق، عصابة fluorescence إضافية في ~ 640 نانومتر (شيلي ج) يمكن أن يحدث. يتم تطبيع الرسومات البيانية للانبعاثات كحد أقصى. (د) تسجيل الأطياف الإثارة في 675 نانومتر (شيلي الأسفار كحد أقصى) لاختبار نقل الطاقة إلى شيلي من جميع أصباغ تستوعب بين 370 نانومتر و 600 نانومتر. إذا كان نقل الطاقة إلى شيلي هو أقل كفاءة، سيؤدي إلى انخفاض العائد الأسفار خاصة بين 465 و 550 نانومتر. يتم تطبيع الرسومات البيانية للحد الأقصى حوالي 440 نانومتر. الأطياف في (ب) (ج) و (د) متطابقة تقريبا إذا كان التركيز عملت بشكل جيد. (ه) التحقق من نقاء FCP المعزولة باستخدام جل تريس تريسيني28. القانون المذكور وفكبب أن مفارز بين كاتشين 18-19. جميع مرئية الملطخة بالفضة البروتينات أكبر من 20 كاتشين هي الملوثات. ثيل. -ثيلاكويدس الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
-
ضوابط الطيفية والمستندة إلى هلام
- سجل امتصاص بين 370-750 نانومتر من 5 ميليلتر من FCP في ميليلتر 995 من B1a بعد الخطوة 1.2.5. مقارنتها مع الطيف التي تم الحصول عليها في الخطوة 1.2.4. استخدام نفس الأدوات والإعدادات كما هو موضح في الخطوة 1.2.4.
- تصدير البيانات ك *.csv، ثم استيراد البيانات إلى جدول بيانات. تطبيع كل الأطياف بأقصى قدر من شيلي في الفرقةy Q حوالي 672 شمال البحر الأبيض المتوسط، كما هو مبين في الشكل 2.
- حساب معامل التخفيف من العينات المأخوذة من الخطوة 1.2.4 و 1.3.1 بقسمة القيمة المطلقة المقاسة672nm ب تقاسم المنافع المرجوة672nm من 0.03. تمييع العينات تبعاً لذلك مع B1a ونقلها إلى الترعة fluorescence الزجاج الخاص.
- سجل شيلي طيف انبعاث الأسفار مع سبيكتروفلوروميتير الكشف عن نقل الطاقة الضوئية سليمة من شيلي ج لشيلي (الشكل 2).
- استخدام برمجيات مطياف والانتقال إلى وضع قياس الطيف مع الإعدادات التالية: وضع، والانبعاثات؛ شق عرض الإثارة والانبعاثات، 3 نانومتر؛ حساسية، متوسطة؛ سرعة المسح الضوئي، شمال البحر الأبيض المتوسط 100/دقيقة؛ بيانات الملعب، 0.5 نانومتر؛ الطول الموجي الإثارة، 465 نانومتر؛ الانبعاثات، 600-800 نانومتر. أداء أوتوزيرو والتدبير.
- تسجيل الأطياف الإثارة مع نفس العينة ومعدات للكشف عن نقل الطاقة سليمة من جميع أصباغ لشيلي (الشكل 2D). تغيير الإعدادات إلى: وضع، والإثارة؛ الانبعاثات الطول الموجي، 675 نانومتر؛ الإثارة، 370-600 نانومتر. تسجيل الأطياف.
- تصحيح مع طائفة والرودامين في نفس النطاق للخواص الطيفية للمصباح – قوات التحالف. الإرشادات الموجودة في دليل المستخدم.
- عينات FCP ميكس الموافق 1 ميكروغرام من شيلي مع 10 ميليلتر من الحزب الديمقراطي الصربي-تحميل المخزن المؤقت. احتضان لمدة 10 دقائق عند 25 درجة مئوية. أجهزة الطرد المركزي لمدة 5 دقائق في ز 12000 x في الطرد مركزي جدول أعلى.
- تحميل المادة طافية على جل تريس تريسيني28. منفصلة من ح 2 في 150 الخامس والفضة-وصمة فإنه بعد الفصل40.
ملاحظة: فصل مفارز FCP إلى شريطين البروتين بارزة بين كاتشين 18-19، وهي العناصر المكونة للقانون المذكور وفكبب29 (الشكل 2E).
- تحميل المادة طافية على جل تريس تريسيني28. منفصلة من ح 2 في 150 الخامس والفضة-وصمة فإنه بعد الفصل40.
- سجل امتصاص بين 370-750 نانومتر من 5 ميليلتر من FCP في ميليلتر 995 من B1a بعد الخطوة 1.2.5. مقارنتها مع الطيف التي تم الحصول عليها في الخطوة 1.2.4. استخدام نفس الأدوات والإعدادات كما هو موضح في الخطوة 1.2.4.
2-إعداد الدهنية وإدماج FCP
-
إعداد خليط الدهن والدهن المذيلات المنظفات
ملاحظة: الدهون هم عرضه لاحترار درجات الحرارة جنبا إلى جنب مع ظروف الأكسدة. محاولة الاحتفاظ الدهون مبردة وفي ظل جو2 ن.- حساب نسب الدهون ثايلاكويد المطلوب مينيغينيانا جيم- وفقا Vieler et al. 200730. الرجوع إلى المثال الوارد في الجدول 1من التكميلية . إعداد المادة الدهنية حلول الأسهم الذي أوصت به الشركة المصنعة في حاوية دليل على المذيبات.
- "الماصة؛" المبلغ المطلوب من الدهون في أنبوب رد فعل 2 مل وتتبخر كلوروفورم استخدام تدفق نيتروجين لطيف ومحاولة تنتشر في الدهون على منطقة بأكملها من قاعدة الأنبوب. واسمحوا تدفق2 ن حتى يتبخر جميع المذيبات.
- جعل الخليط الدهني في ميليلتر 29 n-أوكتيل β-د-جلوكوبيرانوسيدي حل (الجريدة الرسمية) في 4 درجات مئوية عن 4 h. إينكوباتي خليط الدهن لمدة 10 دقائق في 30 درجة مئوية. احتضان الدهون في حمام سونيكاتور لدقيقة 3 × 3 عند 25 درجة مئوية توقف 30 ثانية على الجليد.
- إضافة ميليلتر 221 من المخزن المؤقت تريسيني و 250 ميليلتر من المخزن المؤقت للغسيل الكلوي x 4.
- استخدام الطارد مع 0.1 ميكرومتر البولي الأغشية لقطر الحويصلية محددة من شمال البحر الأبيض المتوسط 50-70. تجميع الطارد بدعم الغشاء والتصفية. تجنب فقاعات الهواء وتشديد الجمعية العامة تماما.
- ملء حقنه واحدة مع المخزن المؤقت للغسيل الكلوي x 4 والرطب في الطارد مسبقاً حتى يمكن رؤية لا فقاعات في حقنه ثانية.
- تنطبق المادة الدهنية-المنظفات-المذيلات الطارد واضغط الحل من حقنه واحدة للأخرى المنصوص عليها والظهر. كرر هذه الخطوة 5 مرات حتى يظهر الحل متجانسة.
ملاحظة: ويمكن تخزين هذا الحل عند 4 درجة مئوية لعدة أيام. لم تجمد!
-
إدراج مجمعات FCP وإزالة الركام والمنظفات
ملاحظة: في هذا المثال نستخدم الدهون/شيلي بنسبة 12:1، الذي يتوافق مع نسبة الدهون/بروتين لما يقرب من 100: 1.- إضافة FCP يساوي 20 ميكروغرام من شيلي في إجمالي حجم 500 ميليلتر B1a المخزن المؤقت إلى 250 μL من الدهن-المذيلات مقذوف و 250 ميليلتر من 4 × المخزن المؤقت للغسيل الكلوي. احتضان هذه العينات لدقيقة 3 × 3 عند 25 درجة مئوية في ثيرموميكسير 1,500-3,000 لفة في الدقيقة انقطع بسبب توقف s 30 على الجليد.
- قطع غطاء أنبوب رد فعل 1.5 مل أربع فقط تحت أعلى إعطاء خاتم الذي يناسب ما زال على الغطاء. إعداد قطع 1.5 × 1.5 سم من غشاء الديال وغسلها في 20 مل من المخزن المؤقت للغسيل الكلوي x 1
- تعبئة 250 ميليلتر من العينة لكل غطاء. بعناية، تكمن الغشاء على الغطاء المقصورة تماما مليئة العينة ولا فقاعات الهواء تحدث. تشديد الطوق أنبوب رد فعل على الجمعية العامة كي يكون حجرة مغلقة.
- دياليزي العينات في 50 مل 1 × الغسيل الكلوي العازلة بين عشية وضحاها (12-16 ح) على الجليد على شاكر هبوط. يستعاض عن المخزن المؤقت المستخدمة في الغسيل الكلوي بواحدة جديدة وإضافة 7 مغ حبات الممتصة لإزالة المنظفات المتبقية لمالا يقل عن 6 ح.
- يستعاض عن المخزن المؤقت الغسيل الكلوي مرة أخرى ودياليزي لاسترداد h. 12 آخر في الدهنية بثقب الغشاء الغسيل الكلوي مع تلميح ميكروبيبيتي 200 ميليلتر ونضح الدهنية كل من غطاء أنبوب رد فعل.
- خطوة اختيارية: إذا كانت درجة نقاء عالية (> 95%) مطلوب. إعداد تدرج كثافة متقطع في 17 مل قارورة تنبيذ فائق مع الخطوات التي تحتوي على 6%، 10%، 15% و 20% من كوبوليمر ابيتشلورهيدرين السكروز في المخزن المؤقت للغسيل الكلوي. تحميل الدهنية في الأعلى وأولتراسينتريفوجي في 100,000 ز س ح 4 في دوار دلو يتأرجح.
- استرداد الفرقة براون العلوي مع المحاقن وتمييع عينة 1:5 مع موانئ دبي والمضي قدما إلى الخطوة التالية.
- الطرد المركزي الدهنية FCP في 2 مل على الأقل من 1 × الغسيل الكلوي المخزن المؤقت لح 1.5 100000 x ز و 4 درجات مئوية. استرداد الدهنية بتحول أنبوب الطرد المركزي بزاوية مقدارها 45 درجة. تسمح الدهنية لتحريك لأسفل لمدة 1 دقيقة (الشكل 3A).
- استرداد الدهنية FCP بحجم نهائي في 25-50 ميليلتر. تجنب الإخلال ترسبات.
-
ضوابط 1: امتصاص، التحليل الطيفي الأسفار
- إضافة قاسمة 3 ميليلتر من FCP-الدهنية إلى وحدة تخزين نهائي 1 مل 1 × الغسيل الكلوي المخزن المؤقت والطرد المركزي لمدة 5 دقائق في 12,000 س ز.
- تسجيل امتصاص بين 370 و 750 نيوتن متر من FCP-الدهنية مع نفس المعدات كما هو موضح في 1.2.4. تطبيع الطيف إلى الحد الأقصى في منطقةy Q في شيلي (670-680 nm) ومقارنتها بطيف تطبيع solubilized FCP (الشكل 3).
- إعداد FCP-الدهنية في 1 مل من موانئ دبي مع امتصاص (ABS) = 0.03 فيما يتعلق بالحد الأقصى بين 670-680 نانومتر. ضبط FCP solubilized في المنظفات من الخطوة 1.2.6 للقيمة المطلقة نفس تمييع مع B1a.
- تسجيل أطياف امتصاص كل العينات كما هو موضح في 1.2.4. تسجيل شيلي طيف انبعاث الأسفار من كلا عينات كما هو موضح في 1.3.3.
ملاحظة: انخفض محصول الأسفار في العينة الحويصلية FCP (3D الشكل و انظر المناقشة.)
- إضافة قاسمة 3 ميليلتر من FCP-الدهنية إلى وحدة تخزين نهائي 1 مل 1 × الغسيل الكلوي المخزن المؤقت والطرد المركزي لمدة 5 دقائق في 12,000 س ز.
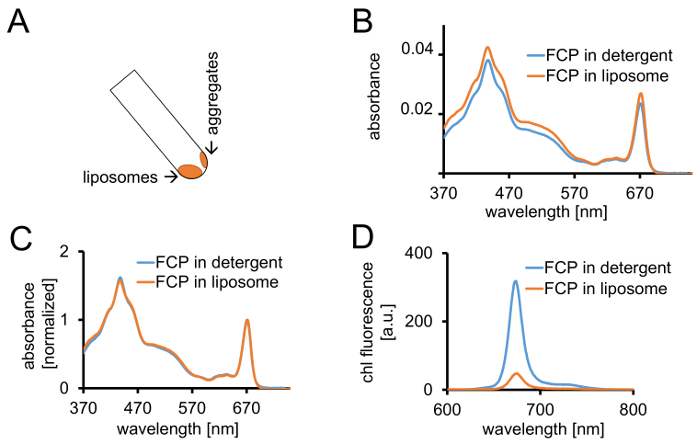
الشكل 3: عزل بروتيوليبوسوميس FCP متبوعاً بضوابط الطيفية وتصوير [كنفوكل]. (أ) الانتعاش من FCP الدهنية بعد الطرد المركزي. تشغيل الأنبوب الطرد المركزي إلى 45° والانتظار حوالي 1 دقيقة--سوف تنزل الدهنية حين FCP المجاميع التي لم تدمج عصا الدهنية على جدار الأنبوبة. (ب) مقارنة بين أطياف امتصاص FCP solubilized في المنظفات (الأزرق) و FCP في الدهنية (برتقالي) (ج) تطبيع الأطياف نفسه كما هو الحال في (ب) إلى شيلي كحد أقصى في المنطقة الحمراء (~ 670 نانومتر-ذروة كي)؛ FCP solubilized في المنظفات (أزرق) و FCP في الدهنية (برتقالي). محتملة، يمكن أن يكون هناك خسارة صباغ أساسا من الكاروتينات مرئية في منطقة شمال البحر الأبيض المتوسط 500-550. تجميع FCP في الدهنية قد تؤدي إلى توسيع نطاق الذروة وتحولاً طفيفا شيلي كحد أقصى (~ 670 نانومتر) إلى اللون الأحمر. (د) أطياف الانبعاث من FCP solubilized في المنظفات و FCP في الحويصلية. تجميع من FCP في الحويصلية يعزز التفاعلات النشطة من مجمعات FCP الذي يخفض الغلة الفلورية (المنحنى البرتقالي) ونوبات ماكسيما الانبعاثات قليلاً إلى اللون الأحمر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
النتائج
ويصف البروتوكول عزل إجمالي FCP جزء من مينيغينيانا سيكلوتيلا وإدماج ذلك في الدهنية مع تكوين الدهن الأصلي. عزل ثايلاكويد استنساخه بدرجة عالية، ولكن قد يتغير العائد ثايلاكويد. والنتيجة مقبولة إذا كان أكثر من 50% من جميع الصبغات يتم استردادها في خطوة 1.1.4. أكثر من 80% من الأم?...
Discussion
الدهنية FCP مع تكوين الدهن الطبيعية توفر أداة يدوية وبسيطة واستنساخه للتحقيق في الخصائص الطيفية في المختبر. البيئة المادة الدهنية في FCP الدهنية تشبه الحالة داخل الغشاء ثايلاكويد، مما أدى إلى النتائج التجريبية التي أقرب إلى الظروف الطبيعية.
وهناك العديد من المزايا لاست?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونشكر أحمد عديل رنا للمساعدة في تنقية FCP. الأستاذ كلوديا بوشل المسلم لإجراء مناقشات مفيدة وقراءة المخطوطة. هذا العمل كان تدعمها "مؤسسة البحوث الألمانية" إلى دينار (DI1956-1/1) ومؤسسة هومبولدت لزمالة فيودور لنن إلى ld.
Materials
| Name | Company | Catalog Number | Comments |
| 500 ml centrifuge vials | |||
| high speed centrifuge | Heraeus | ||
| Bead Mill VI 2 | Edmund-Bühler (edmund-buehler.de) | newer version: Vibrogen-Zellmühle Vl 6 | |
| Silibeads S 400 µm | Sigmund-Lindner.com | 5223-7 | |
| Silibeads S 1,-1,3 mm | Sigmund-Lindner.com | 4504 | |
| VitraPOR filter funnel - por1 | ROBU GmbH | 21121 | |
| polycarbonate ultracentrifuagtion vials (30 mL) for T-865 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 314348 | |
| Ultracentrifuge Discovery 90SE | Sorvall | n.a. | |
| rotor T 865 | ThermoFisher Scientific (thermofisher.com) | 51411 | |
| Neubauer Cell Counter Chamber (improved) | Carl Roth Laborbedarf (Carlroth.com) | T729.1 | |
| Zeiss Mikroskop Primostar (7) | Optik-Pro (optik-pro.de) | 51428 | |
| optical glass cuvettes (6040-OG) | Hellma Analytics (hellma-analytics.com) | "6040-10-10" | |
| V-630 UV-VIS Spectrophotometer (incl. software) | Jasco (jasco.de) | V-630 | |
| n-Dodecyl-β-D-Maltopyranoside | ANATRACE (anatrace.com) | D310LA | |
| Ultra-Clear tubes 17 ml for AH629 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 344061 | |
| rotor AH629-17-mL | ThermoFisher Scientific (thermofisher.com) | 54285 | |
| Membrane concentrator_Centriprep 30 kDa cutoff | Millipore (merckmillipore.com) | 4307 | |
| Biometra Minigel-Twin | Analytik Jena AG (analytik-jena.de) | 846-010-100 | |
| Silver Stain Plus Kit | Bio-Rad (bio-rad.com) | 1610449 | |
| libre office spread sheet | The document foundation | https://de.libreoffice.org/download/libreoffice-still/ | |
| special glass cuvettes for fluorescence (101-0S) | Hellma Analytics (hellma-analytics.com) | 101-10-20 | |
| Spectrofluorometer FP-6500 (incl. Software) | Jasco (jasco.de) | FP-6500 | |
| SDS-loading buffer Roti-Load | ROTH (carlroth.com) | K929.1 | |
| n-octyl β-D-glucopyranoside | ANATRACE (anatrace.com) | O311 | |
| Monogalactosyl Diaclyglycerol (MGDG) | Larodan AB (larodan.com) | 59-1300 | make stock solution in chloroform |
| Digalactosyl Diacylglycerol (DGDG) | Larodan AB (larodan.com) | 59-1310 | make stock solution in chloroform |
| Sulphoquinovosyl Diacylglycerol (SQDG) | Larodan AB (larodan.com) | 59-1230 | make stock solution in chloroform |
| L-alpha-Phosphatidylglycerol (PG) | Larodan AB (larodan.com) | 37-0150 | make stock solution in chloroform |
| L-α-Phosphatidylcholine | Sigma-Aldrich (sigmaaldrich.com) | P3782 SIGMA | make stock solution in chloroform |
| sonicator bath S-50TH | Sonicor (getmedonline.com | SONICOR-S-50TH | |
| mini-Extruder | Avanti Polar Lipids (Avanti.com) | 610000 | |
| Nuleopore polycarbonate membrane | Avanti Polar Lipids (Avanti.com) | 610005 | |
| dialysis membrane Visking 14 kDa cutoff | ROTH (carlroth.com) | 0653.1 | boil in destilled water before use |
| Biobeads SM2 Adsorbent | Biorad (Bio-rad.com) | 152-3920 | |
| sucrose epichlorhydrin copolymer - Ficoll 400 | Sigma-Aldrich (sigmaaldrich.com) | F4375 | |
| Polycarbonate ultracentrifuagtion vials (2.7 mL) for TFT 80.4 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 252150 | |
| rotor TFT 80.4 | Millipore (merckmillipore.com) | 54356 | |
| material listed in order of appearance | For specific safety instructions please refer to material safety sheets and repective manuals. Standard lab material and substances are not listed. |
References
- Eberhard, S., Finazzi, G., Wollman, F. A. The Dynamics of Photosynthesis. Annual Review of Genetics. 42, 463-515 (2008).
- Li, Z. R., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and Responding to Excess Light. Annual Review of Plant Biology. 60, 239-260 (2009).
- Niyogi, K. K., Truong, T. B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology. 16 (3), 307-314 (2013).
- Li, X. -. P., et al. A pigment-binding protein essential for regulation of photosynthetic light harvesting. Nature. 403 (6768), 391-395 (2000).
- Peers, G., et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature. 462 (7272), 518-521 (2009).
- Correa-Galvis, V., et al. Photosystem II Subunit PsbS Is Involved in the Induction of LHCSR Protein-dependent Energy Dissipation in Chlamydomonas reinhardtii. The Journal of biological chemistry. 291 (33), 17478-17487 (2016).
- Bailleul, B., et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18214-18219 (2010).
- Taddei, L., et al. Multisignal control of expression of the LHCX protein family in the marine diatom Phaeodactylum tricornutum. Journal of experimental botany. 67 (13), 3939-3951 (2016).
- Lepetit, B., et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis. New Phytologist. 214 (1), 205-218 (2017).
- Büchel, C. Evolution and function of light harvesting proteins. Journal of Plant Physiology. 172, 62-75 (2015).
- Lavaud, J., Rousseau, B., van Gorkom, H. J., Etienne, A. -. L. Influence of the Diadinoxanthin Pool Size on Photoprotection in the Marine Planktonic Diatom Phaeodactylum tricornutum. Plant Physiology. 129 (3), 1398-1406 (2002).
- Ruban, A., et al. The super-excess energy dissipation in diatom algae: comparative analysis with higher plants. Photosynthesis Research. 82 (2), 165-175 (2004).
- Mann, D. G. The species concept in diatoms. Phycologia. 38 (6), 437-495 (1999).
- Papagiannakis, E., van Stokkum, I. H. M., Fey, H., Büchel, C., van Grondelle, R. Spectroscopic Characterization of the Excitation Energy Transfer in the Fucoxanthin-Chlorophyll Protein of Diatoms. Photosynthesis Research. 86 (1-2), 241-250 (2005).
- Premvardhan, L., Robert, B., Beer, A., Büchel, C. Pigment organization in fucoxanthin chlorophyll a/c2 proteins (FCP) based on resonance Raman spectroscgopy and sequence analysis. Biochimica et Biophysica Acta-Bioenergetics. 1797 (9), 1647-1656 (2010).
- Gildenhoff, N., Herz, J., Gundermann, K., Büchel, C., Wachtveitl, J. The excitation energy transfer in the trimeric fucoxanthin-chlorophyll protein from Cyclotella meneghiniana analyzed by polarized transient absorption spectroscopy. Chemical Physics. 373 (1), 104-109 (2010).
- Ramanan, C., et al. Exploring the mechanism(s) of energy dissipation in the light harvesting complex of the photosynthetic algae Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1837 (9), 1507-1513 (2014).
- Haferkamp, S., Kirchhoff, H. Significance of molecular crowding in grana membranes of higher plants for light harvesting by photosystem II. Photosynthesis Research. 95 (2-3), 129-134 (2008).
- Wahadoszamen, M., et al. Stark fluorescence spectroscopy reveals two emitting sites in the dissipative state of FCP antennas. Biochimica et Biophysica Acta-Bioenergetics. 1837 (1), 193-200 (2014).
- Zhou, F., et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids. Photosynthesis Research. 99 (3), 185-193 (2009).
- Moya, I., Silvestri, M., Vallon, O., Cinque, G., Bassi, R. Time-resolved fluorescence analysis of the photosystem II antenna proteins in detergent micelles and liposomes. Biochemistry. 40 (42), 12552-12561 (2001).
- Natali, A., et al. Light-harvesting Complexes (LHCs) Cluster Spontaneously in Membrane Environment Leading to Shortening of Their Excited State Lifetimes. Journal of Biological Chemistry. 291 (32), 16730-16739 (2016).
- Gundermann, K., Büchel, C. Factors determining the fluorescence yield of fucoxanthin-chlorophyll complexes (FCP) involved in non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1817 (7), 1044-1052 (2012).
- Ahmad, R. A., Dietzel, L. Relaxation of cellular K+ gradients by valinomycin induces diatoxanthin accumulation in Cyclotella meneghiniana cells and alters FCPa fluorescence yield in vitro. Physiologia Plantarum. , 171-180 (2017).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Archiv für Mikrobiologie. 25 (4), 392-428 (1957).
- Jeffrey, S., Humphrey, G. New spectrophotometry equations for determining chlorophyll a, chlorophyll b, chlorophyll c-1 and chlorophyll c-2 in higher plants, algae and natural phytoplankton. Biochemie und Physiologie der Pflanzen. 167, 191-194 (1975).
- Beer, A., Gundermann, K., Beckmann, J., Büchel, C. Subunit Composition and Pigmentation of Fucoxanthin−Chlorophyll Proteins in Diatoms: Evidence for a Subunit Involved in Diadinoxanthin and Diatoxanthin Binding. Biochemistry. 45 (43), 13046-13053 (2006).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry. 166 (2), 368-379 (1987).
- Büchel, C. Fucoxanthin-Chlorophyll Proteins in Diatoms: 18 and 19 kDa Subunits Assemble into Different Oligomeric States. Biochemistry. 42 (44), 13027-13034 (2003).
- Vieler, A., Wilhelm, C., Goss, R., Süß, R., Schiller, J. The lipid composition of the unicellular green alga Chlamydomonas reinhardtii and the diatom Cyclotella meneghiniana investigated by MALDI-TOF MS and TLC. Chemistry and Physics of Lipids. 150 (2), 143-155 (2007).
- Gundermann, K., Büchel, C. The fluorescence yield of the trimeric fucoxanthin-chlorophyll-protein FCPa in the diatom Cyclotella meneghiniana is dependent on the amount of bound diatoxanthin. Photosynthesis Research. 95 (2-3), 229-235 (2008).
- Miloslavina, Y., et al. Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1787 (10), 1189-1197 (2009).
- Grouneva, I., Jakob, T., Wilhelm, C., Goss, R. The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1787 (7), 929-938 (2009).
- Chukhutsina, V. U., Büchel, C., van Amerongen, H. Disentangling two non-photochemical quenching processes in Cyclotella meneghiniana by spectrally-resolved picosecond fluorescence at 77 K. Biochimica et Biophysica Acta-Bioenergetics. 1837 (6), 899-907 (2014).
- Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., Büchel, C. Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochimica Et Biophysica Acta-Bioenergetics. 1857 (9), 1373-1379 (2016).
- Darley, W. M. Biochemical composition. The biology of diatoms. 13, 198-223 (1977).
- Milsman, M. H. W., Schwendner, R. A., Weder, H. G. Preparation of large single bilayer liposomes by a fast and controlled dialysis. Biochimica Et Biophysica Acta. 512 (1), 147-155 (1978).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid-detergent-mixed micelles. Biochimica Et Biophysica Acta. 640 (1), 252-262 (1981).
- Verchere, A., Broutin, I., Picard, M. Photo-induced proton gradients for the in vitro investigation of bacterial efflux pumps. Scientific Reports. 2 (306), (2012).
- Chevallet, M., Luche, S., Rabilloud, T. Silver staining of proteins in polyacrylamide gels. Nature Protocols. 1 (4), 1852-1858 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved