需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
类囊脂质体中硅藻Cyclotella Meneghiniana中的光捕获天线的分离与融合
摘要
在这里, 我们提出了一种从硅藻中分离 fucoxanthin 叶绿素 a/c 结合蛋白 (FCP) 的协议, 并将其纳入脂质体和天然脂质成分, 研究了离子成分变化时的激发能量传递。
摘要
植物、藻类和硅藻的光合性能强烈依赖于叶绿体类囊体膜中的光收获和能量传递过程的快速有效调控。硅藻的光收获天线, 所谓的 fucoxanthin 叶绿素 a/c 结合蛋白 (FCP), 是需要的光吸收和有效地转移到光合反应中心, 以及为光保护从过量的光。这两个函数之间的切换是一个长期的研究课题。其中许多研究都是用 FCP 在洗涤剂胶束中进行的。在相互作用研究中, 洗涤剂被去除, 导致 FCP 复合物的不特异聚集。在这种方法中, 很难区分工件和生理相关数据。因此, 通过研究蛋白质-蛋白质相互作用, 能量转移和其他光谱特征, 如果它们嵌入在他们的本地脂质环境中, 就可以获得更有价值的 FCP 和其他膜结合光采集配合物的信息。其主要优点是脂质体具有定义的大小和定义的脂/蛋白比, FCP 聚类的程度受到控制。此外, 在体内调节光收获的 pH 值和离子成分的变化也很容易被模拟。与类囊膜相比, 脂质体更均匀、不复杂, 便于获得和理解光谱数据。该协议描述了 FCP 分离纯化、脂质体制备、FCP 脂质体与天然油脂成分结合的过程。给出了典型应用的结果, 并进行了讨论。
引言
像硅藻这样的光合有机体必须应对不断变化的光照条件, 并应对复杂的适应机制, 保持高光合效率和保护光氧化损伤所造成的过度光照。光合真核生物的一个主要的光保护过程是高能淬火 (qE) 的吸收光作为主要贡献的非光化学淬火 (NPQ) 在轻应力条件下1,2 ,3。光采集天线配合物 (LHC) 参与了励磁能量传递通路的调节。由于在叶绿体腔内高光诱导低pH 值, 天线系统从光收获状态切换到淬火状态。这种能量耗散状态保护-高等植物 (PS) 和其他配合物在类囊体膜从光氧化。在光合真核生物中, qE通常由两个因素1、2、3引起。一个因素是专门的光收获蛋白对低pH 值的反应。公安局蛋白在高等植物中诱导 qE 4。LhcSRs5, 由公安局活动调制, 诱导绿藻中 qE 6。硅藻具有与 LHCSRs7、8、9、10的结构相关的 Lhcx 蛋白。
qE的第二个因素是叶黄素的周期, 其中的类胡萝卜素被转化成光保护形式, 通过环氧化和还原环氧化。在植物和绿藻中, 紫黄素转化为玉米黄质。在硅藻中, diadinoxanthin 转换为 diatoxanthin, 然后与 NPQ11的程度相关。硅藻光收获天线具有一定的特殊性, 尽管它与植物和藻类 LHCs 有关。从光照到光保护的转换速度非常快, 与植物12相比, NPQ 容量更高。这可能是为什么硅藻在不同的生态环境中非常成功的原因之一, 他们负责45% 的大洋净初级产量13。因此, 硅藻光收获系统是光合作用研究的一个有趣的对象。
硅藻, 像中心物种Cyclotella meneghiniana,拥有类囊体固有的光采集系统, 命名后的颜料, 他们绑定-fucoxanthin, 叶绿素 (智利) a 和 c, 因此 FCP. 光收获蛋白, 如 FCPs, 是嵌入在囊体膜系统中, 包括几个膜层。硅藻形成三类囊体的带状。这种复杂的情况使得研究它们在类囊体膜中的分子水平是困难的。此外, 许多组件有助于调节光的收获 (见上文)。因此, 在许多方法中, 复合体是从膜中分离出来的, 使用温和的洗涤剂, 如 n-月桂-maltopyranoside (β), 溶解膜, 但保持 FCP 配合完好。利用可溶性 FCP 对分子内能量转移14、15、16、17进行了多光谱研究。然而, 这种前一种方法是有限的, 因为调节能量转移需要激子吸收与其他天线配合物或-高等植物的相互作用。因此, 这些类型的研究不能与可溶性配合, 因为复合体之间的相互作用失去了。
天线调节的一个重要特征是类囊体膜18中天线和-高等植物的 "分子拥挤"。以前, 一种简单的方法来模拟这种效应的体外.洗涤剂被去除, 导致天线复合体的随机聚集。虽然这一方法17、19获得了一些合理的数据, 但洗涤剂的去除并没有反映体内的情况, 也有一些局限性, 因为复合物在其正规的第三系中没有相互作用。结构。
脂质体的使用克服了前几个局限性。第三级结构仍然完全完好。脂质体膜为天线配合物提供了准本机环境。膜从外部环境中分离脂质体的内部。通过这些方法, 脂质体提供了两个反应室, 用于研究离子和 pH 梯度以及运输过程。此外, 实验系统的参数可以更容易地控制在类囊体膜的研究。脂质体已经被证明是研究光合络合物的极好工具。过去的一个主要重点是植物 lhc, 在那里, 改变脂质成分的影响测试了 LHC II20。在其他方法中, 研究了不同的 LHC II. 的蛋白质-蛋白质相互作用21。此外, 还对绿藻进行了一些研究, 描述了 LHC22之间的自发聚类。考虑到硅藻在水生生态系统中的重要性, 对硅藻天线配合物进行了比较少的研究。两项研究调查了中心Cyclotella meneghiniana的天线配合物, 其中显示了 FCP 天线23的聚类和 FCP 对电化学梯度24的响应。因此, 脂质体是研究硅藻天线及其在近地环境中相互作用和调节的极好工具。脂质体是多才多艺的, 因为许多条件, 如脂组成, 脂质体的大小, 蛋白质密度和周围的水相可以控制。此外, 该方法需要少量的样本。实验系统鲁棒性强, 重现性高。脂质体的划分允许研究 pH 值和离子梯度, 这是调节天线配合物的重要因素。
在这里, 我们描述了 FCP 天线配合物的分离从C. meneghiniana和他们的纳入脂质体与自然类囊脂组成。同时, 我们为可溶性 FCP 的光谱表征提供了典范的数据, 并与脂质体中的 FCP 进行了比较。该方法总结了从改进 Gundermann 和 Büchel 201223、娜塔莉等201622、艾哈迈德和 Dietzel 201724获得的知识和标准化协议。

图 1: 工作流的示意图表示形式。(1)是指1段, 描述细胞生长, 破坏和类囊体的分离与以下 FCP 分离的蔗糖密度梯度;沙菲·萨米-Cyclotella meneghiniana细胞。(2) 2 段中描述的天然类囊体脂质混合物 (MGDG、DGDG 和 SQDG) 的制备, 并建立 octylglycoside 脂质洗涤剂胶束。所定义的脂胶束大小是通过使用已定义孔径的膜挤压而实现的。FCP 和脂胶束在预定的脂质上统一: 蛋白质比,通过控制透析形成 FCP proteoliposomes 去除清洁剂和β。请单击此处查看此图的较大版本.
研究方案
注:FCPs 等光合复合物极易受到光和热的影响。总是在冰和昏暗的灯光下工作。
1. 从细胞中分离 FCP
-
从C. meneghiniana细胞分离的类囊体
- 在五500毫升的烧瓶中生长meneghiniana , 每个填充300毫升的 ASP 中23,25和5000万细胞。用一个棉花塞子塞进烧瓶, 让细胞生长到指数生长阶段大约一个星期在 120 rpm 与 16 h 光和 8 h 黑暗的阶段在40µmol 光子或 (m²s) 白色光和温度在15-18 °c 之间。检查细胞数是在 1.5-200万细胞/毫升之间的细胞计数器室。
- 在高速离心机中, 用500毫升离心瓶 (4 °c) 在 4000 x g的预换热器转子上离心出15分钟的电池。用吹打重新悬浮12毫升均匀缓冲中的细胞颗粒 (HB,表 1)。
- 将悬浮液转移到一个50毫升的塑料管上。将样品贮存在摄氏-80 摄氏度或进行步骤1.1.3。
- 预冷的珠磨和设备。用玻璃珠混合料将50毫升烧杯填充到 75%, 并添加细胞悬浮液。对于细胞中断, 使用 7 x 四十五年代脉冲在全速与三十年代的冷却之间的每个脉冲。在步骤1.1.6 中采取20µL 破坏细胞进行质量检查。
- 在玻璃过滤器漏斗上过滤被破坏的细胞, 然后通过将 HB 浇在玻璃珠上, 直到它们看起来清晰为止。将洗涤分数与滤液一起池。保持最终体积低于150毫升。
- 用三50毫升塑料管在 140 x g上离心样品15分钟, 以颗粒状细胞碎片。小心地将上清液转移到20毫升聚碳酸酯离心瓶并丢弃颗粒。
- 用 HB 填充小瓶, 平衡重量, 离心机在合适的转子1小时在 30万 x g和4°c, 以颗粒状囊状体膜。
- 使用离心时间检查被破坏的细胞的比例, 显微镜下400X 放大20µL 样本在1.1.3。计算叶绿体游离与叶绿体含 frustules (二氧化硅壳) 的比值。
注意: 硅藻细胞壁是由二氧化硅制成的, 在显微镜中可见为高度衍射的物质。如果细胞中断工作, 叶绿体就应该从细胞中释放出来。 - 用小画家的刷子重新悬浮膜小球, 尽可能少的洗涤缓冲器 (0.5-1 毫升)。填充聚碳酸酯离心瓶与洗涤缓冲 (表 1), 平衡他们的重量和离心机为20分钟在 20万 x g和4°c。
- 用画家的刷子将洗过的膜重新挂起。添加洗涤缓冲器, 只有当需要保持尽可能高的类囊体浓度。池所有类囊体在一个样品瓶 (15 毫升)。
- 用样品的10µL 和90µL 100% 丙酮预稀释样品。离心机以 1.2万 x g为5分钟, 颗粒沉淀蛋白。采取10µL 的 predilution 和混合它与990µL 90% 丙酮。
- 测定叶绿素 a 和 c 的吸光度 (ABS) 在664毫微米和630毫微米在90% 丙酮。从两个值中减去 ABS750nm 。使用以下公式确定总叶绿素含量:24
1)
2)
- 测定叶绿素 a 和 c 的吸光度 (ABS) 在664毫微米和630毫微米在90% 丙酮。从两个值中减去 ABS750nm 。使用以下公式确定总叶绿素含量:24
- 整除类囊体0.5 毫克的总叶绿素在1.5 毫升反应管, 冻结他们在液氮和储存在-80 °c, 直到进一步使用。
-
FCP 配合物的分离与浓缩
- 准备一个蔗糖梯度溶液和填充 ultracentrifuge 管, 直到顶部减去加载量 (300-500 µL)。将管子冷冻-20 摄氏度, 直到完全凝固。允许管解冻在 +4 摄氏度, 这需要3-4 小时的17毫升管。
- 重复冻结解冻循环两次, 以细化渐变以提高分辨率。
- 使用1.1.9 中获得的0.5 毫克叶绿素的样品, 用缓冲 B1 (表 1) 调整成2毫升的最终体积。为增溶, 添加 n-月桂-maltopyranoside (b) 的最终浓度为20毫米。
- 翻转管3次, 并把它放在冰上20分钟的温柔晃动, 以避免泡沫。离心机为5分钟, 在 1.2万 x g在一个预冷的桌上部离心机在 +4 °c。
- 在渐变上加载上清。如果使用17毫升小瓶, 则不要载入每梯度的总叶绿素的125µg。离心机为22小时在 10万 x g和 +4 °c。
- 使用注射器从渐变中恢复所需的褐色 FCP 分数 (图 2A)。采取5µL 整除和稀释它与995µL B1a。
- 测量紫外-可见光分光光度计中 370-750 nm 之间的吸光度 (ABS) 谱。采用半微光学玻璃小试管。
- 打开光谱管理器软件, 转到频谱模式并记录基线, 从370到 750 nm, 然后是样本测量。使用以下设置: 扫描速度, 200 nm/分钟;数据沥青, 0.5 毫微米;反应, 中等。
- 用微测量回收样品的体积。通过将恢复的体积增加两倍于 B1 缓冲器 (表 1) 来清洗 FCP 络合物。集中在一个 30 kDa 截止到 1000 x g和 +4 °c 的膜选矿厂到 ABS672nm至少20。
注:在样品室中, 由于胶束富集, b 的浓度可能上升。这可能会导致进一步的 FCP 复合体的增溶!如果需要进一步洗涤步骤, 以消除残余蔗糖, 避免过度增溶通过添加洗涤剂自由缓冲 B1。 - 采取20µL 整除的控制。将液体氮气中的样品冷冻, 并将其贮存在-80 摄氏度。
- 准备一个蔗糖梯度溶液和填充 ultracentrifuge 管, 直到顶部减去加载量 (300-500 µL)。将管子冷冻-20 摄氏度, 直到完全凝固。允许管解冻在 +4 摄氏度, 这需要3-4 小时的17毫升管。

图 2: 纯化 FCP, 光谱控制和纯度检查.(A)一夜间离心后蔗糖密度梯度的典型出现。所有褐色带都包含由 FCPa 和 FCPb 组成的 FCP 池. pigm.-未绑定颜料, PS--高等植物(B)采用 30 FCP 截止率的离心过滤装置, 在 (蓝线) 和后 (橙色虚线) 浓度下的吸光度谱.特别是, 类胡萝卜素容易从 FCP 的损失, 这将导致较低的吸光度在该地区之间500-550 毫微米。图被规范化对叶绿素 Qy最大值在 ~ 670 毫微米。(c)叶绿素 a (465 nm) 激发的发光光谱, 用于测试函数激发能量转移。如果智利 c 的能量转移受到阻碍, 则会出现一个额外的荧光带, 在 640 nm (智利 c)。图被规范化到发射最大值。(D)在 675 nm (智利荧光最大值) 上记录的激发谱, 用于测试从 370 nm 到 600 nm 之间吸收的所有颜料的能量转移。如果能量转移到智利 a 是低效率的, 荧光率将减少特别是在465和550毫微米之间。图被规范化了到最大大约440毫微米。如果浓度良好, 则 (B)、(C) 和 (D) 中的光谱几乎相同。(E)使用三 tricine 凝胶28检查隔离 FCP 的纯度。FCPa 和 FCPb 在 18-19 kDa 之间有亚基。所有可见的银染色蛋白大于 20 kDa 是污染物。Thyl。-类囊体请点击这里查看这个数字的大版本.
-
基于光谱和凝胶的控制
- 在1.2.5 后的995µL 中, 记录 370-750 nm 5 µL FCP 的吸收率。将其与步骤1.2.4 中获得的频谱进行比较。使用与步骤1.2.4 中所述相同的检测和设置。
- 将数据导出为 csv 并将数据导入电子表格。将两个光谱正常化为约 672 nm 的 Qy波段中的最大 a, 如图 2B所示。
- 通过将所测量的 abs672nm除以所需 abs672nm 0.03, 计算出步骤1.2.4 和1.3.1 中样品的稀释系数。相应地稀释样品与 B1a 并且转移他们到特别玻璃荧光小试管。
- 记录 spectrofluorometer 的荧光发射光谱, 以显示从 c 到智利的完整的光能量传递 (图 2C)。
- 使用光谱仪软件, 进入频谱测量模式, 具有以下设置: 模式, 发射;狭缝宽度激发和发射, 3 毫微米;灵敏度, 中等;扫描速度, 100 nm/分钟;数据沥青, 0.5 毫微米;激发波长, 465 毫微米;发射, 600-800 nm。执行 autozero 和测量。
- 记录励磁谱与相同的样品和设备, 以揭示完整的能量转移从所有颜料到智利 a (图 2D)。将设置更改为: 模式, 激发;发射波长, 675 毫微米;励磁, 370-600 毫微米。记录光谱。
- 用相同范围内的罗丹明光谱校正灯的光谱特性- cf。用户手册中的说明。
- 混合 FCP 样品对应于1µg 的智利 a 与10µL 的 SDS 加载缓冲区。孵育10分钟, 在25摄氏度。离心机为5分钟, 在 12000 x g 的台面上离心机。
- 在三 tricine 凝胶上装上上清液28。分开它为 2 h 在 150 V 和银色污点它在分离40以后。
注: FCP 亚基分为两个显著的蛋白带之间的 18-19 kDa, 这是成分的 FCPa 和 FCPb29 (图 2E)。
- 在三 tricine 凝胶上装上上清液28。分开它为 2 h 在 150 V 和银色污点它在分离40以后。
- 在1.2.5 后的995µL 中, 记录 370-750 nm 5 µL FCP 的吸收率。将其与步骤1.2.4 中获得的频谱进行比较。使用与步骤1.2.4 中所述相同的检测和设置。
2. 脂质体的制备和 FCP 的加入
-
脂质混合物和脂质洗涤剂胶束的制备
注意:脂类易受温温度和氧化条件的影响。试着保持脂肪冷冻和2的气氛。- 根据 Vieler等200730, 计算meneghiniana所需的囊体脂质比值。请参阅补充表 1中给出的示例。准备由制造商推荐的脂质库存解决方案在一个溶剂证明容器。
- 在2毫升的反应管中吸出所需的脂质, 用温和的氮气流蒸发氯仿, 并尝试将脂质分布到管基的整个区域。让 N2流动, 直到所有溶剂被蒸发。
- 溶解29µL 中的脂质混合物, 在4摄氏度的 glucopyranoside 溶液中, 4 小时, 在30摄氏度孵育脂质混合物10分钟。在 3 x 3 分钟的 sonicator 浴中孵化脂质, 在三十年代在冰上中断25摄氏度。
- 添加221µL tricine 缓冲液和250µL 的4x 透析缓冲液。
- 使用0.1 µm 聚碳酸酯膜的挤出机, 用于定义的脂质体直径为 50-70 nm。将挤出机与膜和过滤器配套组装。避免气泡, 彻底拧紧总成。
- 用4x 透析缓冲液和预湿挤出机填充一支注射器, 直到第二个注射器中没有气泡。
- 将脂质洗涤剂胶束应用于挤出机上, 然后将溶液从一把注射器压向另一支。重复此步骤5次, 直到解决方案出现同构。
注:此解决方案可存储在4摄氏度, 数天。不要冻结!
-
FCP 配合物的加入和洗涤剂和骨料的清除
注:在这个例子中, 我们使用的脂/智利的比率为 12:1, 这相当于一个脂/蛋白质比约100:1。- 添加 FCP 等于20µg 的500µL B1a 缓冲器, 以 250 μL 的挤压脂胶束和250µL 4x 透析缓冲。3 x 3 分钟的样品孵化在25摄氏度的 thermomixer 在 1500-3000 rpm 中断了三十年代暂停冰。
- 将四1.5 毫升反应管的盖子切开, 在顶部给出一个仍然适合盖子的环。准备1.5 厘米 x 1.5 厘米的透析膜, 并在20毫升的1x 透析缓冲液中冲洗。
- 在每个盖子上填充250µL 的样品。小心, 把膜放在盖子上, 这样车厢就完全充满了样品, 没有气泡发生。拧紧组件上的反应管环, 以便有一个封闭的隔间。
- 透析50毫升的1x 透析缓冲液在一个翻滚的振动筛上的冰上过夜 (12-16 小时)。用新鲜的透析缓冲液更换, 再加入7毫克的吸附剂珠, 以除去剩下的洗涤剂至少6小时。
- 再次更换透析缓冲器, 再透析12小时. 用200µL 微尖刺穿透析膜, 从反应管盖中吸取所有脂质体, 以恢复脂质体。
- 可选步骤: 如果需要高纯度 (> 95%)。在透析缓冲液中, 用含有6%、10%、15% 和20% 蔗糖 epichlorhydrin 共聚物的步骤, 制备17毫升离心瓶中的不连续密度梯度。在摆动斗转子上, 将脂质体放在顶部, ultracentrifuge 在 10万 x g 处, 4 小时。
- 用注射器恢复上褐色带, 用 DP 稀释样品 1:5, 然后继续下一步。
- 离心 FCP 脂质体在至少2毫升1x 透析缓冲1.5 小时在 10万 x g 和4°c。在45°角旋转离心管, 以恢复脂质体。允许脂质体向下移动1分钟 (图 3A)。
- 恢复 FCP 脂质体的最终体积为25-50 µL. 避免扰乱沉淀。
-
控制 1: 吸光度, 荧光光谱
- 添加一个3µL 整除的 FCP 脂质体到1毫升最终容积1x 透析缓冲和离心机5分钟在 1.2万 x g。
- 用1.2.4 中描述的相同设备记录 FCP 脂质体370和 750 nm 之间的吸光度。将光谱正常化为 670-680 nm 的 Qy区域的最大值, 并将其与可溶性 FCP 的归一化光谱进行比较 (图 3C)。
- 准备 FCP 脂质体在1毫升的 DP 与吸光度 (ABS) = 0.03 关于最大值介于670-680 毫微米之间。将洗涤剂中的可溶性 FCP 从步骤1.2.6 调整为与 B1a 稀释的同一 ABS。
- 记录1.2.4 中所述两种样品的吸光度谱。记录1.3.3 中描述的两个样品的荧光发射光谱。
注:FCP 脂质体样品中荧光率降低 (图 3D和cf )。
- 添加一个3µL 整除的 FCP 脂质体到1毫升最终容积1x 透析缓冲和离心机5分钟在 1.2万 x g。
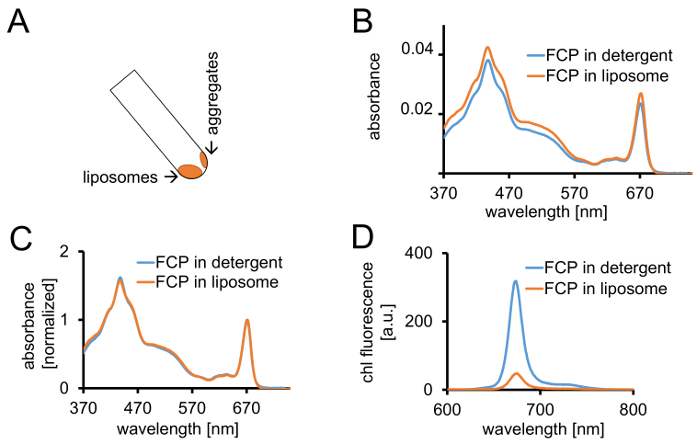
图 3: FCP proteoliposomes 的分离, 其次是光谱控制和共焦成像。(A)离心后 FCP 脂质体的回收。将离心管转到45°并等待约1分钟-脂质体将向下移动, 而 FCP 骨料未纳入脂质体坚持管壁。(b ) 可溶性 FCP 在脂质体 (橙色) 和 FCP 中的吸光度谱的比较 ( b) 在红色区域 (~ 670 nm-Qy 峰值) 正常化为智利最高值的相同光谱;可溶性 FCP 在洗涤剂 (蓝色) 和 FCP 脂质体 (橙色)。潜在的, 可能是色素的损失, 主要是在 500-550 nm 区域可见的类胡萝卜素。FCP 在脂质体中的聚类可能导致峰值的扩大和智利的轻微移位 (约670毫微米) 到红色。(D)脂质体中洗涤剂和 FCP 中可溶性 FCP 的排放谱。FCP 在脂质体中的聚类增强了 FCP 配合物的能量相互作用, 降低了荧光的产生率 (橙色曲线), 并将发射极大值略微移到红色。请单击此处查看此图的较大版本.
结果
该协议描述了从Cyclotella meneghiniana的总 FCP 分数的分离, 并将其纳入脂质体与本机脂组成。类囊体的分离是高度重现性的, 但囊体产量可能会改变。如果在步骤1.1.4 中回收超过50% 的颜料, 结果是可以接受的。超过80% 是最佳的。
类囊体的增溶是一个关键的步骤。如果步骤1.2.2 中的上清液含有大部分颜料, 则获得可溶性膜。如...
讨论
FCP 脂质体具有天然脂质成分, 为研究其体外光谱特性提供了方便、简便、重现性的工具。FCP 脂质体的脂质环境类似于类囊膜内的情况, 导致实验结果更接近自然条件。
利用meneghiniana作为 FCP 天线的模型系统具有多种优点。它的生长相对较快, 比其他硅藻模型物种更健壮,例如海链藻 pseudonana。在珠磨中, 细胞断裂相对容易, 这使得完整的囊状体复合物的高产。...
披露声明
作者没有什么可透露的。
致谢
我们感谢阿迪尔. 艾哈迈德在 FCP 净化方面的帮助。克劳迪娅教授 Büchel 被公认为有帮助的讨论和阅读手稿。这项工作得到德国研究基金会 (DI1956-1/1) 和洪堡基金会 Feodor Lynen 奖学金的支持。
材料
| Name | Company | Catalog Number | Comments |
| 500 ml centrifuge vials | |||
| high speed centrifuge | Heraeus | ||
| Bead Mill VI 2 | Edmund-Bühler (edmund-buehler.de) | newer version: Vibrogen-Zellmühle Vl 6 | |
| Silibeads S 400 µm | Sigmund-Lindner.com | 5223-7 | |
| Silibeads S 1,-1,3 mm | Sigmund-Lindner.com | 4504 | |
| VitraPOR filter funnel - por1 | ROBU GmbH | 21121 | |
| polycarbonate ultracentrifuagtion vials (30 mL) for T-865 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 314348 | |
| Ultracentrifuge Discovery 90SE | Sorvall | n.a. | |
| rotor T 865 | ThermoFisher Scientific (thermofisher.com) | 51411 | |
| Neubauer Cell Counter Chamber (improved) | Carl Roth Laborbedarf (Carlroth.com) | T729.1 | |
| Zeiss Mikroskop Primostar (7) | Optik-Pro (optik-pro.de) | 51428 | |
| optical glass cuvettes (6040-OG) | Hellma Analytics (hellma-analytics.com) | "6040-10-10" | |
| V-630 UV-VIS Spectrophotometer (incl. software) | Jasco (jasco.de) | V-630 | |
| n-Dodecyl-β-D-Maltopyranoside | ANATRACE (anatrace.com) | D310LA | |
| Ultra-Clear tubes 17 ml for AH629 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 344061 | |
| rotor AH629-17-mL | ThermoFisher Scientific (thermofisher.com) | 54285 | |
| Membrane concentrator_Centriprep 30 kDa cutoff | Millipore (merckmillipore.com) | 4307 | |
| Biometra Minigel-Twin | Analytik Jena AG (analytik-jena.de) | 846-010-100 | |
| Silver Stain Plus Kit | Bio-Rad (bio-rad.com) | 1610449 | |
| libre office spread sheet | The document foundation | https://de.libreoffice.org/download/libreoffice-still/ | |
| special glass cuvettes for fluorescence (101-0S) | Hellma Analytics (hellma-analytics.com) | 101-10-20 | |
| Spectrofluorometer FP-6500 (incl. Software) | Jasco (jasco.de) | FP-6500 | |
| SDS-loading buffer Roti-Load | ROTH (carlroth.com) | K929.1 | |
| n-octyl β-D-glucopyranoside | ANATRACE (anatrace.com) | O311 | |
| Monogalactosyl Diaclyglycerol (MGDG) | Larodan AB (larodan.com) | 59-1300 | make stock solution in chloroform |
| Digalactosyl Diacylglycerol (DGDG) | Larodan AB (larodan.com) | 59-1310 | make stock solution in chloroform |
| Sulphoquinovosyl Diacylglycerol (SQDG) | Larodan AB (larodan.com) | 59-1230 | make stock solution in chloroform |
| L-alpha-Phosphatidylglycerol (PG) | Larodan AB (larodan.com) | 37-0150 | make stock solution in chloroform |
| L-α-Phosphatidylcholine | Sigma-Aldrich (sigmaaldrich.com) | P3782 SIGMA | make stock solution in chloroform |
| sonicator bath S-50TH | Sonicor (getmedonline.com | SONICOR-S-50TH | |
| mini-Extruder | Avanti Polar Lipids (Avanti.com) | 610000 | |
| Nuleopore polycarbonate membrane | Avanti Polar Lipids (Avanti.com) | 610005 | |
| dialysis membrane Visking 14 kDa cutoff | ROTH (carlroth.com) | 0653.1 | boil in destilled water before use |
| Biobeads SM2 Adsorbent | Biorad (Bio-rad.com) | 152-3920 | |
| sucrose epichlorhydrin copolymer - Ficoll 400 | Sigma-Aldrich (sigmaaldrich.com) | F4375 | |
| Polycarbonate ultracentrifuagtion vials (2.7 mL) for TFT 80.4 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 252150 | |
| rotor TFT 80.4 | Millipore (merckmillipore.com) | 54356 | |
| material listed in order of appearance | For specific safety instructions please refer to material safety sheets and repective manuals. Standard lab material and substances are not listed. |
参考文献
- Eberhard, S., Finazzi, G., Wollman, F. A. The Dynamics of Photosynthesis. Annual Review of Genetics. 42, 463-515 (2008).
- Li, Z. R., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and Responding to Excess Light. Annual Review of Plant Biology. 60, 239-260 (2009).
- Niyogi, K. K., Truong, T. B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology. 16 (3), 307-314 (2013).
- Li, X. -. P., et al. A pigment-binding protein essential for regulation of photosynthetic light harvesting. Nature. 403 (6768), 391-395 (2000).
- Peers, G., et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature. 462 (7272), 518-521 (2009).
- Correa-Galvis, V., et al. Photosystem II Subunit PsbS Is Involved in the Induction of LHCSR Protein-dependent Energy Dissipation in Chlamydomonas reinhardtii. The Journal of biological chemistry. 291 (33), 17478-17487 (2016).
- Bailleul, B., et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18214-18219 (2010).
- Taddei, L., et al. Multisignal control of expression of the LHCX protein family in the marine diatom Phaeodactylum tricornutum. Journal of experimental botany. 67 (13), 3939-3951 (2016).
- Lepetit, B., et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis. New Phytologist. 214 (1), 205-218 (2017).
- Büchel, C. Evolution and function of light harvesting proteins. Journal of Plant Physiology. 172, 62-75 (2015).
- Lavaud, J., Rousseau, B., van Gorkom, H. J., Etienne, A. -. L. Influence of the Diadinoxanthin Pool Size on Photoprotection in the Marine Planktonic Diatom Phaeodactylum tricornutum. Plant Physiology. 129 (3), 1398-1406 (2002).
- Ruban, A., et al. The super-excess energy dissipation in diatom algae: comparative analysis with higher plants. Photosynthesis Research. 82 (2), 165-175 (2004).
- Mann, D. G. The species concept in diatoms. Phycologia. 38 (6), 437-495 (1999).
- Papagiannakis, E., van Stokkum, I. H. M., Fey, H., Büchel, C., van Grondelle, R. Spectroscopic Characterization of the Excitation Energy Transfer in the Fucoxanthin-Chlorophyll Protein of Diatoms. Photosynthesis Research. 86 (1-2), 241-250 (2005).
- Premvardhan, L., Robert, B., Beer, A., Büchel, C. Pigment organization in fucoxanthin chlorophyll a/c2 proteins (FCP) based on resonance Raman spectroscgopy and sequence analysis. Biochimica et Biophysica Acta-Bioenergetics. 1797 (9), 1647-1656 (2010).
- Gildenhoff, N., Herz, J., Gundermann, K., Büchel, C., Wachtveitl, J. The excitation energy transfer in the trimeric fucoxanthin-chlorophyll protein from Cyclotella meneghiniana analyzed by polarized transient absorption spectroscopy. Chemical Physics. 373 (1), 104-109 (2010).
- Ramanan, C., et al. Exploring the mechanism(s) of energy dissipation in the light harvesting complex of the photosynthetic algae Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1837 (9), 1507-1513 (2014).
- Haferkamp, S., Kirchhoff, H. Significance of molecular crowding in grana membranes of higher plants for light harvesting by photosystem II. Photosynthesis Research. 95 (2-3), 129-134 (2008).
- Wahadoszamen, M., et al. Stark fluorescence spectroscopy reveals two emitting sites in the dissipative state of FCP antennas. Biochimica et Biophysica Acta-Bioenergetics. 1837 (1), 193-200 (2014).
- Zhou, F., et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids. Photosynthesis Research. 99 (3), 185-193 (2009).
- Moya, I., Silvestri, M., Vallon, O., Cinque, G., Bassi, R. Time-resolved fluorescence analysis of the photosystem II antenna proteins in detergent micelles and liposomes. Biochemistry. 40 (42), 12552-12561 (2001).
- Natali, A., et al. Light-harvesting Complexes (LHCs) Cluster Spontaneously in Membrane Environment Leading to Shortening of Their Excited State Lifetimes. Journal of Biological Chemistry. 291 (32), 16730-16739 (2016).
- Gundermann, K., Büchel, C. Factors determining the fluorescence yield of fucoxanthin-chlorophyll complexes (FCP) involved in non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1817 (7), 1044-1052 (2012).
- Ahmad, R. A., Dietzel, L. Relaxation of cellular K+ gradients by valinomycin induces diatoxanthin accumulation in Cyclotella meneghiniana cells and alters FCPa fluorescence yield in vitro. Physiologia Plantarum. , 171-180 (2017).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Archiv für Mikrobiologie. 25 (4), 392-428 (1957).
- Jeffrey, S., Humphrey, G. New spectrophotometry equations for determining chlorophyll a, chlorophyll b, chlorophyll c-1 and chlorophyll c-2 in higher plants, algae and natural phytoplankton. Biochemie und Physiologie der Pflanzen. 167, 191-194 (1975).
- Beer, A., Gundermann, K., Beckmann, J., Büchel, C. Subunit Composition and Pigmentation of Fucoxanthin−Chlorophyll Proteins in Diatoms: Evidence for a Subunit Involved in Diadinoxanthin and Diatoxanthin Binding. Biochemistry. 45 (43), 13046-13053 (2006).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry. 166 (2), 368-379 (1987).
- Büchel, C. Fucoxanthin-Chlorophyll Proteins in Diatoms: 18 and 19 kDa Subunits Assemble into Different Oligomeric States. Biochemistry. 42 (44), 13027-13034 (2003).
- Vieler, A., Wilhelm, C., Goss, R., Süß, R., Schiller, J. The lipid composition of the unicellular green alga Chlamydomonas reinhardtii and the diatom Cyclotella meneghiniana investigated by MALDI-TOF MS and TLC. Chemistry and Physics of Lipids. 150 (2), 143-155 (2007).
- Gundermann, K., Büchel, C. The fluorescence yield of the trimeric fucoxanthin-chlorophyll-protein FCPa in the diatom Cyclotella meneghiniana is dependent on the amount of bound diatoxanthin. Photosynthesis Research. 95 (2-3), 229-235 (2008).
- Miloslavina, Y., et al. Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1787 (10), 1189-1197 (2009).
- Grouneva, I., Jakob, T., Wilhelm, C., Goss, R. The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1787 (7), 929-938 (2009).
- Chukhutsina, V. U., Büchel, C., van Amerongen, H. Disentangling two non-photochemical quenching processes in Cyclotella meneghiniana by spectrally-resolved picosecond fluorescence at 77 K. Biochimica et Biophysica Acta-Bioenergetics. 1837 (6), 899-907 (2014).
- Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., Büchel, C. Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochimica Et Biophysica Acta-Bioenergetics. 1857 (9), 1373-1379 (2016).
- Darley, W. M. Biochemical composition. The biology of diatoms. 13, 198-223 (1977).
- Milsman, M. H. W., Schwendner, R. A., Weder, H. G. Preparation of large single bilayer liposomes by a fast and controlled dialysis. Biochimica Et Biophysica Acta. 512 (1), 147-155 (1978).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid-detergent-mixed micelles. Biochimica Et Biophysica Acta. 640 (1), 252-262 (1981).
- Verchere, A., Broutin, I., Picard, M. Photo-induced proton gradients for the in vitro investigation of bacterial efflux pumps. Scientific Reports. 2 (306), (2012).
- Chevallet, M., Luche, S., Rabilloud, T. Silver staining of proteins in polyacrylamide gels. Nature Protocols. 1 (4), 1852-1858 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。