JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
분리 및 통합 규조류 Cyclotella Meneghiniana Thylakoid 지질으로 리에서에서 광 수확 안테나
요약
여기, 선물이 fucoxanthin 엽록소 a/c 바인딩 단백질 (FCP) 규조류에서 격리 하 여 이온 구성 변경 시 여기 에너지 전달 연구를 자연 지질 작곡과 리로 그들을 통합 하는 프로토콜.
초록
식물, 조류와 규조류의 광합성 성능을 강력 하 게에 따라 다릅니다 빛 수확과 에너지의 신속 하 고 효율적인 규제 엽록체의 thylakoid 막에서 전송 프로세스. 규조류의 안테나를 수확 하는 빛, 이른바 fucoxanthin 엽록소 a/c 바인딩 단백질 (FCP), 빛 흡수를 위한 요구 되 고 광합성 반응에 효율적인 전송 센터 뿐만 아니라 과도 한 빛에서 사진 보호에 관해서는. 이 두 함수 사이의 스위치 연구의 오랜 문제 이다. 이러한 연구의 대부분을 실시 되었습니다 FCP와 세제 micelles에. 상호 작용 연구에 대 한 세제 제거 되었습니다, FCP 단지의 불특정 집계를 주도. 이 방법에서는, 유물과 순수 관련 데이터를 구분 하기 어렵다. 따라서, 만약 그들이 그들의 네이티브 지질 환경에 포함 된 단백질-단백질 상호 작용, 에너지 전송 및 기타 광 기능을 공부 하 여 FCP 및 단지 수확 다른 바인딩된 막 빛에 대 한 더 유용한 정보를 얻을 수 있습니다. 주요 장점은 리는 정의 된 크기와는 FCP 클러스터링의 범위 제어는 정의 된 지질/단백질 비율. 또한, vivo에서 수확 하는 빛을 조절 하는 pH와 이온 구성에서 변경 쉽게 시뮬레이션할 수 있습니다. Thylakoid 막에 비해는 리 있습니다 더 균일 하 고 덜 복잡 한 분 광 데이터 이해를 쉽게 하. 프로토콜의 FCP 격리 및 정화, liposome 준비, 그리고 천연 지질 성분과 리도 FCP의 설립 절차를 설명합니다. 일반적인 응용 프로그램에서 결과 주어진 고 설명.
서문
규조류 등 광합성 유기 체 조명 조건 변화에 대처 하 고 정교한 새 환경 순응 메커니즘을 높은 광합성 효율을 유지 하 고 과도 한 빛에 의해 발생 하는 사진 산화 손상에서 보호로 응답 해야 합니다. 광합성 진핵생물에서 주요 빛 보호 프로세스는 높은 에너지 냉각 (E)의 q 가벼운 스트레스 조건1,2 비 광화학 냉각 (NPQ)에 주요 기여로 발생 하는 빛을 흡수 ,3. 광 수확 안테나 복합물 (LHC) 여기 에너지 이동 통로의 규칙에서 포함 된다. 높은 빛에 대 한 응답에 낮은 pH 상태 냉각 상태를 수확 하는 빛에서 안테나 시스템 전환 엽록체 루멘에서 유도. 이 에너지 되는 낭비 적인 상태 photosystems (PS) 및 thylakoid 막에서 다른 단지 사진 산화에서 보호합니다. 광합성 진핵생물에서 qE 는 일반적으로 두 가지 요인1,,23에 의해 유발 됩니다. 한 요인은 낮은 pH에 반응 하는 단백질을 수확 하는 특수 빛 이다. PsbS 단백질 높은 식물4q전자 유도합니다. LhcSRs5, PsbS 활동에 의해 변조 녹색 조류6q전자 유도. 규조류는 LHCSRs7,8,,910와 구조적으로 관련 된 Lhcx 같은 단백질을가지고 있다.
QE 의 두 번째 요소는 안테나의 카로 티 노이 드 드 epoxidation에 의해 사진 보호 형식으로 변환 하 고 epoxidation에 의해 복귀 빠진 주기입니다. 식물과 녹 조류, violaxanthin 제 아 잔 틴으로 변환 됩니다. 규조류에 diadinoxanthin 다음 NPQ11의 범위와 상관 한다 diatoxanthin로 변환 됩니다. 안테나를 수확 하는 규조류 빛 비록 그것이 진화 식물 및 조류 LHCs와 관련 된 몇 가지 특성을 소유한 다. 사진 보호에 수확 하는 빛에서 스위치 엄청나게 빠른 이며 NPQ 용량 높은 식물12비교. 하나의 이유는 규조류 매우 성공적인 그들은 해양 순 주 생산13의 45%를 담당 하는 방식에서 다른 생태 틈새에서 수 있습니다. 따라서, 규조류 수확 시스템 빛은 광합성 연구의 흥미로운 개체입니다.
규조류, 중심 종 Cyclotella meneghiniana thylakoid 본질적인 빛 수확 하는 그들은 안료 후 명명 된 시스템을가지고 같은 바인딩-fucoxanthin, 엽록소 (chl) a와 c, 그러므로 FCP. 빛 수확 하는 단백질, FCPs, 등 몇몇 막 층으로 구성 된 thylakoid 막 시스템에 포함 된. 규조류는 3 thylakoids의 악대를 형성 한다. 이 복잡 한 상황 어려운 thylakoid 막에 있는 분자 수준에 그들을 공부 하. 또한, 많은 구성 요소 (위 참조)를 수확 하는 빛의 조절에 기여 한다. 따라서, 많은 접근에는 단지 n-라우릴-β-D-maltopyranoside (β-DDM), 막 solubilize 하지만 FCP 단지 그대로 유지 같은 가벼운 세제를 사용 하 여 막에서 분리 했다. 많은 분 광 연구 조사 intramolecular 에너지 전송14,15,,1617solubilized FCP를 사용 하 여 수행 했다. 그러나, 전 이렇게는 에너지 전송 규칙 다른 안테나 단지 또는 photosystems와 excitonic의 상호 작용을 필요로 하기 때문에 제한 되었다. 따라서, 이러한 종류의 연구 수 없습니다 실시 solubilized 단지와 단지 사이 상호 작용은 손실 때문에.
안테나 규칙에 있는 중요 한 기능 안테나와 thylakoid 막18에 photosystems의 "분자 크롤 링"입니다. 이 효과 시뮬레이션 하는 간단한 접근 방식을 실시 되었다 이전, 생체 외에서. 세제, 안테나 복합물의 임의의 집합에 이르게 제거 되었습니다. 합리적인 데이터가 접근17,19에 의해 얻은, 비록 세제 제거 vivo에서 상황을 반영 하지 않는 하 고는 단지 하지 그들의 일반 차에 상호 작용 하는 때문에 몇 가지 한계가 구조입니다.
리를 사용 하 여 여러 전 한계 극복. 3 차 구조는 여전히 완벽 하 게 그대로. Liposome 막 안테나 단지에 대 한 준 네이티브 환경을 제공합니다. 막 외부 환경에서 있는 liposome의 내부를 분리합니다. 이러한 방법으로 리 이온과 pH 기온 변화도의 또한 전송 프로세스에 관해서는 연구에 대 한 두 가지 반응 구획을 제공합니다. 또한, 실험 시스템의 매개 변수는 thylakoid 막에서 연구에 대 한 더 쉽게 제어할 수 있습니다. 리 이미 광합성 단지 공부 하는 훌륭한 도구를 보였다. 과거에 주요 초점 식물 LHC 변경 된 지질 구성의 효과 LHC II20에 테스트 되었습니다 했다. 다른 접근 방식에서 다른 LHC II 단백질-단백질 상호작용 조사21를 했다. 또한, 일부 연구 녹색 조류에 실행 되었다 LHC22사이 자발적인 클러스터링을 설명 하는. 수생 생태계에 대 한 규조류의 중요성을 고려 하면 상대적으로 적은 연구 규조류의 안테나 단지 수행 했다. 두 연구 조사 어디 표시 했다 전기 화학 기온 변화도24 FCP 안테나23 FCP의 응답성의 클러스터링 중심 Cyclotella meneghiniana 의 안테나 복합물. 따라서, 리 공부 규조류 안테나 및 그들의 상호 작용 및 거의 기본 조건에서 규정 하는 훌륭한 도구입니다. 리 지질 구성, liposome 크기, 단백질 밀도 많은 조건 이후 다목적 이며 주변 수성 단계를 제어할 수 있습니다. 또한, 메서드는 낮은 양의 샘플 필요합니다. 실험 시스템은 강력 하 고 매우 재현. 리의 서 산도 공부 가능 하며 안테나 복합물의 규칙에 있는 이온 기온 변화도 중요 한 요인.
여기, 우리 C. meneghiniana 에서 FCP 안테나 복합물의 격리와 자연 thylakoid 지질 성분과 리에 그들의 설립을 설명합니다. 또한, 우리 solubilized FCP의 분 광 특성에 대 한 모범 데이터를 제공 하 고 리에서 FCP와 그들을 비교. 메서드 요약 지식 및 Gundermann 및 Büchel 201223, 나탈리 외. 201622, 그리고 아마 드와 Dietzel 201724의 개선에서 얻은 표준된 프로토콜.

그림 1: 워크플로 도식 표현. (1) 세포 성장, 중단 및 자당 밀도 기울기;에 FCP 분리를 따르는 thylakoid 절연 설명 단락 1 참조 C. m. -Cyclotella meneghiniana 세포. 2와 octylglycoside (OG)와 지질 세제 micelles의 창조 (2) 자연 thylakoid 지질 혼합물 (MGDG, DGDG 및 SQDG)의 준비 절에서 설명합니다. 정의 된 지질-micelle 크기 정의 기 공 직경의 막을 사용 하 여 압출 함으로써 이루어집니다. FCP 및 지질 micelles 미리 정의 된 지질에서 통합: 단백질 비율과 OG 및 β-DDM 세제는 제거를 통해 제어 투 FCP proteoliposomes를 형성. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
프로토콜
참고: FCPs 등 광합성 단지는 빛과 열에 매우 취약 합니다. 항상 얼음에 및 아주 희미 한 불빛 아래에서 작동 합니다.
1입니다. 셀에서 FCP의 격리
-
C. meneghiniana 세포에서 Thylakoid 격리
- C. meneghiniana 각 ASP 매체23,25 및 50 백만 셀의 300 mL 가득 5 500 mL 플라스 크에 성장. 면 마 개와 함께 플라스 크를 연결 하 고 빛 16 h 120 rpm에서 통에 약 1 주일에 대 한 지 수 성장 단계 및 8 h 40 µmol photons/(m²s) 흰 빛에서 어두운 단계 15-18 ° C. 사이의 온도에 성장 하는 세포 수 셀 카운터 챔버와 1.5-2 백만 셀/mL 사이 휴대폰 번호 인지 확인 합니다.
- 고속 원심 분리기에 15 분 동안 500 mL 원심 분리기 튜브 (4 ° C)와 precooled로 터에서 4000 x g 에서 셀 원심 다시 pipetting으로 균질 버퍼 (HB, 표 1)의 12 mL에서 셀 펠 릿을 일시 중단 합니다.
- 단일 50ml 플라스틱 튜브에 정지를 전송. -80 ° C에서 샘플을 저장 하거나 1.1.3 단계를 진행 합니다.
- 전 멋진 비드 밀 및 장비. 유리 비드 혼합물으로 75% 비드 밀의 50 mL 비 커를 세포 현 탁 액 추가. 세포 파쇄, 최고 속도로 30 7 x 45의 펄스 사용 각 맥 박 사이 냉각의 s. 1.1.6 단계에서의 품질 검사에 대 한 방해 셀 20 µ L를 가져가 라.
- 그들은 분명히 표시 때까지 유리 구슬에는 HB를 붓는 의해 유리 필터 퍼 널 및 세척 방해 세포를 필터링 합니다. 여과 액으로 씻어 분수 풀입니다. 150 mL 보다 낮은 최종 볼륨을 유지.
- 140 x g 3 50 mL 플라스틱 튜브를 사용 하 여 작은 세포 파편을 15 분에 대 한 샘플 원심 신중 하 게 20 mL 폴 리카 보 네이트 ultracentrifugation 튜브에는 상쾌한 전송 및 삭제는 펠 릿.
- HB와 튜브를 작성 하 고 무게를 equilibrate 300000 x g 와 펠 렛의 thylakoid 막에 4 ° C에서 1 시간에 대 한 적합 한 회전자에 원심.
- 원심 분리 시간을 사용 하 여 1.1.3에 20 µ L 샘플 400 배 확대에 현미경에 의해 방해 셀의 비율을 확인. 엽록체를 무료 고 frustules (실리 카 포탄)를 포함 하는 엽록체 사이의 비율을 계산 합니다.
참고: 규조류 세포 벽 높게 현미경에서 물질을 diffracting로 표시 되는 실리 카의 만들어집니다. 엽록체를 녹색 점 발생 한다 발표 되었습니다 셀에서 셀 중단 했다면. - 다시 가능한 작은 세척 버퍼와 막 펠 릿을 일시 중단 (0.5-1 mL) 작은 페인 터의 브러시를 사용 하 여. 폴 리 카보 네이트 ultracentrifugation 튜브 버퍼 (표 1) 세척 하는 것을 채워, 그들의 무게와 200000 x g 와 4 ° C에서 20 분 동안 원심 분리기 equilibrate
- 다시는 페인 터의 브러시 세척된 막 일시 중단 합니다. 가능 한 한 높은 thylakoid 농도 유지 하는 데 필요한 경우에 세척 버퍼를 추가 합니다. 하나의 샘플 유리병 (15 mL)에 모든 thylakoids 풀.
- 미리 100% 아세톤의 90 µ L와 10 µ L의 샘플을 사용 하 여 샘플을 희석. 침전 된 단백질 pellet을 5 분 동안 12000 x g 에서 원심. predilution의 10 µ L 고 990 µ L 90% 아세톤의 혼합.
- 엽록소 a와 c 664에서의 흡 광도 (ABS) 측정 및 630 nm에서 90% 아세톤. ABS750nm 두 값에서 뺍니다. 다음 수식을 사용 하 여 총 엽록소 콘텐츠 결정:24
1)
2)
- 엽록소 a와 c 664에서의 흡 광도 (ABS) 측정 및 630 nm에서 90% 아세톤. ABS750nm 두 값에서 뺍니다. 다음 수식을 사용 하 여 총 엽록소 콘텐츠 결정:24
- 1.5 mL 반응 관에서 총 엽록소의 0.5 mg의 부분에서 aliquot thylakoids 액체 질소에서 그들을 멈추게 하 고 추가 사용까지-80 ° C에서 그들을 저장 합니다.
-
분리 및 FCP 복합물의 농도
- 자당 그라데이션 솔루션을 준비 하 고 ultracentrifuge 튜브 로딩 볼륨 (300-500 µ L) 마이너스 상단까지 작성. 그들은 완전히 고정 될 때까지-20 ° C에서 튜브를 고정 합니다. 튜브는 17 mL 튜브에 대 한 3-4 h + 4 ° C에서 녹여 수 있습니다.
- 두 번을 더 나은 해상도 대 한 그라데이션 수정 동결-해 동 주기를 반복 합니다.
- 1.1.9 엽록소의 0.5 밀리 그램에 해당에서 얻은 샘플을 사용 하 고 버퍼 B1 조정 (표 1) 2 mL의 최종 볼륨을. 가용 화, 20 m m의 최종 농도에 n-라우릴-β-D-maltopyranoside (b-DDM)를 추가 합니다.
- 반전 튜브 3 번 하 고 부드러운 거품을 피하기 위해 동요와 20 분 동안 얼음에 그것을 배치. 12000 x g + 4 ° c.에 미리 냉각된 테이블 상단 원심 분리기에서 5 분 동안 원심 분리기
- 그라데이션에 상쾌한을 로드 합니다. 17 mL 튜브 사용 하는 경우에 그라데이션 당 총 엽록소의 이상의 125 µ g를 로드 하지 마십시오. 22 h g 와 + 4 ° C x 100, 000에 대 한 원심 분리기
- 주사기 (그림 2A)를 사용 하 여 그라데이션에서 원하는 갈색 FCP 분수를 복구 합니다. 5 µ L aliquot 고 B1a의 995 µ L로 희석.
- UV-VI-분 광 광도 계에 370-750 nm 사이의 흡 광도 (ABS) 스펙트럼을 측정 합니다. 세미 마이크로 광학 유리 큐 벳을 사용 합니다.
- 스펙트럼 관리자 소프트웨어, 열고, 스펙트럼 모드에가 서 750 370에서 기준 기록 nm 다음 샘플 측정. 다음 설정을 사용 하 여: 스캔 속도, 200 nm/분; 데이터 피치, 0.5 nm; 응답, 중간입니다.
- micropipette와 복구 된 샘플의 볼륨을 측정 합니다. B1 버퍼 (표 1) 두번 복구 된 볼륨을 추가 하 여 FCP 복합물을 세척. 1000 x g 및 적어도 20의 ABS672nm 에 4 ° C에서 컷오프 30 kDa 막 집중 장치에 집중 한다.
참고: B-DDM 농도 micelle 농축 샘플 칸에 인해 상승 수 있습니다. 이 FCP 단지의 추가 가용 화 이어질 수 있습니다! 세제 사용 가능한 버퍼 B1 추가 단계를 세척 하는 경우 잔여 자당을 제거 하는 데 필요한 추가-가용 화를 하지 마십시오. - 20 µ L aliquot 컨트롤에 대 한 가져가 라. 액체 질소에는 샘플을 동결 충격과-80 ° c.에서 그들을 저장합니다
- 자당 그라데이션 솔루션을 준비 하 고 ultracentrifuge 튜브 로딩 볼륨 (300-500 µ L) 마이너스 상단까지 작성. 그들은 완전히 고정 될 때까지-20 ° C에서 튜브를 고정 합니다. 튜브는 17 mL 튜브에 대 한 3-4 h + 4 ° C에서 녹여 수 있습니다.

그림 2: FCP, 광 제어 및 순도 확인의 정화. (A) 하룻밤 원심 분리 후 자당 농도 기온 변화도의 전형적인 모습 FCPa 및 FCPb. pigm. 구성 된 FCP 수영장을 포함 하는 모든 갈색 밴드-언바운드 안료, PS-(파란 선) 전에 FCP의 photosystems (B) 흡 광도 스펙트럼 (오렌지-점선) 농도 30 kDa 컷오프와 원심 필터 장치를 사용 하 여 후 . 특히, 카로 티 노이 드 500-550 nm 사이 지역에서 낮은 흡 광도 착될 FCP에서 손실 경향이 있다. 그래프는 최대 ~ 670에서 엽록소 Qy 으로 정규화 nm. Chl c의 여기 (C) 엽록소 a 방출 스펙트럼 (465 nm) 기능 여기 에너지 전송 테스트. Chl chl c의 에너지 전송 하는 경우는, 방해 ~ 640에서 추가 형광 밴드 nm (chl c) 발생. 그래프는 최대 방출에 정규화 됩니다. (D) 여기 스펙트럼 기록 675 chl 에너지 전송 테스트 nm (chl 최대 형광)는 모든 안료 370 사이 흡수에서 nm와 600 nm. Chl에 에너지를 전송 하는 경우는 비효율적, 형광 항복 465와 550 nm 사이 특히 감소 것입니다. 그래프는 최대 약 440으로 정규화 nm. 스펙트럼 (b), (C)와 (D) 농도 잘 작동 하는 경우 거의 같습니다. (E) 28트리 스 tricine 젤 사용 하 여 격리 된 FCP의 순도를 확인 합니다. FCPa 및 FCPb 18-19 kDa 사이의 소 단위 있다. 모든 보이는 실버 스테인드 단백질 20 kDa 보다 큰은 오염 물질입니다. Thyl입니다. -Thylakoids 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
-
분 광 및 젤 기반 컨트롤
- 1.2.5 단계 후 B1a의 995 µ L에서 FCP의 5 µ L의 370-750 nm 사이의 흡 광도 기록 합니다. 1.2.4 단계에서 얻은 스펙트럼과 그것을 비교 합니다. 같은 계측 및 단계 1.2.4에서에서 설명한 대로 설정을 사용 합니다.
- *.Csv로 데이터를 내보내기 하 고 스프레드시트에 데이터를 가져옵니다. Chl 최대 두 스펙트럼을 정규화는 약 672의 Qy 밴드에 nm 그림 2B에서 같이.
- 0.03의 원하는 ABS672nm 에 의해 측정 된 ABS672nm 를 분할 하 여 단계 1.2.4와 1.3.1에서에서 샘플의 희석 비율을 계산 합니다. 그에 따라 샘플을 희석 B1a와 특별 한 유리 형광 큐 벳에 그들을 전송.
- Chl chl (그림 2C) chl c에서 그대로 빛 에너지 이전을 spectrofluorometer로 형광 방출 스펙트럼을 기록 합니다.
- 분석기 소프트웨어를 사용 하 고 다음 설정 사용 하 여 스펙트럼 측정 모드에가 서: 모드, 방출; 슬릿 폭 여기 및 방출, 3 nm; 감도, 중간; 스캔 속도, 100 nm/분; 데이터 피치, 0.5 nm; 여기 파장, 465 nm; 방출, 600-800 nm입니다. 오토 및 측정을 수행 합니다.
- 동일한 샘플 및 공개 chl 모든 안료에서 그대로 에너지 전송 장비와 여기 스펙트럼 (그림 2D) 기록 합니다. 설정을 변경: 모드, 여기; 방출 파장, 675 nm; 여기, 370-600 nm 스펙트럼을 기록 합니다.
- Rhodamine 스펙트럼 램프- cf의 스펙트럼 속성에 대 한 동일한 범위에 수정 합니다. 사용자 설명서에 지시입니다.
- 믹스 FCP 샘플 해당 chl의 1 µ g 하는 SDS 로딩 버퍼의 10 µ L로. 25 ° c.에서 10 분 동안 품 어 탁상용 원심 분리기에서 12000 x g에 5 분 동안 원심 분리기.
- 트리 스 tricine 젤28에 상쾌한 로드. 150 V에 2 시간에 대 한 별도 고 실버-분리40후 그것은 얼룩.
참고: FCP subunits FCPa 및 FCPb29 (그림 2E) 지역구는 18-19 kDa 사이의 두 저명한 단백질 대역으로 구분 합니다.
- 트리 스 tricine 젤28에 상쾌한 로드. 150 V에 2 시간에 대 한 별도 고 실버-분리40후 그것은 얼룩.
- 1.2.5 단계 후 B1a의 995 µ L에서 FCP의 5 µ L의 370-750 nm 사이의 흡 광도 기록 합니다. 1.2.4 단계에서 얻은 스펙트럼과 그것을 비교 합니다. 같은 계측 및 단계 1.2.4에서에서 설명한 대로 설정을 사용 합니다.
2. 리 및 FCP의 설립의 준비
-
지질 혼합 및 지질 세제 micelles 준비
참고: 지질 산화 조건와 결합 하는 온도 따뜻하게 받습니다. 냉장 및 N2 분위기에서 지질을 유지 하려고 합니다.- Vieler 외. 200730에 따르면 C. meneghiniana 에 대 한 원하는 thylakoid 지질 비율을 계산 합니다. Supplemental 표 1에 주어진 예제를 참조 하십시오. 지질 용 매 증거 컨테이너에서 제조업체에서 권장 하는 재고 솔루션을 준비 합니다.
- 원하는 양의 2 mL 반응 관에 지질 플라스틱 부드러운 질소 흐름을 사용 하 여 클로 프롬을 증발 고 지질 관 자료의 전체 영역에 걸쳐 하려고 합니다. 모든 용 매 증발 될 때까지 N2 흐름을 보자.
- 4 헤 품 30 ° c.에서 10 분 동안 지질 혼합 4 ° C에서 29 µ L n octyl β-D-glucopyranoside 솔루션 (OG)의 지질 혼합물을 solubilize 30에 의해 중단 하는 25 ° C에서 3 x 3 분 sonicator 목욕에 지질을 품 어 얼음에 s.
- Tricine 버퍼의 221 µ L 4 x 투 버퍼의 250 µ L를 추가 합니다.
- 0.1 µ m 폴 리 카보 네이트 멤브레인과는 압출 기를 사용 하 여 정의 된 liposome 직경 50-70 nm의에 대 한. 멤브레인 및 필터 지원으로 압출 조립. 공기 거품을 방지 하 고 어셈블리를 철저 하 게 조입니다.
- 4 x 투 버퍼 한 주사기와 없는 거품 두 번째 주사기에서 볼 수 있습니다 때까지 미리 압출 기를 젖은.
- 압출 기에 지질 세제 micelles을 적용 하 고 다른 한 주사기에서 솔루션 앞 누르고 다시. 솔루션 동종 나타날 때까지 5 번이이 단계를 반복 합니다.
참고: 이 솔루션은 4 ° C에서 며칠 동안 저장할 수 있습니다. 꼼짝 하지 마십시오!
-
FCP 단지 및 세제 및 집계의 제거의
참고: 우리는 지질/chl 12: 1의 비율을 사용 하 여이 예제에는 약 100: 1의 지질/단백질 비율에 해당 합니다.- FCP chl의 20 µ g 크거나 추가 500 µ L 250 μL 압출된 지질 micelles의 B1a 버퍼의 고 투 버퍼 x 4의 250 µ L의 총 볼륨에. 얼음에 30 s 일시 중지에 의해 중단 하는 1500-3000 rpm에서 thermomixer에 25 ° C에서 3 x 3 분 샘플을 품 어.
- 여전히 뚜껑에 맞는 반지를 주는 상단 바로 아래 4 개의 1.5 mL 반응 관의 뚜껑을 잘라. 투 석 막의 1.5 c m x 1.5 c m 조각 준비 및 1 x 투 버퍼의 20 mL에 그들을 씻어합니다
- 각 뚜껑을 샘플의 250 µ L을 입력 합니다. 구획 완전히 채워집니다 샘플 없음 기포 발생, 신중 하 게 뚜껑에 막을 하다. 닫힌 구획이 하려면 어셈블리에 반응 튜브 반지를 조입니다.
- 넘어지는 셰이 커에 얼음에 하룻밤 투 버퍼 x 1의 50 ml (12-16 h) 샘플을 dialyze. 신선한 것으로 사용 된 투 석 버퍼를 교체 하 고 적어도 6 h에 대 한 남은 세제를 제거 하려면 adsorbent 구슬의 7 mg을 추가 합니다.
- 다시 투 석 버퍼를 교체 하 고 dialyze 다른 12 헤 200 µ L micropipette 팁 투 석 막 피어 싱으로 리 복구에 대 한 반응 관 뚜껑에서 모든 리 발음.
- 선택적 단계: 경우 고 순도 (> 95%)이 필요. 투 석 버퍼에 6%, 10%, 15%와 20% 자당 epichlorhydrin 공중 합체를 포함 하는 단계 17 mL에 불연속 밀도 그라데이션 ultracentrifugation 튜브를 준비 합니다. 상단과 4 h 진동 물통 회전자에 대 한 100000 x g에서 ultracentrifuge에 리를 로드 합니다.
- 주사기와 위 갈색 밴드를 복구, DP와 샘플 1: 5을 희석 하 고 단계로 진행.
- 1 x 1.5 h g와 4 ° C x 100, 000에 대 한 투 석 버퍼의 최소 2 ml에서 FCP 리 원심 45 °의 각도에서 원심 분리기 관으로는 리를 복구 합니다. 1 분 (그림 3A) 이동 리를 허용 합니다.
- 25-50 µ L.의 최종 볼륨에서 FCP 리 침전을 방해 하지 않도록 복구할 수 있습니다.
-
컨트롤 1: 흡 광도, 형광 분광학
- 1 투 석 버퍼 및 12000 x g에 5 분 동안 원심 분리기의 1 mL 최종 볼륨 FCP-리의 3 µ L 약 수를 추가 합니다.
- 1.2.4에 설명 된 대로 동일한 장비와 FCP 리 370 및 750 nm 사이의 흡 광도 기록 합니다. Chl (670-680 nm)의 Qy 지역에서 최대 스펙트럼을 정상화 하 고 solubilized FCP (그림 3C)의 정규화 된 스펙트럼을 비교 합니다.
- 흡 광도 (ABS)와 DP의 1 mL에서 준비 하는 FCP 리 670-680 nm 사이 최대 기준 0.03 =. Diluting B1a와 같은 abs 단계 1.2.6에서에서 세제에서 solubilized FCP를 조정 합니다.
- 1.2.4에 설명 된 대로 두 샘플의 흡 광도 스펙트럼을 기록 합니다. 1.3.3에서 설명 된 대로 두 샘플의 형광 방출 스펙트럼 chl를 기록 합니다.
참고: FCP liposome 샘플 (그림 3D 및 cf. 토론.)에 형광 수확량 감소
- 1 투 석 버퍼 및 12000 x g에 5 분 동안 원심 분리기의 1 mL 최종 볼륨 FCP-리의 3 µ L 약 수를 추가 합니다.
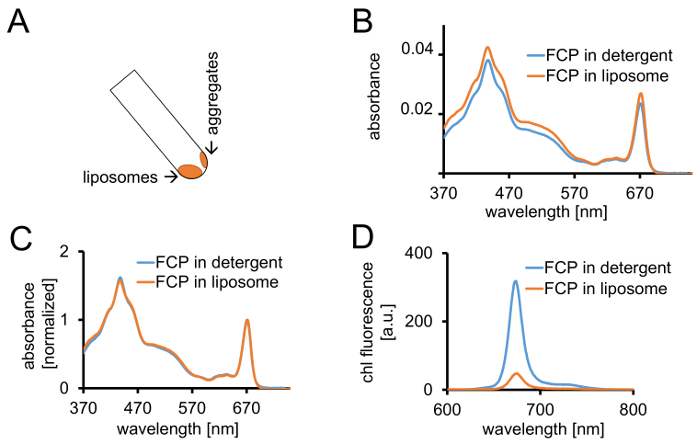
그림 3: 격리 FCP proteoliposomes의 뒤에 광 컨트롤과 confocal 영상. (A) 원심 분리 후 FCP 리의 복구. 45 °를 원심 분리 관을 돌려 약 1 분을 기다립니다-에 리는 FCP 집계는 리 스틱 튜브 벽에 통합 되지는 반면 아래로 이동 합니다. (B) 세제 (파란색)에서 solubilized FCP와 리 (오렌지)에서 FCP의 흡 광도 스펙트럼의 비교 (C) (B)와 같이 동일한 스펙트럼 정규화 chl 빨간 지역에서 최대 (~ 670 nm-Qy 피크); 세제 (파란색)에서 solubilized FCP와 리 (오렌지)에서 FCP. 잠재적으로, 될 수 있다 주로 카로 티 노이 드의 색소 손실 볼 수 500-550 nm 지역에서. FCP는 리에의 클러스터링 및 이어질 수 있습니다 피크 확대는 chl의 약간의 변화는 최대 (~ 670 nm)는 빨간색. (D) 세제에서 solubilized FCP와 liposome에서 FCP의 방출 스펙트럼. FCP는 liposome에서의 클러스터링 FCP 단지는 형광 수율 (오렌지색 곡선)을 절감 하 고 방출 맥시 마 약간 빨간색의 활기찬 상호 작용을 향상 시킵니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
결과
프로토콜에는 Cyclotella meneghiniana 에서 총 FCP 분수의 고립과 네이티브 지질 성분과 리를 설명합니다. Thylakoid 격리는 높은 재현 하지만 thylakoid 수율 변경 될 수 있습니다. 결과 모든 안료의 50% 이상 단계 1.1.4에에서 복구 하는 경우 허용 됩니다. 80% 이상이 최적입니다.
thylakoids의 가용 화는 중요 한 단계입니다. 잘 solubilized ?...
토론
천연 지질 성분과 FCP 리 광 속성을 조사 하 편리한, 간단 하 고 재현 가능한 도구를 제공 생체 외에서. FCP 리에서 지질 환경 자연 조건에 가까이 있는 실험 결과를 야 기한 thylakoid 막 내 상황을 유사 합니다.
C. meneghiniana 를 사용 하 여 FCP 안테나를 모델 시스템으로 서의 몇 가지 이점이 있다. 그것은 비교적 빨리 성장 하 고 다른 규조류 모델 종, 예를 들어, Thalassi...
공개
저자는 공개 없다.
감사의 말
우리는 FCP 정화에 모이 라 Adeel 아마 드 감사합니다. 교수 클 Büchel 유용한 토론에 대 한 인정은 원고를 읽고. 이 작품은 LD (DI1956-1/1)에 독일 연구 재단 및 LD. Feodor Lynen 친교의 훔볼트 재단에 의해 지원 되었다
자료
| Name | Company | Catalog Number | Comments |
| 500 ml centrifuge vials | |||
| high speed centrifuge | Heraeus | ||
| Bead Mill VI 2 | Edmund-Bühler (edmund-buehler.de) | newer version: Vibrogen-Zellmühle Vl 6 | |
| Silibeads S 400 µm | Sigmund-Lindner.com | 5223-7 | |
| Silibeads S 1,-1,3 mm | Sigmund-Lindner.com | 4504 | |
| VitraPOR filter funnel - por1 | ROBU GmbH | 21121 | |
| polycarbonate ultracentrifuagtion vials (30 mL) for T-865 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 314348 | |
| Ultracentrifuge Discovery 90SE | Sorvall | n.a. | |
| rotor T 865 | ThermoFisher Scientific (thermofisher.com) | 51411 | |
| Neubauer Cell Counter Chamber (improved) | Carl Roth Laborbedarf (Carlroth.com) | T729.1 | |
| Zeiss Mikroskop Primostar (7) | Optik-Pro (optik-pro.de) | 51428 | |
| optical glass cuvettes (6040-OG) | Hellma Analytics (hellma-analytics.com) | "6040-10-10" | |
| V-630 UV-VIS Spectrophotometer (incl. software) | Jasco (jasco.de) | V-630 | |
| n-Dodecyl-β-D-Maltopyranoside | ANATRACE (anatrace.com) | D310LA | |
| Ultra-Clear tubes 17 ml for AH629 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 344061 | |
| rotor AH629-17-mL | ThermoFisher Scientific (thermofisher.com) | 54285 | |
| Membrane concentrator_Centriprep 30 kDa cutoff | Millipore (merckmillipore.com) | 4307 | |
| Biometra Minigel-Twin | Analytik Jena AG (analytik-jena.de) | 846-010-100 | |
| Silver Stain Plus Kit | Bio-Rad (bio-rad.com) | 1610449 | |
| libre office spread sheet | The document foundation | https://de.libreoffice.org/download/libreoffice-still/ | |
| special glass cuvettes for fluorescence (101-0S) | Hellma Analytics (hellma-analytics.com) | 101-10-20 | |
| Spectrofluorometer FP-6500 (incl. Software) | Jasco (jasco.de) | FP-6500 | |
| SDS-loading buffer Roti-Load | ROTH (carlroth.com) | K929.1 | |
| n-octyl β-D-glucopyranoside | ANATRACE (anatrace.com) | O311 | |
| Monogalactosyl Diaclyglycerol (MGDG) | Larodan AB (larodan.com) | 59-1300 | make stock solution in chloroform |
| Digalactosyl Diacylglycerol (DGDG) | Larodan AB (larodan.com) | 59-1310 | make stock solution in chloroform |
| Sulphoquinovosyl Diacylglycerol (SQDG) | Larodan AB (larodan.com) | 59-1230 | make stock solution in chloroform |
| L-alpha-Phosphatidylglycerol (PG) | Larodan AB (larodan.com) | 37-0150 | make stock solution in chloroform |
| L-α-Phosphatidylcholine | Sigma-Aldrich (sigmaaldrich.com) | P3782 SIGMA | make stock solution in chloroform |
| sonicator bath S-50TH | Sonicor (getmedonline.com | SONICOR-S-50TH | |
| mini-Extruder | Avanti Polar Lipids (Avanti.com) | 610000 | |
| Nuleopore polycarbonate membrane | Avanti Polar Lipids (Avanti.com) | 610005 | |
| dialysis membrane Visking 14 kDa cutoff | ROTH (carlroth.com) | 0653.1 | boil in destilled water before use |
| Biobeads SM2 Adsorbent | Biorad (Bio-rad.com) | 152-3920 | |
| sucrose epichlorhydrin copolymer - Ficoll 400 | Sigma-Aldrich (sigmaaldrich.com) | F4375 | |
| Polycarbonate ultracentrifuagtion vials (2.7 mL) for TFT 80.4 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 252150 | |
| rotor TFT 80.4 | Millipore (merckmillipore.com) | 54356 | |
| material listed in order of appearance | For specific safety instructions please refer to material safety sheets and repective manuals. Standard lab material and substances are not listed. |
참고문헌
- Eberhard, S., Finazzi, G., Wollman, F. A. The Dynamics of Photosynthesis. Annual Review of Genetics. 42, 463-515 (2008).
- Li, Z. R., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and Responding to Excess Light. Annual Review of Plant Biology. 60, 239-260 (2009).
- Niyogi, K. K., Truong, T. B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology. 16 (3), 307-314 (2013).
- Li, X. -. P., et al. A pigment-binding protein essential for regulation of photosynthetic light harvesting. Nature. 403 (6768), 391-395 (2000).
- Peers, G., et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature. 462 (7272), 518-521 (2009).
- Correa-Galvis, V., et al. Photosystem II Subunit PsbS Is Involved in the Induction of LHCSR Protein-dependent Energy Dissipation in Chlamydomonas reinhardtii. The Journal of biological chemistry. 291 (33), 17478-17487 (2016).
- Bailleul, B., et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18214-18219 (2010).
- Taddei, L., et al. Multisignal control of expression of the LHCX protein family in the marine diatom Phaeodactylum tricornutum. Journal of experimental botany. 67 (13), 3939-3951 (2016).
- Lepetit, B., et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis. New Phytologist. 214 (1), 205-218 (2017).
- Büchel, C. Evolution and function of light harvesting proteins. Journal of Plant Physiology. 172, 62-75 (2015).
- Lavaud, J., Rousseau, B., van Gorkom, H. J., Etienne, A. -. L. Influence of the Diadinoxanthin Pool Size on Photoprotection in the Marine Planktonic Diatom Phaeodactylum tricornutum. Plant Physiology. 129 (3), 1398-1406 (2002).
- Ruban, A., et al. The super-excess energy dissipation in diatom algae: comparative analysis with higher plants. Photosynthesis Research. 82 (2), 165-175 (2004).
- Mann, D. G. The species concept in diatoms. Phycologia. 38 (6), 437-495 (1999).
- Papagiannakis, E., van Stokkum, I. H. M., Fey, H., Büchel, C., van Grondelle, R. Spectroscopic Characterization of the Excitation Energy Transfer in the Fucoxanthin-Chlorophyll Protein of Diatoms. Photosynthesis Research. 86 (1-2), 241-250 (2005).
- Premvardhan, L., Robert, B., Beer, A., Büchel, C. Pigment organization in fucoxanthin chlorophyll a/c2 proteins (FCP) based on resonance Raman spectroscgopy and sequence analysis. Biochimica et Biophysica Acta-Bioenergetics. 1797 (9), 1647-1656 (2010).
- Gildenhoff, N., Herz, J., Gundermann, K., Büchel, C., Wachtveitl, J. The excitation energy transfer in the trimeric fucoxanthin-chlorophyll protein from Cyclotella meneghiniana analyzed by polarized transient absorption spectroscopy. Chemical Physics. 373 (1), 104-109 (2010).
- Ramanan, C., et al. Exploring the mechanism(s) of energy dissipation in the light harvesting complex of the photosynthetic algae Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1837 (9), 1507-1513 (2014).
- Haferkamp, S., Kirchhoff, H. Significance of molecular crowding in grana membranes of higher plants for light harvesting by photosystem II. Photosynthesis Research. 95 (2-3), 129-134 (2008).
- Wahadoszamen, M., et al. Stark fluorescence spectroscopy reveals two emitting sites in the dissipative state of FCP antennas. Biochimica et Biophysica Acta-Bioenergetics. 1837 (1), 193-200 (2014).
- Zhou, F., et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids. Photosynthesis Research. 99 (3), 185-193 (2009).
- Moya, I., Silvestri, M., Vallon, O., Cinque, G., Bassi, R. Time-resolved fluorescence analysis of the photosystem II antenna proteins in detergent micelles and liposomes. Biochemistry. 40 (42), 12552-12561 (2001).
- Natali, A., et al. Light-harvesting Complexes (LHCs) Cluster Spontaneously in Membrane Environment Leading to Shortening of Their Excited State Lifetimes. Journal of Biological Chemistry. 291 (32), 16730-16739 (2016).
- Gundermann, K., Büchel, C. Factors determining the fluorescence yield of fucoxanthin-chlorophyll complexes (FCP) involved in non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1817 (7), 1044-1052 (2012).
- Ahmad, R. A., Dietzel, L. Relaxation of cellular K+ gradients by valinomycin induces diatoxanthin accumulation in Cyclotella meneghiniana cells and alters FCPa fluorescence yield in vitro. Physiologia Plantarum. , 171-180 (2017).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Archiv für Mikrobiologie. 25 (4), 392-428 (1957).
- Jeffrey, S., Humphrey, G. New spectrophotometry equations for determining chlorophyll a, chlorophyll b, chlorophyll c-1 and chlorophyll c-2 in higher plants, algae and natural phytoplankton. Biochemie und Physiologie der Pflanzen. 167, 191-194 (1975).
- Beer, A., Gundermann, K., Beckmann, J., Büchel, C. Subunit Composition and Pigmentation of Fucoxanthin−Chlorophyll Proteins in Diatoms: Evidence for a Subunit Involved in Diadinoxanthin and Diatoxanthin Binding. Biochemistry. 45 (43), 13046-13053 (2006).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry. 166 (2), 368-379 (1987).
- Büchel, C. Fucoxanthin-Chlorophyll Proteins in Diatoms: 18 and 19 kDa Subunits Assemble into Different Oligomeric States. Biochemistry. 42 (44), 13027-13034 (2003).
- Vieler, A., Wilhelm, C., Goss, R., Süß, R., Schiller, J. The lipid composition of the unicellular green alga Chlamydomonas reinhardtii and the diatom Cyclotella meneghiniana investigated by MALDI-TOF MS and TLC. Chemistry and Physics of Lipids. 150 (2), 143-155 (2007).
- Gundermann, K., Büchel, C. The fluorescence yield of the trimeric fucoxanthin-chlorophyll-protein FCPa in the diatom Cyclotella meneghiniana is dependent on the amount of bound diatoxanthin. Photosynthesis Research. 95 (2-3), 229-235 (2008).
- Miloslavina, Y., et al. Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1787 (10), 1189-1197 (2009).
- Grouneva, I., Jakob, T., Wilhelm, C., Goss, R. The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1787 (7), 929-938 (2009).
- Chukhutsina, V. U., Büchel, C., van Amerongen, H. Disentangling two non-photochemical quenching processes in Cyclotella meneghiniana by spectrally-resolved picosecond fluorescence at 77 K. Biochimica et Biophysica Acta-Bioenergetics. 1837 (6), 899-907 (2014).
- Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., Büchel, C. Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochimica Et Biophysica Acta-Bioenergetics. 1857 (9), 1373-1379 (2016).
- Darley, W. M. Biochemical composition. The biology of diatoms. 13, 198-223 (1977).
- Milsman, M. H. W., Schwendner, R. A., Weder, H. G. Preparation of large single bilayer liposomes by a fast and controlled dialysis. Biochimica Et Biophysica Acta. 512 (1), 147-155 (1978).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid-detergent-mixed micelles. Biochimica Et Biophysica Acta. 640 (1), 252-262 (1981).
- Verchere, A., Broutin, I., Picard, M. Photo-induced proton gradients for the in vitro investigation of bacterial efflux pumps. Scientific Reports. 2 (306), (2012).
- Chevallet, M., Luche, S., Rabilloud, T. Silver staining of proteins in polyacrylamide gels. Nature Protocols. 1 (4), 1852-1858 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유