A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד, שילוב אנטנות קציר-אור של צורניות Cyclotella Meneghiniana בתוך ליפוזומים עם שומנים תילקואיד
In This Article
Summary
כאן, אנו מציגים פרוטוקול לבודד fucoxanthin כלורופיל a/c מחייב חלבונים (FCP) מ- diatoms ועד לשלב אותם בתוך ליפוזומים עם יצירות השומנים טבעית ללמוד עירור העברת אנרגיה על שינויים בהרכב יון.
Abstract
הביצועים פוטוסינתטיים של צמחים, אצות, diatoms בחוזקה תלוי התקנה מהירה ויעילה של אור קציר, אנרגיה בתהליכי העברה קרום תילקואיד של מהכלורופלסט. האור קציר האנטנה של diatoms, שנקרא fucoxanthin כלורופיל a/c איגוד החלבונים (FCP), נדרשים עבור בליעת אור ומרכזי יעיל להעברת התגובה פוטוסינתטיים גם לגבי צילום-הגנה מפני אור מוגזמת. הבורר בין שתי פונקציות הוא עניין ארוכת שנים של מחקר. רבים מהמחקרים הללו בוצעו עם FCP ב הקזאין דטרגנט. ללימודים אינטראקציה, דטרגנטים הוסרו, מה שהוביל את מצבור לא ספציפי של מתחמי FCP. בגישה זו, קשה יותר להפלות בין חפצים נתונים רלוונטיים מבחינה פיזיולוגית. לפיכך, ניתן לקבל מידע בעל ערך רב יותר אודות FCP ואור ממברנה מאוגד אחרים קציר מתחמי על ידי לימוד אינטראקציות חלבון-חלבון, העברת אנרגיה ותכונות ספקטרוסקופיות אחרים אם הם מוטבעים בסביבתם השומנים מקורית. היתרון העיקרי הוא שיש ליפוזומים בגודל מוגדר, יחס של ליפיד/חלבונים מאת אשר נשלטת היקף FCP קיבוץ באשכולות. עוד יותר, שינויים בהרכב pH ויון המסדירים אור קציר ויוו יכול בקלות להיות מדומה. בהשוואה ממברנה תילקואיד, ליפוזומים הם הומוגני יותר ומורכב פחות, מה שהופך אותו קל יותר להשיג ולהבין נתונים ספקטרוסקופיות. הפרוטוקול מתאר את ההליך של בידוד FCP, טיהור, הכנה ליפוזום תיאגוד FCP לתוך ליפוזומים להרכב השומנים הטבעיים. היא תוצאה של יישום אופייני הם נתנו ודן.
Introduction
אורגניזמים פוטוסינתטיים כגון diatoms חייב להתמודד עם המשתנה לתנאי תאורה ולהגיב עם מנגנונים מתוחכמים להתאקלמות יעילות גבוהה פוטוסינתטיים ומפלגות להגן מפני נזק חמצוני-צילום הנגרמת על ידי האור מוגזמת. תהליך אור-מגן הגדולות ב פרוקריוטים פוטוסינתטיים הוא אנרגיה גבוהה quenching (qE) האור נספג המתרחשת כמו התרומה העיקרית-פוטו אטמוספרי quenching (NPQ) תחת מתח אור תנאים1,2 ,3. האור האיסוף מתחמי אנטנות (LHC) מעורבים בוויסות עירור אנרגיה העברת מסלולים. בתגובה אור גבוהה המושרה נמוך- pH של לומן כלורופלסט, מתגי מערכת אנטנה מן האור קציר למדינה המדינה quenching. מדינה dissipative אנרגיה מגן photosystems (PS) ואת שאר מכלולי ממברנה תילקואיד צילום-חמצון. ב פוטוסינתטיים פרוקריוטים, ה-qE בדרך כלל הנגרמת על ידי שני גורמים1,2,3. גורם אחד הוא האור מיוחדים קציר חלבון המגיב ה- pHנמוך. החלבון PsbS מעוררת את קיוE צמחים גבוהים יותר4. LhcSRs5, מווסת על ידי פעילות PsbS, זירוז שE אצות6. Diatoms בעלי חלבונים כמו Lhcx אשר לארגונם הקשורים LHCSRs7,8,9,10.
הגורם השני של קיוE הוא מחזור xanthophyll בהם קרוטנואידים של האנטנה המרה לצורה צילום-מגן על ידי דה-epoxidation, חזר על-ידי epoxidation. צמחים, אצות, violaxanthin מומר וזאקסנטין. ב- diatoms, diadinoxanthin מומר diatoxanthin, אשר לאחר מכן עולה בקנה אחד עם מידת NPQ11. האור צורניות קציר אנטנה בעלת כמה מוזרויות למרות שזה אבולוציונית הקשורים LHCs בשאריות אצות וצמחים. מתג האור קציר להגנה-צילום מהיר מאוד, הקיבולת NPQ גבוה יותר לעומת צמחים12. זו יכולה להיות סיבה אחת למה diatoms מצליחים מאוד בתוך נישות אקולוגיות שונות כך הם אחראים עד 45% של אושיאניק הייצור הראשוני נטו13. לכן, צורניות אור קציר מערכות הן אובייקט מעניין של מחקר פוטוסינתזה.
Diatoms, כאילו המין ממוקדת Cyclotella meneghiniana, בעלי אור פנימי תילקואיד קציר מערכות קרוי הפיגמנטים הם לאגד - fucoxanthin, כלורופיל (קלוא) ו- c, ולכן האור FCP. קציר חלבונים, כגון FCPs, הם מוטבע במערכת ממברנה תילקואיד המורכבת ממספר שכבות קרום. Diatoms יוצרים להקות של שלושה thylakoids. מתחם זה המצב מקשה ללמוד אותן ברמה המולקולרית בתוך הקרומית תילקואיד. בנוסף, רכיבים רבים לתרום ברגולציה של אור קציר (ראה לעיל). לכן, בגישות רבות, מתחמי הם בודדו אותנו מהמתרחש קרום באמצעות דטרגנטים קלים, כגון n-Dodecyl-β-D-maltopyranoside (β-DDM), אשר solubilize את הקרום אבל לשמור את מתחמי FCP ללא שינוי. מחקרים רבים ספקטרוסקופיות בוצעו באמצעות solubilized FCP לחקור את התפלגות האנרגיה העברת14,15,16,17. עם זאת, גישה זו לשעבר הייתה מוגבלת מאחר ברגולציה של העברת האנרגיה צריך excitonic אינטראקציה עם מתחמי אנטנות או photosystems אחרים. לפיכך, אלו סוגים של מחקרים לא יכול להתבצע עם מתחמי solubilized כי האינטראקציה בין מתחמי אובד.
תכונה חשובה בתקנה האנטנה הוא "מולקולרי הצפיפות" של האנטנה, photosystems קרום תילקואיד18. . לשעבר, בגישה פשוטה בוצע כדי לדמות את האפקט הזה במבחנה. ? הנוזל הוסר, מה שמוביל צבירה אקראי של מתחמי אנטנות. למרות שחלק מהנתונים סביר היה מתקבל על ידי17,זו הגישה19, הסרת דטרגנט אינו משקף את המצב ויוו , יש כמה מגבלות מאז מתחמי לא אינטראקציה בעוד השלישון הרגיל שלהם מבנה.
השימוש ליפוזומים מתגבר על כמה מן המגבלות לשעבר. מבנה שלישוני הוא עדיין מלא ללא פגע. קרום ליפוזום מספק סביבה ומעין מקורית מתחמי אנטנות. הקרום מפריד את החלק הפנימי של ליפוזום מהסביבה שבחוץ. באמצעים אלה, ליפוזומים מספקים שני תאים התגובה ללימודים של יון ו- pH מעברי צבע כמו גם לגבי תחבורה תהליכים. עוד יותר, הפרמטרים של המערכת ניסיוני יכול להיות נשלט בקלות רבה יותר ללימודי תילקואיד ממברנה. ליפוזומים הוצגו כבר להיות כלי מצוין ללמוד מתחמי פוטוסינתטיים. מוקד מרכזי בעבר היה על צמח LHC שבו ההשפעה של הרכב השומנים שינו נבחנה ב- LHC II20. גישות אחרות, אינטראקציית חלבון בין II LHC שונים היו ובדוקים21. כמו כן, מחקרים באצות בוצעו המתארים קיבוץ באשכולות ספונטני בין LHC22. בהתחשב החשיבות של diatoms עבור המערכת האקולוגית הימית, בוצעו מחקרים מעטים יחסית עם מתחמי אנטנות של diatoms. שני מחקרים חקרו את מתחמי אנטנות של ממוקדת Cyclotella meneghiniana, איפה קיבוץ באשכולות של האנטנה FCP23 ואת ההיענות של FCP-מעברי צבע אלקטרוכימי24 הוצגו. לפיכך, ליפוזומים הינם כלי מצוין ללמוד צורניות אנטנות, שלהם אינטראקציה, תקנה בתנאים כמעט מקורי. ליפוזומים רב-תכליתי מאז תנאים רבים כמו הרכב השומנים, גודל ליפוזום, חלבון צפיפות, יכול להיות נשלט השלב מימית שמסביב. יתר על כן, השיטה דורשת כמויות נמוכות של דגימות. מערכת ניסיונית היא מאוד לשחזור ועמיד. מידור של ליפוזומים מאפשר ללמוד pH, יון מעברי צבע, אשר חשובים גורמים ברגולציה של מתחמי אנטנות.
כאן נתאר את ניתוקה של מתחמי אנטנות FCP מ ג meneghiniana ואת ההתאגדות שלהם בתוך ליפוזומים להרכב השומנים תילקואיד טבעי. בנוסף, אנחנו מספקים נתונים למופת ספקטרוסקופיות פלואורסנציה solubilized FCP ולהשוות אותם עם FCP בליפוזומים. השיטה מסכמת ידע ופרוטוקולים סטנדרטיים המתקבל השיפורים של Gundermann ו- Büchel 201223, נטלי ואח 201622אחמד ו-2017 Dietzel24.

איור 1: ייצוג סכמטי של זרימת העבודה. (1) מתייחס פסקה 1 המתאר צמיחת תאים, הפרעה ובידוד תילקואיד עם בעקבות ההפרדה FCP סוכרוז צפיפות מעברי צבע; מ ג -תאיםCyclotella meneghiniana . (2) הכנת התערובת השומנים תילקואיד טבעי (MGDG, DGDG ו- SQDG) שמתואר בפיסקה 2 ויצירת השומנים-דטרגנט הקזאין עם octylglycoside (OG). גודל מוגדר השומנים-מיצלה מושגת על ידי ההבלטה באמצעות ממברנות של קוטר נקבובית מוגדרים. FCP ואת השומנים-הקזאין האחידה-ליפופרוטאין מוגדרות מראש: יחס חלבון ודטרגנטים ו β-DDM הם מוסרים דרך מבוקר דיאליזה ויוצרים FCP proteoliposomes. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Protocol
הערה: מתחמי פוטוסינתטיים כגון FCPs פגיעים מאוד אור וחום. תמיד עובד על הקרח, תחת אור עמום.
1. בידוד של FCP מתאי
-
תילקואיד בידוד מתאי meneghiniana ג
- לגדול meneghiniana ג ב. חמש מבחנות 500 מ"ל שכל מלא 300 מ של ASP-בינוני23,25 ו- 50 מיליון תאים. לחבר את צלוחיות עם פקק כותנה ולאפשר לתאים לגדול את שלב הגידול המעריכי למשך שבוע על מטרף-120 סל ד עם אור ה 16 ו 8 שעות שלב כהה באור photons/(m²s) לבן 40 µmol טמפרטורה בין 15-18 מעלות צלזיוס. בדוק כי המספר הסלולרי הוא בין 1.5-2 מיליון תאים למ"ל עם תא מונה התא.
- Centrifuge התאים ב- x 4,000 g ברוטור precooled עם צלוחיות צנטריפוגה 500 מ ל (4 מעלות צלזיוס) למשך 15 דקות צנטריפוגה במהירות גבוהה. מחדש להשעות את כדורי תא ב 12 מ של מאגר המגון (על בסיס חצי פנסיון, טבלה 1) על ידי pipetting.
- להעביר את המתלים צינור פלסטיק 50 מל יחיד. או להמשיך לצעוד 1.1.3 הדגימות ב-80 מעלות צלזיוס.
- מראש מגניב את הטחנה חרוז וציוד. ולמלא את הספל 50 מ של הטחנה חרוז ל- 75% בתערובת חרוז זכוכית ולהוסיף התליה תא. עבור לשבירת תאים, השתמש 7 x 45 s פולסים במהירות מלאה עם 30 s קירור בין לכל פעימה. . קח 20 µL של תאים שיבשו לבדיקות איכות בשלב 1.1.6
- לסנן את התאים שיבשו משפך מסנן זכוכית ועל שטיפת לפי השוטף של HB את חרוזי זכוכית עד שהם יופיעו ברורה. בריכה השבר לשטוף עם פילטרט. שמור את עוצמת הקול הסופי נמוך מ 150 מ.
- Centrifuge המדגם למשך 15 דקות ב x 140 גרם באמצעות שלושה צינורות פלסטיק 50 מל גלולה את שאריות תאים. בזהירות להעביר את תגובת שיקוע 20 מ"ל פוליקרבונט ultracentrifugation בקבוקונים וזורקים בגדר.
- למלא את הבקבוקונים HB equilibrate המשקל, צנטריפוגה ברוטור מתאימים עבור 1 h ב- 300,000- g ו- 4 ° C עד הצניפה בקרום תילקואיד.
- לנצל את הזמן צנטריפוגה כדי לבדוק את הפרופורציה של תאים שיבשו מיקרוסקופית בהגדלה X 400 עם הדגימה µL 20 ב 1.1.3. לחשב את היחס בין כלורופלסט חינם כלורופלסט המכילים frustules (פגזים סיליקה).
הערה: קירות התא צורניות עשויים סיליקה, המופיעה גם מאוד diffracting חומר במיקרוסקופ. מהכלורופלסט המתרחשים ירוק כמו נקודות כדאי פורסמו מתאי אם השיבוש תא עבד. - מחדש להשעות בגדר קרום עם כמו מאגר כביסה קטנה ככל האפשר (0.5-1 מ ל) באמצעות המברשת של צייר קטן. למלא את הבקבוקונים ultracentrifugation פוליקרבונט שטיפה מאגר (טבלה 1), equilibrate שלהם משקל, צנטריפוגה במשך 20 דקות ב- 200,000 x g ו- 4 מעלות צלזיוס.
- מחדש להשעות את הקרומים שטוף עם המברשת של צייר. להוסיף מאגר כביסה רק אם צריכים להשאיר את הריכוז תילקואיד גבוה ככל האפשר. בריכת thylakoids כל בתוך המבחנה דוגמא אחת (15 מ"ל).
- מראש לדלל את הדגימות באמצעות 10 µL מדגם µL 90 של אצטון 100%. Centrifuge זה ב x 12,000 g עבור 5 דקות כדי הצניפה זירז חלבון. לקחת 10 µL של predilution ומערבבים אותו עם 990 µL של 90% אצטון.
- למדוד את ספיגת (ABS) של כלורופיל a ו- c-664 nm ו 630 ננומטר ב- 90% אצטון. להחסיר את שרירי הבטן750nm בין שני הערכים. לקבוע את תוכן הכולל כלורופיל באמצעות הנוסחה הבאה:24
1)
2)
- למדוד את ספיגת (ABS) של כלורופיל a ו- c-664 nm ו 630 ננומטר ב- 90% אצטון. להחסיר את שרירי הבטן750nm בין שני הערכים. לקבוע את תוכן הכולל כלורופיל באמצעות הנוסחה הבאה:24
- Thylakoids aliquot בחלקים של 0.5 מ ג של כלורופיל הכולל צינורות התגובה 1.5 mL, להקפיא אותם בחנקן נוזלי ואחסן אותם ב- 80 ° C עד שימוש נוסף.
-
ההפרדה וריכוז של מתחמי FCP
- להכין פתרון הדרגתי סוכרוז ולמלא את הצינורות ultracentrifuge עד העליון פחות טעינת אמצעי האחסון (300 – 500 µL). להקפיא את הצינורות ב-20 ° C עד קפואים לחלוטין. לאפשר הצינורות להפשיר ב +4 ° C, אשר לוקח 3-4 h עבור צינור 17 מ.
- חזור על מחזור ההקפאה-הפשרה פעמיים כדי לחדד את מעבר הצבע עבור רזולוציה טובה יותר.
- השתמש הדגימות בשנת 1.1.9 המתאים 0.5 מ ג של כלורופיל ולהתאים עם מאגר B1 (טבלה 1) באמצעי אחסון הסופי של 2 מ ל. עבור solubilization, להוסיף n-Dodecyl-β-D-maltopyranoside (b-DDM) ריכוז סופי של 20 מ מ.
- היפוך הצינור 3 פעמים ומניחים אותו על קרח למשך 20 דקות עם טלטול עדין כדי להימנע קצף. צנטריפוגה במשך 5 דקות, ב x 12,000 g ומפרידה העליון מקורר מראש הטבלה ב +4 º C.
- לטעון את תגובת שיקוע במעבר הצבע. אין לטעון יותר מ 125 µg של כלורופיל הכולל לכל צבע אם הבקבוקונים 17 מ ל משמשים. צנטריפוגה עבור h 22 ב-100,000 x g ו- +4 ° C.
- להתאושש שברים FCP חום הרצוי מעבר הצבע באמצעות מזרק (איור 2 א). קח את µL 5 aliquot, לדלל את זה עם µL 995 של B1a.
- למדוד את הספקטרום ספיגת (ABS) בין 370-750 ננומטר בספקטרופוטומטר UV-VIS. השתמש מיקרו למחצה אופטי זכוכית וואקום.
- פתח את תוכנת מנהל ספקטרה, לעבור למצב ' ספקטרום ' ולהקליט תוכנית בסיסית מ- 370 ל- 750 ננומטר ואחריו מדגם מדידות. השתמש בהגדרות הבאות: סריקה מהירות, 200 ננומטר/דקה; נתוני גובה, 0.5 ננומטר; תגובה, בינוני.
- למדוד את עוצמת הקול של המדגם התאושש עם micropipette. לשטוף את מתחמי FCP על-ידי הוספת פעמיים את אמצעי האחסון התאושש באמצעות מאגר B1 (טבלה 1). להתרכז concentrator קרום עם הקיצוץ ב x 1000 g ו- +4 ° C עד ABS672nm לפחות 20 30 kDa.
הערה: ריכוז b-DDM עלול לעלות בשל מיצלה העשרה בתא מדגם. הדבר עלול להוביל solubilization נוספת של מתחמי FCP! להימנע solubilization יתר על-ידי הוספת מאגר חופשי דטרגנט B1 אם שטיפה נוספת צעדים נדרשים כדי להסיר שאריות סוכרוז. - קח את µL 20 aliquot עבור הפקדים. הלם להקפיא את הדגימות של חנקן נוזלי ואחסן אותם ב- 80 ° c
- להכין פתרון הדרגתי סוכרוז ולמלא את הצינורות ultracentrifuge עד העליון פחות טעינת אמצעי האחסון (300 – 500 µL). להקפיא את הצינורות ב-20 ° C עד קפואים לחלוטין. לאפשר הצינורות להפשיר ב +4 ° C, אשר לוקח 3-4 h עבור צינור 17 מ.

איור 2: טיהור של FCP, פקדים ספקטרוסקופיות סימון טוהר. (א) טיפוסי המראה של מעבר הדרגתי צפיפות סוכרוז לאחר צנטריפוגה לילה. כל להקות חום להכיל את הבריכה FCP המורכב FCPa, FCPb. pigm. - לא מאוגד פיגמנטים, נ. ב- photosystems (B) ספיגת ספקטרום של FCP לפני (קו כחול) ואחרי (קו מקווקו תפוזים) הריכוז באמצעות התקנים צנטריפוגלי מסנן עם הקיצוץ 30 kDa . במיוחד, קרוטנואידים נוטים אובדן מ FCP, פעולה שעלולה להוביל ספיגת התחתון בין האזור שבין 500-550 ננומטר. גרפים הינם מנורמל ל כלורופיל Qy המרבי ב ~ 670 ננומטר. ספקטרום הפליטה של כלורופיל (C) עם עירור של קלוא c (465 nm) לבדיקה את העברת האנרגיה של עירור פונקציונלי. אם להעביר האנרגיה של c קלוא קלוא היא הקשו, להקת פלורסצנטיות נוספים ב-640 ~ nm (קלוא c) תתרחש. גרפים הינם מנורמל ל הפליטה המרבי. (ד) עירור ספקטרה להקליט 675 nm (קלוא פלורסצנטיות המרבי) לבדיקת העברת אנרגיה כדי קלוא של קליטת בין 370 כל פיגמנטים nm ו 600 ננומטר. אם האנרגיה להעביר קלוא יעילה פחות, קרינה פלואורסצנטית התשואה תקטן, במיוחד בין 465, 550 ננומטר. הגרפים הינם מנורמל למקסימום בסביבות 440 ננומטר. הספקטרום (ב'), (ג) ו- (ד) כמעט זהות אם הריכוז עבד טוב. (ה) בדוק טוהר FCP מבודדים בעזרת ג'ל טריס-tricine28. FCPa ו- FCPb יש subunits בין 18-19 kDa. כל גלויה צבעונית-כסף חלבונים גדולה יותר 20 kDa הם מזהמים. Thyl. -Thylakoids אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
-
פקדים ספקטרוסקופיות, מבוסס על ג'ל
- להקליט את ספיגת בין 370-750 ננומטר של 5 µL של FCP ב- 995 µL של B1a לאחר שלב 1.2.5. להשוות את זה עם הקשת מתקבל בשלב 1.2.4. השתמש באותו מכשור הגדרות כפי שמתואר בשלב 1.2.4.
- לייצא נתונים כקובץ *. csv ולאחר לייבא את הנתונים לתוך גיליון אלקטרוני. לנרמל את שני ספקטרה למספר המרבי של קלוא הלהקהy Q של בסביבות 672 nm כפי שהיא מתוארת דמות 2B.
- לחשב את הגורם לדילול של דגימות מן שלב 1.2.4 1.3.1 על-ידי חלוקת ABS672nm נמדד על ידי השרירים הרצויים672nm של 0.03. לדלל את הדגימות בהתאם עם B1a ולהעביר אותם כימיקלים קרינה פלואורסצנטית זכוכית מיוחדת.
- שיא קלוא ספקטרום פליטה זריחה עם מצלמות-דיגיטליות כדי לחשוף את העברת אנרגיית אור שלם מ- c קלוא קלוא (איור 2C).
- השתמש בתוכנה ספקטרומטר ולעבור למצב מדידת ספקטרום עם ההגדרות הבאות: מצב, פליטה; חתך רוחב עירור, פליטה, 3 ננומטר; רגישות, בינוני; מהירות סריקה, 100 ננומטר/דקות; נתוני גובה, 0.5 ננומטר; עירור אורך גל, 465 nm; פליטת, 600-800 ננומטר. לבצע autozero ולמדוד.
- עירור שיא ספקטרה באותה דגימת זרע, ציוד כדי לחשוף את האנרגיה ללא פגע העברה של פיגמנטים כל קלוא (איור דו-ממדי). שנה הגדרות: מצב, עירור; פליטה אורך גל, 675 ננומטר; עירור, 370-600 ננומטר. לתעד את הספקטרום.
- תקן עם קשת rhodamine בטווח זהה עבור ספקטראליות של המנורה – cf. ההוראות במדריך למשתמש.
- מיקס FCP דגימות המתאים µg 1 של קלוא עם µL 10 מאגר העמסה מרחביות. תקופת דגירה של 10 דקות ב 25 º C. צנטריפוגה למשך 5 דקות ב g 12000 x ומפרידה מלמעלה בטבלה.
- לטעון את תגובת שיקוע על ג'ל טריס-tricine28. להפרידו עבור h 2 ב-150 V, כסף-כתם זה לאחר ההפרדה40.
הערה: subunits FCP נפרדים לתוך שתי להקות חלבון בולטים בין 18-19 kDa, אשר הם המרכיבים של FCPa ו FCPb29 (איור 2E).
- לטעון את תגובת שיקוע על ג'ל טריס-tricine28. להפרידו עבור h 2 ב-150 V, כסף-כתם זה לאחר ההפרדה40.
- להקליט את ספיגת בין 370-750 ננומטר של 5 µL של FCP ב- 995 µL של B1a לאחר שלב 1.2.5. להשוות את זה עם הקשת מתקבל בשלב 1.2.4. השתמש באותו מכשור הגדרות כפי שמתואר בשלב 1.2.4.
2. הכנת ליפוזומים, תיאגוד FCP
-
הכנת תערובת השומנים, השומנים הקזאין דטרגנט
הערה: ליפידים הם רגישים חמים טמפרטורות בשילוב עם תנאי חמצוני. נסו לשמור ליפידים צוננת ותחת אווירה2 N.- לחשב את יחס השומנים תילקואיד הרצוי עבור meneghiniana ג לפי בילר. et al. 200730. עיין בדוגמה נתון המשלימים טבלה 1. הכינו השומנים מלאי פתרונות מומלצים על ידי היצרן במיכל הוכחה הממס.
- Pipette את הסכום הרצוי של ליפידים בשפופרת תגובה 2 מ"ל ו להתאדות ההרדמה באמצעות זרם עדין חנקן ולנסות להתפשט ליפידים כל האזור של הבסיס שפופרת. תנו לזרום2 N עד הממס כל הוא התאדה.
- Solubilize את התערובת השומנים ב 29 µL של n-תמצית β-D-glucopyranoside פתרון (OG) ב 4 ° C עבור 4 h. Incubate התערובת השומנים 10 דקות ב 30 º C. דגירה ליפידים באמבט sonicator למשך 3 x 3 דקות 25 ° c נקטע על ידי 30 s על קרח.
- הוסף µL 221 tricine מאגר µL 250 4 x דיאליזה המאגר.
- להשתמש extruder עם ממברנות פוליקרבונט מיקרומטר 0.1 ליפוזום מוגדר קוטר של 50-70 ננומטר. להרכיב. המתקן עם תמיכה ממברנה וסינון. להימנע בועות אוויר, והדק את מכלול ביסודיות.
- ממלאים מזרק אחד עם מאגר דיאליזה x 4, טרום רטוב. המתקן עד אין בועות ניתן לראות את המזרק השני.
- להחיל את השומנים-חומרי ניקוי-הקזאין. המתקן, הקש את הפתרון של מזרק אחד לשני הלאה ובחזרה. חזור על שלב זה 5 פעמים להופעת הפתרון הומוגנית.
הערה: פתרון זה ניתן לאחסן ב 4 מעלות צלזיוס למשך מספר ימים. לא לזוז!
-
התאגדות של מתחמי FCP והסרה של חומרי ניקוי, אגרגטים
הערה: בדוגמה זו אנו משתמשים של ליפיד/קלוא יחס של 12:1, אשר תואמת יחס ליפיד/חלבון של בערך 100: 1.- להוסיף FCP שווה ל- µg 20 של קלוא בהנפח הכולל של 500 µL מאגר B1a כדי 250 μלליטר השומנים-הקזאין מעוקם, 250 µL של 4 x מאגר דיאליזה. דגירה בדגימות 3 x 3 דקות 25 ° c ב- thermomixer-1500-3000 סל ד נקטע על ידי הפסקה s 30 על קרח.
- חותכים את המכסה של 1.5 mL ארבע התגובה צינור מתחת העליון נותן טבעת עדיין מתאים על המכסה. להכין 1.5 ס"מ x 1.5 ס"מ חתיכות של קרום דיאליזה ולשטוף אותם ב- 20 מ של מאגר דיאליזה x 1
- מילוי µL 250 המדגם מכסה כל. . בזהירות, הנח את הקרום על המכסה כך התא מתמלא לחלוטין הדגימה, אין בועות אוויר להתרחש. להדק את התגובה טבעת על מכלול כדי שיהיה תאים סגורים.
- Dialyze את הדגימות ב 50 מ ל 1 x דיאליזה מאגר בן לילה (12-16 שעות) על קרח על פעלולי מטרף. להחליף את המאגר דיאליזה בשימוש טרייה ולהוסיף 7 מ"ג של חרוזים adsorbent כדי להסיר את חומרי ניקוי הנותרים לפחות 6 שעות.
- להחליף את המאגר דיאליזה שוב dialyze עבור ה 12 עוד לשחזר ליפוזומים על ידי פירסינג קרום דיאליזה עם טיפ micropipette 200 µL, תשאף ליפוזומים כל מ המכסה צינור התגובה.
- שלב אופציונלי: אם טוהר גבוהה (> 95%) יש צורך. להכין הדרגתי צפיפות מקוטע ב 17 מ ל ultracentrifugation צלוחיות עם מדרגות המכיל 6%, 10%, 15% ו-20% סוכרוז epichlorhydrin קופולימר במאגר דיאליזה. לטעון ליפוזומים למעלה, ultracentrifuge ב g x 100,000 במשך 4 שעות ברוטור דלי מתנדנדים.
- לשחזר את הלהקה חום עליון עם מזרק, לדלל את דוגמה 1:5 עם העקורים והמשך לשלב הבא.
- Centrifuge ליפוזומים FCP בלפחות 2 מ ל 1 x דיאליזה המאגר עבור 1.5 h ב-100,000 x g ו- 4 מעלות צלזיוס. לשחזר ליפוזומים על-ידי הפעלת הצינור צנטריפוגה בזווית של 45°. לאפשר ליפוזומים להעביר 1 דקות (איור 3 א).
- שחזור ליפוזומים FCP בנפח סופי של 25-50 µL. להימנע מהפרעה את התמיסה.
-
שולטת 1: ספיגת, ספקטרוסקופיה קרינה פלואורסצנטית
- להוסיף על aliquot 3 µL של FCP-ליפוזומים נפח סופי 1 מ"ל של 1-מאגר דיאליזה וצנטריפוגה למשך 5 דקות ב 12,000 x g.
- להקליט את ספיגת בין 370 ל-750 ננומטר של FCP-ליפוזומים עם הציוד כמתואר 1.2.4. לנרמל את הספקטרום למקסימום באזורy Q קלוא (670-680 ננומטר), להשוות אותו הספקטרום המנורמל של solubilized FCP (איור 3C).
- להכין FCP-ליפוזומים ב 1 מ"ל של DP עם ספיגת (ABS) = 0.03 ביחס המרבי בין 670-680 ננומטר. התאם את FCP solubilized ותחטא מהשלב 1.2.6 שרירי הבטן באותו דילול עם B1a.
- שיא ספיגת ספקטרום של שתי דגימות כפי שמתואר 1.2.4. שיא קלוא קשת פליטת קרינה פלואורסצנטית של שתי דגימות כפי שמתואר 1.3.3.
הערה: קרינה פלואורסצנטית התשואה יורדת במדגם FCP-ליפוזום (דיוןאיור 3D ו cf. .)
- להוסיף על aliquot 3 µL של FCP-ליפוזומים נפח סופי 1 מ"ל של 1-מאגר דיאליזה וצנטריפוגה למשך 5 דקות ב 12,000 x g.
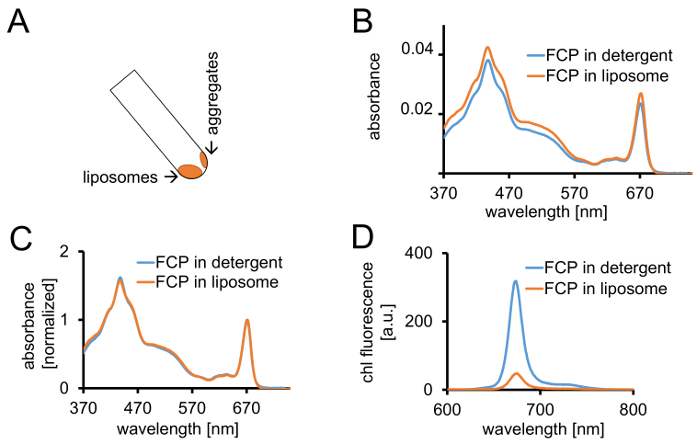
איור 3: בידוד של FCP proteoliposomes ואחריו פקדים ספקטרוסקופיות והדמיה קונפוקלי. (א) השחזור של ליפוזומים FCP לאחר צנטריפוגה. להפוך את הצינור צנטריפוגה ° 45 ולא לחכות כ 1 דקות - ליפוזומים יזוז ואילו FCP אגרגטים אשר הם לא שולבו ליפוזומים מקל לקיר צינור. (B) השוואה של ספיגת ספקטרום של solubilized FCP ותחטא (כחול) ו FCP בליפוזומים (כתום) (ג) ספקטרום אותו כמו (B) מנורמל ל קלוא מקסימום באזור האדום (~ 670 nm - שיא Qy); solubilized FCP ותחטא (כחול), FCP בליפוזומים (כתום). באופן פוטנציאלי, ייתכן אובדן הפיגמנט בעיקר של קרוטנואידים גלוי באזור 500-550 ננומטר. קיבוץ באשכולות של FCP בליפוזומים עלול להוביל שיא התרחבות, משמרת קלה של קלוא מקסימום (~ 670 nm) לאדום. (ד) ספקטרום הפליטה של solubilized FCP ותחטא ו FCP ב ליפוזום. קיבוץ באשכולות של FCP ב ליפוזום מגבירה את האינטראקציות האנרגטיות של מתחמי FCP אשר מוריד את התשואה קרינה פלואורסצנטית (עיקול כתום), משמרות את מקסימה פליטה מעט לאדום. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
תוצאות
הפרוטוקול מתאר את ניתוקה של שבר FCP סה כ מ Cyclotella meneghiniana שהשתלבה ליפוזומים להרכב מקורי השומנים. הבידוד תילקואיד מאוד לשחזור, אבל התשואה תילקואיד עשויים להשתנות. התוצאה היא מקובלת, אם יותר מ- 50% של פיגמנטים כל התאוששו בשלב 1.1.4. יותר מ- 80% הוא אופטימלי.
Discussion
ליפוזומים FCP להרכב השומנים הטבעיים מספקים כלי שימושי, פשוט לשחזור לחקור את מאפייני ספקטרוסקופיות במבחנה. הסביבה השומנים ב FCP ליפוזומים דומה המצב בתוך קרום תילקואיד, והוליד תוצאות ניסויית כי הם קרובים יותר בתנאי הטבע.
ישנם מספר יתרונות של שימוש meneghiniana ג מערכת מודל ?...
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים רנא אורנה חריטן אחמד לסיוע FCP טיהור. פרופסור קלאודיה Büchel הוא הודה המועיל דיונים, לקרוא את כתב היד. עבודה זו נתמכה על ידי קרן מחקר גרמני כדי LD (DI1956-1/1) ושל קרן הומבולדט עבור מלגת פיודור-Lynen LD.
Materials
| Name | Company | Catalog Number | Comments |
| 500 ml centrifuge vials | |||
| high speed centrifuge | Heraeus | ||
| Bead Mill VI 2 | Edmund-Bühler (edmund-buehler.de) | newer version: Vibrogen-Zellmühle Vl 6 | |
| Silibeads S 400 µm | Sigmund-Lindner.com | 5223-7 | |
| Silibeads S 1,-1,3 mm | Sigmund-Lindner.com | 4504 | |
| VitraPOR filter funnel - por1 | ROBU GmbH | 21121 | |
| polycarbonate ultracentrifuagtion vials (30 mL) for T-865 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 314348 | |
| Ultracentrifuge Discovery 90SE | Sorvall | n.a. | |
| rotor T 865 | ThermoFisher Scientific (thermofisher.com) | 51411 | |
| Neubauer Cell Counter Chamber (improved) | Carl Roth Laborbedarf (Carlroth.com) | T729.1 | |
| Zeiss Mikroskop Primostar (7) | Optik-Pro (optik-pro.de) | 51428 | |
| optical glass cuvettes (6040-OG) | Hellma Analytics (hellma-analytics.com) | "6040-10-10" | |
| V-630 UV-VIS Spectrophotometer (incl. software) | Jasco (jasco.de) | V-630 | |
| n-Dodecyl-β-D-Maltopyranoside | ANATRACE (anatrace.com) | D310LA | |
| Ultra-Clear tubes 17 ml for AH629 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 344061 | |
| rotor AH629-17-mL | ThermoFisher Scientific (thermofisher.com) | 54285 | |
| Membrane concentrator_Centriprep 30 kDa cutoff | Millipore (merckmillipore.com) | 4307 | |
| Biometra Minigel-Twin | Analytik Jena AG (analytik-jena.de) | 846-010-100 | |
| Silver Stain Plus Kit | Bio-Rad (bio-rad.com) | 1610449 | |
| libre office spread sheet | The document foundation | https://de.libreoffice.org/download/libreoffice-still/ | |
| special glass cuvettes for fluorescence (101-0S) | Hellma Analytics (hellma-analytics.com) | 101-10-20 | |
| Spectrofluorometer FP-6500 (incl. Software) | Jasco (jasco.de) | FP-6500 | |
| SDS-loading buffer Roti-Load | ROTH (carlroth.com) | K929.1 | |
| n-octyl β-D-glucopyranoside | ANATRACE (anatrace.com) | O311 | |
| Monogalactosyl Diaclyglycerol (MGDG) | Larodan AB (larodan.com) | 59-1300 | make stock solution in chloroform |
| Digalactosyl Diacylglycerol (DGDG) | Larodan AB (larodan.com) | 59-1310 | make stock solution in chloroform |
| Sulphoquinovosyl Diacylglycerol (SQDG) | Larodan AB (larodan.com) | 59-1230 | make stock solution in chloroform |
| L-alpha-Phosphatidylglycerol (PG) | Larodan AB (larodan.com) | 37-0150 | make stock solution in chloroform |
| L-α-Phosphatidylcholine | Sigma-Aldrich (sigmaaldrich.com) | P3782 SIGMA | make stock solution in chloroform |
| sonicator bath S-50TH | Sonicor (getmedonline.com | SONICOR-S-50TH | |
| mini-Extruder | Avanti Polar Lipids (Avanti.com) | 610000 | |
| Nuleopore polycarbonate membrane | Avanti Polar Lipids (Avanti.com) | 610005 | |
| dialysis membrane Visking 14 kDa cutoff | ROTH (carlroth.com) | 0653.1 | boil in destilled water before use |
| Biobeads SM2 Adsorbent | Biorad (Bio-rad.com) | 152-3920 | |
| sucrose epichlorhydrin copolymer - Ficoll 400 | Sigma-Aldrich (sigmaaldrich.com) | F4375 | |
| Polycarbonate ultracentrifuagtion vials (2.7 mL) for TFT 80.4 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 252150 | |
| rotor TFT 80.4 | Millipore (merckmillipore.com) | 54356 | |
| material listed in order of appearance | For specific safety instructions please refer to material safety sheets and repective manuals. Standard lab material and substances are not listed. |
References
- Eberhard, S., Finazzi, G., Wollman, F. A. The Dynamics of Photosynthesis. Annual Review of Genetics. 42, 463-515 (2008).
- Li, Z. R., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and Responding to Excess Light. Annual Review of Plant Biology. 60, 239-260 (2009).
- Niyogi, K. K., Truong, T. B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology. 16 (3), 307-314 (2013).
- Li, X. -. P., et al. A pigment-binding protein essential for regulation of photosynthetic light harvesting. Nature. 403 (6768), 391-395 (2000).
- Peers, G., et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature. 462 (7272), 518-521 (2009).
- Correa-Galvis, V., et al. Photosystem II Subunit PsbS Is Involved in the Induction of LHCSR Protein-dependent Energy Dissipation in Chlamydomonas reinhardtii. The Journal of biological chemistry. 291 (33), 17478-17487 (2016).
- Bailleul, B., et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18214-18219 (2010).
- Taddei, L., et al. Multisignal control of expression of the LHCX protein family in the marine diatom Phaeodactylum tricornutum. Journal of experimental botany. 67 (13), 3939-3951 (2016).
- Lepetit, B., et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis. New Phytologist. 214 (1), 205-218 (2017).
- Büchel, C. Evolution and function of light harvesting proteins. Journal of Plant Physiology. 172, 62-75 (2015).
- Lavaud, J., Rousseau, B., van Gorkom, H. J., Etienne, A. -. L. Influence of the Diadinoxanthin Pool Size on Photoprotection in the Marine Planktonic Diatom Phaeodactylum tricornutum. Plant Physiology. 129 (3), 1398-1406 (2002).
- Ruban, A., et al. The super-excess energy dissipation in diatom algae: comparative analysis with higher plants. Photosynthesis Research. 82 (2), 165-175 (2004).
- Mann, D. G. The species concept in diatoms. Phycologia. 38 (6), 437-495 (1999).
- Papagiannakis, E., van Stokkum, I. H. M., Fey, H., Büchel, C., van Grondelle, R. Spectroscopic Characterization of the Excitation Energy Transfer in the Fucoxanthin-Chlorophyll Protein of Diatoms. Photosynthesis Research. 86 (1-2), 241-250 (2005).
- Premvardhan, L., Robert, B., Beer, A., Büchel, C. Pigment organization in fucoxanthin chlorophyll a/c2 proteins (FCP) based on resonance Raman spectroscgopy and sequence analysis. Biochimica et Biophysica Acta-Bioenergetics. 1797 (9), 1647-1656 (2010).
- Gildenhoff, N., Herz, J., Gundermann, K., Büchel, C., Wachtveitl, J. The excitation energy transfer in the trimeric fucoxanthin-chlorophyll protein from Cyclotella meneghiniana analyzed by polarized transient absorption spectroscopy. Chemical Physics. 373 (1), 104-109 (2010).
- Ramanan, C., et al. Exploring the mechanism(s) of energy dissipation in the light harvesting complex of the photosynthetic algae Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1837 (9), 1507-1513 (2014).
- Haferkamp, S., Kirchhoff, H. Significance of molecular crowding in grana membranes of higher plants for light harvesting by photosystem II. Photosynthesis Research. 95 (2-3), 129-134 (2008).
- Wahadoszamen, M., et al. Stark fluorescence spectroscopy reveals two emitting sites in the dissipative state of FCP antennas. Biochimica et Biophysica Acta-Bioenergetics. 1837 (1), 193-200 (2014).
- Zhou, F., et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids. Photosynthesis Research. 99 (3), 185-193 (2009).
- Moya, I., Silvestri, M., Vallon, O., Cinque, G., Bassi, R. Time-resolved fluorescence analysis of the photosystem II antenna proteins in detergent micelles and liposomes. Biochemistry. 40 (42), 12552-12561 (2001).
- Natali, A., et al. Light-harvesting Complexes (LHCs) Cluster Spontaneously in Membrane Environment Leading to Shortening of Their Excited State Lifetimes. Journal of Biological Chemistry. 291 (32), 16730-16739 (2016).
- Gundermann, K., Büchel, C. Factors determining the fluorescence yield of fucoxanthin-chlorophyll complexes (FCP) involved in non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1817 (7), 1044-1052 (2012).
- Ahmad, R. A., Dietzel, L. Relaxation of cellular K+ gradients by valinomycin induces diatoxanthin accumulation in Cyclotella meneghiniana cells and alters FCPa fluorescence yield in vitro. Physiologia Plantarum. , 171-180 (2017).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Archiv für Mikrobiologie. 25 (4), 392-428 (1957).
- Jeffrey, S., Humphrey, G. New spectrophotometry equations for determining chlorophyll a, chlorophyll b, chlorophyll c-1 and chlorophyll c-2 in higher plants, algae and natural phytoplankton. Biochemie und Physiologie der Pflanzen. 167, 191-194 (1975).
- Beer, A., Gundermann, K., Beckmann, J., Büchel, C. Subunit Composition and Pigmentation of Fucoxanthin−Chlorophyll Proteins in Diatoms: Evidence for a Subunit Involved in Diadinoxanthin and Diatoxanthin Binding. Biochemistry. 45 (43), 13046-13053 (2006).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry. 166 (2), 368-379 (1987).
- Büchel, C. Fucoxanthin-Chlorophyll Proteins in Diatoms: 18 and 19 kDa Subunits Assemble into Different Oligomeric States. Biochemistry. 42 (44), 13027-13034 (2003).
- Vieler, A., Wilhelm, C., Goss, R., Süß, R., Schiller, J. The lipid composition of the unicellular green alga Chlamydomonas reinhardtii and the diatom Cyclotella meneghiniana investigated by MALDI-TOF MS and TLC. Chemistry and Physics of Lipids. 150 (2), 143-155 (2007).
- Gundermann, K., Büchel, C. The fluorescence yield of the trimeric fucoxanthin-chlorophyll-protein FCPa in the diatom Cyclotella meneghiniana is dependent on the amount of bound diatoxanthin. Photosynthesis Research. 95 (2-3), 229-235 (2008).
- Miloslavina, Y., et al. Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1787 (10), 1189-1197 (2009).
- Grouneva, I., Jakob, T., Wilhelm, C., Goss, R. The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1787 (7), 929-938 (2009).
- Chukhutsina, V. U., Büchel, C., van Amerongen, H. Disentangling two non-photochemical quenching processes in Cyclotella meneghiniana by spectrally-resolved picosecond fluorescence at 77 K. Biochimica et Biophysica Acta-Bioenergetics. 1837 (6), 899-907 (2014).
- Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., Büchel, C. Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochimica Et Biophysica Acta-Bioenergetics. 1857 (9), 1373-1379 (2016).
- Darley, W. M. Biochemical composition. The biology of diatoms. 13, 198-223 (1977).
- Milsman, M. H. W., Schwendner, R. A., Weder, H. G. Preparation of large single bilayer liposomes by a fast and controlled dialysis. Biochimica Et Biophysica Acta. 512 (1), 147-155 (1978).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid-detergent-mixed micelles. Biochimica Et Biophysica Acta. 640 (1), 252-262 (1981).
- Verchere, A., Broutin, I., Picard, M. Photo-induced proton gradients for the in vitro investigation of bacterial efflux pumps. Scientific Reports. 2 (306), (2012).
- Chevallet, M., Luche, S., Rabilloud, T. Silver staining of proteins in polyacrylamide gels. Nature Protocols. 1 (4), 1852-1858 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved