A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحقيق ضغوط معتدلة في سفن مختومة باستخدام الثلج الجاف كمصدر2 CO الصلبة
In This Article
Summary
نقدم هنا بروتوكولا للقيام بردود فعل في أوعية التفاعل بسيطة تحت ضغوط منخفضة إلى متوسطة من CO2. ردود الفعل التي يمكن أن يؤديها في مجموعة متنوعة من السفن ببساطة إدارة ثاني أكسيد الكربون في شكل الثلج الجاف، دون الحاجة إلى معدات مكلفة أو معقدة أو التكوينات.
Abstract
وترد هذه الوثيقة استراتيجية عامة للقيام بردود فعل تحت معتدل CO2 ضغوط معتدلة مع الثلج الجاف. هذا الأسلوب يغني عن الحاجة إلى معدات متخصصة لتحقيق ضغوط متواضعة، ويمكن حتى أن تستخدم لتحقيق أعلى من الضغوط في معدات متخصصة أكثر وأكثر ثباتا من أوعية التفاعل. في نهاية رد فعل، يمكن أن للالتحام القنينات بسهولة قبل الافتتاح في درجة حرارة الغرفة. في هذا المثال بمثابة CO2 مجموعة توجيه المفترضة فضلا عن طريقة تخميل ركائز أمين، وبالتالي منع الأكسدة أثناء عملية التفاعل الفلزية. بالإضافة إلى سهولة إضافة، إزالة مجموعة توجيه أيضا تحت الفراغ، تنتفي الحاجة إلى تطهير واسعة النطاق لإزالة مجموعة توجيه. هذه الاستراتيجية تسمح أريليشن γ-C(sp3)-ح السطحية من الأمينات الاليفاتيه وإمكانية تطبيقها على مجموعة متنوعة من ردود أفعال أخرى على أساس أمين.
Introduction
عادة ما يتطلب استخدام المركبات الغازية في التفاعلات الكيميائية المعدات المتخصصة وإجراءات1،2. على مقاعد البدلاء النطاق، يمكن إضافة بعض الغازات مباشرة من دبابة باستخدام منظم ضغط العالي3. أسلوب بديل لتكثيف الغاز تحت الظروف المبردة4،5. على الرغم من فائدة، هذه الاستراتيجيات تتطلب استخدام مفاعلات الضغط المتخصصة مع الصمامات، التي يمكن أن تكون تكلفة باهظة بالنسبة لتشغيل ردود فعل عديدة في نفس الوقت. ولهذا يمكن إبطاء معدل فحص رد الفعل الذي يمكن أن يسير إلى حد كبير. نتيجة لذلك الكيميائيين وجدت أنه من المرغوب فيه لإدخال هذه المركبات باستخدام طرق بديلة. يمكن إضافة الأمونيا إلى ردود فعل استخدام أملاح كاربوكسيلات الأمونيوم المختلفة، مع الاستفادة من ضعف التوازن بين هذه الأملاح والأمونيا الحرة6. نقل الهدرجة هي استراتيجية هامة للحد من ردود الفعل الاوليفينات والكربونيل ومجموعات نيترو تلتف استخدام غاز الهيدروجين قابل للاشتعال مع مركبات مثل فورمات الأمونيوم أو الهيدرازين كشركة نقل جوي من ح27. غاز آخر للفائدة في هذا المجال هو أول أكسيد الكربون8 --يمكن أن تكون أول أكسيد الكربون الذي تم إنشاؤه في الموقع قبل التحرير من الكربونيل المعدني مجمعات9،10، أو بدلاً من ذلك فإنه يمكن إنشاؤها بواسطة ديكاربونيليشن من مصادر مثل فورماتيز وفورماميديس11،،من1213 أو كلوروفورم14،15.
غاز واحدة التي لم تحظ بتطور هام في هذا الصدد هو16من ثاني أكسيد الكربون. واحد أسباب ذلك هو أن العديد من التحولات التي تنطوي على CO2 يحتاج أيضا إلى ارتفاع درجات الحرارة والضغوط، وهكذا تلقائياً تنزل إلى مفاعلات المتخصصة17،18. الجهود التي بذلت مؤخرا لوضع محفزات أكثر من رد الفعل، ومع ذلك، قد سهلت تشغيل العديد من ردود الفعل هذه تحت الضغط الجوي CO219،20،،من21إلى22. لقد اكتشفنا مؤخرا من ردود فعل التي يمكن استخدام ثاني أكسيد الكربون للتوسط في γ-ج (sp3) – أريليشن ح من الأمينات الاليفاتيه23. هذه الاستراتيجية كان من المتوقع أن تجمع بين فوائد اتباع نهج المجموعة توجيه ثابت بما في ذلك أميد24،،من2526،،من2728، سلفوناميد 29 , 30 , 31 , 32أو33،ثيوكاربونيل34هيدرازوني35-على أساس توجيه المجموعات (روبوستيسيتي الكيميائية)، مع سهولة مجموعة توجيه عابرة (الخطوة انخفض الاقتصاد)36، 37،،من3839.
على الرغم من أن يمكن أن يحدث رد فعل تحت الضغط الجوي من CO2، الحاجة إلى هيكل شلينك ردود فعل الشاشة أثبتت باهظة، بطيئة. وعلاوة على ذلك، زيادة الضغط قليلاً وأدت إلى تحسين غلة رد الفعل، ولكن لا يمكن بسهولة تحقيق استخدام خط شلينك. وقد سعينا لذلك استراتيجية بديلة، وحددت بعد ذلك أن الثلج الجاف ويمكن استخدامها بسهولة كمصدر قوي ل CO2 التي يمكن أن تضاف إلى مجموعة متنوعة من أوعية التفاعل إدخال المبلغ اللازم من ثاني أكسيد الكربون لتحقيق معتدلة الضغوط (الشكل 1). على الرغم من أن الناقصة في التوليف، استراتيجية مماثلة شائع إلى حد كبير كوسيلة لتوليد السائل CO2 للفصل اللوني واستخراج التطبيقات40،،من4142،43، 44. استخدام هذه الاستراتيجية سمحت مجموعتنا بسرعة شاشة إعداد كبيرة من ردود الفعل بالتوازي، مع القدرة على الوصول إلى معتدلة CO2 الضغوط من بين 2-20 أجواء كانت حاسمة لتحسين الغلة من ردود الفعل. في ظل هذه الظروف، يمكن الابتدائية (رقم 1) والامينات الثانوية (2°) أريلاتيد مع الغنية إلكترون والكترون هاليدات أريل الفقراء.
Protocol
تنبيه: 1) البروتوكولات التالية تعتبر آمنة من خلال التجارب المتكررة. ومع ذلك، ينبغي توخي الحذر عند ختم القنينات، في رد فعل، وخصوصا عندما فتح ردود الفعل، قنينة إينهوموجينيتي في رد فعل يؤدي إلى تعطل المعدات. ينبغي تفتيشها قنينات للعيوب الجسدية قبل الاستخدام. ينبغي أن توضع قارورة وراء بعض أشكال درع الانفجار أو تفشل وشاح هود فورا بعد ختم لمنع الحوادث ينبغي قنينة. 2) على الرغم من أن هناك فرصة ضئيلة للاختناق بسبب كميات صغيرة من CO2 يستخدم، ردود الفعل ينبغي أن يكون التشكيل، فضلا عن فتح في منطقة جيدة التهوية، أو في غطاء دخان. 3) الثلج الجاف كريوجين ويمكن أن يسبب تلف الأنسجة خطيرة. لذلك توخي الحذر أثناء معالجة لتجنب قضمه الصقيع، مثل الحد من الاتصال المباشر أو باستخدام القفازات المبردة. 4) الثلج الجاف سوف تتكثف بخار الماء، مما يعني أنه ينبغي أن يكون سينظف الجليد الجاف ميكانيكيا قبل الاستخدام، للتأكد من الكتلة من أول أكسيد الكربون2 (s) فقط. ويمكن تحقيق ذلك ببساطة فرك الثلج الجاف بين الأصابع، أو بشكل أكثر أماناً، فرك بين الأصابع بطبقة واقية مثل القفازات أو منشفة.
1-رد الفعل في قنينة 7.5 مل (الهواء لا تستبعد)
- إضافة شريط إثارة لمل 7.5 جاف قنينة.
- إضافة خلات البلاديوم (6.7 ملغ، 0.03 ملمول) إلى القنينة.
- إضافة تريفلورواسيتاتي الفضة (مغ 99.9، ملمول 0.45) إلى القنينة.
- إضافة يوديد فينيل (مغ 92.3، ملمول 0.45) إلى القنينة.
- إضافة ثالثي-أمين الأميل (26.3 ملغ، ملمول 0.30) إلى القنينة.
- إضافة حمض الخليك (1.0 مل) إلى القنينة.
ملاحظة: نسبة حجم الحل فيال الحجم المهم، كما التسامي الفوري من CO2 عند إضافة الثلج الجاف يمكن أن يزيح ميكانيكيا يستخدم مذيب إذا كان أكثر من اللازم بالنسبة لحجم وعاء التفاعل. - إضافة المياه (21.7 ميكروليتر، ملمول مقاس 12.1 بوصة) إلى القنينة.
- وزن الثلج الجاف (26.3 ملغ، ملمول 0.60)، وإضافة الثلج الجاف فورا إلى القنينة، مع ضمان أن أيضا الختم فورا القنينة مع قبعة مبطنة PTFE.
ملاحظة: ينبغي إجراء العملية بأكملها ضمن مدة 5 ثواني تقريبا لمنع التسامي والهروب من كمية صغيرة من أول أكسيد الكربون2 وأضاف (هذا هو أبطأ من قبل تشكيل حمض الخليك المجمدة حول الجليد الجاف). سوف يكون مقدار CO2 إضافة قيمة تقريبية، وفي أيدينا انحراف ملغ قليلة المسموح بها. - يقلب القنينة رد فعل مختومة لمدة 15 دقيقة في درجة حرارة الغرفة.
- نقل السفينة رد فعل على صفيحة ساخنة مسبقاً عند 110 درجة مئوية ويقلب لمدة 14 ساعة قبل السماح لتبرد.
- عند التبريد، بعناية فتح القنينة للتنفيس CO2.
- قم بإزالة كافة التطاير في الخلاء.
ملاحظة: يمكن إجراء هذه العملية في القنينة، أو يمكن نقل الحل إلى قارورة أسفل جولة أكبر. - إضافة 1.2 M HCl(aq) (6 مل) إلى خليط التفاعل وآثاره مفتوحة للهواء لمدة 15 دقيقة.
- نقل الكسر مائي لقمع سيباراتوري، الغسل بإضافية 1.2 M HCl (4 مل)، واستخراج بمزيج الاثير ثنائي إثيل 1:1/هيكسانيس (3 × 8 مل).
ملاحظة: هذا يغسل العضوية يحتوي على يوديد فينيل الزائدة وغيره من المنتجات الثانوية محايدة، ويمكن التخلص منها. - تحييد وجعل الأساسية في المحلول بإضافة4يا NH المشبعة(aq) (10 مل نقطة انطلاق جيدة).
- استخراج الطبقة المائية مع الميثان (2 × 10 مل).
- جاف الكسور العضوية مجتمعة ما يزيد على نا2حتى4، ثم عامل تصفية في نموذج تريد فيال.
- تتبخر المذيبات في الخلاء، إعطاء المنتج (2-الميثيل-4-فينيل-بوتاناميني) زيت أصفر.
2-رد فعل في قنينة 7.5 مل (تطهير الأوضاع – الجوية تستبعد)
- إضافة شريط إثارة لمل 7.5 جاف قنينة.
- إضافة خلات البلاديوم (6.7 ملغ، 0.03 ملمول) إلى القنينة.
- إضافة تريفلورواسيتاتي الفضة (مغ 99.9، ملمول 0.45) إلى القنينة.
- إضافة يوديد فينيل (مغ 92.3، ملمول 0.45) إلى القنينة.
- إضافة ثالثي-أمين الأميل (26.3 ملغ، ملمول 0.30) إلى القنينة.
- إضافة حمض الخليك (1.0 مل) إلى القنينة.
ملاحظة: نسبة حجم الحل فيال الحجم المهم، كما التسامي الفوري من CO2 عند إضافة الثلج الجاف يمكن أن يزيح ميكانيكيا يستخدم مذيب إذا كان أكثر من اللازم بالنسبة لحجم وعاء التفاعل. - إضافة المياه (21.7 ميكروليتر، ملمول مقاس 12.1 بوصة) إلى القنينة.
- تغليف القنينة في توازن وإضافة حوالي 98 ملغ ثلج الجاف ثم السماح CO2 تهذيب قبالة حتى يتحقق كتلة نهائي حوالي 26 ملغ، تليها مباشرة ختم القنينة مع قبعة مبطنة PTFE.
ملاحظة: إذا كان ذلك مرغوباً فيه، ويمكن تنفيذ هذه الخطوة مع كتلة أكبر من الثلج الجاف لمواصلة استبعاد الهواء من القنينة. جدير بالذكر أن هذا قد يعرض المياه، وهكذا قد لا تكون الاستراتيجية الأكثر فعالية للمياه ردود فعل حساسة. - يقلب القنينة رد فعل مختومة لمدة 15 دقيقة في درجة حرارة الغرفة.
- نقل السفينة رد فعل على صفيحة ساخنة مسبقاً عند 110 درجة مئوية ويقلب لمدة 14 ساعة قبل السماح لتبرد.
- عند التبريد، بعناية فتح القنينة للتنفيس CO2.
- قم بإزالة كافة التطاير في الخلاء.
ملاحظة: يمكن إجراء هذه العملية في القنينة، أو يمكن نقل الحل إلى قارورة أسفل جولة أكبر. - إضافة 1.2 M HCl(aq) (6 مل) إلى الخليط رد فعل، وآثاره مفتوحة للهواء لمدة 15 دقيقة.
- نقل الكسر مائي لقمع سيباراتوري، الغسل بإضافية 1.2 M HCl (4 مل)، واستخراج بمزيج الاثير ثنائي إثيل 1:1/هيكسانيس (3 × 8 مل).
ملاحظة: هذا يغسل العضوية يحتوي على يوديد فينيل الزائدة وغيره من المنتجات الثانوية محايدة، ويمكن التخلص منها. - تحييد وجعل الأساسية في المحلول بإضافة4يا NH المشبعة(aq) (10 مل نقطة انطلاق جيدة).
- استخراج الطبقة المائية مع الميثان (2 × 10 مل).
- جاف الكسور العضوية مجتمعة ما يزيد على نا2حتى4، ثم عامل تصفية في نموذج تريد فيال.
- تتبخر المذيبات في الخلاء، إعطاء المنتج (2-الميثيل-4-فينيل-بوتاناميني) زيت أصفر.
3-رد الفعل في قنينة 40 مل (الهواء لا تستبعد)
- إضافة شريط إثارة لقنينة جافة 40 مل.
- إضافة خلات البلاديوم (33.5 ملغ، 0.15 ملمول) إلى القنينة.
- إضافة الفضة تريفلورواسيتاتي (499.5 ملغ، ملمول 2.25) إلى القنينة.
- إضافة يوديد فينيل (ملغ 461.5، ملمول 2.25) إلى القنينة.
- إضافة أمين ثالثي-الأميل (131.5 ملغ، 1.5 ملمول) إلى القنينة.
- إضافة حمض الخليك (5.0 مل) إلى القنينة.
ملاحظة: نسبة حجم الحل فيال الحجم المهم، كما التسامي الفوري من CO2 عند إضافة الثلج الجاف يمكن أن يزيح ميكانيكيا يستخدم مذيب إذا كان أكثر من اللازم بالنسبة لحجم وعاء التفاعل. - إضافة المياه (108.5 ميكروليتر، ملمول 6، 02) إلى القنينة.
- وزن الثلج الجاف (131.5 ملغ، ملمول 3.0)، وإضافة الثلج الجاف فورا إلى القنينة، مع ضمان لختم أيضا فورا القنينة مع قبعة مبطنة PTFE.
ملاحظة: ينبغي إجراء العملية بأكملها ضمن مدة 5 ثواني تقريبا لمنع التسامي والهروب من كمية صغيرة من أول أكسيد الكربون2 وأضاف (هذا هو أبطأ من قبل تشكيل حمض الخليك المجمدة حول الجليد الجاف). سوف يكون مقدار CO2 إضافة قيمة تقريبية، وفي أيدينا انحراف ملغ قليلة المسموح بها. - يقلب القنينة رد فعل مختومة لمدة 15 دقيقة في درجة حرارة الغرفة.
- نقل السفينة رد فعل على صفيحة ساخنة مسبقاً عند 110 درجة مئوية ويقلب لمدة 14 ساعة قبل السماح لتبرد.
- عند التبريد، بعناية فتح القنينة للتنفيس CO2.
- قم بإزالة كافة التطاير في الخلاء.
ملاحظة: يمكن إجراء هذه العملية في القنينة، أو يمكن نقل الحل إلى قارورة أسفل جولة أكبر. - إضافة 1.2 M HCl(aq) (30 مل) إلى خليط التفاعل وآثاره مفتوحة للهواء لمدة 15 دقيقة.
- نقل الكسر مائي لقمع سيباراتوري، الغسل بإضافية 1.2 M HCl (20 مل)، واستخراج بمزيج الاثير ثنائي إثيل 1:1/هيكسانيس (3 × 8 مل).
ملاحظة: هذا يغسل العضوية يحتوي على يوديد فينيل الزائدة وغيره من المنتجات الثانوية محايدة، ويمكن التخلص منها. - تحييد وجعل الأساسية في المحلول بإضافة4يا NH المشبعة(aq) (10 مل نقطة انطلاق جيدة).
- استخراج الطبقة المائية مع الميثان (2 × 20 مل).
- جاف الكسور العضوية مجتمعة ما يزيد على نا2حتى4، ثم عامل تصفية في نموذج تريد فيال.
- تتبخر المذيبات في الخلاء، إعطاء المنتج (2-الميثيل-4-فينيل-بوتاناميني) زيت أصفر.
4-رد فعل في 35 مل من أنبوب الضغط (الهواء لا تستبعد)
- إضافة شريط إثارة إلى أنبوب ضغط مل 35 جافة.
- إضافة خلات البلاديوم (6.7 ملغ، 0.03 ملمول) إلى أنبوب الضغط.
- إضافة تريفلورواسيتاتي الفضة (132.5 ملغ، 0.6 ميللي مول) إلى أنبوب الضغط.
- إضافة يوديد فينيل (183.6 ملغ، 0.9 مليمول) إلى أنبوب الضغط.
- إضافة 2-الميثيل-N-(3-methylbenzyl) بوتان-2-أمين (57.4 ملغ، 0.3 ميللي مول) إلى أنبوب الضغط.
- إضافة حمض الخليك (1.0 مل) إلى القنينة، تليها 1,1,1,3,3,3،-هيكسافلورويسوبروبانول (1.0 مل).
ملاحظة: نسبة حجم الحل فيال الحجم المهم، كما التسامي الفوري من CO2 عند إضافة الثلج الجاف يمكن أن يزيح ميكانيكيا يستخدم مذيب إذا كان أكثر من اللازم بالنسبة لحجم وعاء التفاعل. - إضافة المياه (21.7 ميكروليتر، 1.2 ميللي مول) إلى أنبوب الضغط.
- وزن الثلج الجاف (1.32 ز، 30 ملمول)، و فورا إضافة الثلج الجاف لأنابيب الضغط، مع ضمان أن أيضا فورا ختم أنبوب الضغط مع تفلون ملولبة المناسبة.
ملاحظة: ينبغي إجراء العملية بأكملها ضمن مدة 5 ثواني تقريبا لمنع التسامي والهروب من كمية صغيرة من أول أكسيد الكربون2 وأضاف (هذا هو أبطأ من قبل تشكيل حمض الخليك المجمدة حول الجليد الجاف). سوف يكون مقدار CO2 إضافة قيمة تقريبية، وفي أيدينا انحراف ملغ قليلة المسموح بها. - يقلب وعاء التفاعل مختومة لمدة 15 دقيقة في درجة حرارة الغرفة.
- نقل السفينة رد فعل على صفيحة ساخنة مسبقاً عند 90 درجة مئوية ويقلب لمدة 24 ساعة قبل السماح لتبرد.
- عند التبريد، وضع منشفة أو قفاز مبطن خلال عملية النداءات الموحدة، وفتح أنبوب الضغط للتنفيس عن CO2بعناية.
- قم بإزالة كافة التطاير في الخلاء.
ملاحظة: يمكن إجراء هذه العملية في أنبوب الضغط مع محول مناسبة، أو يمكن نقل الحل إلى قارورة أسفل جولة أكبر. - إضافة 1.2 M HCl(aq) (12 مل) إلى خليط التفاعل وآثاره مفتوحة للهواء لمدة 15 دقيقة.
- نقل الكسر مائي لقمع سيباراتوري، الغسل بإضافية 1.2 M HCl (8 مل)، واستخراج بمزيج الاثير ثنائي إثيل 1:1/هيكسانيس (3 × 8 مل).
ملاحظة: هذا يغسل العضوية يحتوي على يوديد فينيل الزائدة وغيره من المنتجات الثانوية محايدة ويمكن التخلص منها. - تحييد وجعل الأساسية في المحلول بإضافة4يا NH المشبعة(aq) (10 مل نقطة انطلاق جيدة).
- استخراج الطبقة المائية مع الميثان (2 × 10 مل).
- جاف الكسور العضوية مجتمعة ما يزيد على نا2حتى4، ثم عامل تصفية في نموذج تاريد فيال.
- تتبخر المذيبات في الخلاء، إعطاء المنتج (2-Methyl-N-(3-methylbenzyl)-4-phenylbutan-2-amine) زيت أصفر.
النتائج
في أعقاب هذه البروتوكولات، فمن الممكن لشحن قنينة رد فعل مع كمية مناسبة من ثاني أكسيد الكربون لتحقيق التفاعلات الكيميائية التي تتطلب شركة أجواء2 . ويحسب الضغط الذي يتحقق في الخطوة 1 أن قرابة 3 أجواء (انظر المناقشة لتحديد هذه القيمة)، على الرغم من أن سبب المذيب جزئية، ا...
Discussion
استخدام فإن دير "فالس المعادلة للدولة"، يمكن ضغط التقريبي لهذه الأنظمة المحسوبة45
مكافئ. 1: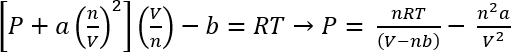
في ظل الظروف في "البروتوكول الأول"، يمكننا أن نفترض مغ 26.3 CO2 يعطي ن = 5.98 × 10-4 mols
Disclosures
استخدام CO2 كمجموعة توجيه لتفعيل ح ج من ركائز أساسية لويس حاليا تركيز "الولايات المتحدة للبراءات المؤقت" رقم 62/608، 074.
Acknowledgements
الكتاب تود أن تقر بدء التمويل من "جامعة توليدو"، فضلا عن أموال من مؤسسة فراش هيرمان جمعية الكيميائيين الأمريكية في دعم جزئي لهذا العمل. السيد توماس كينا المسلم لمساعدته مع وضع مقياس ضغط مناسبة لقياس الضغوط رد فعل. وشكر السيد ستيف مضر هو مناقشات مفيدة.
Materials
| Name | Company | Catalog Number | Comments |
| 7.5 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-00984 | Can be reused. |
| 40 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-01039 | Can be reused. |
| Pressure Tube, #15 Thread, 7" Long, 25.4 mm O.D. | Ace Glass | 8648-06 | Can be reused. |
| Pie-Block for 2 Dram Vials | ChemGlass | CG-1991-P14 | Can be reused. |
| Pie-Block for 10 Dram Vials | ChemGlass | CG-1991-P12 | Can be reused. |
| 3.2 mm PTFE Disposable Stir Bars | Fisher | 14-513-93 | Can be reused. |
| C-MAG HS 7 Control Hotplate | IKA | 20002695 | |
| Analytical Weighing Balance | Sartorius | QUINTIX2241S | |
| Double-Ended Micro-Tapered Spatula | Fisher Scientific | 21-401-10 | |
| Hei-VAP Advantage - Hand Lift Model with G5 Dry Ice Condenser Rotary Evaporator | Heidolph | 561-01500-00 | |
| Bump Trap 14/20 Joint | ChemGlass | CG-1322-01 | |
| tert-Amyl amine | Alfa Aesar | B24639-14 | Used as received. |
| 2-Methyl-N-(3-methylbenzyl)butan-2-amine | N/A | N/A | Prepared from reductive amination of tert-amyl amine and 3-tolualdehyde in the presence of sodium borohydride in methanol. |
| Palladium Acetate | Chem-Impex International, Inc. | 4898 | Used as received. |
| Silver Trifluoroacetate | Oakwood Chemicals | 007271 | Used as received. |
| Phenyl Iodide | Oakwood Chemicals | 003461 | Used as received. |
| Acetic Acid | Fisher Chemical | A38 | Used as received. |
| 1,1,1,3,3,3-Hexafluoroisopropanol | Oakwood Chemicals | 003409 | Used as received. |
| Deionized Water | Obtained from in-house deionized water system. | ||
| Dry Ice | Carbonic Enterprises Dry Ice Inc. | Non-food grade dry ice. | |
| Concentrated Hydrochloric Acid | Fisher Chemical | A144SI | Diluted to a 1.2 M solution prior to use. |
| Diethyl Ether, Certified | Fisher Chemical | E138 | Used as received. |
| Hexanes, Certified ACS | Fisher Chemical | H292 | Used as received. |
| Saturated Ammonium Hydroxide | Fisher Chemical | A669 | Used as received. |
| Dichloromethane | Fisher Chemical | D37 | Used as received. |
| Sodium Sulfate, Anhydrous | Oakwood Chemicals | 044702 | Used as received. |
| 250 mL Separatory Funnel | Prepared in-house by staff glassblower. | ||
| 100 mL Round Bottom Flask | Prepared in-house by staff glassblower. | ||
| Scientific Disposable Funnel | Caplugs | 2085136030 | |
| Borosilicate Glass Scintillation Vials, 20 mL | Fisher Scientific | 03-337-15 | |
| 5 mm O.D. Thin Walled Precision NMR Tubes | Wilmad | 666000575 | |
| Chloroform-d | Cambridge Isotope Laboratories, Inc. | DLM-7 | Used as received. |
References
- Verboom, W. Selected Examples of High-Pressure Reactions in Glass Microreactors. Chemical Engineering and Technology. 32 (11), 1695-1701 (2009).
- Schettino, V., Bini, R. Constraining Molecules at the Closest Approach: Chemistry at High Pressure. Chemical Society Reviews. 36, 869-880 (2007).
- Hemminger, O., Marteel, A., Mason, M. R., Davies, J. A., Tadd, A. R., Abraham, M. A. Hydroformylation of 1-Hexene in Supercritical Carbon Dioxide Using a Heterogeneous Rhodium Catalyst. 3. Evaluation of Solvent Effects. Green Chemistry. 4, 507-512 (2002).
- Mo, F., Dong, G. Regioselective Ketone α-Alkylation with Simple Olefins via Dual Activation. Science. 345 (6192), 68-72 (2014).
- Schultz, A. G., Kirincich, S. J., Rahm, R. Asymmetric Organic Synthesis. Preparation and Birch Reduction-Alkylation of 2-Methyl-3,4-Dihydroisoquinolin-1-ones. Tetrahedron Letters. 36 (26), 4551-4554 (1995).
- Dong, L., Aleem, S., Fink, C. A. Microwave-Accelerated Reductive Amination Between Ketones and Ammonium Acetate. Tetrahedron Letters. 51 (39), 5210-5212 (2010).
- Wang, D., Astruc, D. The Golden Age of Transfer Hydrogenation. Chemical Reviews. 115 (13), 6621-6686 (2015).
- Morimoto, T., Kakiuchi, K. Evolution of Carbonylation Catalysis: No Need for Carbon Monoxide. Angewandte Chemie International Edition in English. 43 (42), 5580-5588 (2004).
- Iranpoor, N., Firouzabadi, H., Motevalli, S., Talebi, M. Palladium-Free Aminocarbonylation of Aryl, Benzyl, and Styryl Iodides and Bromides by Amines Using Mo(CO)6 and Norbornadiene. Tetrahedron. 69 (1), 418-426 (2013).
- Ren, W., Yamane, M. Mo(CO)6-Mediated Carbamoylation of Aryl Halides. Journal of Organic Chemistry. 75 (24), 8410-8415 (2010).
- Wang, H., Dong, B., Wang, Y., Li, J., Shi, Y. A Palladium-Catalyzed Regioselective Hydroesterification of Alkenylphenols to Lactones with Phenyl Formate as CO Source. Organic Letters. 16 (1), 186-189 (2014).
- Zhang, Y., Chen, J. -. L., Chen, Z. -. B., Zhu, Y. -. M., Ji, S. -. J. Palladium-Catalyzed Carbonylative Annulation Reactions Using Aryl Formate as a CO Source: Synthesis of 2-Substituted Indene-1,3(2H)-Dione Derivatives. Journal of Organic Chemistry. 80 (21), 10643-10650 (2015).
- Wan, Y., Alterman, M., Larhed, M., Hallberg, A. Dimethylformamide as a Carbon Monoxide Source in Fast Palladium-Catalyzed Aminocarbonylations of Aryl Bromides. Journal of Organic Chemistry. 67 (17), 6232-6235 (2002).
- Gockel, S. N., Hull, K. L. Chloroform as a Carbon Monoxide Precursor: In or Ex Situ Generation of CO for Pd-Catalyzed Aminocarbonylations. Organic Letters. 17 (13), 3236-3239 (2015).
- Zhao, H., Du, H., Yuan, X., Wang, T., Han, W. Iron-Catalyzed Carbonylation of Aryl Halides with Arylborons Using Stoichiometric Chloroform as the Carbon Monoxide Source. Green Chemistry. 18, 5782-5787 (2016).
- Chen, P., Xu, C., Yin, H., Gao, X., Qu, L. Shock Induced Conversion of Carbon Dioxide to Few Layer Graphene. Carbon. , 471-476 (2017).
- Iijima, T., Yamaguchi, T. Efficient Regioselective Carboxylation of Phenol to Salicylic Acid with Supercritical CO2 in the Presence of Alumnium Bromide. Journal of Molecular Catalysis A: Chemical. 295 (1-2), 52-56 (2008).
- Jevtovikj, I., Manzini, S., Hanauer, M., Rominger, F., Schaub, T. Investigations on the Catalytic Carboxylation of Olefins with CO2 Towards α, β-Unsaturated Carboxylic Acid Salts: Characterization of Intermediates and Ligands as well as Substrate Effects. Dalton Transactions. 44, 11083-11094 (2015).
- Juliá-Hernández, F., Moragas, T., Cornella, J., Martin, R. Remote Carboxylation of Halogenated Aliphatic Hydrocarbons with Carbon Dioxide. Nature. 545, 84-88 (2017).
- North, M., Pasquale, R. Mechanism of Cyclic Carbonate Synthesis from Epoxides and CO2. Angewandte Chemie International Edition. 48 (16), 2946-2948 (2009).
- Yeung, C. S., Dong, V. M. Beyond Aresta's Complex: Ni- and Pd-Catalyzed Organozinc Coupling to CO2. Journal of the American Chemical Society. 130 (25), 7826-7827 (2008).
- Zhu, D. -. Y., Fang, L., Han, H., Wang, Y., Xia, J. -. B. Reductive CO2 Fixation via Tandem C-C and C-N Bond Formation: Synthesis of Spiro-Indopyrrolidines. Organic Letters. 19 (16), 4259-4262 (2017).
- Kapoor, M., Liu, D., Young, M. C. Carbon Dioxide Mediated C(sp3)–H Arylation of Amine Substrates. J. Am. Chem. Soc. , (2018).
- Zhang, Y. -. F., Zhao, H. -. W., Wang, H., Wei, J. -. B., Shi, Z. -. J. Readily Removable Directing Group Assisted Chemo- and Regioselective C(sp3)-H Activation by Palladium Catalysis. Angewandte Chemie International Edition. 54 (46), 13686-13690 (2015).
- He, G., Chen, G. A Practical Strategy for the Structural Diversification of Aliphatic Scaffolds Through the Palladium-Catalyzed Picolinamide-Directed Remote Functionalization of Unactivated C(sp3)-H Bonds. Angewandte Chemie International Edition. 50 (22), 5192-5196 (2011).
- Nack, W. A., Wang, X., Wang, B., He, G., Cheng, G. Palladium-Catalyzed Picolinamide-Directed Iodination of Remote ortho-C-H Bonds of Arenes: Synthesis of Tetrahydroquinolines. Beilstein Journal of Organic Chemistry. 12, 1243-1249 (2016).
- Feng, P., Li, M., Ge, H. Room Temperature Palladium-Catalyzed Decarboxylative ortho-Acylation of Acetanilides with α-Oxocarboxylic Acids. Journal of the American Chemical Society. 132 (34), 11898-11899 (2010).
- Coomber, C. E., Benhamou, L., Bučar, D. -. K., Smith, P. D., Porter, M. J., Sheppard, T. D. Silver-Free Palladium-Catalyzed C(sp3)-H Arylation of Saturated Bicyclic Amine Scaffolds. Journal of Organic Chemistry. 83 (5), 2495-2503 (2018).
- Mei, T. -. S., Wang, X., Yu, J. -. Q. Pd(II)-Catalyzed Amination of C-H Bonds Using Single-Electron or Two-Electron Oxidants. Journal of the American Chemical Society. 131 (31), 10806-10807 (2009).
- Xie, W., Yang, J., Wang, B., Li, B. Regioselective Ortho Olefination of Aryl Sulfonamide via Rhodium-Catalyzed Direct C-H Bond Activation. Journal of Organic Chemistry. 79 (17), 8278-8287 (2014).
- Rodriguez, N., Romero-Revilla, J. A., Fernández-Ibáñez, M. &. #. 1. 9. 3. ;., Carretero, J. C. Palladium-Catalyzed N-(2-pyridyl)sulfonyl-Directed C(sp3)-H γ-Arylation of Amino Acid Derivatives. Chemical Science. 4, 175-179 (2013).
- Zheng, Y., Song, W., Zhu, Y., Wei, B., Xuan, L. Pd-Catalyzed Acetoxylation of γ-C(sp3)-H Bonds of Amines Directed by a Removable Bts-Protecting Group. Journal of Organic Chemistry. 83 (4), 2448-2454 (2018).
- Jain, P., Verma, P., Xia, G., Yu, J. -. Q. Enantioselective Amine α-Functionalization Via Palladium-Catalysed C-H Arylation of Thioamides. Nature Chemistry. 9, 140-144 (2017).
- Tran, A. T. Practical Alkoxythiocarbonyl Auxiliaries for Ir(I)-Catalyzed C-H Alkylation of Azacycles. Angewandte Chemie International Edition. 56 (35), 10530-10534 (2017).
- Huang, Z., Wang, C., Dong, G. A Hydrazone-Based exo-Directing Group Strategy for β-C-H Oxidation of Aliphatic Amines. Angewandte Chemie International Edition. 55 (17), 5299-5303 (2016).
- Xu, Y., Young, M. C., Wang, C., Magness, D. M., Dong, G. Catalytic C(sp3)-H Arylation of Free Primary Amines via an in situ Generated Exo-Directing Group. Chemie International Edition. 55 (31), 9084-9087 (2016).
- Liu, Y., Ge, H. Site-Selective C-H Arylation of Primary Aliphatic Amines Enabled by a Catalytic Transient Directing Group. Nature Chemistry. 9, 26-32 (2017).
- Wu, Y., Chen, Y. -. Q., Liu, T., Eastgate, M. D., Yu, J. -. Q. Pd-Catalyzed γ-C(sp3)-H Arylation of Free Amines Using a Transient Directing Group. Journal of the American Chemical Society. 138 (44), 14554-14557 (2016).
- Yada, A., Liao, W., Sato, Y., Murakami, M. Buttressing Salicylaldehydes: A Multipurpose Directing Group for C(sp3)-H Bond Activation. Angewandte Chemie International Edition. 56 (4), 1073-1076 (2017).
- Baldwin, B. W., Kuntzleman, T. S. Liquid CO2 in Centrifuge Tubes: Separation of Chamazulene from Blue Tansy (Tanacetum annum) Oil via Extraction and Thin-Layer Chromatography. Journal of Chemical Education. 95 (4), 620-624 (2018).
- McKenzie, L. C., Thompson, J. E., Sullivan, R., Hutchison, J. E. Green Chemical Processing in the Teaching Laboratory: A Convenient Liquid CO2 Extraction of Natural Products. Green Chemistry. 6, 355-358 (2004).
- Hudson, R., Ackerman, H. M., Gallo, L. K., Gwinner, A. S., Krauss, A., Sears, J. D., Bishop, A., Esdale, K. N., Katz, J. L. CO2 Dry Cleaning: A Benign Solvent Demonstration Accessible to K-8 Audiences. Journal of Chemical Education. 94, 480-482 (2017).
- Barcena, H., Chen, P. An Anesthetic Drug Demonstration and an Introductory Antioxidant Activity Experiment with "Eugene, the Sleepy Fish.". Journal of Chemical Education. 93, 202-205 (2016).
- Bodsgard, B. R., Lien, N. R., Waulters, Q. T. Liquid CO2 Extraction and NMR Characterization of Anethole from Fennel Seed: A General Chemistry Laboratory. Journal of Chemical Education. 93, 397-400 (2016).
- Fishbane, P. M., Gasiorowicz, S. G., Thornton, S. T. . Physics for Scientists and Engineers. , (2005).
- Rumpf, B., Xia, J., Maurer, G. Solubility of Carbon Dioxide in Aqueous Solutions Containing Acetic Acid or Sodium Hydroxide in the Temperature Range from 313 to 433 K and at Total Pressures up to 10 MPa. Industrial & Engineering Chemistry Research. 37, 2012-2019 (1998).
- Luo, J., Larrosa, I. C-H Carboxylation of Aromatic Compounds Through CO2 Fixation. ChemSusChem: Chemistry & Sustainability, Energy & Materials. 10, 3317-3332 (2017).
- Manjolinho, F., Arndt, M., Gooßen, K., Gooßen, L. J. Catalytic C-H Carboxylation of Terminal Alkynes with Carbon Dioxide. ACS Catalysis. 2, 2014-2021 (2012).
- Banerjee, A., Dick., G. R., Yoshino, T., Kanan, M. W. Carbon Dioxide Utilization via Carbonate-Promoted C-H Carboxylation. Nature. 531, 215-219 (2016).
- Fei, H., Sampson, M. D., Lee, Y., Kubiak, C. P., Cohen, S. M. Photocatalytic CO2 Reduction to Formate Using a Mn(I) Molecular Catalyst in a Robust Metal-Organic Framework. Inorganic Chemistry. 54, 6821-6828 (2015).
- Chabolla, S. A., Yang, J. Y. For CO2 Reduction, Hydrogen-Bond Donors Do the Trick. ACS Central Science. 4, 315-317 (2018).
- Kim, D., Kley, C. S., Li, Y., Yang, P. Copper Nanoparticle Ensembles for Selective Electroreduction of CO2 to C2-C3 Products. Proceedings of the National Academy of Sciences of the United States of America. , C2-C3 (2017).
- Liu, Q., Wu, L., Jackstell, R., Beller, M. Using carbon dioxide as a building block in organic synthesis. Nature Communications. 6, 5933-5945 (2015).
- Hâncu, D., Green, J., Beckman, E. J. H2O2 in CO2 Sustainable Production and Green Reactions. Accounts of Chemical Research. 35, 757-764 (2002).
- Ballivet-Tkatchenko, D., Camy, S., Condoret, J. S., Lichtofouse, E., Scwarzbauer, J., Robert, D. Carbon Dioxide, a Solvent and Synthon for Green Chemistry. Environmental Chemistry. , 541-552 (2005).
- Hyatt, J. A. Liquid and Supercritical Carbon Dioxide as Organic Solvents. Journal of Organic Chemistry. 49, 5097-5101 (1984).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved