Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Достижение умеренного давления в герметичных сосудов с помощью сухого льда в качестве источника твердых CO2
В этой статье
Резюме
Здесь мы представляем протокол для проведения реакции в простой реакции сосудов под низким средним давлением CO2. Реакции могут выполняться в различных судов просто управляющей диоксида углерода в виде сухого льда, без необходимости в дорогостоящих или разработки оборудования или установок.
Аннотация
Здесь представлена общая стратегия для выполнения реакций под легкой до умеренной CO2 давления с сухим льдом. Этот метод устраняет необходимость для специализированного оборудования для достижения скромного давления и может использоваться даже для достижения более высокого давления в более специализированное оборудование и крепкий реакции сосудов. В конце реакции флаконов может быть легко редуктором, открыв при комнатной температуре. В настоящем примере CO2 служит предполагаемый руководства группы, а также способ пассивации Амин субстратов, тем самым предотвращая окисление во время металлоорганические реакции. В дополнение к легко добавлены, руководство группы также удаляется под вакуумом, избавит от необходимости для обширных очистки для удаления руководства группы. Эта стратегия позволяет легким γ-C(sp3)-H арилирования алифатических аминов и имеет потенциал, чтобы применяться к целый ряд других реакций на основе аминов.
Введение
Для использования газообразных соединений в химических реакциях обычно требуется специализированное оборудование и процедуры1,2. В ходе лабораторных некоторые газы могут быть добавлены непосредственно из бака, используя регулятор высокого давления3. Альтернативный метод заключается в конденсации газ под криогенных условий4,5. Несмотря на полезность, эти стратегии требуют использования специализированных давления реакторов с клапанами, которые могут быть дорого для параллельно многочисленные реакции. Поэтому это может значительно замедлить темпы, на какой реакции можно продолжить скрининга. В результате химики нашли желательно ввести эти соединения, с помощью альтернативных методов. Аммиака могут быть добавлены к реакциям, используя различные аммониевых солей карбоксилат, воспользовавшись слабым равновесия между этими соли и6свободный аммиак. Гидрирование передачи является важной стратегией для сокращения реакции олефины, карбонил и нитро групп, обходит использования легковоспламеняющихся водорода с соединениями, например аммония формате или гидразина как носители H27. Еще один газ интерес в этой области является окись углерода8 -CO может быть созданный в situ путем освобождения от металлических карбонильные комплексы9,10, или в качестве альтернативы он может быть порождена decarbonylation от источников, таких как форматах formamides11,12,13 или хлороформ14,и15.
Один газ, который не пользуется значительным событием в этом отношении является двуокись углерода16. Одна из причин этого является, что множество преобразований, которые связаны с CO2 также требуют высоких температур и давления и таким образом автоматически отводится специализированным реакторов17,18. Недавние усилия для разработки более реактивный катализаторы, однако, облегчили выполнение многих из этих реакций под атмосферным давлением CO219,20,,2122. Недавно мы обнаружили реакции, в котором двуокиси углерода могут использоваться для посредничества γ-C (sp3) – H арилирования Алифатические амины23. Ожидается, что эта стратегия была объединить преимущества подхода статической направляющей группы , включая Амида24,25,26,27,28, сульфаниламиды 29 , 30 , 31 , 32,33,thiocarbonyl34или35гидразоны-на основе направления групп (химическая robusticity), с легкостью переходных руководство группы (снижение шаг экономики)36, 37,,3839.
Хотя реакция может происходить при атмосферном давлении CO2, необходимость Шленк настройки экрана реакций, оказались чрезмерно медленно. Кроме того повышение давления, слегка привело к Улучшена реакция урожайности, но не могут быть достигнуты легко с помощью строки Шленк. Поэтому мы искали альтернативную стратегию, и впоследствии определены что сухого льда может легко использоваться как твердого источника CO2 , которые могут быть добавлены к различным реакции сосудов представить необходимое количество углекислого газа для достижения умеренной давление (рис. 1). Хотя недостаточно в синтезе, аналогичная стратегия является довольно распространенным, как метод для создания жидкого CO2 для хроматографии и извлечения приложений40,,4142,43, 44. Используя эту стратегию позволило нашей группы быстро экрана большого количества реакций параллельно, в то время как возможность доступа к умеренной CO2 давления между 2-20 атмосфер имеют решающее значение для повышения урожайности реакций. В этих условиях начальных (1°) и средних (2°) амины может быть arylated с электронно богатых и бедных арил галогениды электронов.
протокол
Предупреждение: 1) следующие протоколы были признаны безопасно через повторные испытания. Однако следует проявлять осторожность при герметизации флаконов, на протяжении реакции, и особенно при открытии реакции, как неоднородность в реакции флаконов может привести к неисправности оборудования. Пузырьки должны быть проверены на физических дефектов до использования. Флаконы должны находиться позади щита взрыв в той или иной форме или не створки капота сразу же после того, как уплотнение для предотвращения инцидентов следует флаконов. 2) хотя существует мало шансов для удушья из-за небольшого количества CO2 используется, реакции должен быть настроен, а также открыт в хорошо проветриваемом помещении или в зонта. 3) сухого льда Криоген и может вызвать повреждения серьезные тканей. Таким образом, проявлять осторожность во время манипулирования его, чтобы избежать обморожения, такие, как ограничение прямого контакта или с использованием криогенных перчатки. 4) сухого льда будет конденсации водяного пара, означает, что до использования, следует механически расслаивается сухого льда, чтобы убедиться, что масса CO2 (s) только. Это может быть достигнуто путем просто затирание сухой лед между пальцам, или более безопасно, втирая его между пальцам с защитным слоем как перчатка или полотенце.
1. реакции в 7,5 мл флаконе (Air не исключены)
- Добавьте панель переполох в сухой 7,5 мл флакон.
- Добавьте ацетата палладия (6,7 мг, 0,03 ммоль) во флаконе.
- Добавьте Серебряный trifluoroacetate (99.9 мг, 0,45 ммоль) во флаконе.
- Добавьте фенил йодид (92.3 мг, 0,45 ммоль) во флаконе.
- Добавить трет-Амиловый Амин (26.3 мг, 0.30 ммоль) в пузырек.
- Добавьте уксусной кислоты (1.0 мл) во флаконе.
Примечание: Соотношение объема раствора на флаконе размер имеет важное значение, как немедленное сублимации CO2 при добавлении сухого льда механически могут сместить растворителя, если слишком много используется относительно размера реакции судна. - Добавьте деионизированной воды (21,7 мкл, 12.1 ммоль) флакон.
- Вес сухого льда (26.3 мг, 0,60 ммоль), и сразу же добавить сухой лед флакона, обеспечивая при этом также немедленно печать флакон с крышкой из ПТФЭ выстроились.
Примечание: Вся операция должна быть выполнена в течение примерно 5 секунд, чтобы предотвратить сублимации и бежать небольшое количество CO2 добавил (это замедлил формирование замороженных уксусной кислоты вокруг сухой лед). Приближенное значение будет количество CO2 добавлена, и в наших руках допустимо отклонение в нескольких мг. - Перемешайте флакона запечатанном реакции на 15 минут при комнатной температуре.
- Передача реакционный сосуд на подогретую тарелку на 110 ° C и перемешайте 14 часов, прежде чем разрешить охладить.
- После охлаждения, осторожно откройте флакон провентилировать CO2.
- Удалите все из летучих веществ в вакууме.
Примечание: Эта операция может быть выполнена во флаконе, или решение может быть передано более круглым дном колбу. - Добавить 1,2 М HCl(aq) (6 мл) в реакционной смеси и перемешать открыты для воздуха на 15 минут.
- Трансфер водная фракция в воронку separatory, мытье с дополнительным 1.2 М HCl (4 мл) и извлечь с диэтиловым эфиром/гексаны 1:1 смесь (3 x 8 мл).
Примечание: Это органические мыть содержит избыточные фенил йодида и других нейтральных побочных продуктов и могут быть удалены. - Нейтрализовать и сделать основной водный раствор с добавлением насыщенных NH4OH(aq) (10 мл является хорошей отправной точкой).
- Экстракт водный слой с Дихлорметан (2 x 10 мл).
- Сухие комбинированные органические фракции за Na2,4, а затем фильтр в образец тарированного флаконе.
- Испарения растворителя в вакууме, давая продукт (2-метил-4-фенил butanamine) как желтое масло.
2. реакция в 7,5 мл флаконе (очистка условий – воздуха исключены)
- Добавьте панель переполох в сухой 7,5 мл флакон.
- Добавьте ацетата палладия (6,7 мг, 0,03 ммоль) во флаконе.
- Добавьте Серебряный trifluoroacetate (99.9 мг, 0,45 ммоль) во флаконе.
- Добавьте фенил йодид (92.3 мг, 0,45 ммоль) во флаконе.
- Добавить трет-Амиловый Амин (26.3 мг, 0.30 ммоль) в пузырек.
- Добавьте уксусной кислоты (1.0 мл) во флаконе.
Примечание: Соотношение объема раствора на флаконе размер имеет важное значение, как немедленное сублимации CO2 при добавлении сухого льда механически могут сместить растворителя, если слишком много используется относительно размера реакции судна. - Добавьте деионизированной воды (21,7 мкл, 12.1 ммоль) флакон.
- Масса тары флакона на баланс, добавить примерно 98 мг сухого льда и, а затем CO2 сублимировать выключения, пока не будет достигнуто окончательное масса приблизительно 26 мг, следуют сразу герметизации флакон с крышкой из ПТФЭ выстроились.
Примечание: Если желательно, этот шаг может выполняться с большей массы сухого льда далее исключить воздух из флакона. Примечательно, что это может ввести воду и таким образом не может быть наиболее эффективной стратегией для воды чувствительных реакций. - Перемешайте флакона запечатанном реакции на 15 минут при комнатной температуре.
- Передача реакционный сосуд на подогретую тарелку на 110 ° C и перемешайте 14 часов, прежде чем разрешить охладить.
- После охлаждения, осторожно откройте флакон провентилировать CO2.
- Удалите все из летучих веществ в вакууме.
Примечание: Эта операция может быть выполнена во флаконе, или решение может быть передано более круглым дном колбу. - Добавить 1,2 М HCl(aq) (6 мл) в реакционной смеси и перемешать открыты для воздуха на 15 минут.
- Трансфер водная фракция в воронку separatory, мытье с дополнительным 1.2 М HCl (4 мл) и извлечь с диэтиловым эфиром/гексаны 1:1 смесь (3 x 8 мл).
Примечание: Это органические мыть содержит избыточные фенил йодида и других нейтральных побочных продуктов и могут быть удалены. - Нейтрализовать и сделать основной водный раствор с добавлением насыщенных NH4OH(aq) (10 мл является хорошей отправной точкой).
- Экстракт водный слой с Дихлорметан (2 x 10 мл).
- Сухие комбинированные органические фракции за Na2,4, а затем фильтр в образец тарированного флаконе.
- Испарения растворителя в вакууме, давая продукт (2-метил-4-фенил butanamine) как желтое масло.
3. реакция в 40 мл флаконе (Air не исключены)
- Добавьте панель переполох в сухой 40 мл во флаконе.
- Добавьте ацетата палладия (33.5 мг, 0,15 ммоль) во флаконе.
- Добавьте Серебряный trifluoroacetate (499.5 мг, 2,25 ммоль) во флаконе.
- Добавьте фенил йодид (461.5 мг, 2,25 ммоль) во флаконе.
- Добавьте трет Амиловый Амин (131,5 мг, 1,5 ммоль) во флаконе.
- Добавьте уксусной кислоты (5,0 мл) во флаконе.
Примечание: Соотношение объема раствора на флаконе размер имеет важное значение, как немедленное сублимации CO2 при добавлении сухого льда механически могут сместить растворителя, если слишком много используется относительно размера реакции судна. - Добавьте деионизированной воды (108,5 мкл, 6,02 ммоль) флакон.
- Вес сухого льда (131,5 мг, 3.0 ммоль) и сразу же добавить сухой лед флакона, обеспечивая также немедленно закрыть флакон с крышкой из ПТФЭ выстроились.
Примечание: Вся операция должна быть выполнена в течение примерно 5 секунд, чтобы предотвратить сублимации и бежать небольшое количество CO2 добавил (это замедлил формирование замороженных уксусной кислоты вокруг сухой лед). Приближенное значение будет количество CO2 добавлена, и в наших руках допустимо отклонение в нескольких мг. - Перемешайте флакона запечатанном реакции на 15 минут при комнатной температуре.
- Передача реакционный сосуд на подогретую тарелку на 110 ° C и перемешайте 14 часов, прежде чем разрешить охладить.
- После охлаждения, осторожно откройте флакон провентилировать CO2.
- Удалите все из летучих веществ в вакууме.
Примечание: Эта операция может быть выполнена во флаконе, или решение может быть передано более круглым дном колбу. - Добавить 1,2 М HCl(aq) (30 мл) в реакционной смеси и перемешать открыты для воздуха на 15 минут.
- Трансфер водная фракция в воронку separatory, мытье с дополнительным 1.2 М HCl (20 мл) и экстракт с диэтиловым эфиром/гексаны 1:1 смесь (3 x 8 мл).
Примечание: Это органические мыть содержит избыточные фенил йодида и других нейтральных побочных продуктов и могут быть удалены. - Нейтрализовать и сделать основной водный раствор с добавлением насыщенных NH4OH(aq) (10 мл является хорошей отправной точкой).
- Экстракт водный слой с Дихлорметан (2 x 20 мл).
- Сухие комбинированные органические фракции за Na2,4, а затем фильтр в образец тарированного флаконе.
- Испарения растворителя в вакууме, давая продукт (2-метил-4-фенил butanamine) как желтое масло.
4. реакция в 35 мл давления трубка (Air не исключены)
- Добавьте панель переполох в сухой 35 мл давления.
- Добавьте ацетата палладия (6,7 мг, 0,03 ммоль) в трубе давления.
- Добавьте Серебряный trifluoroacetate (132.5 мг, 0,6 ммоль) к трубе давления.
- Добавьте фенил йодид (183,6 мг, 0,9 ммоль) в трубе давления.
- Добавить 2-метил -N-(3-methylbenzyl) Бутан-2-Амин (57.4 мг, 0,3 ммоль) для труб давление.
- Добавьте уксусной кислоты (1.0 мл) во флаконе, следуют 1,1,1,3,3,3,-hexafluoroisopropanol (1.0 мл).
Примечание: Соотношение объема раствора на флаконе размер имеет важное значение, как немедленное сублимации CO2 при добавлении сухого льда механически могут сместить растворителя, если слишком много используется относительно размера реакции судна. - Добавьте деионизированной воды (21,7 мкл, 1,2 ммоль) давления трубы.
- Вес сухого льда (1.32 g, 30 ммоль), и сразу же добавить сухой лед давления трубка, обеспечивая при этом также немедленно печать давления Трубка с соответствующим тефлон колпачок.
Примечание: Вся операция должна быть выполнена в течение примерно 5 секунд, чтобы предотвратить сублимации и бежать небольшое количество CO2 добавил (это замедлил формирование замороженных уксусной кислоты вокруг сухой лед). Приближенное значение будет количество CO2 добавлена, и в наших руках допустимо отклонение в нескольких мг. - Перемешайте запечатанном сосуде на 15 минут при комнатной температуре.
- Передача реакционный сосуд на подогретую тарелку на 90 ° C и перемешать на 24 часа, прежде чем разрешить охладить.
- После охлаждения, положить полотенце или мягкие перчатка над крышкой и тщательно открыть давления трубы вентиляционные CO2.
- Удалите все из летучих веществ в вакууме.
Примечание: Эта операция может быть выполнена в трубе давления с соответствующим адаптером, или решение может быть передано более круглым дном колбу. - Добавить 1,2 М HCl(aq) (12 мл) в реакционной смеси и перемешать открыты для воздуха на 15 минут.
- Трансфер водная фракция в воронку separatory, мытье с дополнительным 1.2 М HCl (8 мл) и извлечь с диэтиловым эфиром/гексаны 1:1 смесь (3 x 8 мл).
Примечание: Это органические мыть содержит избыточные фенил йодида и других нейтральных побочных продуктов и могут быть удалены. - Нейтрализовать и сделать основной водный раствор с добавлением насыщенных NH4OH(aq) (10 мл является хорошей отправной точкой).
- Экстракт водный слой с Дихлорметан (2 x 10 мл).
- Сухие комбинированные органические фракции за Na2,4, а затем фильтр в образец тарированного флаконе.
- Испарения растворителя в вакууме, давая продукт (2-Methyl-N-(3-methylbenzyl)-4-phenylbutan-2-amine) как желтое масло.
Результаты
После эти протоколы это можно поручить реакции флакон с соответствующим количеством углекислого газа для достижения химических реакций, которые требуют CO2 атмосфер. Давление в шаге 1 рассчитывается как приблизительно 3 атмосфер (см. обсуждение для определения э?...
Обсуждение
С помощью ван дер Ваальса уравнение состояния, приблизительное давление этих систем может быть вычисляемых45
Уравнение 1: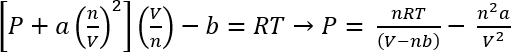
В условиях протокола 1, мы можем предположить 26,3 мг CO2 дает n = 5,98 x 10-4
Раскрытие информации
Использование CO2 в качестве руководства группы для активации C-H Льюис основные субстратов в настоящее время в центре внимания предварительный патент США #62/608, 074.
Благодарности
Авторы хотели бы отметить начальное финансирование от Университет Толедо, а также средства от американского химического общества Фонд Германа Frasch в частичной поддержке этой работы. Г-н Томас Кина признается за его помощь в разработке подходящих манометр для измерения давления реакции. Г-н Стив Modar поблагодарил за полезные дискуссии.
Материалы
| Name | Company | Catalog Number | Comments |
| 7.5 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-00984 | Can be reused. |
| 40 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-01039 | Can be reused. |
| Pressure Tube, #15 Thread, 7" Long, 25.4 mm O.D. | Ace Glass | 8648-06 | Can be reused. |
| Pie-Block for 2 Dram Vials | ChemGlass | CG-1991-P14 | Can be reused. |
| Pie-Block for 10 Dram Vials | ChemGlass | CG-1991-P12 | Can be reused. |
| 3.2 mm PTFE Disposable Stir Bars | Fisher | 14-513-93 | Can be reused. |
| C-MAG HS 7 Control Hotplate | IKA | 20002695 | |
| Analytical Weighing Balance | Sartorius | QUINTIX2241S | |
| Double-Ended Micro-Tapered Spatula | Fisher Scientific | 21-401-10 | |
| Hei-VAP Advantage - Hand Lift Model with G5 Dry Ice Condenser Rotary Evaporator | Heidolph | 561-01500-00 | |
| Bump Trap 14/20 Joint | ChemGlass | CG-1322-01 | |
| tert-Amyl amine | Alfa Aesar | B24639-14 | Used as received. |
| 2-Methyl-N-(3-methylbenzyl)butan-2-amine | N/A | N/A | Prepared from reductive amination of tert-amyl amine and 3-tolualdehyde in the presence of sodium borohydride in methanol. |
| Palladium Acetate | Chem-Impex International, Inc. | 4898 | Used as received. |
| Silver Trifluoroacetate | Oakwood Chemicals | 007271 | Used as received. |
| Phenyl Iodide | Oakwood Chemicals | 003461 | Used as received. |
| Acetic Acid | Fisher Chemical | A38 | Used as received. |
| 1,1,1,3,3,3-Hexafluoroisopropanol | Oakwood Chemicals | 003409 | Used as received. |
| Deionized Water | Obtained from in-house deionized water system. | ||
| Dry Ice | Carbonic Enterprises Dry Ice Inc. | Non-food grade dry ice. | |
| Concentrated Hydrochloric Acid | Fisher Chemical | A144SI | Diluted to a 1.2 M solution prior to use. |
| Diethyl Ether, Certified | Fisher Chemical | E138 | Used as received. |
| Hexanes, Certified ACS | Fisher Chemical | H292 | Used as received. |
| Saturated Ammonium Hydroxide | Fisher Chemical | A669 | Used as received. |
| Dichloromethane | Fisher Chemical | D37 | Used as received. |
| Sodium Sulfate, Anhydrous | Oakwood Chemicals | 044702 | Used as received. |
| 250 mL Separatory Funnel | Prepared in-house by staff glassblower. | ||
| 100 mL Round Bottom Flask | Prepared in-house by staff glassblower. | ||
| Scientific Disposable Funnel | Caplugs | 2085136030 | |
| Borosilicate Glass Scintillation Vials, 20 mL | Fisher Scientific | 03-337-15 | |
| 5 mm O.D. Thin Walled Precision NMR Tubes | Wilmad | 666000575 | |
| Chloroform-d | Cambridge Isotope Laboratories, Inc. | DLM-7 | Used as received. |
Ссылки
- Verboom, W. Selected Examples of High-Pressure Reactions in Glass Microreactors. Chemical Engineering and Technology. 32 (11), 1695-1701 (2009).
- Schettino, V., Bini, R. Constraining Molecules at the Closest Approach: Chemistry at High Pressure. Chemical Society Reviews. 36, 869-880 (2007).
- Hemminger, O., Marteel, A., Mason, M. R., Davies, J. A., Tadd, A. R., Abraham, M. A. Hydroformylation of 1-Hexene in Supercritical Carbon Dioxide Using a Heterogeneous Rhodium Catalyst. 3. Evaluation of Solvent Effects. Green Chemistry. 4, 507-512 (2002).
- Mo, F., Dong, G. Regioselective Ketone α-Alkylation with Simple Olefins via Dual Activation. Science. 345 (6192), 68-72 (2014).
- Schultz, A. G., Kirincich, S. J., Rahm, R. Asymmetric Organic Synthesis. Preparation and Birch Reduction-Alkylation of 2-Methyl-3,4-Dihydroisoquinolin-1-ones. Tetrahedron Letters. 36 (26), 4551-4554 (1995).
- Dong, L., Aleem, S., Fink, C. A. Microwave-Accelerated Reductive Amination Between Ketones and Ammonium Acetate. Tetrahedron Letters. 51 (39), 5210-5212 (2010).
- Wang, D., Astruc, D. The Golden Age of Transfer Hydrogenation. Chemical Reviews. 115 (13), 6621-6686 (2015).
- Morimoto, T., Kakiuchi, K. Evolution of Carbonylation Catalysis: No Need for Carbon Monoxide. Angewandte Chemie International Edition in English. 43 (42), 5580-5588 (2004).
- Iranpoor, N., Firouzabadi, H., Motevalli, S., Talebi, M. Palladium-Free Aminocarbonylation of Aryl, Benzyl, and Styryl Iodides and Bromides by Amines Using Mo(CO)6 and Norbornadiene. Tetrahedron. 69 (1), 418-426 (2013).
- Ren, W., Yamane, M. Mo(CO)6-Mediated Carbamoylation of Aryl Halides. Journal of Organic Chemistry. 75 (24), 8410-8415 (2010).
- Wang, H., Dong, B., Wang, Y., Li, J., Shi, Y. A Palladium-Catalyzed Regioselective Hydroesterification of Alkenylphenols to Lactones with Phenyl Formate as CO Source. Organic Letters. 16 (1), 186-189 (2014).
- Zhang, Y., Chen, J. -. L., Chen, Z. -. B., Zhu, Y. -. M., Ji, S. -. J. Palladium-Catalyzed Carbonylative Annulation Reactions Using Aryl Formate as a CO Source: Synthesis of 2-Substituted Indene-1,3(2H)-Dione Derivatives. Journal of Organic Chemistry. 80 (21), 10643-10650 (2015).
- Wan, Y., Alterman, M., Larhed, M., Hallberg, A. Dimethylformamide as a Carbon Monoxide Source in Fast Palladium-Catalyzed Aminocarbonylations of Aryl Bromides. Journal of Organic Chemistry. 67 (17), 6232-6235 (2002).
- Gockel, S. N., Hull, K. L. Chloroform as a Carbon Monoxide Precursor: In or Ex Situ Generation of CO for Pd-Catalyzed Aminocarbonylations. Organic Letters. 17 (13), 3236-3239 (2015).
- Zhao, H., Du, H., Yuan, X., Wang, T., Han, W. Iron-Catalyzed Carbonylation of Aryl Halides with Arylborons Using Stoichiometric Chloroform as the Carbon Monoxide Source. Green Chemistry. 18, 5782-5787 (2016).
- Chen, P., Xu, C., Yin, H., Gao, X., Qu, L. Shock Induced Conversion of Carbon Dioxide to Few Layer Graphene. Carbon. , 471-476 (2017).
- Iijima, T., Yamaguchi, T. Efficient Regioselective Carboxylation of Phenol to Salicylic Acid with Supercritical CO2 in the Presence of Alumnium Bromide. Journal of Molecular Catalysis A: Chemical. 295 (1-2), 52-56 (2008).
- Jevtovikj, I., Manzini, S., Hanauer, M., Rominger, F., Schaub, T. Investigations on the Catalytic Carboxylation of Olefins with CO2 Towards α, β-Unsaturated Carboxylic Acid Salts: Characterization of Intermediates and Ligands as well as Substrate Effects. Dalton Transactions. 44, 11083-11094 (2015).
- Juliá-Hernández, F., Moragas, T., Cornella, J., Martin, R. Remote Carboxylation of Halogenated Aliphatic Hydrocarbons with Carbon Dioxide. Nature. 545, 84-88 (2017).
- North, M., Pasquale, R. Mechanism of Cyclic Carbonate Synthesis from Epoxides and CO2. Angewandte Chemie International Edition. 48 (16), 2946-2948 (2009).
- Yeung, C. S., Dong, V. M. Beyond Aresta's Complex: Ni- and Pd-Catalyzed Organozinc Coupling to CO2. Journal of the American Chemical Society. 130 (25), 7826-7827 (2008).
- Zhu, D. -. Y., Fang, L., Han, H., Wang, Y., Xia, J. -. B. Reductive CO2 Fixation via Tandem C-C and C-N Bond Formation: Synthesis of Spiro-Indopyrrolidines. Organic Letters. 19 (16), 4259-4262 (2017).
- Kapoor, M., Liu, D., Young, M. C. Carbon Dioxide Mediated C(sp3)–H Arylation of Amine Substrates. J. Am. Chem. Soc. , (2018).
- Zhang, Y. -. F., Zhao, H. -. W., Wang, H., Wei, J. -. B., Shi, Z. -. J. Readily Removable Directing Group Assisted Chemo- and Regioselective C(sp3)-H Activation by Palladium Catalysis. Angewandte Chemie International Edition. 54 (46), 13686-13690 (2015).
- He, G., Chen, G. A Practical Strategy for the Structural Diversification of Aliphatic Scaffolds Through the Palladium-Catalyzed Picolinamide-Directed Remote Functionalization of Unactivated C(sp3)-H Bonds. Angewandte Chemie International Edition. 50 (22), 5192-5196 (2011).
- Nack, W. A., Wang, X., Wang, B., He, G., Cheng, G. Palladium-Catalyzed Picolinamide-Directed Iodination of Remote ortho-C-H Bonds of Arenes: Synthesis of Tetrahydroquinolines. Beilstein Journal of Organic Chemistry. 12, 1243-1249 (2016).
- Feng, P., Li, M., Ge, H. Room Temperature Palladium-Catalyzed Decarboxylative ortho-Acylation of Acetanilides with α-Oxocarboxylic Acids. Journal of the American Chemical Society. 132 (34), 11898-11899 (2010).
- Coomber, C. E., Benhamou, L., Bučar, D. -. K., Smith, P. D., Porter, M. J., Sheppard, T. D. Silver-Free Palladium-Catalyzed C(sp3)-H Arylation of Saturated Bicyclic Amine Scaffolds. Journal of Organic Chemistry. 83 (5), 2495-2503 (2018).
- Mei, T. -. S., Wang, X., Yu, J. -. Q. Pd(II)-Catalyzed Amination of C-H Bonds Using Single-Electron or Two-Electron Oxidants. Journal of the American Chemical Society. 131 (31), 10806-10807 (2009).
- Xie, W., Yang, J., Wang, B., Li, B. Regioselective Ortho Olefination of Aryl Sulfonamide via Rhodium-Catalyzed Direct C-H Bond Activation. Journal of Organic Chemistry. 79 (17), 8278-8287 (2014).
- Rodriguez, N., Romero-Revilla, J. A., Fernández-Ibáñez, M. &. #. 1. 9. 3. ;., Carretero, J. C. Palladium-Catalyzed N-(2-pyridyl)sulfonyl-Directed C(sp3)-H γ-Arylation of Amino Acid Derivatives. Chemical Science. 4, 175-179 (2013).
- Zheng, Y., Song, W., Zhu, Y., Wei, B., Xuan, L. Pd-Catalyzed Acetoxylation of γ-C(sp3)-H Bonds of Amines Directed by a Removable Bts-Protecting Group. Journal of Organic Chemistry. 83 (4), 2448-2454 (2018).
- Jain, P., Verma, P., Xia, G., Yu, J. -. Q. Enantioselective Amine α-Functionalization Via Palladium-Catalysed C-H Arylation of Thioamides. Nature Chemistry. 9, 140-144 (2017).
- Tran, A. T. Practical Alkoxythiocarbonyl Auxiliaries for Ir(I)-Catalyzed C-H Alkylation of Azacycles. Angewandte Chemie International Edition. 56 (35), 10530-10534 (2017).
- Huang, Z., Wang, C., Dong, G. A Hydrazone-Based exo-Directing Group Strategy for β-C-H Oxidation of Aliphatic Amines. Angewandte Chemie International Edition. 55 (17), 5299-5303 (2016).
- Xu, Y., Young, M. C., Wang, C., Magness, D. M., Dong, G. Catalytic C(sp3)-H Arylation of Free Primary Amines via an in situ Generated Exo-Directing Group. Chemie International Edition. 55 (31), 9084-9087 (2016).
- Liu, Y., Ge, H. Site-Selective C-H Arylation of Primary Aliphatic Amines Enabled by a Catalytic Transient Directing Group. Nature Chemistry. 9, 26-32 (2017).
- Wu, Y., Chen, Y. -. Q., Liu, T., Eastgate, M. D., Yu, J. -. Q. Pd-Catalyzed γ-C(sp3)-H Arylation of Free Amines Using a Transient Directing Group. Journal of the American Chemical Society. 138 (44), 14554-14557 (2016).
- Yada, A., Liao, W., Sato, Y., Murakami, M. Buttressing Salicylaldehydes: A Multipurpose Directing Group for C(sp3)-H Bond Activation. Angewandte Chemie International Edition. 56 (4), 1073-1076 (2017).
- Baldwin, B. W., Kuntzleman, T. S. Liquid CO2 in Centrifuge Tubes: Separation of Chamazulene from Blue Tansy (Tanacetum annum) Oil via Extraction and Thin-Layer Chromatography. Journal of Chemical Education. 95 (4), 620-624 (2018).
- McKenzie, L. C., Thompson, J. E., Sullivan, R., Hutchison, J. E. Green Chemical Processing in the Teaching Laboratory: A Convenient Liquid CO2 Extraction of Natural Products. Green Chemistry. 6, 355-358 (2004).
- Hudson, R., Ackerman, H. M., Gallo, L. K., Gwinner, A. S., Krauss, A., Sears, J. D., Bishop, A., Esdale, K. N., Katz, J. L. CO2 Dry Cleaning: A Benign Solvent Demonstration Accessible to K-8 Audiences. Journal of Chemical Education. 94, 480-482 (2017).
- Barcena, H., Chen, P. An Anesthetic Drug Demonstration and an Introductory Antioxidant Activity Experiment with "Eugene, the Sleepy Fish.". Journal of Chemical Education. 93, 202-205 (2016).
- Bodsgard, B. R., Lien, N. R., Waulters, Q. T. Liquid CO2 Extraction and NMR Characterization of Anethole from Fennel Seed: A General Chemistry Laboratory. Journal of Chemical Education. 93, 397-400 (2016).
- Fishbane, P. M., Gasiorowicz, S. G., Thornton, S. T. . Physics for Scientists and Engineers. , (2005).
- Rumpf, B., Xia, J., Maurer, G. Solubility of Carbon Dioxide in Aqueous Solutions Containing Acetic Acid or Sodium Hydroxide in the Temperature Range from 313 to 433 K and at Total Pressures up to 10 MPa. Industrial & Engineering Chemistry Research. 37, 2012-2019 (1998).
- Luo, J., Larrosa, I. C-H Carboxylation of Aromatic Compounds Through CO2 Fixation. ChemSusChem: Chemistry & Sustainability, Energy & Materials. 10, 3317-3332 (2017).
- Manjolinho, F., Arndt, M., Gooßen, K., Gooßen, L. J. Catalytic C-H Carboxylation of Terminal Alkynes with Carbon Dioxide. ACS Catalysis. 2, 2014-2021 (2012).
- Banerjee, A., Dick., G. R., Yoshino, T., Kanan, M. W. Carbon Dioxide Utilization via Carbonate-Promoted C-H Carboxylation. Nature. 531, 215-219 (2016).
- Fei, H., Sampson, M. D., Lee, Y., Kubiak, C. P., Cohen, S. M. Photocatalytic CO2 Reduction to Formate Using a Mn(I) Molecular Catalyst in a Robust Metal-Organic Framework. Inorganic Chemistry. 54, 6821-6828 (2015).
- Chabolla, S. A., Yang, J. Y. For CO2 Reduction, Hydrogen-Bond Donors Do the Trick. ACS Central Science. 4, 315-317 (2018).
- Kim, D., Kley, C. S., Li, Y., Yang, P. Copper Nanoparticle Ensembles for Selective Electroreduction of CO2 to C2-C3 Products. Proceedings of the National Academy of Sciences of the United States of America. , C2-C3 (2017).
- Liu, Q., Wu, L., Jackstell, R., Beller, M. Using carbon dioxide as a building block in organic synthesis. Nature Communications. 6, 5933-5945 (2015).
- Hâncu, D., Green, J., Beckman, E. J. H2O2 in CO2 Sustainable Production and Green Reactions. Accounts of Chemical Research. 35, 757-764 (2002).
- Ballivet-Tkatchenko, D., Camy, S., Condoret, J. S., Lichtofouse, E., Scwarzbauer, J., Robert, D. Carbon Dioxide, a Solvent and Synthon for Green Chemistry. Environmental Chemistry. , 541-552 (2005).
- Hyatt, J. A. Liquid and Supercritical Carbon Dioxide as Organic Solvents. Journal of Organic Chemistry. 49, 5097-5101 (1984).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены