JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
단단한 CO2 원본으로 드라이 아이스를 사용 하 여 밀봉된 용기에 적당 한 압력을 달성
요약
여기 선물이 CO2의 낮은 중간 압력 아래 간단한 반응 용기에 반응을 수행 하기 위한 프로토콜. 반응 비용 또는 정교한 장비 또는 설정에 대 한 필요 없이 드라이 아이스의 형태로 이산화탄소를 관리 하는 것 만으로도 혈관의 다양 한 수행할 수 있습니다.
초록
여기는 드라이 아이스와 함께 적당 한 CO2 압력에 온화한에서 반응을 수행 하는 일반적인 전략 제시. 이 기술은 겸손 한 압력을 달성 하기 위해 특수 장비에 대 한 필요성을 obviates 그리고 심지어 보다 전문적인된 장비 및 sturdier 반응 용기에서 더 높은 압력을 달성 하기 위해 사용할 수 있습니다. 반응의 끝에, 튜브는 실내 온도 의해 쉽게 depressurized 될 수 있습니다. 현재 예제에서 CO2 putative 감독 그룹 뿐만 아니라 아민 기판, 유기 금속 반응 중 산화 방지 passivate 하는 방법을 제공 합니다. 쉽게 추가 되 고, 뿐만 아니라 감독 그룹은 또한 제거 진공, 아래 감독 그룹을 제거 하려면 광범위 한 정화에 대 한 필요성을 obviating. 이 전략은 지방 족 아민의 손쉬운 γ-C(sp3)-H arylation을 허용 하 고 다른 아민 기반 반응의 다양 한에 적용 될 가능성이 있다.
서문
화학 반응에서 기체 화합물의 사용은 일반적으로 전문된 장비 및 절차1,2필요합니다. 벤치 규모, 일부 가스는 고압 레 귤 레이 터3을 사용 하 여 탱크에서 직접 추가할 수 있습니다. 저온 조건4,5에서 가스를 응축 하는 대체 방법이입니다. 유용, 하지만 이러한 전략 전문된 압력 밸브, 동시에 수많은 반응 실행을 위해 금지 비용 수 있는 원자로의 사용을 해야 합니다. 이 따라서 크게는 반응에서 심사를 진행 하는 속도 느리게 할 수 있습니다. 그 결과, 화학자 나타났습니다 그것 대체 방법을 사용 하 여이 화합물을 소개 하는 것이 좋습니다. 암모니아는 반응 다른 암모늄 카복실산 염, 이러한 소금 무료 암모니아6사이의 약한 평형의 활용을 사용 하 여 추가할 수 있습니다. 전송 수소 암모늄 편대 또는 히드라 진 같은 화합물으로 가연성 수소 가스를 사용 하 여 H27의 운반대로 circumvents 올레, 생성, 및 니트로 그룹 감소 반응에 대 한 중요 한 전략 이다. 이 지역에 관심의 또 다른 가스는 일산화 탄소8 -CO 생성 된 제자리에 금속 생성 단지9,10에서 해방 하 여 수 또는 양자 택일로 그것에서 decarbonylation에 의해 생성 될 수 있습니다. formates와 formamides11,,1213 또는 클로 프롬14,15같은 소스입니다.
이 점에서 상당한 발전을 즐길 하지는 한 가스는 이산화탄소16. 이 대 한 이유 중 하나는 CO2 를 포함 하는 많은 변환 또한 높은 온도 압력를 요구 하 고 따라서 자동으로 전문된 원자로17,18에 강등입니다. 그러나 더 반응 촉매를 개발, 공동219,20,,2122의 대기 압력에서 이러한 반응의 많은 실행 하는 것을 촉진가지고 최근 노력. 우리는 최근 이산화탄소 γ C (sp3) 중재에 사용 될 수 있는 반응을 발견-지방 족 아민23H arylation. 이 전략 아 미드24,25,26,,2728, 술을 포함 하 여 정적 연출 그룹 접근 방식의 이점을 결합 하는 것으로 예상 했다 29 , 30 , 31 , 32, thiocarbonyl33,34또는 hydrazone35- 임시 감독 그룹 (감소 단계 경제)36,의 용이성과 그룹 (화학 robusticity), 감독을 기반으로 37,,3839.
반응은 CO2의 대기 압력 하에서 발생할 수 있습니다, 하지만 화면 반응 엄청나게 입증 Schlenk 설정에 대 한 필요 천천히. 또한, 약간에 지도 하는 압력을 증가 반응 수율을 개선 하지만 수 쉽게 달성 될 Schlenk 선을 사용 하 여. 우리는 그러므로 대체 전략 모색 그리고 이후에 확인 그 드라이 아이스 사용 될 수 쉽게 보통 달성 하기 위해 이산화탄소의 필요한 양을 소개 하 반응 혈관의 다양 한에 추가 될 수 있는 CO2 의 단단한 소스로 압력 (그림 1)입니다. 합성에 미달, 유사한 전략은 상당히 일반적인 크로마토그래피와 추출 응용 프로그램40,41,,4243, 액체 CO2 를 생성 하는 방법으로 44. 이 전략을 활용 하 여 허용 액세스 적당 한 CO2 의 압력 사이 2-20 대기 하는 동안 동시에 반응의 큰 숫자를 화면 빠르게 우리의 그룹 반응의 수율 향상에 중요 했다. 이러한 조건 하에서 기본 (1 °) 및 보조 (2 °) 아민 전자 부자와 가난한 aryl 할로겐 전자 arylated 될 수 있습니다.
프로토콜
주의: 1)는 다음과 같은 프로토콜 있다 간주 되었습니다 반복된 실험을 통해 안전. 그러나, 반응, 전역 병을 밀봉 할 경우 주의 행사 한다 하 고 특히 열 때 반응, 반응의 이질성으로 병으로 이어질 수 있습니다 장비 고장. 튜브 물리적인 결함이 사용 하기 전에 검사 해야 합니다. 튜브 형태의 폭발 방패 뒤에 두어야 한다 또는 후드 창틀 튜브 해야 사고를 방지 하기 위해 밀봉 한 후에 바로 실패. 2) 공동2 사용의 소량으로 질 식에 대 한 약간의 기회가 있지만, 반응 설정 해야 뿐만 아니라 통풍이 잘되는 지역에서 나는 증기 두건에서 열. 3) 드라이 아이스는 제 이며 심각한 조직 손상을 일으킬 수 있습니다. 케어 따라서 동상, 직접 접촉 제한 등 극저온 장갑 사용을 피하기 위해 그것을 조작 하는 동안 운동 한다. 4) 드라이 아이스는 사용 전에 드라이 아이스 해야 될 기계적 피부 박피 질량의 CO2 (s) 만 되도록 의미 수증기 응축 됩니다. 이 간단 하 게 드라이 아이스를 문 지르고 하 여 달성 될 수 있다 하나의 손가락, 또는, 더 안전 하 게 문 지르고 장갑 이나 수건 같은 보호 레이어를 포함 한의 손가락 사이.
1. 7.5 mL 유리병 (공기 하지 제외)에 반응
- 저 어 바 건조 7.5 mL 유리병에 추가 합니다.
- 유리병에 팔라듐 아세테이트 (6.7 mg, 0.03 mmol)을 추가 합니다.
- 유리병에 실버 trifluoroacetate (99.9 m g, 0.45 mmol)을 추가 합니다.
- 유리병에 페 닐 요오드 화물 (92.3 mg, 0.45 mmol)을 추가 합니다.
- 추가 tert-유리병에 산은 아민 (26.3 mg, 0.30 mmol).
- 유리병에 초 산 (1.0 mL)를 추가 합니다.
참고: 솔루션 볼륨 유리병 크기의 비율은 중요 한, 드라이 아이스의 추가 따라 CO2 의 즉각적인 승화 수 있습니다 기계적으로 치환 경우 너무 많은 용 매 반응 배의 크기를 기준으로 사용 됩니다. - 유리병에 이온된 수 (21.7 μ, 12.1 mmol)을 추가 합니다.
- 드라이 아이스 (26.3 mg, 0.60 mmol), 무게 그리고 즉시 PTFE 늘어선 뚜껑 유리병 또한 즉시 인감을 보장 하면서 유리병, 드라이 아이스를 추가할.
참고: 전체 작업 승화와 CO2 추가의 작은 금액의 탈출을 방지 하기 위해 약 5 초 이내 수행 한다 (이 주위에 드라이 아이스 냉동된 초 산의 형성에 의해 둔화 이다). CO2 추가 금액 대략적인 값, 그리고 우리의 손에 몇 mg의 편차는 허용. - 실 온에서 15 분 동안 봉인된 반응 유리병을 저 어.
- 110 ° C에서 미리가 열된 플레이트에 반응 배를 전송 하 고 냉각 허용 하기 전에 14 시간 동안 저 어.
- 냉각, 신중 하 게 CO2를 환기 하는 유리병을 엽니다.
- 모두는 휘발성 vacuo에서제거.
참고: 유리병에서이 작업을 수행할 수 있습니다 또는 솔루션 큰 둥근 바닥 플라스 크에 옮겨질 수 있다. - 1.2 M HCl(aq) (6 mL) 반응 혼합물에 추가 하 고 15 분 동안 공기에 열려있는 저 어.
- 추가 1.2 세척 separatory 깔때기, 수성 분수 전송 M HCl (4 mL), 및 1:1 diethyl 에테르/hexanes 혼합 (3 x 8 mL) 추출 물.
참고:이 유기 세척 초과 페 닐 요오드 화물 및 다른 중립 부산물을 포함 하 고 삭제 될 수 있습니다. - 중화 하 고 포화 NH4오(aq) 의 추가 의해 수성 솔루션 기본 확인 (10 mL은 좋은 시작 지점).
- Dichloromethane (2 x 10 mL)와 수성 층을 추출 합니다.
- 그래서4, 다음 필터 tared 샘플으로 유리병 나2이상의 결합 된 유기 분수를 건조.
- 증발 하는 용 매 에 vacuo, 노란색 기름으로 (2-메 틸-4-페 닐-butanamine) 제품을 제공.
2. 반응 (조건-제외 어를 제거) 7.5 mL 유리병
- 저 어 바 건조 7.5 mL 유리병에 추가 합니다.
- 유리병에 팔라듐 아세테이트 (6.7 mg, 0.03 mmol)을 추가 합니다.
- 유리병에 실버 trifluoroacetate (99.9 m g, 0.45 mmol)을 추가 합니다.
- 유리병에 페 닐 요오드 화물 (92.3 mg, 0.45 mmol)을 추가 합니다.
- 추가 tert-유리병에 산은 아민 (26.3 mg, 0.30 mmol).
- 유리병에 초 산 (1.0 mL)를 추가 합니다.
참고: 솔루션 볼륨 유리병 크기의 비율은 중요 한, 드라이 아이스의 추가 따라 CO2 의 즉각적인 승화 수 있습니다 기계적으로 치환 경우 너무 많은 용 매 반응 배의 크기를 기준으로 사용 됩니다. - 유리병에 이온된 수 (21.7 μ, 12.1 mmol)을 추가 합니다.
- 균형에 유리병 포장용, 드라이 아이스의 약 98 m g을 추가 하 고 즉시 PTFE 늘어선 뚜껑 유리병 씰링 다음 약 26 밀리 그램의 마지막 질량 달성 될 때까지 떨어져 승화 CO2 를 허용.
참고: 지금까지 바람직한, 하는 경우에이 단계 더 유리병에서 공기를 제외 하는 드라이 아이스의 큰 질량으로 수행할 수 있습니다. 그것은이 물, 소개 하 고 따라서 수 있습니다 물에 대 한 가장 효과적인 전략 민감한 반응이 주목 된다입니다. - 실 온에서 15 분 동안 봉인된 반응 유리병을 저 어.
- 110 ° C에서 미리가 열된 플레이트에 반응 배를 전송 하 고 냉각 허용 하기 전에 14 시간 동안 저 어.
- 냉각, 신중 하 게 CO2를 환기 하는 유리병을 엽니다.
- 모두는 휘발성 vacuo에서제거.
참고: 유리병에서이 작업을 수행할 수 있습니다 또는 솔루션 큰 둥근 바닥 플라스 크에 옮겨질 수 있다. - 1.2 M HCl(aq) (6 mL) 반응 혼합물에 추가 하 고 15 분 동안 공기에 열려있는 저 어.
- 추가 1.2 세척 separatory 깔때기, 수성 분수 전송 M HCl (4 mL), 및 1:1 diethyl 에테르/hexanes 혼합 (3 x 8 mL) 추출 물.
참고:이 유기 세척 초과 페 닐 요오드 화물 및 다른 중립 부산물을 포함 하 고 삭제 될 수 있습니다. - 중화 하 고 포화 NH4오(aq) 의 추가 의해 수성 솔루션 기본 확인 (10 mL은 좋은 시작 지점).
- Dichloromethane (2 x 10 mL)와 수성 층을 추출 합니다.
- 그래서4, 다음 필터 tared 샘플으로 유리병 나2이상의 결합 된 유기 분수를 건조.
- 증발 용 매 vacuo, 주는 노란색 오일으로 제품 (2-메 틸-4-페 닐-butanamine).
3. 반응 40 mL 유리병 (공기 하지 제외)
- 저 어 바 건조 40 mL 유리병에 추가 합니다.
- 유리병에 팔라듐 아세테이트 (33.5 mg, 0.15 mmol)을 추가 합니다.
- 유리병에 실버 trifluoroacetate (499.5 mg, 2.25 mmol)을 추가 합니다.
- 유리병에 페 닐 요오드 화물 (461.5 mg, 2.25 mmol)을 추가 합니다.
- 유리병에 tert-산은 아민 (131.5 m g, 1.5 m m o l)을 추가 합니다.
- 유리병에 초 산 (5.0 mL)를 추가 합니다.
참고: 솔루션 볼륨 유리병 크기의 비율은 중요 한, 드라이 아이스의 추가 따라 CO2 의 즉각적인 승화 수 있습니다 기계적으로 치환 경우 너무 많은 용 매 반응 배의 크기를 기준으로 사용 됩니다. - 유리병에 이온된 수 (108.5 μ, 6.02 mmol)을 추가 합니다.
- 드라이 아이스 (131.5 mg, 3.0 m m o l), 무게 그리고 즉시 또한 즉시 PTFE 줄지어 모자와 함께 유리병을 밀봉을 보장 하면서 유리병, 드라이 아이스를 추가할.
참고: 전체 작업 승화와 CO2 추가의 작은 금액의 탈출을 방지 하기 위해 약 5 초 이내 수행 한다 (이 주위에 드라이 아이스 냉동된 초 산의 형성에 의해 둔화 이다). CO2 추가 금액 대략적인 값, 그리고 우리의 손에 몇 mg의 편차는 허용. - 실 온에서 15 분 동안 봉인된 반응 유리병을 저 어.
- 110 ° C에서 미리가 열된 플레이트에 반응 배를 전송 하 고 냉각 허용 하기 전에 14 시간 동안 저 어.
- 냉각, 신중 하 게 CO2를 환기 하는 유리병을 엽니다.
- 모두는 휘발성 vacuo에서제거.
참고: 유리병에서이 작업을 수행할 수 있습니다 또는 솔루션 큰 둥근 바닥 플라스 크에 옮겨질 수 있다. - 1.2 M HCl(aq) (30 mL) 반응 혼합물에 추가 하 고 15 분 동안 공기에 열려있는 저 어.
- 추가 1.2 세척 separatory 깔때기, 수성 분수 전송 M HCl (20 mL), 및 1:1 diethyl 에테르/hexanes 혼합 (3 x 8 mL) 추출 물.
참고:이 유기 세척 초과 페 닐 요오드 화물 및 다른 중립 부산물을 포함 하 고 삭제 될 수 있습니다. - 중화 하 고 포화 NH4오(aq) 의 추가 의해 수성 솔루션 기본 확인 (10 mL은 좋은 시작 지점).
- Dichloromethane (2 x 20 mL)와 수성 층을 추출 합니다.
- 그래서4, 다음 필터 tared 샘플으로 유리병 나2이상의 결합 된 유기 분수를 건조.
- 증발 하는 용 매 에 vacuo, 노란색 기름으로 (2-메 틸-4-페 닐-butanamine) 제품을 제공.
4. 35 mL 압력 튜브 (공기 하지 제외)에 반응
- 저 어 바 건조 35 mL 압력 관을 추가 합니다.
- 압력 튜브에 팔라듐 아세테이트 (6.7 mg, 0.03 mmol)을 추가 합니다.
- 압력 튜브에 실버 trifluoroacetate (132.5 mg, 0.6 m m o l)을 추가 합니다.
- 압력 튜브에 페 닐 요오드 화물 (183.6 m g, 0.9 m m o l)을 추가 합니다.
- 추가 2-메 틸-N-(3-methylbenzyl) butan-2-아민 (57.4 m g, 0.3 m m o l) 압력 튜브에.
- 1,1,1,3,3,3, 다음 유리병에 초 산 (1.0 mL)를 추가-hexafluoroisopropanol (1.0 mL).
참고: 솔루션 볼륨 유리병 크기의 비율은 중요 한, 드라이 아이스의 추가 따라 CO2 의 즉각적인 승화 수 있습니다 기계적으로 치환 경우 너무 많은 용 매 반응 배의 크기를 기준으로 사용 됩니다. - 압력 튜브를 이온된 수 (21.7 μ, 1.2 mmol)을 추가 합니다.
- 드라이 아이스 (1.32 g, 30 mmol), 무게 하 고 즉시 적절 한 테 플 론 나사 모자와 압력 튜브도 즉시 인감을 보장 하면서 압력 튜브에 드라이 아이스를 추가 합니다.
참고: 전체 작업 승화와 CO2 추가의 작은 금액의 탈출을 방지 하기 위해 약 5 초 이내 수행 한다 (이 주위에 드라이 아이스 냉동된 초 산의 형성에 의해 둔화 이다). CO2 추가 금액 대략적인 값, 그리고 우리의 손에 몇 mg의 편차는 허용. - 실 온에서 15 분 동안 봉인된 반응 배를 저 어.
- 90 ° C에서 미리가 열된 플레이트에 반응 배를 전송 하 고 냉각 허용 하기 전에 24 시간 동안 저 어.
- 냉각, 모자, 수건 또는 패딩된 장갑 넣어 하 고 신중 하 게 CO2환기 압력 튜브를 엽니다.
- 모두는 휘발성 vacuo에서제거.
참고:이 작업은 적절 한 접합 기, 압력 튜브에서 수행할 수 있습니다 또는 솔루션 큰 둥근 바닥 플라스 크에 옮겨질 수 있다. - 1.2 M HCl(aq) (12 mL) 반응 혼합물에 추가 하 고 15 분 동안 공기에 열려있는 저 어.
- 추가 1.2 세척 separatory 깔때기, 수성 분수 전송 M HCl (8 mL), 및 1:1 diethyl 에테르/hexanes 혼합 (3 x 8 mL) 추출 물.
참고:이 유기 세척 초과 페 닐 요오드 화물 및 다른 중립 부산물을 포함 하 고 삭제 될 수 있습니다. - 중화 하 고 포화 NH4오(aq) 의 추가 의해 수성 솔루션 기본 확인 (10 mL은 좋은 시작 지점).
- Dichloromethane (2 x 10 mL)와 수성 층을 추출 합니다.
- 그래서4, 다음 필터 tared 샘플으로 유리병 나2이상의 결합 된 유기 분수를 건조.
- 증발 된 용 매 에 vacuo, 주는 제품 (노란색 기름으로 2-Methyl-N-(3-methylbenzyl)-4-phenylbutan-2-amine).
결과
이 프로토콜에 따라2 대기 이산화탄소 CO를 필요로 하는 화학 반응을 달성 하기 위해 적절 한 양의 반응 유리병을 충전 가능 하다. 1 단계에서에서 달성 하는 압력은 계산 약 3 분위기 (이 값의 결정에 대 한 토론 참조), 부분 solvation, 인 관찰된 압력, 실내 온도에 2 분위기입니다 고 한다 반응 조건 하에서 약 2.6 대기 따라서, 1 단계에서에서 조건, 2-메 틸-4-페 닐-butanami...
토론
반 데르 발스 상태 방정식을 사용 하 여, 이러한 시스템의 대략적인 압력 수 계산된45
1 식: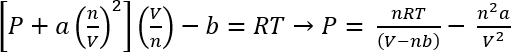
프로토콜 1에서 조건에서 CO2 의 26.3 mg n 제공 가정 수 = 5.98 x 10-4 몰
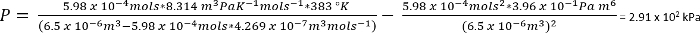
대략적인...
공개
루이스 기본 기판의 C H 활성화에 대 한 감독 그룹으로 CO2 의 사용은 현재 미국 잠정 특허 #62/608, 074의 초점.
감사의 말
저자는이 작품의 부분적인 지원에서 Toledo의 대학에서 창업 자금 뿐 아니라 미국 화학 협회의 허먼 Frasch 재단에서 자금을 인정 하고자 합니다. 미스터 토마스 키나는 반응 압력을 측정 하기 위한 적합 한 압력 게이지 개발 그의 지원을 인정 했다. 미스터 스티브 Modar 유용한 토론에 대 한 감사입니다.
자료
| Name | Company | Catalog Number | Comments |
| 7.5 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-00984 | Can be reused. |
| 40 mL Sample Vial with Screw Cap (Thermoset) | Qorpak | GLC-01039 | Can be reused. |
| Pressure Tube, #15 Thread, 7" Long, 25.4 mm O.D. | Ace Glass | 8648-06 | Can be reused. |
| Pie-Block for 2 Dram Vials | ChemGlass | CG-1991-P14 | Can be reused. |
| Pie-Block for 10 Dram Vials | ChemGlass | CG-1991-P12 | Can be reused. |
| 3.2 mm PTFE Disposable Stir Bars | Fisher | 14-513-93 | Can be reused. |
| C-MAG HS 7 Control Hotplate | IKA | 20002695 | |
| Analytical Weighing Balance | Sartorius | QUINTIX2241S | |
| Double-Ended Micro-Tapered Spatula | Fisher Scientific | 21-401-10 | |
| Hei-VAP Advantage - Hand Lift Model with G5 Dry Ice Condenser Rotary Evaporator | Heidolph | 561-01500-00 | |
| Bump Trap 14/20 Joint | ChemGlass | CG-1322-01 | |
| tert-Amyl amine | Alfa Aesar | B24639-14 | Used as received. |
| 2-Methyl-N-(3-methylbenzyl)butan-2-amine | N/A | N/A | Prepared from reductive amination of tert-amyl amine and 3-tolualdehyde in the presence of sodium borohydride in methanol. |
| Palladium Acetate | Chem-Impex International, Inc. | 4898 | Used as received. |
| Silver Trifluoroacetate | Oakwood Chemicals | 007271 | Used as received. |
| Phenyl Iodide | Oakwood Chemicals | 003461 | Used as received. |
| Acetic Acid | Fisher Chemical | A38 | Used as received. |
| 1,1,1,3,3,3-Hexafluoroisopropanol | Oakwood Chemicals | 003409 | Used as received. |
| Deionized Water | Obtained from in-house deionized water system. | ||
| Dry Ice | Carbonic Enterprises Dry Ice Inc. | Non-food grade dry ice. | |
| Concentrated Hydrochloric Acid | Fisher Chemical | A144SI | Diluted to a 1.2 M solution prior to use. |
| Diethyl Ether, Certified | Fisher Chemical | E138 | Used as received. |
| Hexanes, Certified ACS | Fisher Chemical | H292 | Used as received. |
| Saturated Ammonium Hydroxide | Fisher Chemical | A669 | Used as received. |
| Dichloromethane | Fisher Chemical | D37 | Used as received. |
| Sodium Sulfate, Anhydrous | Oakwood Chemicals | 044702 | Used as received. |
| 250 mL Separatory Funnel | Prepared in-house by staff glassblower. | ||
| 100 mL Round Bottom Flask | Prepared in-house by staff glassblower. | ||
| Scientific Disposable Funnel | Caplugs | 2085136030 | |
| Borosilicate Glass Scintillation Vials, 20 mL | Fisher Scientific | 03-337-15 | |
| 5 mm O.D. Thin Walled Precision NMR Tubes | Wilmad | 666000575 | |
| Chloroform-d | Cambridge Isotope Laboratories, Inc. | DLM-7 | Used as received. |
참고문헌
- Verboom, W. Selected Examples of High-Pressure Reactions in Glass Microreactors. Chemical Engineering and Technology. 32 (11), 1695-1701 (2009).
- Schettino, V., Bini, R. Constraining Molecules at the Closest Approach: Chemistry at High Pressure. Chemical Society Reviews. 36, 869-880 (2007).
- Hemminger, O., Marteel, A., Mason, M. R., Davies, J. A., Tadd, A. R., Abraham, M. A. Hydroformylation of 1-Hexene in Supercritical Carbon Dioxide Using a Heterogeneous Rhodium Catalyst. 3. Evaluation of Solvent Effects. Green Chemistry. 4, 507-512 (2002).
- Mo, F., Dong, G. Regioselective Ketone α-Alkylation with Simple Olefins via Dual Activation. Science. 345 (6192), 68-72 (2014).
- Schultz, A. G., Kirincich, S. J., Rahm, R. Asymmetric Organic Synthesis. Preparation and Birch Reduction-Alkylation of 2-Methyl-3,4-Dihydroisoquinolin-1-ones. Tetrahedron Letters. 36 (26), 4551-4554 (1995).
- Dong, L., Aleem, S., Fink, C. A. Microwave-Accelerated Reductive Amination Between Ketones and Ammonium Acetate. Tetrahedron Letters. 51 (39), 5210-5212 (2010).
- Wang, D., Astruc, D. The Golden Age of Transfer Hydrogenation. Chemical Reviews. 115 (13), 6621-6686 (2015).
- Morimoto, T., Kakiuchi, K. Evolution of Carbonylation Catalysis: No Need for Carbon Monoxide. Angewandte Chemie International Edition in English. 43 (42), 5580-5588 (2004).
- Iranpoor, N., Firouzabadi, H., Motevalli, S., Talebi, M. Palladium-Free Aminocarbonylation of Aryl, Benzyl, and Styryl Iodides and Bromides by Amines Using Mo(CO)6 and Norbornadiene. Tetrahedron. 69 (1), 418-426 (2013).
- Ren, W., Yamane, M. Mo(CO)6-Mediated Carbamoylation of Aryl Halides. Journal of Organic Chemistry. 75 (24), 8410-8415 (2010).
- Wang, H., Dong, B., Wang, Y., Li, J., Shi, Y. A Palladium-Catalyzed Regioselective Hydroesterification of Alkenylphenols to Lactones with Phenyl Formate as CO Source. Organic Letters. 16 (1), 186-189 (2014).
- Zhang, Y., Chen, J. -. L., Chen, Z. -. B., Zhu, Y. -. M., Ji, S. -. J. Palladium-Catalyzed Carbonylative Annulation Reactions Using Aryl Formate as a CO Source: Synthesis of 2-Substituted Indene-1,3(2H)-Dione Derivatives. Journal of Organic Chemistry. 80 (21), 10643-10650 (2015).
- Wan, Y., Alterman, M., Larhed, M., Hallberg, A. Dimethylformamide as a Carbon Monoxide Source in Fast Palladium-Catalyzed Aminocarbonylations of Aryl Bromides. Journal of Organic Chemistry. 67 (17), 6232-6235 (2002).
- Gockel, S. N., Hull, K. L. Chloroform as a Carbon Monoxide Precursor: In or Ex Situ Generation of CO for Pd-Catalyzed Aminocarbonylations. Organic Letters. 17 (13), 3236-3239 (2015).
- Zhao, H., Du, H., Yuan, X., Wang, T., Han, W. Iron-Catalyzed Carbonylation of Aryl Halides with Arylborons Using Stoichiometric Chloroform as the Carbon Monoxide Source. Green Chemistry. 18, 5782-5787 (2016).
- Chen, P., Xu, C., Yin, H., Gao, X., Qu, L. Shock Induced Conversion of Carbon Dioxide to Few Layer Graphene. Carbon. , 471-476 (2017).
- Iijima, T., Yamaguchi, T. Efficient Regioselective Carboxylation of Phenol to Salicylic Acid with Supercritical CO2 in the Presence of Alumnium Bromide. Journal of Molecular Catalysis A: Chemical. 295 (1-2), 52-56 (2008).
- Jevtovikj, I., Manzini, S., Hanauer, M., Rominger, F., Schaub, T. Investigations on the Catalytic Carboxylation of Olefins with CO2 Towards α, β-Unsaturated Carboxylic Acid Salts: Characterization of Intermediates and Ligands as well as Substrate Effects. Dalton Transactions. 44, 11083-11094 (2015).
- Juliá-Hernández, F., Moragas, T., Cornella, J., Martin, R. Remote Carboxylation of Halogenated Aliphatic Hydrocarbons with Carbon Dioxide. Nature. 545, 84-88 (2017).
- North, M., Pasquale, R. Mechanism of Cyclic Carbonate Synthesis from Epoxides and CO2. Angewandte Chemie International Edition. 48 (16), 2946-2948 (2009).
- Yeung, C. S., Dong, V. M. Beyond Aresta's Complex: Ni- and Pd-Catalyzed Organozinc Coupling to CO2. Journal of the American Chemical Society. 130 (25), 7826-7827 (2008).
- Zhu, D. -. Y., Fang, L., Han, H., Wang, Y., Xia, J. -. B. Reductive CO2 Fixation via Tandem C-C and C-N Bond Formation: Synthesis of Spiro-Indopyrrolidines. Organic Letters. 19 (16), 4259-4262 (2017).
- Kapoor, M., Liu, D., Young, M. C. Carbon Dioxide Mediated C(sp3)–H Arylation of Amine Substrates. J. Am. Chem. Soc. , (2018).
- Zhang, Y. -. F., Zhao, H. -. W., Wang, H., Wei, J. -. B., Shi, Z. -. J. Readily Removable Directing Group Assisted Chemo- and Regioselective C(sp3)-H Activation by Palladium Catalysis. Angewandte Chemie International Edition. 54 (46), 13686-13690 (2015).
- He, G., Chen, G. A Practical Strategy for the Structural Diversification of Aliphatic Scaffolds Through the Palladium-Catalyzed Picolinamide-Directed Remote Functionalization of Unactivated C(sp3)-H Bonds. Angewandte Chemie International Edition. 50 (22), 5192-5196 (2011).
- Nack, W. A., Wang, X., Wang, B., He, G., Cheng, G. Palladium-Catalyzed Picolinamide-Directed Iodination of Remote ortho-C-H Bonds of Arenes: Synthesis of Tetrahydroquinolines. Beilstein Journal of Organic Chemistry. 12, 1243-1249 (2016).
- Feng, P., Li, M., Ge, H. Room Temperature Palladium-Catalyzed Decarboxylative ortho-Acylation of Acetanilides with α-Oxocarboxylic Acids. Journal of the American Chemical Society. 132 (34), 11898-11899 (2010).
- Coomber, C. E., Benhamou, L., Bučar, D. -. K., Smith, P. D., Porter, M. J., Sheppard, T. D. Silver-Free Palladium-Catalyzed C(sp3)-H Arylation of Saturated Bicyclic Amine Scaffolds. Journal of Organic Chemistry. 83 (5), 2495-2503 (2018).
- Mei, T. -. S., Wang, X., Yu, J. -. Q. Pd(II)-Catalyzed Amination of C-H Bonds Using Single-Electron or Two-Electron Oxidants. Journal of the American Chemical Society. 131 (31), 10806-10807 (2009).
- Xie, W., Yang, J., Wang, B., Li, B. Regioselective Ortho Olefination of Aryl Sulfonamide via Rhodium-Catalyzed Direct C-H Bond Activation. Journal of Organic Chemistry. 79 (17), 8278-8287 (2014).
- Rodriguez, N., Romero-Revilla, J. A., Fernández-Ibáñez, M. &. #. 1. 9. 3. ;., Carretero, J. C. Palladium-Catalyzed N-(2-pyridyl)sulfonyl-Directed C(sp3)-H γ-Arylation of Amino Acid Derivatives. Chemical Science. 4, 175-179 (2013).
- Zheng, Y., Song, W., Zhu, Y., Wei, B., Xuan, L. Pd-Catalyzed Acetoxylation of γ-C(sp3)-H Bonds of Amines Directed by a Removable Bts-Protecting Group. Journal of Organic Chemistry. 83 (4), 2448-2454 (2018).
- Jain, P., Verma, P., Xia, G., Yu, J. -. Q. Enantioselective Amine α-Functionalization Via Palladium-Catalysed C-H Arylation of Thioamides. Nature Chemistry. 9, 140-144 (2017).
- Tran, A. T. Practical Alkoxythiocarbonyl Auxiliaries for Ir(I)-Catalyzed C-H Alkylation of Azacycles. Angewandte Chemie International Edition. 56 (35), 10530-10534 (2017).
- Huang, Z., Wang, C., Dong, G. A Hydrazone-Based exo-Directing Group Strategy for β-C-H Oxidation of Aliphatic Amines. Angewandte Chemie International Edition. 55 (17), 5299-5303 (2016).
- Xu, Y., Young, M. C., Wang, C., Magness, D. M., Dong, G. Catalytic C(sp3)-H Arylation of Free Primary Amines via an in situ Generated Exo-Directing Group. Chemie International Edition. 55 (31), 9084-9087 (2016).
- Liu, Y., Ge, H. Site-Selective C-H Arylation of Primary Aliphatic Amines Enabled by a Catalytic Transient Directing Group. Nature Chemistry. 9, 26-32 (2017).
- Wu, Y., Chen, Y. -. Q., Liu, T., Eastgate, M. D., Yu, J. -. Q. Pd-Catalyzed γ-C(sp3)-H Arylation of Free Amines Using a Transient Directing Group. Journal of the American Chemical Society. 138 (44), 14554-14557 (2016).
- Yada, A., Liao, W., Sato, Y., Murakami, M. Buttressing Salicylaldehydes: A Multipurpose Directing Group for C(sp3)-H Bond Activation. Angewandte Chemie International Edition. 56 (4), 1073-1076 (2017).
- Baldwin, B. W., Kuntzleman, T. S. Liquid CO2 in Centrifuge Tubes: Separation of Chamazulene from Blue Tansy (Tanacetum annum) Oil via Extraction and Thin-Layer Chromatography. Journal of Chemical Education. 95 (4), 620-624 (2018).
- McKenzie, L. C., Thompson, J. E., Sullivan, R., Hutchison, J. E. Green Chemical Processing in the Teaching Laboratory: A Convenient Liquid CO2 Extraction of Natural Products. Green Chemistry. 6, 355-358 (2004).
- Hudson, R., Ackerman, H. M., Gallo, L. K., Gwinner, A. S., Krauss, A., Sears, J. D., Bishop, A., Esdale, K. N., Katz, J. L. CO2 Dry Cleaning: A Benign Solvent Demonstration Accessible to K-8 Audiences. Journal of Chemical Education. 94, 480-482 (2017).
- Barcena, H., Chen, P. An Anesthetic Drug Demonstration and an Introductory Antioxidant Activity Experiment with "Eugene, the Sleepy Fish.". Journal of Chemical Education. 93, 202-205 (2016).
- Bodsgard, B. R., Lien, N. R., Waulters, Q. T. Liquid CO2 Extraction and NMR Characterization of Anethole from Fennel Seed: A General Chemistry Laboratory. Journal of Chemical Education. 93, 397-400 (2016).
- Fishbane, P. M., Gasiorowicz, S. G., Thornton, S. T. . Physics for Scientists and Engineers. , (2005).
- Rumpf, B., Xia, J., Maurer, G. Solubility of Carbon Dioxide in Aqueous Solutions Containing Acetic Acid or Sodium Hydroxide in the Temperature Range from 313 to 433 K and at Total Pressures up to 10 MPa. Industrial & Engineering Chemistry Research. 37, 2012-2019 (1998).
- Luo, J., Larrosa, I. C-H Carboxylation of Aromatic Compounds Through CO2 Fixation. ChemSusChem: Chemistry & Sustainability, Energy & Materials. 10, 3317-3332 (2017).
- Manjolinho, F., Arndt, M., Gooßen, K., Gooßen, L. J. Catalytic C-H Carboxylation of Terminal Alkynes with Carbon Dioxide. ACS Catalysis. 2, 2014-2021 (2012).
- Banerjee, A., Dick., G. R., Yoshino, T., Kanan, M. W. Carbon Dioxide Utilization via Carbonate-Promoted C-H Carboxylation. Nature. 531, 215-219 (2016).
- Fei, H., Sampson, M. D., Lee, Y., Kubiak, C. P., Cohen, S. M. Photocatalytic CO2 Reduction to Formate Using a Mn(I) Molecular Catalyst in a Robust Metal-Organic Framework. Inorganic Chemistry. 54, 6821-6828 (2015).
- Chabolla, S. A., Yang, J. Y. For CO2 Reduction, Hydrogen-Bond Donors Do the Trick. ACS Central Science. 4, 315-317 (2018).
- Kim, D., Kley, C. S., Li, Y., Yang, P. Copper Nanoparticle Ensembles for Selective Electroreduction of CO2 to C2-C3 Products. Proceedings of the National Academy of Sciences of the United States of America. , C2-C3 (2017).
- Liu, Q., Wu, L., Jackstell, R., Beller, M. Using carbon dioxide as a building block in organic synthesis. Nature Communications. 6, 5933-5945 (2015).
- Hâncu, D., Green, J., Beckman, E. J. H2O2 in CO2 Sustainable Production and Green Reactions. Accounts of Chemical Research. 35, 757-764 (2002).
- Ballivet-Tkatchenko, D., Camy, S., Condoret, J. S., Lichtofouse, E., Scwarzbauer, J., Robert, D. Carbon Dioxide, a Solvent and Synthon for Green Chemistry. Environmental Chemistry. , 541-552 (2005).
- Hyatt, J. A. Liquid and Supercritical Carbon Dioxide as Organic Solvents. Journal of Organic Chemistry. 49, 5097-5101 (1984).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유