Method Article
أسلوب متعدد الاستخدامات لتركيب نبات يترك لتصوير الوقت الفاصل بين إينترافيتال
In This Article
Summary
نحن تقرير طريقة بسيطة ومرنة لإجراء تصوير لايف الفلورسنت من أوراق نبات التمويل على مدى فترة ممتدة من الوقت. ونحن نستخدم نبات نبات المعدلة وراثيا معربا عن جين مراسل فلورسنت تحت سيطرة المروجين المتعلقة بالحصانة كمثال لفهم الاستجابات المناعية مصنع الزمانية المكانية.
Abstract
يتم بدء الاستجابة المناعية النباتات المرتبطة ببرمجة النسخي على نطاق الجينوم في موقع الإصابة. وهكذا، ينظم الاستجابة المناعية مكانياً وزمنياً. استخدام الجينات الفلورسنت تحت سيطرة المروج المتعلقة بالحصانة في تركيبة مع الفحص المجهري fluorescence الآلي طريقة بسيطة لفهم تنظيم الزمانية المكانية لمصنع الحصانة. خلافا لانسجة الجذر التي تم استخدامها لعدد من مختلف التجارب التصوير الفلورسنت إينترافيتال، توجد بعض الأمثلة العيش-التصوير الفلورسنت لانسجة نبات التي تواجهها صفيف عدوى الجرثومية المحمولة جوا. ولذلك، قمنا بتطوير طريقة بسيطة لتحميل أوراق النباتات نبات التمويل لتصوير خلية يعيش على مدى فترة ممتدة من الوقت. قمنا باستخدام النباتات المعدلة وراثيا نبات معربا عن جينيفوسيد بروتين فلوري الصفراء (يفب) إلى إشارة التعريب النووية (NLS) تحت سيطرة المروج للجين العلامة المتعلقة بالدفاع، ( 1 باثوجينيسيسريلاتيد PR1). نحن تسللت إلى ورقة المحورة وراثيا مع Pseudomonas syringae الكهروضوئية. الطماطم DC3000 سلالة (Pst_a2) (avrRpt2) وإجراء تصوير الوقت الفاصل بين المجراة في إشارة يفب لما مجموعة 40 ح باستخدام ستيريوميكروسكوبي fluorescence الآلي. ويمكن استخدام هذا الأسلوب ليس فقط للدراسات المتعلقة بالاستجابات المناعية النبات ولكن أيضا لتحليل مختلف الأحداث الإنمائية والبيئية الاستجابات التي تحدث في أنسجة نبات.
Introduction
الاستجابة المناعية النبات ينطوي برمجة النسخي دينامية ينظمها النسخ المتعددة العوامل كذلك phytohormones1. تراكم البيانات الترنسكربيتوم ويوفر فرصاً لجمع معلومات عن مصنع الجهاز المناعي: على سبيل المثال، تتالي هيكل الشبكة مما يشير إلى2. إلا أن معرفتنا بدينامية المكانية والزمانية الحصانة المصنع لا يزال محدود3،،من45.
في دراسات سابقة، التنظيم الزمانية المكانية لتعبير الجينات المتعلقة بالدفاع قد تم معظمها تحليلها باستخدام التهجين في الموقع و β-glucuronidase (غوس) مراسل مقايسة6،،من78. هذه الأساليب تسمح لنا بتصور النسخي تفعيل جينات مختلفة من الاهتمام في الموقع. بيد أن هذه الإجراءات تتطلب التثبيت الكيميائي للعينات، ومما يؤدي إلى فقدان جميع المعلومات الزمنية. الأحداث البيولوجية، مثل الحصانة، والتقدم المحرز على مر الزمن. وقد مكن استخدام لوسيفراس كمراسل القبض على ديناميات الزمانية للمروج لفائدة3. ومع ذلك، يتطلب التحليل القائم على لوسيفراس الركيزة مكلفة وحساسة للغاية للكشف عن. لزيادة فهمنا للجوانب الزمانية المكانية للاستجابة المناعية المصنع باستخدام إجراءات بسيطة، ونحن إنشاء المحورة وراثيا التمويل نبات النباتات المعبرة البروتينات الفلورية الأصفر (يفب) الجينات تنصهر فيها إشارة التعريب النووية (يفب-NLS) تحت سيطرة المروج للجينات العلامة المتعلقة بالدفاع، 1 باثوجينيسيسريلاتيد (PR1)9. كنا أوتوفلوريسسينسي الكلوروفيل، علامة على الخلايا الحية، لالتقاط عملية موت الخلايا المبرمج (PCD)، الذي غالباً ما يحدث خلال حصانة أثارت المستجيب (إيتي)، شكلاً من أشكال الحصانة النباتية الناجمة عن العدوى الممرض محددة9 , 10-رصد ديناميات الزمانية لكثافة إشارة fluorescence في الانتقال بحرية الكائنات، مثل الذين يعيشون أوراق نبات ، يتطلب صورة معقدة تجهيز البرمجيات بنيت داخليا أو المتاحة تجارياً. وبدلاً من ذلك، يحول دون نقل العينات طريقة بسيطة لحل القضية. وهنا، قمنا بتطوير طريقة مرنة وبسيطة لتصاعد يعيشون أوراق نبات نبات المحورة وراثيا للمراقبة طويلة الأجل تحت ستيريوميكروسكوبي fluorescence الآلي. الأسلوب الذي يسمح لنا بالتقاط المروج يترك الديناميات داخل المصنع سليمة نابعة من التربة خلال الأيام القليلة القادمة.
Protocol
ملاحظة: من المهم أن تمنع النوم الحركة الحية نبات عينات خلال الوقت الفاصل بين التصوير. لتقليل الإجهاد الميكانيكي على أوراق، ضروري التثبيت لطيف من الأوراق. فقط أوراق الإعداد الكافي عينات إنتاج الوقت الفاصل بين الصور مناسبة لتحليلات مختلفة في الصورة. بروتوكول استخدام النباتات المعدلة وراثيا نبات معربا عن الانصهار NLS يفب تحت سيطرة PR1 الجينات المروج (pPR1-يفب-NLS النباتات) والكهروضوئية Pseudomonas syringae . الطماطم DC3000 ويرد أدناه وصف السلالة (avrRpt2) (Pst_a2)، على سبيل مثال.
1-إعداد النباتات والكائنات الممرضة
- ملء علبة توصيل خلية بلاستيكية (جدول المواد) مع التربة يعقم.
- زرع بذور نبات المعدلة وراثيا واحد كل خلية (الشكل 1أ).
- نقل العلبة إلى غرفة نمو الحفاظ على 23 درجة مئوية وتنمو النباتات تحت الضوء الأبيض المستمر لمدة 2-3 أسابيع.
- يومين قبل التطعيم الممرض، خط Pseudomonas syringae الكهروضوئية. الطماطم سلالة (Pst_a2) من مخزون الجلسرين على NYG المتوسطة (ببتون 5 غرام/لتر، استخراج الخميرة 3 غرام/لتر، والغليسيرول 20 مل/لتر، أجار البكتريولوجية 15 غرام/لتر، ودرجة الحموضة 7.0) تحتوي على 100 مغ/لتر والريفامبيسين و 50 مغ/لتر كاناميسين DC3000 avrRpt2 واحتضان عند 28 درجة مئوية ح 48.
- حصاد الخلايا البكتيرية التي تظهر على سطح المتوسطة استخدام تلميحات البلاستيك ونقلها إلى أنبوب بلاستيك التي تحتوي على 10 مم مجكل2ريسوسبيند. قياس الكثافة البصرية (OD) الحل في 600 نانومتر (OD600). ضبط تركيز الخلية الأخيرة من الخلايا البكتيرية إلى 108 وحدات تشكيل مستعمرة (زيمبابوي)/مل، الذي يقابل عادة OD600 = 0.211.
2-مسببات المرض التطعيم
- قطع المكونات خلية التي تحتوي على مصنع تبلغ من العمر 2-3 في الأسبوع دون إلحاق الضرر بالنبات بعناية. قم بتعيين الخلية في علبة توصيل خلية فارغة (2 × 2 الخلايا تكفي) للحفاظ على توازن جيد (الشكل 1ب).
- حدد ورقة ظاهر صحية للتطعيم. عموما، الثالث، والرابع، والخامس يترك (#3 و #4 و #5، على التوالي، في الشكل 1ج) من الجزء السفلي من النبات هي سهلة للتعامل. استخدام يترك في نفس الموضع في مجموعة من التجارب لإمكانية تكرار نتائج أفضل. مياه التربة عقد المصنع قبل التطعيم لتصوير مرور الزمن الطويل الأجل.
- بشكل اختياري، في حالة تحليل المروجين تستجيب للإجهاد مثل pPR1، للتأكد من أن النباتات لا التشديد بطبيعة الحال، فحص الأوراق تحت ستيريوميكروسكوبي fluorescence قبل التطعيم الممرض للتحقق من عدم وجود إشارة يفب. يترك استبعاد الإشارات يفب تبين من التجربة.
- ارتداء قفازات مطاط المتاح قبل التسلل تجنب الاتصال المباشر مع مسببات المرض. استخدام المحاقن بلاستيكية needleless 1 مل، التسلل بعناية على الجانب أباكسيال نبات مع تعليق البكتيرية (108 زيمبابوي/mL)11 (الشكل 1د). التطعيم لجزء صغير على نصف الورقة يمكن تصور جيد للنشاط pPR1 ؛ منطقة تسلل يصبح مرئياً كالأخضر أكثر قتامة في اللون بالمقارنة مع الأوراق المتبقية. أن يكون حذراً للغاية لا أن يسبب أي أضرار ميكانيكية للورقة أثناء عمليات التسلل.
ملاحظة: تأكد من أن كافة المسافات بين الخلايا في منطقة تسلل بشكل كامل الوفاء بها (عمودياً) مع تعليق الممرض؛ وبخلاف ذلك، سيكون من الصعب تصور تحت ستيريوميكروسكوبي نيون المجال PCD. يمكن أن يكون ببساطة أكد هذا إنجاز تخضير الظلام في منطقة تسلل. - امتصاص فائض تعليق البكتيرية من المنطقة المحيطة بالقسم تسلل تسلل نبات مع منشفة ورقية ناعمة.
3-تصاعد ورقة الملقحين
- فورا بعد التطعيم، إصلاح شريحة زجاجية في علبة بلاستيكية باستخدام الشريط الجراحي (جدول المواد) مثل نبات تسلل ويقع في وسط الشريحة الزجاجية. التأكد من أن شفرة أوراق الملقحين مجهز تماما داخل الشريحة الزجاجية (الشكل 2أ).
- إعداد شريط بلاستيكي مزدوج الطبقات (في حالة الشريط السميك 0.2 مم، انظر الجدول للمواد) وقطع عليه إلى قسمين القطع (الشكل 2ب؛ قطع 1 و 2) لتناسب المسافات على طول سويقات نبات تسلل. ترتيب طول هذين التشريعين، وأشار إلى سهم برأس مزدوج في الشكل 2ب، لتناسب طول سهم مزدوج الرأس هو مبين في الشكل 2أ.
ملاحظة: الاستغناء عن ركن من كل من قطعتين يساعد على تجنب إلحاق الضرر بشفرة ورقة (الشكل 2بمن رؤوس الأسهم؛ انظر أيضا الخطوة 3، 4 أدناه). أي نوع من الشريط البلاستيك مع سمك مماثلة مناسبة لصنع جسر أكثر سويقات. صلابة الشريط البلاستيك مهم لسهولة التعامل أثناء الإجراء الموضح أدناه. - استخدام زوج من ملاقط غرامة، عصا قطع الشريط 1 و 2 على أي من جانبي سويقات بمحاذاة زوايا قطع كل قطعة مع قاعدة النصل ليف (الشكل 2-ج). التأكد من أن قطع الشريط لا تلمس بليد سويقات أو أوراق.
ملاحظة: هذه القطع شريط بلاستيكي مزدوج الطبقات في القاعدة النصل ورقة بمثابة الفواصل ومنع الإجهاد البدني على سويقات أثناء تصاعد. - إعداد قطعة إضافية من الشريط البلاستيك مزدوج الطبقات (الشكل 2ب، 3 قطعة) تناسب حجم سهم مزدوج الرأس في الشكل 2ب والتمسك بها على رأس قطع الشريط 1 و 2 تشكل جسراً على سويقات ( 2 الرقمد، ه). أن يكون حذراً للغاية ليس للقبض على شفرة سويقات وليف مباشرة بين قطع الشريط في المواضع المشار إليها بالأسهم في الشكل 2د وه.
- عصا قطعة صغيرة من الشريط الجراحي (الشكل 2و، قطعة 4) على الشريحة الزجاجية أعلاه غيض شفرة ورقة بلطف حيث أن شفرة ليف هو ثابت جداً بهدوء على الشريحة الزجاجية. فقط اضغط بقوة إلى أسفل الجزء من الشريط الجراحي مباشرة لمس الشريحة الزجاجية (الشكل 2ومن المنطقة المحددة بخط أحمر متقطع)، لا الجزء الآخر تغمر الورقة.
- عصا بلطف آخر قطعة صغيرة من الشريط الجراحي (الشكل 2ز، قطعة 5) على الحدود سويقات والشريط البلاستيك القطع (1 و 2 و 3) حيث أن سويقات جداً بهدوء ثابت على كل من الشرائح الزجاجية والبلاستيكية الشريط قطعة. فقط اعتقادا راسخا إرفاق الجزء من الشريط الجراحي مباشرة لمس الزجاج الشريحة إلى شريحة الزجاج وقطع الشريط البلاستيك (الشكل 2ز، المنطقة المحددة بخط أحمر متقطع)، لا الجزء الآخر تغمر في سويقات.
- يحول دون الانتقال إلى مجال الرؤية المجهر 200 ميليلتر ماصة نصائح (الشكل 2ح) باستخدام أوراق المجاورة. إدراج نصائح ماصة في التربة بلطف عقد أوراق المجاورة بعيداً عن نبات تسلل. احرص على عدم إدراج النصائح عميقة جداً في التربة لتفادي الأضرار الجذرية الممكنة.
ملاحظة: المصنع مستعدا الآن جاهزة للتصوير ستيريوميكروسكوبي الأسفار.
4-المجهري الوقت الفاصل بين المراقبة
- قم بتشغيل ستيريوميكروسكوبي نيون.
ملاحظة: هنا، ستيريوميكروسكوبي الآلي مجهزة أحادي 1.4 ميجا حساسة للغاية يستخدم الكاميرا الرقمية في وضع 12 بت (جدول المواد). المجهر ينبغي أن توضع في غرفة مظلمة مزودة بوحدة لتكييف هواء أو في خزانة مظلمة مع التهوية الكافية للحفاظ على درجة حرارة الغرفة في 23 درجة مئوية خلال الوقت الفاصل بين التصوير. - ضبط المصنع في المساحة أعلاه تحت عدسة الهدف من ستيريوميكروسكوبي للتصوير.
- إعداد المعلمات للتصوير بمرور الوقت (انظر الأمثلة في الجدول 1). تأكد من أن خطوات البرنامج للتعرض للضوء أثناء فترة الفاصل الزمني للوقت الفاصل بين التصوير منذ الضوء له تأثير كبير على مصنع الحصانة12.
- استخدام عامل تصفية يفب التقليدية (الإثارة 500-520 نانومتر؛ الانبعاثات 540-580 نانومتر) لتصور إشارة يفب.
- استخدام عامل تصفية تكساس الأحمر (تكسر) (الإثارة 540-580 نانومتر؛ الانبعاثات 610 نانومتر طويلة تمرير) لتصور أوتوفلوريسسينسي الكلوروفيل حيث يكون المجال PCD مرئياً كمنطقة مظلمة (لا أوتوفلوريسسينسي) محاطة بإيجابية يفب خلية طبقات9 (الشكل 3 A).
- استخدم الإعداد التقليدية مجال برنامج التحصين الموسع-مشرق لخطوات إضافية التعرض للضوء.
ملاحظة: قبل التجربة، قياس قوة مصدر الضوء برنامج التحصين الموسع-مشرق وضبطه على مستوى حالة نمو النباتات الخاصة بها.
- قم بتشغيل برنامج الوقت الفاصل بين التصوير. للمراقبة طويلة الأجل على مدى عدة أيام، النظر في سقي النبات على نحو مناسب، وعلى سبيل المثال، أثناء الخطوات التعرض للضوء.
- وبعد الحصول على الصور، قم بحذف القنوات الإضافية المستخدمة للتعرض للضوء في الفواصل الزمنية (يقابل قنوات 3-8 في الجدول 1) من مجموعة البيانات. تحليل البيانات بطرق مختلفة، مثل تحليل (ROI) المنطقة من الفائدة واستخدام برنامج تحليل الصور المختلفة مثل فيجي9.
النتائج
وهنا استخدمنا Pst_a2-التي يسببها إيتي كمثال للوقت الفاصل بين التصوير. تم الحصول على بيانات الوقت الفاصل بين كسلسلة من الصور، وعدد قليل من التي تظهر في الشكل 3ب، و الوقت الفاصل بين فيلم (تكميلية فيلم 1)9. في تجارب ناجحة باستخدام pPR1-يفب-NLS أثناء Pst_a2-المستحث إيتي، التنشيط عابرة من pPR1 لوحظ، كما يتضح من يفب معربا عن البؤر، في عدة طبقات من الخلايا المحيطة بالمجال PCD (الشكل 3ب) 9-تفعيل pPR1 في الخلايا المحيطة بالمجال PCD عادة ما يبدأ عند حوالي 5 ساعات بعد التطعيم (hpi)، قمم في hpi حوالي الساعة 12، ويستمر لفترة تصل إلى 40 hpi (الشكل 3ب)9. منذ الصور تم الحصول عليها باستخدام نظام برنامج التحصين الموسع-فلوري، تولدت يفب الإشارات التي تم الحصول عليها هنا من عدة طبقات الخلية أداكسيال، بما في ذلك الخلايا mesophyll البشرة فضلا عن العلوي.

الشكل 1 : أسلوب يستخدم للتسلل من مسببات الأمراض البكتيرية في نبات التمويل ليف. (أ) كانت تزرع النباتات اثنين إلى ثلاثة الأسبوع-عمرها نبات في علبة توصيل خلية. خلية واحدة (ب) المكونات التي تحتوي على قطع النباتات المحددة التي ستستخدم للتطعيم والمراقبة ووضعها في علبة التوصيل خلية فارغة للحفاظ على التوازن. (ج) الثالث، والرابع، والخامس يترك (#3 و #4 و #5، على التوالي) هي مناسبة لتحليل الصور. (د) تسلل تعليق الممرض إلى ورقة مختارة باستخدام حقنه needleless. يمكن التعرف على منطقة تسلل استناداً إلى لونه أخضر أغمق من الأوراق المتبقية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2 : الطريقة المستخدمة لتركيب تسلل نبات ليف للوقت الفاصل بين التصوير. (أ) صورة فوتوغرافية للنبات نبات مع شريحة زجاجية ثابتة تحت ورقة الملقحين. تم وضع ورقة تسلل في وسط الشريحة الزجاجية. سهم مزدوج الرأس يشير إلى طول الفواصل الشريط البلاستيك. (ب) إعداد الفواصل الشريط البلاستيك والجسر. مزدوج-تم قص الشريط البلاستيك الطبقات إلى قسمين كان قص القطع (1 و 2) للفواصل، وقطعة أخرى (3، المحددة بخط أحمر متقطع) لإعداد جسر. أطوال الأسهم مزدوج الرأس متطابقة تقريبا على طول سهم مزدوج الرأس في (أ). أحد الأركان الأربعة لقطع 1 و 2، يشار إليه بالسهام، وانقطعت. تم لصق القطع (ج) اثنين من شريط بلاستيكي مزدوج الطبقات (تعداد رقمي 1 و 2) بعناية على الزجاج الشريحة على طول سويقات استخدام زوج من ملاقط غرامة، دون إجراء اتصال مباشر مع بليد سويقات وأوراق. (د) قطعة إضافية من مزدوج الطبقات البلاستيكية الشريط (رقم 3)، الذي أعد من (ب)، وضعت على كل الفواصل القاعدية (1 و 2) تشكل جسراً عبر سويقات، مع ضمان لا للقبض سويقات بين 1 و 2 في الأشرطة المواضع المشار إليها بالأسهم. (ه) صورة فوتوغرافية تظهر سويقات مسجلة. من المهم عدم قبض الأنسجة النباتية مباشرة بين القطع البلاستيكية الشريط في المواضع المشار إليها بالأسهم. (و) قطعة صغيرة من الشريط الجراحي (رقم 4) تم لصق بلطف على الشريحة الزجاجية حول غيض شفرة ورقة. المنطقة المحددة بخط أحمر متقطع فقط تم الضغط بشدة على شريحة الزجاج. (ز) الصغيرة آخر قطعة من الشريط الجراحي (رقم 5) تم لصق بلطف على الحدود سويقات وقطع الشريط البلاستيك. تم الضغط على المنطقة المحددة بخط أحمر متقطع فقط لتحديد سويقات بهدوء على شريحة الزجاج وقطع الشريط البلاستيك. (ح) اثنين ماصة المتاح نصائح استخدمت للحيلولة دون الانتقال إلى مجال الرؤية ستيريوميكروسكوبي يترك المجاورة. نصائح ماصة أدرجت مباشرة في التربة في المواقع المناسبة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
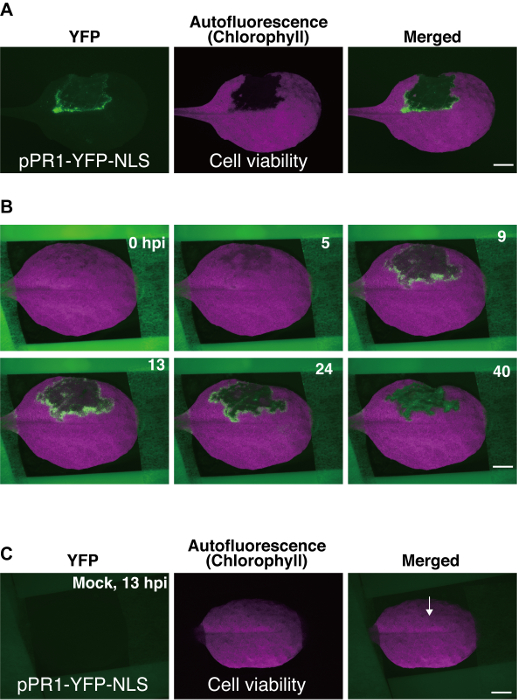
الشكل 3 : الممثل النتائج باستخدام نبات ليف تصاعد الأسلوب. (أ) الصور ستيريوميكروسكوبيك نيون من ورقة نبات المحورة وراثيا (pPR1-يفب-NLS النبات). وكان تسلل جزء من الورقة مع Pst_a2 (108 زيمبابوي/mL) على سطحه أباكسيال، وتم القبض على الصور في 22 ساعة بعد التطعيم (hpi). الأنوية التي تم تنشيط مروج pPR1 تم الكشف عن استخدام عامل التصفية يفب، وتم الكشف عن موت الخلايا المبرمج (PCD) استناداً إلى فقدان الكلوروفيل أوتوفلوريسسينسي باستخدام عامل التصفية تكساس الأحمر (تكسر). شريط المقياس = 2.5 مم-(ب) عدد قليل من الوقت الفاصل بين الصور مختارة من مجموعة من 800 الصور التي تم الحصول عليها باستخدام البروتوكول هو موضح هنا. هذه البيانات توفر نظرة في فيفو ديناميات النشاط pPR1 ل 40 hpi الزمانية المكانية. تظهر الصور المدمجة الصور يفب وتكسر. شريط المقياس = 2.5 مم-(ج) تسلل وهمية ورقة المحورة وراثيا (pPR1-يفب-NLS النبات). في تسلل وهمية، 10 مم مجكل2 كان تسلل إلى الجانب أباكسيال نبات، تليها الوقت الفاصل بين التصوير. العلاج الوهمي لم يتسبب في نشاط خارج الرحم pPR1 ولا تتداخل مع أوتوفلوريسسينسي الكلوروفيل في 13 hpi. يشير سهم إلى موقف تسلل وهمية. شريط المقياس = 2.5 مم. تم تعديل هذه الصور من دراسة سابقة9. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
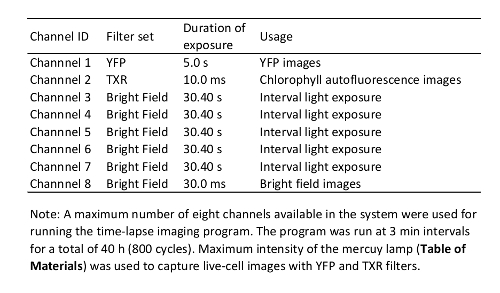
الجدول 1: الوقت الفاصل بين برنامج التصوير المستخدمة في هذه الدراسة.
تكميلية الفيلم 1: فيلم الوقت الفاصل بين عرض ديناميات الزمانية المكانية pPR1 التنشيط في المعدلة وراثيا نبات نبات الناجم عن حصانة أثارت المستجيب التالية (إيتي) Pst_a2 التطعيم. وكان تسلل جزء من الجانب أباكسيال من نبات المحورة وراثيا تحمل في بناء pPR1-يفب-NLS مع Pst_a2 (108 زيمبابوي/mL). الصور تم الحصول عليها في فترات 3-دقيقة لما مجموعة 40 ح. الطابع الزمني المبين في dd:hh:mm:ss.sss الشكل. تم تعديل هذا الفيلم من دراسة سابقة9. من فضلك انقر هنا لمشاهدة هذا الفيديو. (انقر بالزر الأيمن التحميل.)
Discussion
هنا، نحن تقرير طريقة بسيطة لجبل العيش ورقة نبات التعبير عن جين مراسل فلورسنت تحت سيطرة مروج للفائدة للمراقبة طويلة الأجل باستخدام ستيريوميكروسكوبي نيون الآلي. الوقت الفاصل بين التصوير مراسل الفلورية قد أنجز كثيرا في الأنسجة الجذرية؛ ومع ذلك، سوى عدد قليل من الدراسات المماثلة قد أجريت في أنسجة نبات. هذا الأكثر احتمالاً لأن يترك قادرة على التحرك بحرية في الفضاء، في حين غالباً ما دفن الجذور وإصلاحها في أجار الصلبة المتوسطة.
في هذا التقرير، ركزنا على ديناميات الزمانية المكانية للنشاط pPR1 خلال إيتي الناجمة عن Pst_a2. بالإضافة إلى تثبيت لطيف نبات المفصلة أعلاه، من المهم أن وضوح تصور ديناميات الأحداث الخلوية مثل التنشيط المروج و PCD الزمانية المكانية. إذا كان التمييز بين الخلايا تظهر النشاط pPR1 و PCD ليست حادة، تأكد من أن كافة المسافات بين الخلايا في منطقة تسلل تمتلئ تماما مع تعليق الممرض (راجع الخطوة 2، 4). هذا أمر بالغ الأهمية عند استخدام ستيريوميكروسكوبيس fluorescence واسع المجال منذ التقاط هذه المجاهر جميع إشارات يمكن اكتشافها على طول نفس الموضع العمودي للعينة. أوتوفلوريسسينسي الكلوروفيل من خلايا الباقين على قيد الحياة إلى أعلى أو أسفل الخلايا في النطاق PCD أقنعة بسهولة الخلايا الميتة العارضة لا أوتوفلوريسسينسي. وهذا أيضا صحيح بالنسبة لإشارة يفب.
ظروف الوقت الفاصل بين التصوير بحاجة إلى أن توضع بعناية من خلال عدة تجارب أولية تحت ظروف تجريبية مختلفة. معلمات لتصوير مرور الزمن يعتمد على عدة عوامل مثل نظام المجهرية والنباتات المحورة وراثيا، ومسببات الأمراض. للحصول على هذه المعلمات، نحن أولاً تحليل مختلف أوقات التعرض لكثافة إشارة يفب في ورقة تسلل في hpi 7، الذي يتزامن تقريبا مع التنشيط الأولى من pPR1. عازمة على تعرض s 5 حسب الاقتضاء لالتقاط الإشارات يفب مع ستيريوميكروسكوبي المستخدمة في هذه الدراسة. وأجرى اختبار مشابهة للتصوير أوتوفلوريسسينسي الكلوروفيل. كان مبرمجاً تعرض العينة للضوء بين فترات 3 دقيقة في الوقت الفاصل بين برنامج التصوير كتصوير ميدان مشرقة طبيعية مع الوقت أقصى قدر من التعرض. نظامنا (جدول المواد) سمح لنا أن يكون 2.5 دقيقة بالإضافة إلى يفب، وتكسر، وتصوير ميدان مشرق. وكان هذا القيد أن السبب الرئيسي لاختيار فاصل 3 دقيقة. وبعد ذلك، أكدنا أن هذا الشرط الزمني الفاصل تسبب أي ضرر واضح للعينات النباتية، وعدم حمل خارج الرحم التنشيط الخفيفة المتصلة بالإجهاد من pPR1 (الشكل 3ب، ج). وهذا أدى إلى تطوير البرنامج المستخدم في هذه الدراسة. وهكذا، تعتبر فترات 3-دقيقة لتصوير fluorescence كافية لالتقاط ديناميات pPR1 أثناء Pst_a2-بوساطة إيتي9.
المروج-مراسل ثوابت، لا سيما مع المراسل الفلورسنت تنصهر فيها NLS، استخدمت العديد من المجموعات، وهي متاحة بسهولة من مجتمع البحوث؛ وكنا في بناء نشرتها كوبو et al. 13-وهكذا، يمكن استخدام البروتوكول هو موضح هنا في دراسة علم الأحياء النباتية أي فحص أنسجة نبات، إذا تتوفر النباتات المعدلة وراثيا ملائمة. وينص البروتوكول بسيطة وسهلة لدينا فرصة عظيمة للباحثين الذين يحرصون على تحليل ديناميات الزمانية المكانية لأي حدث البيولوجية التي تحدث في أوراق، مثل الاستجابة المناعية. فمن المعقول أن لدينا طريقة استخدام قطع الشريط الحث إجهاد البدني طفيفا على العينات. ومع ذلك، يمكن أن تسيطر هذه المسألة بما في ذلك الضوابط المناسبة، الإيجابية والسلبية، مثل العلاجات وهمية، في التجارب (الشكل 3ج). يمكن تعديل الشروط التجريبية كذلك والأمثل من خلال تحليل عناصر التحكم هذه في ظروف مختلفة.
في السنوات الأخيرة، والتطور السريع لأدوات وتقنيات التصوير حفز اهتمام الباحثين في الجوانب الزمانية المكانية المعقدة للأحداث البيولوجية. في أي تحليل التصوير، تصاعد المناسبة وتحديد العينات من بين أهم القضايا. ويمكن تطبيق أسلوب المعيشة المتصاعدة أوراق نبات نمواً في هذه الدراسة البسيطة وتنوعاً والأمثل لمختلف تجارب التصوير.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
هذا العمل كان يدعمها في اليابان وكالة العلوم والتكنولوجيا [PRESTO117665 لنشره، ERATOJPMJER1502 إلى ن. ن.]، و "الجمعية اليابانية" "تعزيز العلوم" (معونة "بدء نشاط البحوث" [22880008 لنشره] والعلماء الشباب (ب) [ 23780040 إلى نشرة]). ونحن نشكر سينزاكي ألف وهاء بيتسوياكو سوزوكي Y.، Y. سوجيساوا للمساعدة التقنية الممتازة، J. باركر لتوفير سلالة Pst_a2 ، و "ديمورا ت." لتوفير ناقلات ببجين.
Materials
| Name | Company | Catalog Number | Comments |
| Bacto Agar | BD biosciences | 214010 | |
| Bacto Protease Peptone No. 3 | BD biosciences | 211693 | |
| Bacto Yeast Extract | BD biosciences | 212750 | |
| BM2 soil | Berger | ||
| Glycerol | nacalai tesque | 17017-35 | |
| Kanamycin sulfate | Wako | 113-00343 | |
| Leica M205FA with DFC365FX, LED_MCI and Leica EL6000 (Las X software-regulated) | Leica Microsystems | Yellow fluorescent protein (YFP) and Texas Red (TXR) filters installed | |
| Magnesium Chloride Hexahydrate | Wako | 135-00165 | |
| Micro Slide Glass (Size: 76 mm × 26 mm, Thickness: 1.0–1.2 mm) | MATSUNAMI | S1112 | |
| Micropore Surgical Tape (1.25 cm × 9 m) | 3M | 1530-0 | |
| Needleless 1 ml plastic syringe | Terumo | SS-01T | |
| Plastic cell plug tray (cell size: 44 mm × 44mm × 44 mm) | Tanaka sangyo, Japan | htray-bk72 | Any tray with similar sized cells can be used |
| Rifampicin | nacalai tesque | 30259-81 | |
| Plastic Tape (0.2 mm thick × 19 mm wide × 10 m long) | Yamato | No0200-19-1 | Any plastic/vinyl tape with similar thickness can be used |
References
- Tsuda, K., Somssich, I. E. Transcriptional networks in plant immunity. New Phytologist. 206 (3), 932-947 (2015).
- Mine, A., Sato, M., Tsuda, K. Toward a systems understanding of plant-microbe interactions. Frontiers in Plant Science. 5, (2014).
- Murray, S. L., Thomson, C., Chini, A., Read, N. D., Loake, G. J. Characterization of a novel, defense-related Arabidopsis mutant, cir1, isolated by luciferase imaging. Molecular Plant-Microbe Interactions. 15 (6), 557-566 (2002).
- Spoel, S. H., Johnson, J. S., Dong, X. Regulation of tradeoffs between plant defenses against pathogens with different lifestyles. Proceedings of the National Academy of Sciences of the United States of America. 104 (47), 18842-18847 (2007).
- Asai, S., Shirasu, K. Plant cells under siege: plant immune system versus pathogen effectors. Current Opinion in Plant Biology. 28, 1-8 (2015).
- Schmelzer, E., Kruger-Lebus, S., Hahlbrock, K. Temporal and Spatial Patterns of Gene Expression around Sites of Attempted Fungal Infection in Parsley Leaves. The Plant Cell. 1 (10), 993-1001 (1989).
- Ohshima, M., Itoh, H., Matsuoka, M., Murakami, T., Ohashi, Y. Analysis of stress-induced or salicylic acid-induced expression of the pathogenesis-related 1a protein gene in transgenic tobacco. The Plant Cell. 2 (2), 95-106 (1990).
- Rushton, P. J., Reinstädler, A., Lipka, V., Lippok, B., Somssich, I. E. Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen- and wound-induced signaling. The Plant Cell. 14 (4), 749-762 (2002).
- Betsuyaku, S., et al. Salicylic Acid and Jasmonic Acid Pathways are Activated in Spatially Different Domains Around the Infection Site During Effector-Triggered Immunity in Arabidopsis thaliana. Plant & Cell Physiology. 59 (1), 8-16 (2018).
- Dodds, P. N., Rathjen, J. P. Plant immunity: towards an integrated view of plant-pathogen interactions. Nature Reviews Genetics. 11 (8), 539-548 (2010).
- Katagiri, F., Thilmony, R. The Arabidopsis thaliana-Pseudomonas syringae interaction. Arabidopsis Book. , (2002).
- Zeier, J., Pink, B., Mueller, M. J., Berger, S. Light conditions influence specific defence responses in incompatible plant-pathogen interactions: uncoupling systemic resistance from salicylic acid and PR-1 accumulation. Planta. 219 (4), 673-683 (2004).
- Kubo, M., et al. Transcription switches for protoxylem and metaxylem vessel formation. Genes & Development. 19 (16), 1855-1860 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved