Method Article
Un metodo Versatile per il montaggio di Arabidopsis lascia per l'Imaging di time-lapse videomicroscopia
In questo articolo
Riepilogo
Segnaliamo un metodo semplice e versatile per l'esecuzione di live-imaging fluorescente di Arabidopsis thaliana foglie per un periodo prolungato di tempo. Usiamo una piante transgeniche di Arabidopsis che esprimono un gene reporter fluorescente sotto il controllo di un promotore di immunità-correlati come esempio per acquisire spatiotemporal comprensione delle risposte immunitarie pianta.
Abstract
La risposta immunitaria di impianto connessa con un genoma di riprogrammare trascrizionale è iniziata presso il sito di infezione. Così, la risposta immunitaria è regolata spazialmente e temporalmente. L'uso di un gene fluorescente sotto il controllo di un promotore di immunità-relative in combinazione con un microscopio a fluorescenza automatizzato è un modo semplice per capire spatiotemporal regolazione dell'immunità di pianta. In contrasto con i tessuti di radice che sono stati utilizzati per un numero di vari esperimenti di imaging fluorescenti videomicroscopia, esistono alcuni esempi di vivere-imaging fluorescenti per i tessuti della foglia che incontrano una matrice delle infezioni microbiche nell'aria. Di conseguenza, abbiamo sviluppato un metodo semplice per montare le foglie delle piante di Arabidopsis thaliana per l'imaging di cellule vive per un periodo prolungato di tempo. Abbiamo utilizzato piante transgeniche di Arabidopsis esprimenti la proteina fluorescente gialla (YFP) genefused per il segnale di localizzazione nucleare (NLS) sotto il controllo del promotore di un gene marcatore correlate a difesa, Pathogenesis-Related 1 ( PR1). Abbiamo infiltrato una foglia transgenica con Pseudomonas syringae pv. pomodoro DC3000 (avrRpt2) ceppo (Pst_a2) ed eseguito imaging in vivo time-lapse del segnale per un totale di 40 h utilizzando uno stereomicroscopio automatizzato fluorescenza YFP. Questo metodo può essere utilizzato non solo per gli studi sulle risposte immunitarie di pianta, ma anche per l'analisi dei vari eventi dello sviluppo e risposte ambientali che si verificano nei tessuti fogliari.
Introduzione
Risposta immunitaria pianta comporta una dinamica riprogrammare trascrizionale regolata dalla trascrizione multipli fattori così come fitormoni1. L'accumulo di dati del trascrittoma fornisce opportunità per raccogliere informazioni sul sistema immunitario pianta: ad esempio, la struttura di rete di segnalazione a cascata2. Tuttavia, la nostra conoscenza del dinamismo spaziale e temporale dell'immunità pianta rimane ancora limitato3,4,5.
Negli studi precedenti, spatiotemporal regolazione dell'espressione genica correlate a defense è stato analizzato principalmente tramite l'ibridazione in situ e un β-glucuronidasi (GUS) reporter dosaggio6,7,8. Questi metodi consentono di visualizzare l'attivazione trascrizionale di diversi geni di interesse in situ. Tuttavia, queste procedure richiedono fissazione chimica degli esemplari e quindi causare la perdita di tutte le informazioni temporali. Eventi biologici, quali l'immunità, progressi nel tempo. L'uso della luciferasi come reporter ha permesso la cattura di dinamica temporale del promotore di interesse3. Tuttavia, basato su luciferase assay richiede un substrato costoso e altamente sensibile detector. Per aumentare la nostra comprensione degli aspetti spaziotemporali della risposta immunitaria pianta utilizzando una semplice procedura, abbiamo generato transgenici Arabidopsis thaliana piante esprimenti la proteina fluorescente gialla (YFP) gene fusa per la segnale di localizzazione nucleare (YFP-NLS) sotto il controllo del promotore del gene marcatore correlate a difesa, Pathogenesis-Related 1 (PR1)9. Abbiamo usato autofluorescence di clorofilla, un marcatore delle cellule viventi, di catturare il processo di morte cellulare programmata (PCD), che spesso si verifica durante attivato effettrici dell'immunità (ETI), una forma di immunità pianta indotta dal patogeno specifico infezione9 , 10. monitoraggio la dinamica temporale dell'intensità del segnale di fluorescenza in liberamente oggetti in movimento, come ad esempio living foglie di Arabidopsis , richiede un'immagine complessa elaborazione software integrato internamente o disponibile in commercio. In alternativa, impedendo lo spostamento di esemplari è un metodo semplice per risolvere il problema. Qui, abbiamo sviluppato un metodo semplice e versatile per il montaggio vivono foglie di una pianta Arabidopsis transgenica per l'osservazione a lungo termine sotto uno stereomicroscopio automatizzato fluorescenza. Il metodo permette di catturare il promotore dinamiche all'interno del terreno coltivato pianta intatta foglie sopra un paio di giorni.
Protocollo
Nota: È importante prevenire sonno movimento di vita foglia campioni durante imaging time-lapse. Per ridurre al minimo lo stress meccanico sulle foglie, gentle fissazione delle foglie è necessaria. Campioni di foglia adeguatamente preparati solo producono time-lapse immagini adatte per diverse analisi di immagine. Un protocollo utilizzando piante transgeniche di Arabidopsis esprimenti YFP-NLS fusione sotto il controllo del promotore del gene PR1 (pPR1-YFP-NLS piante) e Pseudomonas syringae pv. pomodoro Dc3000 ceppo (avrRpt2) (Pst_a2) è descritto di seguito come esempio.
1. preparazione di piante e patogeni
- Riempire un vassoio di plastica cellulare spina (Tabella materiali) con terreno sterilizzato nell'autoclave.
- Seminare un seme di Arabidopsis transgenico per cella (Figura 1A).
- Trasferire il vassoio in una camera di crescita mantenuta a 23 ° C e far crescere le piante sotto luce bianca continua per 2-3 settimane.
- Due giorni prima dell'inoculazione del patogeno, striscia Pseudomonas syringae pv. pomodoro Dc3000 avrRpt2 ceppo (Pst_a2) da uno stock di glicerolo sul NYG medio (peptone 5 g/L, 3 g/L estratto di lievito, glicerolo di 20 mL/L, agar batteriologico 15 g/L, pH 7,0) contenenti 100 mg/L rifampicina e 50 mg/L kanamicina e incubare a 28 ° C per 48 h.
- Raccogliere le cellule batteriche che appaiono sulla superficie del mezzo utilizzando punte di plastica, trasferirli in un tubo di plastica contenente 10 mM MgCl2e risospendere. Misurare la densità ottica (OD) della soluzione a 600 nm (OD600). Regolare la concentrazione finale delle cellule delle cellule batteriche a 10 unità di formazione di8 colonie (CFU) / mL, che normalmente corrisponde alla OD600 = 0,211.
2. inoculazione del patogeno
- Tagliare con una spina di cella contenente una pianta di 2-3-settimana-vecchio senza danneggiare la pianta. Impostare la cella in un vassoio di spina cella vuota (2 x 2 celle sono sufficienti) per mantenere un buon equilibrio (Figura 1B).
- Seleziona una foglia visibilmente sana per inoculazione. In genere, il terzo, quarto e quinto lascia (#3, #4 e #5, rispettivamente, in Figura 1C) dalla parte inferiore della pianta sono facili da gestire. Utilizzare foglie nella stessa posizione in una serie di esperimenti per migliore riproducibilità. Acqua il terreno tenendo la pianta prima dell'inoculazione per l'imaging di time-lapse a lungo termine.
- Facoltativamente, nel caso di analisi di stress-responsive promotori quali pPR1, per garantire che le piante non sono naturalmente sollecitati, esaminare le foglie sotto uno stereomicroscopio di fluorescenza prima dell'inoculazione del patogeno per verificare l'assenza di segnale YFP. Escludi lascia segnale YFP visualizzando dall'esperimento.
- Indossare guanti in lattice monouso prima di infiltrazione per evitare il contatto diretto con l'agente patogeno. Usando una siringa da 1 mL senza ago in plastica, infiltrarsi attentamente il lato abbagliai della foglia con la sospensione batterica (108 CFU/mL),11 (Figura 1D). Inoculazione di una piccola porzione su metà della foglia consente una buona visualizzazione di attività pPR1 ; la zona infiltrata diventa visibile come colore rispetto alla restante foglia verde più scuro. Essere estremamente attenti a non causare danni meccanici alla foglia durante l'infiltrazione.
Nota: Assicurarsi che tutti gli spazi intercellulari in zona infiltrato sono completamente soddisfatte (in verticale) con la sospensione dell'agente patogeno; in caso contrario, il dominio PCD sarà difficile da visualizzare sotto lo stereomicroscopio fluorescente. Questo può essere semplicemente confermato da complemento di greening scuro nella zona infiltrata. - Assorbire l'eccesso di sospensione batterica dalla zona che circonda la sezione infiltrata della foglia infiltrata con un tovagliolo di carta morbido.
3. montaggio la foglia inoculata
- Immediatamente dopo l'inoculazione, fissare una lastra di vetro sul vassoio in plastica utilizzando nastro chirurgico (Tabella materiali) tale che la foglia infiltrata si trova al centro del vetrino. Assicurarsi che il disco di foglia inoculato completamente è montato all'interno della diapositiva di vetro (Figura 2A).
- Preparare il nastro di plastica a due strati (nel caso di nastro di spessore di 0,2 mm, Vedi Tabella materiali) e tagliarlo in due pezzi (Figura 2B; le parti 1 e 2) per adattare gli spazi lungo il picciolo della foglia infiltrata. Organizzare la lunghezza di questi due pezzi, indicato con una freccia a due punte in Figura 2B, per adattarsi alla lunghezza della freccia a due punte, illustrata nella Figura 2A.
Nota: Ritagliando un angolo da ciascuno dei due pezzi aiuta a evita di danneggiare la lamina fogliare (Figura 2B, punte di freccia; vedere anche il punto 3.4 qui sotto). Qualsiasi tipo di nastro di plastica con spessore simile è adatto alla realizzazione di un ponte sopra il picciolo. La rigidità del nastro di plastica è importante per una facile movimentazione durante la procedura descritta di seguito. - Utilizzando un paio di pinzette bene, attaccare pezzi di nastro 1 e 2 su entrambi i lati del picciolo tale che gli angoli di taglio di ogni pezzo allineare con la base della lamina fogliare (Figura 2C). Garantire che i pezzi di nastro non tocchino la lama picciolo o foglia.
Nota: Questi pezzi di nastro di plastica doppio strato alla base del lembo fogliare fungono da distanziali e prevenire lo stress fisico il picciolo durante il montaggio. - Preparare un pezzo aggiuntivo di doppio-strato di nastro di plastica (Figura 2B, pezzo 3) per adattarsi alle dimensioni della doppia freccia in Figura 2B e incollarla sopra i pezzi di nastro 1 e 2 per formare un ponte sopra il picciolo ( Figura 2D, E). Essere estremamente attenti a non prendere la lama picciolo e foglia direttamente tra i pezzi di nastro alle posizioni indicate con le frecce in Figura 2D, E.
- Delicatamente attaccare un piccolo pezzo di nastro chirurgico (Figura 2F, pezzo 4) su lastra di vetro sopra la punta del lembo fogliare in modo che il lembo fogliare è stato risolto molto morbidamente su vetrino. Solo premere con forza verso il basso la parte del nastro chirurgico direttamente toccando il vetrino (Figura 2F, zona evidenziata con una linea rossa tratteggiata), non l'altra parte che ricopre la foglia.
- Delicatamente bastone un altro piccolo pezzo di nastro chirurgico (Figura 2G, pezzo 5) al bordo del picciolo e nastro di plastica pezzi (1, 2 e 3) affinché il picciolo è molto morbidamente fissi sul vetrino e nastro di plastica pezzi. Solo fissare saldamente la parte del nastro chirurgico direttamente toccando il vetrino al vetrino e pezzi di nastro di plastica (Figura 2G, area delimitata da una linea rossa tratteggiata), non l'altra parte che ricopre il picciolo.
- Impediscono il movimento nel campo visivo del microscopio usando punte di pipetta 200 µ l (Figura 2H) di foglie vicine. Inserire i puntali nel terreno per premere delicatamente le foglie vicine lontano la foglia infiltrata. Fare attenzione a non inserire le punte troppo in profondità nel terreno per evitare danni alle radici possibili.
Nota: La pianta preparata è ora pronta per l'imaging di fluorescenza stereomicroscopio.
4. microscopica osservazione time-lapse
- Accendere lo stereomicroscopio fluorescente.
Nota: Qui, uno stereomicroscopio automatizzato dotato di un altamente sensibile monocromatico 1,4 megapixel fotocamera digitale in modalità a 12 bit è utilizzata (Tabella materiali). Il microscopio deve trovarsi in una stanza buia con un'unità di aria condizionata o in un armadio scuro con una ventilazione adeguata per mantenere la temperatura a 23 ° C durante la formazione immagine di time-lapse. - Impostare la pianta nello spazio sopra sotto la lente dell'obiettivo dello stereomicroscopio per l'imaging.
- Impostare i parametri per l'imaging di time-lapse (Vedi esempi nella tabella 1). Assicurarsi che a passi di programma per l'esposizione alla luce durante il periodo di intervallo di time-lapse imaging poiché la luce ha un notevole impatto su pianta immunità12.
- Utilizzare il filtro YFP convenzionale (eccitazione 500-520 nm; emissione 540-580 nm) per visualizzare il segnale YFP.
- Utilizzare il filtro di Texas Red (TXR) (eccitazione 540-580 nm; passaggio lungo di emissione 610 nm) per visualizzare autofluorescence di clorofilla, in modo che il dominio PCD è visibile come una zona scura (nessun autofluorescence) circondata da YFP-positiva delle cellule strati9 (Figura 3 A).
- Utilizzare l'installazione convenzionale campo epi-chiaro per la procedura di ulteriore esposizione alla luce.
Nota: Prima dell'esperimento, misurare la potenza della sorgente luminosa epi-brillante e regolare il livello di condizione di crescita del proprio impianto.
- Eseguire il programma di imaging time-lapse. Per osservazione a lungo termine per diversi giorni, è consigliabile innaffiare la pianta in modo appropriato, ad esempio, durante le fasi di esposizione alla luce.
- Dopo l'acquisizione di immagini, omettere canali extra utilizzati per esposizione alla luce negli intervalli (corrispondenti ai canali 3-8 nella tabella 1) dal set di dati. Analizzare i dati con vari metodi, ad esempio analisi del regione di interesse (ROI), utilizzando software di analisi di immagine diversa ad esempio Fiji9.
Risultati
Qui, abbiamo usato Pst_a2-indotto ETI come esempio per l'imaging di time-lapse. Time-lapse dati sono stati ottenuti come una serie di immagini, alcune delle quali sono mostrate in Figura 3Be come un filmato time-lapse (Supplemental Movie 1)9. Negli esperimenti di successo utilizzando pPR1-YFP-NLS durante Pst_a2-indotto ETI, attivazione transitoria di pPR1 è stato osservato, come evidente da YFP esprimendo i fuochi, in parecchi strati delle cellule che circondano il dominio PCD (Figura 3B) 9. l'attivazione di pPR1 in cellule che circondano il dominio PCD solitamente inizia a circa 5 ore post l'inoculazione (hpi), picchi a circa 12 hpi e dura fino a 40 hpi (Figura 3B)9. Poiché le immagini sono state acquisite utilizzando un sistema di epi-fluorescente, i segnali YFP ottenuti qui sono stati generati da diversi strati di cellule adassiale, compreso le cellule del mesofillo epidermica, così come superiore.

Figura 1 : Metodo utilizzato per l'infiltrazione di agente patogeno batterico nella Arabidopsis thaliana foglia. (A) due a tre-week-old Arabidopsis piante sono state coltivate in un vassoio di spina di cella. (B) One-cell spina contenente l'impianto selezionato per essere utilizzato per l'inoculazione e l'osservazione è stato tagliato e caricata nel vassoio spina cella vuota per mantenere l'equilibrio. (C) Il terzo, quarto e quinto lascia (#3, #4 e #5, rispettivamente) sono adatti per l'analisi di immagine. (D) infiltrazione della sospensione dell'agente patogeno in una foglia selezionata usando una siringa senza ago. L'area infiltrata può essere riconosciuto basato il suo colore verde più scuro che la foglia rimanente. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Metodo utilizzato per il montaggio l'infiltrato Arabidopsis foglia per time-lapse imaging. (A) fotografia della pianta Arabidopsis con una lastra di vetro fissata sotto la foglia inoculata. La foglia di infiltrato è stata posizionata al centro del vetrino. La doppia freccia indica la lunghezza dei distanziali con nastri in plastica. (B) preparazione del nastro di plastica distanziali e ponte. Doppia - nastro di plastica a più livelli è stato tagliato in due pezzi (1 e 2) per i distanziali e un altro pezzo (3, indicato con una linea rossa tratteggiata) è stato tagliato per preparare un ponte. Le lunghezze delle frecce a due punte sono quasi identiche alla lunghezza della freccia a due punte in (A). Uno dei quattro angoli delle parti 1 e 2, indicato con le frecce, sono stati tagliati. (C), due pezzi di nastro di plastica a due strati (numerati come 1 e 2) sono stati accuratamente incollati sul vetro scorrevole lungo il picciolo utilizzando un paio di pinzette bene, senza contatto diretto con la lama di picciolo e foglia. (D) un pezzo aggiuntivo di doppio-strato di nastro di plastica (numerato come 3), che è stato preparato da (B), è stato posto su entrambi i distanziatori basali (1 e 2) per formare un ponte sopra il picciolo, garantendo nel contempo per non prendere il picciolo tra nastri 1 e 2 alle posizioni indicate con le frecce. (E) una fotografia che mostra il picciolo nastrato. È importante non prendere tessuto vegetale direttamente tra i pezzi di nastro di plastica alle posizioni indicate con le frecce. (F), un piccolo pezzo di nastro chirurgico (numerato come 4) è stato incollato delicatamente il vetrino intorno alla punta del lembo fogliare. Solo l'area delineata dalla linea rossa tratteggiata è stato premuto saldamente sul vetrino. (G), un altro piccolo pezzo di nastro chirurgico (numerato come 5) delicatamente è stato incollato al bordo del picciolo e pezzi di nastro di plastica. Solo l'area delineata dalla linea rossa tratteggiata è stato premuto per fissare il picciolo dolcemente sul vetrino vetro e pezzi di nastro di plastica. Puntali monouso (H), due sono stati usati per impedire il movimento nel campo di vista dello stereomicroscopio foglie vicine. I puntali sono stati inseriti direttamente nel terreno in posizioni appropriate. Clicca qui per visualizzare una versione più grande di questa figura.
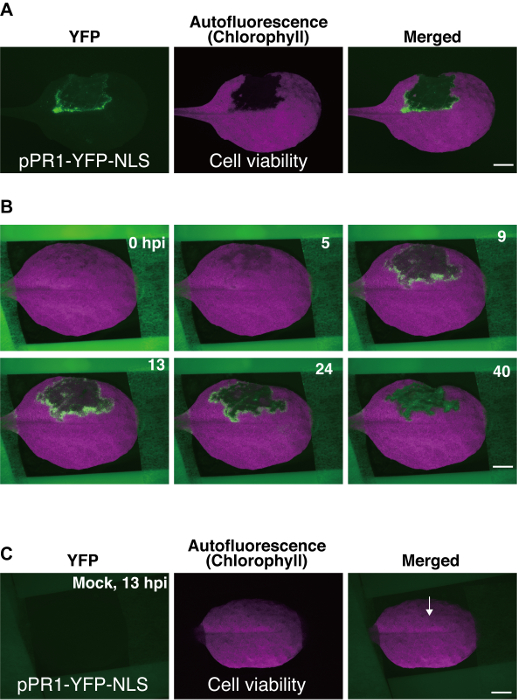
Figura 3 : Rappresentante i risultati utilizzando il Arabidopsis foglia metodo di montaggio. Immagini di stereomicroscopia fluorescente (A) di una foglia transgenica di Arabidopsis (pianta pPR1-YFP-NLS). Una porzione della foglia è stata infiltrata con Pst_a2 (108 CFU/mL) sulla sua superficie abbagliai, e immagini sono state catturate 22 ore post inoculazione (hpi). I nuclei in cui è stato attivato il promotore di pPR1 sono stati rilevati utilizzando il filtro YFP, e morte cellulare programmata (PCD) è stata rilevata basato sulla perdita di clorofilla autofluorescence utilizzando il filtro di Texas Red (TXR). Barra della scala = 2,5 mm. (B) alcuni time-lapse immagini selezionate da una collezione di 800 immagini ottenute mediante il protocollo descritto qui. Questi dati forniscono una panoramica in vivo delle dinamiche spazio-temporale di attività pPR1 per 40 hpi. Immagini unite di YFP e TXR immagini sono mostrati. Barra della scala = 2,5 mm. (C) Mock infiltrazione di una foglia transgenica (pianta pPR1-YFP-NLS). In finto infiltrazione, 10mm MgCl2 è stato infiltrato nel lato abbagliai della foglia, seguita da formazione immagine di time-lapse. Trattamento finto non ha causato ectopico pPR1 attività e non ha interferito con clorofilla autofluorescence alle 13 hpi. Una freccia indica la posizione di infiltrazione finto. Barra della scala = 2,5 mm. Queste immagini sono state modificate da un precedente studio9. Clicca qui per visualizzare una versione più grande di questa figura.
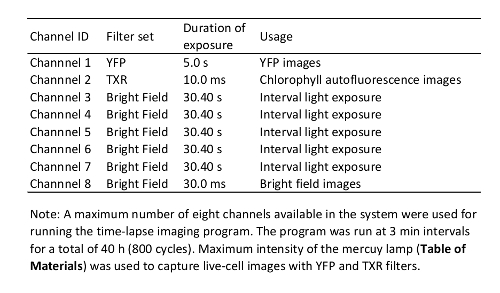
Tabella 1: Time-lapse programma di imaging utilizzata in questo studio.
Supplementare Movie 1: filmato time-lapse che mostra la dinamica spazio-temporale del pPR1 attivazione in un transgenico Arabidopsis foglia di immunità seguenti attivato effettrici (ETI) indotta da Pst_a2 inoculazione. Con Pst_a2 si è infiltrata in una parte del lato abbagliai di una foglia transgenica che trasportano il costrutto pPR1-YFP-NLS (108 CFU/mL). Immagini sono state acquisite a intervalli di 3 minuti per un totale di 40 h. Il timestamp mostrato è in dd:hh:mm:ss.sss il formato. Questo film è stato modificato da un precedente studio9. Per favore clicca qui per vedere questo video. (Tasto destro per scaricare.)
Discussione
Qui, segnaliamo un metodo semplice per montare un vivente Arabidopsis foglia che esprimono un gene reporter fluorescente sotto il controllo di un promotore di interesse per l'osservazione a lungo termine utilizzando uno stereomicroscopio fluorescente automatizzato. Time-lapse imaging di un reporter fluorescente è stata eseguita frequentemente nei tessuti della radice; Tuttavia, solo pochi studi simili sono stati condotti nei tessuti fogliari. Questo è probabilmente perché le foglie sono in grado di muoversi liberamente nello spazio, considerando che le radici sono spesso sepolto e fissate nel terreno agar solido.
In questo rapporto, ci siamo concentrati sulla dinamica spazio-temporale di pPR1 attività durante ETI indotto da Pst_a2. Oltre la fissazione delicata della foglia descritta sopra, è importante visualizzare chiaramente la dinamica spazio-temporale degli eventi cellulari come attivazione del promotore e PCD. Se la distinzione tra cellule che mostrano attività pPR1 e PCD non è nitida, assicurarsi che tutti gli spazi intercellulari in zona infiltrato sono completamente riempiti con la sospensione dell'agente patogeno (Vedi punto 2.4). Questo è fondamentale quando si utilizza grandangolari stereomicroscopi poiché questi microscopi catturano tutti i segnali rilevabili lungo la stessa posizione verticale dell'esemplare. Autofluorescenza clorofilla dalle cellule sopravvissute di sopra o di sotto le cellule nel dominio PCD maschera facilmente le cellule morte che esibiscono nessun autofluorescence. Questo vale anche per il segnale YFP.
Condizioni per l'imaging di time-lapse necessario stabilire attentamente attraverso diversi esperimenti preliminari in diverse condizioni sperimentali. Parametri per l'imaging di time-lapse dipendono da diversi fattori quali il sistema microscopico, piante transgeniche e patogeni. Per ottenere questi parametri, abbiamo prima analizzato diversi tempi di esposizione per l'intensità del segnale YFP nella foglia infiltrata a 7 hpi, che quasi coincide con l'attivazione iniziale di pPR1. Un'esposizione di s 5 è stata determinata come appropriato per catturare YFP segnale con lo stereomicroscopio utilizzato in questo studio. Un test simile è stato effettuato per l'imaging autofluorescence di clorofilla. Esposizione dell'esemplare alla luce tra gli intervalli di 3 minuti è stato programmato nel time-lapse programma imaging come formazione immagine normale campo luminoso con tempo di esposizione massimo. Il nostro sistema (Tabella materiali) ci ha permesso di avere 2,5 min oltre YFP, TXR e campo chiaro imaging. Questo vincolo è stato il motivo principale per scegliere un intervallo di 3 min. Successivamente, abbiamo confermato che questa condizione di time-lapse non causato nessun danno apparente per i campioni di pianta e non ha indotto ectopico fotoattivazione sollecit-relativi di pPR1 (Figura 3B, C). Ciò ha condotto allo sviluppo del programma utilizzato in questo studio. Così, gli intervalli di 3 minuti di formazione immagine di fluorescenza sono stati ritenuti sufficienti per catturare pPR1 dinamiche durante Pst_a2-mediata ETI9.
Costruzioni del promotore-reporter, soprattutto con il reporter fluorescente fuso a NLS, sono stati utilizzati da molti gruppi e sono facilmente reperibile dalla comunità di ricerca; Abbiamo usato il costrutto pubblicato da Kubo et al. 13. così, il protocollo descritto qui può essere utilizzato in qualsiasi studio di biologia vegetale esaminando tessuti fogliari, se appropriati piante transgeniche sono disponibili. Il nostro protocollo semplice e facile fornisce una grande opportunità per i ricercatori che sono interessati ad analizzare la dinamica spazio-temporale di tutti gli eventi biologici che si verificano foglie, come la risposta immunitaria. È plausibile che il nostro metodo usando pezzi di nastro induce un lieve stress fisico sugli esemplari. Tuttavia, questo problema può essere controllato mediante l'inclusione di appropriati controlli positivi e negativi, come i trattamenti finti, negli esperimenti (Figura 3C). Le condizioni sperimentali possono essere ulteriormente modificate e ottimizzate analizzando questi controlli in condizioni diverse.
Negli ultimi anni, il rapido sviluppo di tecniche e strumenti di imaging ha stimolato l'interesse dei ricercatori per i complessi aspetti spaziotemporali eventi biologici. In ogni analisi di imaging, appropriato montaggio e fissaggio degli esemplari sono tra le questioni più importanti. Il metodo semplice e versatile di montaggio viventi che Arabidopsis lascia sviluppato in questo studio possa essere applicato e ottimizzato per vari esperimenti di imaging.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal Japan Science and Technology Agency [PRESTO117665 a S.B., ERATOJPMJER1502 di N.N.] e dalla società per la promozione della scienza (localizzativi per l'avvio di attività di ricerca [22880008 a S.B.] e per giovani scienziati (B) [Giappone 23780040 a S.B.]). Ringraziamo r. Senzaki, Y. Suzuki, Y. Sugisawa ed E. Betsuyaku per l'eccellente assistenza tecnica, J. Parker per fornire il ceppo Pst_a2 e T. Demura per fornire il vettore di pBGYN.
Materiali
| Name | Company | Catalog Number | Comments |
| Bacto Agar | BD biosciences | 214010 | |
| Bacto Protease Peptone No. 3 | BD biosciences | 211693 | |
| Bacto Yeast Extract | BD biosciences | 212750 | |
| BM2 soil | Berger | ||
| Glycerol | nacalai tesque | 17017-35 | |
| Kanamycin sulfate | Wako | 113-00343 | |
| Leica M205FA with DFC365FX, LED_MCI and Leica EL6000 (Las X software-regulated) | Leica Microsystems | Yellow fluorescent protein (YFP) and Texas Red (TXR) filters installed | |
| Magnesium Chloride Hexahydrate | Wako | 135-00165 | |
| Micro Slide Glass (Size: 76 mm × 26 mm, Thickness: 1.0–1.2 mm) | MATSUNAMI | S1112 | |
| Micropore Surgical Tape (1.25 cm × 9 m) | 3M | 1530-0 | |
| Needleless 1 ml plastic syringe | Terumo | SS-01T | |
| Plastic cell plug tray (cell size: 44 mm × 44mm × 44 mm) | Tanaka sangyo, Japan | htray-bk72 | Any tray with similar sized cells can be used |
| Rifampicin | nacalai tesque | 30259-81 | |
| Plastic Tape (0.2 mm thick × 19 mm wide × 10 m long) | Yamato | No0200-19-1 | Any plastic/vinyl tape with similar thickness can be used |
Riferimenti
- Tsuda, K., Somssich, I. E. Transcriptional networks in plant immunity. New Phytologist. 206 (3), 932-947 (2015).
- Mine, A., Sato, M., Tsuda, K. Toward a systems understanding of plant-microbe interactions. Frontiers in Plant Science. 5, (2014).
- Murray, S. L., Thomson, C., Chini, A., Read, N. D., Loake, G. J. Characterization of a novel, defense-related Arabidopsis mutant, cir1, isolated by luciferase imaging. Molecular Plant-Microbe Interactions. 15 (6), 557-566 (2002).
- Spoel, S. H., Johnson, J. S., Dong, X. Regulation of tradeoffs between plant defenses against pathogens with different lifestyles. Proceedings of the National Academy of Sciences of the United States of America. 104 (47), 18842-18847 (2007).
- Asai, S., Shirasu, K. Plant cells under siege: plant immune system versus pathogen effectors. Current Opinion in Plant Biology. 28, 1-8 (2015).
- Schmelzer, E., Kruger-Lebus, S., Hahlbrock, K. Temporal and Spatial Patterns of Gene Expression around Sites of Attempted Fungal Infection in Parsley Leaves. The Plant Cell. 1 (10), 993-1001 (1989).
- Ohshima, M., Itoh, H., Matsuoka, M., Murakami, T., Ohashi, Y. Analysis of stress-induced or salicylic acid-induced expression of the pathogenesis-related 1a protein gene in transgenic tobacco. The Plant Cell. 2 (2), 95-106 (1990).
- Rushton, P. J., Reinstädler, A., Lipka, V., Lippok, B., Somssich, I. E. Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen- and wound-induced signaling. The Plant Cell. 14 (4), 749-762 (2002).
- Betsuyaku, S., et al. Salicylic Acid and Jasmonic Acid Pathways are Activated in Spatially Different Domains Around the Infection Site During Effector-Triggered Immunity in Arabidopsis thaliana. Plant & Cell Physiology. 59 (1), 8-16 (2018).
- Dodds, P. N., Rathjen, J. P. Plant immunity: towards an integrated view of plant-pathogen interactions. Nature Reviews Genetics. 11 (8), 539-548 (2010).
- Katagiri, F., Thilmony, R. The Arabidopsis thaliana-Pseudomonas syringae interaction. Arabidopsis Book. , (2002).
- Zeier, J., Pink, B., Mueller, M. J., Berger, S. Light conditions influence specific defence responses in incompatible plant-pathogen interactions: uncoupling systemic resistance from salicylic acid and PR-1 accumulation. Planta. 219 (4), 673-683 (2004).
- Kubo, M., et al. Transcription switches for protoxylem and metaxylem vessel formation. Genes & Development. 19 (16), 1855-1860 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon