Method Article
Eine vielseitige Methode für die Montage von Arabidopsis verlässt für intravitalen Zeitraffer Aufnahmen
In diesem Artikel
Zusammenfassung
Wir berichten über eine einfache und vielseitige Methode zur Durchführung von fluoreszierenden live-Imaging von Arabidopsis Thaliana Blätter über einen längeren Zeitraum hinweg. Wir verwenden eine transgene Arabidopsis -Pflanze mit dem Ausdruck einer fluoreszierenden Reporter-gen unter der Kontrolle von einer Immunität im Zusammenhang mit Promoter als Vorbild für die räumlich-zeitliche Verständnis der Pflanze Immunantworten.
Zusammenfassung
Die Pflanze Immunantwort eine genomweite transkriptionelle Neuprogrammierung zugeordnet wird am Ort der Infektion eingeleitet. Somit ist die Immunantwort räumlich und zeitlich geregelt. Die Verwendung von fluoreszierenden gen unter der Kontrolle von einer Immunität im Zusammenhang mit Promoter in Kombination mit einer automatisierten Fluoreszenz-Mikroskopie ist eine einfache Möglichkeit, räumlich-zeitliche Regelung der Anlage Immunität zu verstehen. Im Gegensatz zu den Wurzel-Geweben, die für eine Reihe von verschiedenen intravitalen fluoreszierende bildgebenden Experimenten verwendet wurden, gibt es fluoreszierende live-Imaging Beispiele für die Blatt-Gewebe, die ein Array von airborne mikrobielle Infektionen auftreten. Daher entwickelten wir eine einfache Methode um Blätter von Arabidopsis Thaliana Pflanzen für das live Cell Imaging über einen längeren Zeitraum hinweg zu montieren. Wir verwendeten transgenen Arabidopsis -Pflanzen mit dem Ausdruck der gelben fluoreszierenden Proteins (YFP) Genefused mit dem nuklearen Lokalisierung Signal (NLS) unter der Kontrolle der Förderer der Verteidigung bezogene Markergen, Pathogenesis-Related 1 ( PR1). Wir haben ein transgenes Blatt mit Pseudomonas Syringae pv infiltriert. Tomaten DC3000 (avrRpt2) Stamm (Pst_a2) und in-vivo Zeitraffer Bildgebung des YFP Signals für eine Gesamtmenge von 40 h mit einer automatisierten Fluoreszenz Stereomikroskop durchgeführt. Diese Methode kann nicht nur für Studien zur Pflanze Immunantworten, sondern auch für die Analyse von verschiedenen Entwicklungsstörungen Ereignisse und Umwelt Reaktionen auftreten im Blatt Gewebe verwendet werden.
Einleitung
Pflanze Immunantwort beinhaltet eine dynamische transkriptionelle Umprogrammierung durch mehrere Transkription reguliert Faktoren sowie Phytohormone1. Die Anhäufung von Transkriptom Daten bietet Möglichkeiten zum Sammeln von Informationen auf das Immunsystem der Pflanze: zum Beispiel die Netzwerkstruktur der Signalisierung Kaskaden2. Unser Wissen über die räumliche und zeitliche Dynamik der Pflanze Immunität bleibt jedoch immer noch nur3,4,5.
In früheren Studien wurde meist raumzeitlichen Regulation der Genexpression im Zusammenhang mit der Verteidigung mittels in-situ Hybridisierung und β-Glucuronidase (GUS) Reporter Assay6,7,8analysiert. Diese Methoden ermöglichen es uns, die transkriptionelle Aktivierung von verschiedenen Genen des Interesses an Ort und Stelle zu visualisieren. Jedoch diese Verfahren erfordern chemische Fixierung der Proben, und somit zum Verlust aller zeitlichen Informationen führen. Biologische Ereignisse, z. B. Immunität, Fortschritte im Laufe der Zeit. Die Verwendung von Luciferase als Reporter hat die Erfassung der zeitlichen Dynamik des Veranstalters von Interesse3aktiviert. Luciferase-basierten Test erfordert jedoch eine teure Substrat und hochempfindlichen Detektoren. Um unser Verständnis der räumlich-zeitliche Aspekte der Pflanze Immunantwort mit Hilfe eines einfachen Verfahrens zu erhöhen, generierten wir transgene Arabidopsis Thaliana Pflanzen, die gelb fluoreszierenden Proteins (YFP) gen verschmolzen die nukleare Lokalisierung Signal (YFP-NLS) unter der Kontrolle der Förderer der Verteidigung-bezogenen Marker-gen, Pathogenesis-Related 1 (PR1)9. Wir verwendeten Chlorophyll Autofluoreszenz, eine Markierung von lebenden Zellen, den Prozess des programmierten Zelltod (PCD), erfassen die tritt häufig während der Effektor ausgelöst Immunität (ETI), eine Form der Pflanze Immunität induziert durch spezifische Erreger Infektion9 , 10. Überwachung die zeitliche Dynamik der Fluoreszenz Signalintensität in frei bewegender Objekte, wie z. B. Arabidopsis Blätter Leben, erfordert eine komplexe Bildverarbeitungs-Software entweder selbst gebaut oder verfügbar im Handel. Alternativ ist das verhindern des Verschiebens von Proben eine einfache Methode, um das Problem zu lösen. Hier haben wir eine vielseitige und einfache Methode für die Montage, die Blätter einer transgenen Pflanze der Arabidopsis zur Dauerbeobachtung unter einem automatisierten Fluoreszenz Stereomikroskop Leben entwickelt. Die Methode ermöglicht es uns, den Projektträger zu erfassen, die Dynamik innerhalb der intakten Pflanze Boden gewachsen in ein paar Tagen verlässt.
Protokoll
Hinweis: Es ist wichtig, zu verhindern, dass Schlaf Bewegung des lebendigen Blatt Proben während der Time-Lapse Bildgebung. Zur Minimierung von mechanischer Belastung auf den Blättern ist sanfte Fixierung der Blätter erforderlich. Nur ausreichend vorbereitet Blattproben produzieren Zeitraffer Bilder für verschiedene Bild-Analysen geeignet. Ein Protokoll mit transgenen Arabidopsis -Pflanzen mit dem Ausdruck YFP-NLS Fusion unter der Kontrolle von PR1 gen Promoter (pPR1-YFP-NLS Pflanzen) und Pseudomonas Syringae pv. Tomaten DC3000 (avrRpt2) Stamm (Pst_a2) wird im folgenden beispielhaft beschrieben.
1. Vorbereitung von Pflanzen und pathogenen
- Autoklaviert Boden ein Kunststoff Zelle Stecker Tablett (Table of Materials) einfüllen.
- Säe eine transgene Arabidopsis Samen pro Zelle (Abb. 1A).
- Übertragen Sie das Fach zu einem Wachstum Raum auf 23 ° C gehalten und wachsen Sie die Pflanzen unter weißes Dauerlicht für 2-3 Wochen.
- Streifen Sie zwei Tage vor der Erreger Inokulation, Pseudomonas Syringae pv. Tomaten DC3000 avrRpt2 Stamm (Pst_a2) aus einem Glycerin-bestand auf NYG Medium (5 g/L Pepton, 3 g/L Hefeextrakt, 20 mL/L Glycerin, bakteriologische Agar 15 g/L, pH 7,0) mit 100 mg/L Rifampicin und 50 mg/L Kanamycin und inkubieren Sie bei 28 ° C für 48 h.
- Ernten Sie die Bakterienzellen, die auf der Oberfläche des Mediums mit Kunststoff-Tipps erscheinen zu, übertragen Sie sie auf ein Kunststoffrohr mit 10 mM MgCl2und aufzuwirbeln. Messen Sie die optische Dichte (OD) der Lösung bei 600 nm (OD600). Passen Sie die endgültige Zellkonzentration von Bakterienzellen, 108 Kolonie Bildung Einheiten (KBE) / mL, die normalerweise OD600 entspricht = 0,211.
2. Erreger Inokulation
- Schneiden Sie eine Zelle-Stecker mit einer 2-3-Woche-alten Anlage ohne Beschädigung der Anlage sorgfältig aus. Legen Sie die Zelle in eine leere Zelle Stecker Fach (2 x 2 Zellen sind ausreichend) um ein gutes Gleichgewicht (Abbildung 1B).
- Wählen Sie ein sichtlich gesunden Blatt zum Animpfen. In der Regel der dritten, vierten und fünften verlässt (#3, #4 und #5, jeweils in Abbildung 1C) von der Unterseite der Pflanze sind leicht zu handhaben. Gebrauch hinterlässt an der gleichen Stelle in einer Reihe von Experimenten für bessere Reproduzierbarkeit. Wasser den Boden hält die Pflanze vor der Impfung für langfristige Zeitraffer-Aufnahmen.
- Optional, bei Analyse Druck reagierende Promotoren wie pPR1, um sicherzustellen, dass die Pflanzen natürlich nicht gestresst sind, untersuchen Sie die Blätter unter eine Fluoreszenz Stereomikroskop vor der Erreger Inokulation, fehlender YFP Signal zu überprüfen. Ausschließen lässt zeigt YFP Signal aus dem Experiment.
- Einweg Latex Handschuhe vor Infiltration, direkten Kontakt mit dem Erreger zu vermeiden. Mit einer nadellosen Plastik Spritze 1 mL die abaxial Seite des Blattes mit der Bakteriensuspension sorgfältig infiltrieren (108 KBE/mL)11 (Abbildung 1D). Inokulation von einem kleinen Teil auf die Hälfte des Blattes ermöglicht eine gute Visualisierung der pPR1 Tätigkeit; infiltriert wird als dunkler Grün in der Farbe im Vergleich mit dem restlichen Blatt sichtbar. Achten Sie sehr darauf, kein mechanischer Schaden das Blatt während Infiltration.
Hinweis: Sicherstellen, dass der interzellulären Räumen im Bereich infiltrierten komplett (vertikal) erfüllt mit dem Erreger Fahrwerk; Andernfalls wird die PCD-Domäne unter Fluoreszenz Stereomikroskop visualisieren schwierig. Dies kann einfach durch Abschluss der dunklen Begrünung im Bereich infiltrierten bestätigt werden. - Nehmen Sie den Überschuss der Bakteriensuspension aus der Umgebung des infiltrierten Abschnitts des infiltrierten Blattes mit einem weichen Papiertuch auf.
3. Montage der beimpften Blattes
- Sofort nach der Inokulation befestigen Sie einen Objektträger auf der Plastikschale chirurgische Band (Table of Materials) zu verwenden, so dass das eingedrungene Blatt in der Mitte der Folie Glas befindet. Sicherstellen Sie, dass die beimpften Blattspreite komplett innerhalb der Objektträger (Abb. 2A) ausgestattet ist.
- Bereiten Sie doppellagig Kunststoffband (im Falle von 0,2 mm dicken Band, siehe Tabelle of Materials) und schneiden Sie es in zwei Stücke (Abbildung 2B; Teile 1 und 2), um die Räume entlang der Blattstiel der infiltrierten Blatt passen. Ordnen Sie die Länge dieser beiden Stücke, gekennzeichnet mit einem Doppelpfeil in Abbildung 2B, in der Länge der Doppelpfeil dargestellt in Abbildung 2Apassen.
Hinweis: Eine Ecke von jedem der beiden Stücke ausschneiden verhindert Schäden an der Blattspreite (Abbildung 2B, Pfeilspitzen; siehe auch Schritt 3.4 unten). Jede Art von Kunststoffband mit ähnlichen Dicke eignet sich für die Herstellung einer Brücke über den Blattstiel. Die Steifigkeit des Kunststoffband ist wichtig für eine einfache Handhabung während des Verfahrens beschrieben. - Mit einer feinen Pinzette, kleben Sie Stücke Band 1 und 2 auf beiden Seiten der Blattstiel derart, dass die abgeschrägten Ecken jedes einzelnen Stückes mit der Basis der Blattspreite (Abbildung 2C) ausrichten. Stellen Sie sicher, dass die Band Stücke die Blattstiel oder Blatt Klinge nicht berühren.
Hinweis: Diese doppellagige Kunststoffband Stücke an der Basis der Blattspreite dienen als Abstandhalter und körperlichen Belastung auf den Blattstiel bei der Montage verhindern. - Bereiten Sie ein zusätzliches Stück doppellagig Kunststoffband (Abbildung 2B, 3 Stück), passen die Größe der Doppelpfeil in Abbildung 2B und kleben Sie es auf die Stücke der Band 1 und 2, um eine Brücke über den Blattstiel ( bilden Abbildung 2D, E). Seien Sie extrem vorsichtig nicht zu fangen die Stängel und Blatt Klinge direkt zwischen den Band-Stücken an den Positionen, die durch Pfeile in der Abbildung 2D, Egekennzeichnet.
- Halten Sie vorsichtig ein kleines Stück chirurgische Band (Abbildung 2F, 4 Stück) auf den Objektträger oberhalb der Spitze der Blattspreite damit die Blattspreite ganz leise auf dem Objektträger fixiert ist. Nur drücken Sie fest nach unten der Teil des chirurgischen Klebeband direkt berühren die Objektträger (Abbildung 2F, Bereich mit einer gestrichelten roten Linie umrissen), nicht der andere Teil über das Blatt.
- Vorsichtig bleiben ein weiteres kleines Stück chirurgische Band (Abbildung 2G, 5 Stück) an der Grenze zwischen dem Blattstiel und Kunststoffband Stücke (1, 2 und 3), so dass der Blattstiel Stücke sehr sanft auf den Objektträger und Kunststoffband fixiert ist. Fest legen nur den Teil des chirurgischen Klebeband direkt berühren den Objektträger auf die Objektträger und Kunststoffband Stücke (Abbildung 2G, Bereich mit einer gestrichelten roten Linie umrissen), nicht der andere Teil über den Blattstiel.
- Verhindern Sie, dass benachbarte Blätter Einzug in das Sichtfeld des Mikroskops mit 200 µL Pipettenspitzen (Abb. 2H). Legen Sie die Pipettenspitzen im Boden sanft die benachbarten Blätter weg von den eingedrungenen Blatt halten. Achten Sie darauf, dass Sie nicht setzen die Tipps zu tief im Boden möglich Wurzelschäden zu vermeiden.
Hinweis: Die vorbereitete Anlage ist nun bereit für die Fluoreszenz Stereomikroskop Bildgebung.
(4) mikroskopische Zeitraffer Beobachtung
- Schalten Sie die Fluoreszenz Stereomikroskop.
Hinweis: Hier eine automatisierte Stereomikroskop, ausgestattet mit einem hochsensiblen 1,4 Megapixel Monochrom verwendeten Digitalkamera im 12-Bit-Modus (Table of Materials). Das Mikroskop sollte in einem dunklen Raum mit einer Klimaanlage versehen oder in einem dunklen Schrank mit ausreichender Belüftung in Zeitraffer Bildgebung weiterhin die Raumtemperatur bei 23 ° C liegen. - Stellen Sie die Pflanze in den Raum oben unter das Objektiv von Stereomikroskop für die Bildgebung.
- Richten Sie die Parameter für Zeitraffer-Aufnahmen (siehe Beispiele in Tabelle 1). Stellen Sie sicher, Programmschritte für Belichtung im Bezugszeitraum von Zeitraffer-imaging, da Licht einen großen Einfluss auf Pflanzen Immunität12 hatIntervall.
- Verwenden Sie den konventionellen YFP Filter (Erregung 500-520 nm, Emission 540-580 nm), das YFP Signal zu visualisieren.
- Verwenden Sie den Texas Red (TXR) Filter (Erregung 540-580 nm, Emission 610 nm langen Pass) Chlorophyll Autofluoreszenz sichtbar zu machen, so dass die PCD-Domäne als einen dunklen Bereich (keine Autofluoreszenz) umgeben von YFP-positiven Zellen Schichten9 (Abbildung 3 sichtbar ist ( A).
- Verwenden Sie das konventionelle Epi-Hellfeld-Setup für zusätzliche Belichtung Schritte.
Hinweis: Vor dem Experiment messen Sie die Kraft des Epi-helle Lichtquelle und auf der Ebene der eigenen Anlagenzustandes Wachstum einstellen.
- Führen Sie die Time-Lapse Bildbearbeitungsprogramm. Langzeit-Beobachtung über mehrere Tage betrachten Sie in der Bewässerung der Pflanzenschutzmittels entsprechend, zum Beispiel während der Belichtung Schritte.
- Lassen Sie nach der Bildaufnahme Weg, zusätzliche Kanäle für Belichtung in den Intervallen (entsprechend 3 bis 8 Kanäle in Tabelle 1) aus dem Datensatz verwendet. Analysieren von Daten mit unterschiedlichen Methoden, wie z. B. Region of Interest (ROI) Analyse, mit verschiedenen Bildanalyse-Software wie Fidschi-9.
Ergebnisse
Hier verwendeten wir Pst_a2-induzierte ETI als Beispiel für Zeitraffer-Aufnahmen. Zeitraffer-Daten wurden erhalten, als eine Serie von Bildern, die die einige davon in Abbildung 3Bgezeigt werden, sowie einen Zeitrafferfilm (Supplemental Film 1)9. In erfolgreichen Experimenten mit pPR1-YFP-NLS bei Pst_a2-induzierte ETI, vorübergehende Aktivierung des pPR1 wurde beobachtet, so offensichtlich von YFP mit dem Ausdruck ihrer Herde, in mehreren Schichten von Zellen, die rund um die PCD-Domäne (Abb. 3B) 9. die Aktivierung des pPR1 in den Zellen rund um die PCD-Domain in der Regel beginnt bei ca. 5 Stunden Post Inokulation (Hpi), Peaks bei ca. 12 Hpi und dauert bis zu 40 Hpi (Abbildung 3B)9. Da Bilder mit einem Epi-Leuchtstoff-System erworben wurden, wurden die YFP Signale erhalten Sie hier von mehreren adaxial Zellschichten, einschließlich der epidermalen sowie obere Mesophyll Zellen erzeugt.

Abbildung 1 : Methode zur Infiltration der bakteriellen Erreger in der Arabidopsis thaliana Blatt. (A) zwei bis drei Wochen alten Arabidopsis -Pflanzen wurden in einer Zelle Stecker Schale angebaut. (B) ein-Zellen stecken, enthält die ausgewählte Pflanze für Impfung und Beobachtung zu verwendende wurde ausgeschnitten und gelegt in die leere Zelle Stecker-Ablage, Balance zu halten. (C) Der dritten, vierten und fünften verlässt (#3, #4 und #5, beziehungsweise) eignen sich für die Bildanalyse. (D) Infiltration der Erreger Suspension in einem ausgewählten Blatt mit einer nadellosen Spritze. Infiltrierte Bereich erkennt man anhand seiner dunkler grün als die übrigen Blatt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Methode für die Montage der infiltrierten verwendet Arabidopsis Blatt für Zeitraffer Imaging. (A) Foto von Arabidopsis -Anlage mit einem Objektträger fixiert unter den beimpften Blatt. Die infiltrierte Blatt war in der Mitte der Folie Glas positioniert. Der Doppelpfeil zeigt die Länge der Abstandshalter Kunststoffband. (B) Vorbereitung von Kunststoffband Abstandhalter und Brücke. Doppel - geschichteten Kunststoff Bürokratie war in zwei Stücken (1 und 2) für die Abstandhalter und ein weiteres Stück (3, mit einer gestrichelten roten Linie skizziert) wurde geschnitten, um eine Brücke zu bereiten. Die Längen der Doppelpfeile sind nahezu identisch mit der Länge der Doppelpfeil in (A). Einer der vier Ecken der Teile 1 und 2, mit Pfeilen angegeben wurden geschnitten. (C) zwei Stücke von doppellagig Kunststoffband (nummeriert von 1 und 2) wurden sorgfältig auf die Folie Glas entlang der Blattstiel mit einer feinen Pinzette, ohne direkten Kontakt mit dem Stängel und Blatt Blatt aufgeklebt. (D) ein zusätzliches Stück doppellagig Kunststoffband (Nummer 3), die von (B) vorbereitet wurde, wurde auf beiden basalen Abstandshalter (1 und 2) eine Brücke über den Blattstiel bilden gelegt, dabei nicht um den Blattstiel zwischen Bänder 1 und 2 an zu fangen Positionen mit Pfeilen angegeben. (E) Foto zeigt die aufgezeichneten Blattstiel. Es ist wichtig nicht zu fangen Pflanzengewebe direkt zwischen den Kunststoffband Stücken an Positionen mit Pfeilen angegeben. (F) A kleines Stück chirurgische Band (Nummer 4) wurde sanft auf der Glas-Folie um die Spitze der Blattspreite eingefügt. Nur der Bereich durch die gestrichelte rote Linie umrissen wurde auf den Objektträger fest gedrückt. (G) ein weiteres kleines Stück chirurgisches Klebeband (Nummer 5) wurde an der Grenze der Blattstiel und Kunststoffband Teile sanft eingefügt. Nur der Bereich durch die gestrichelte rote Linie umrissen wurde gedrückt, für die Festsetzung der Blattstiel sanft auf die Folie Glas und Kunststoff Band Stücke. (H) zwei Einweg-Pipettenspitzen wurden verwendet, um zu verhindern, dass benachbarte Blätter Einzug in das Sichtfeld des Stereomikroskops. Die Pipettenspitzen wurden direkt in den Boden an den entsprechenden Positionen eingefügt. Bitte klicken Sie hier für eine größere Version dieser Figur.
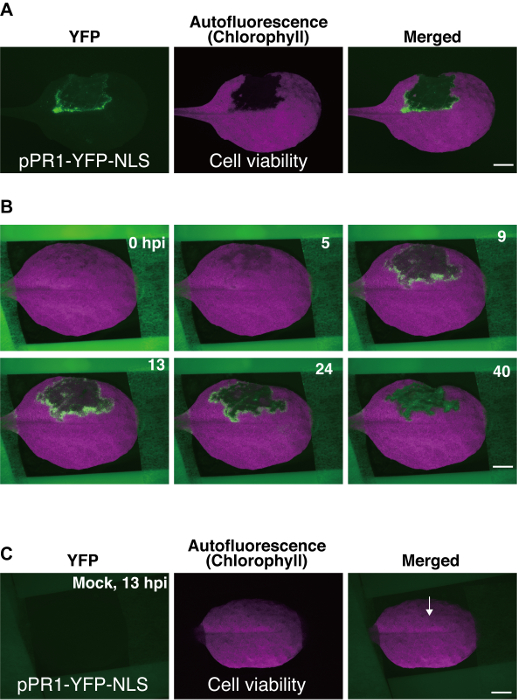
Abbildung 3 : Vertreter ergibt sich mit der Arabidopsis Montage-Methode Blatt. (A) fluoreszierende stereomicroscopic Bilder eines transgenen Arabidopsis -Blattes (pPR1-YFP-NLS-Anlage). Ein Teil des Blattes war mit Pst_a2 infiltriert (108 KBE/mL) auf seiner abaxial Oberfläche und die Bilder wurden aufgenommen bei 22 Stunden Post Inokulation (Hpi). Kerne, in denen der Veranstalter pPR1 aktiviert wurde, gefunden mit dem YFP Filter und programmierten Zelltod (PCD) erkannt wurde, basierend auf den Verlust von Chlorophyll Autofluoreszenz mit dem Texas Red (TXR) Filter. Maßstabsleiste = 2,5 mm. (B) ein paar Zeitraffer Bilder ausgewählt aus einer Sammlung von 800 Bildern, die mit dem beschriebenen Protokoll hier. Diese Daten liefern eine in-Vivo -Übersicht über die räumlich-zeitliche Dynamik der pPR1 Aktivität für 40 Hpi. Zusammengeführte Bilder YFP und TXR Bilder angezeigt werden. Maßstabsleiste = 2,5 mm. (C) Mock Infiltration eines transgenen Blattes (pPR1-YFP-NLS-Anlage). Mock Infiltration wurde 10 mM MgCl2 in der abaxial Seite des Blattes, gefolgt von Time-Lapse Bildgebung infiltriert. Mock Behandlung nicht die Ursache für ektopische pPR1 Aktivität und Chlorophyll Autofluoreszenz bei 13 Hpi nicht stören. Ein Pfeil zeigt die Position der mock Infiltration. Maßstabsleiste = 2,5 mm. Diese Bilder wurden aus einer früheren Studie9geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
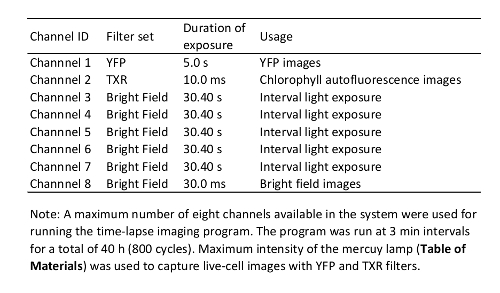
Tabelle 1: Time-Lapse Bildbearbeitungsprogramm in dieser Studie verwendeten.
Ergänzende Film 1: Zeitraffer-Film zeigt die räumlich-zeitliche Dynamik der pPR1 Aktivierung in einem transgenen Arabidopsis Blatt, die folgenden Effektor ausgelöst Immunität (ETI) verursacht Pst_a2 Impfung. Ein Teil der abaxial Seite eines transgenen Blattes trägt das pPR1-YFP-NLS -Konstrukt war mit Pst_a2 infiltriert (108 KBE/mL). Bilder wurden in 3 min Abständen für eine Gesamtmenge von 40 h erworben. Der Zeitstempel angezeigt wird im Format dd:hh:mm:ss.sss. Dieser Film wurde von einer früheren Studie9geändert. Bitte klicken Sie hier, um dieses Video anzusehen. (Rechtsklick zum download)
Diskussion
Hier berichten wir über eine einfache Methode, eine lebendige Arabidopsis -Blatt mit dem Ausdruck einer fluoreszierenden Reporter-gen unter der Kontrolle eines Promotors des Interesses für Langzeit-Beobachtung mit einem automatisierten Fluoreszenz Stereomikroskop zu montieren. Time-Lapse Bildgebung eines fluoreszierenden Reporter wurde häufig in Wurzel Gewebe durchgeführt; in Blatt Geweben wurden jedoch nur wenige ähnliche Studien durchgeführt. Dies ist sehr wahrscheinlich, weil die Blätter in der Lage sind, frei im Raum bewegen, während Wurzeln sind oft vergraben und in festen Agar Medium fixiert.
In diesem Bericht konzentrierten wir uns auf die räumlich-zeitliche Dynamik der pPR1 Aktivität während ETI induziert durch Pst_a2. Neben der sanfte Fixierung des oben beschriebenen Blattes ist es wichtig, die räumlich-zeitliche Dynamik der zelluläre Ereignisse wie Veranstalter Aktivierung und PCD deutlich sichtbar zu machen. Die Unterscheidung zwischen Zellen zeigen pPR1 Aktivität und PCD nicht scharf ist, stellen sicher, dass alle den interzellulären Räumen im Bereich infiltriert die Erreger Aussetzung voll sind (siehe Punkt 2.4). Dies ist wichtig, wenn Sie Weitfeld-Fluoreszenz Stereomikroskope verwenden, da diese Mikroskope alle erkennbaren Signale entlang der gleichen vertikalen Position der Probe zu erfassen. Chlorophyll Autofluoreszenz von Überlebenden Zellen oberhalb oder unterhalb der Zellen im Bereich PKD Masken einfach die abgestorbenen Zellen ohne Autofluoreszenz ausstellen. Dies gilt auch für YFP Signal.
Bedingungen für Zeitraffer-Aufnahmen müssen sorgfältig durch mehrere Vorversuchen unter verschiedenen experimentellen Bedingungen geschaffen werden. Parameter für Zeitraffer-Aufnahmen hängen von mehreren Faktoren wie mikroskopische System, transgene Pflanzen und pathogenen. Um diese Parameter zu erhalten, haben wir zunächst verschiedenen Belichtungszeiten für YFP Signalintensität im infiltrierten Blatt 7 HPI, die fast mit der Erstaktivierung pPR1zusammenfällt analysiert. Eine 5 s Belichtung wurde als geeignet für die Aufnahme von YFP Signal mit dem Stereomikroskop in dieser Studie verwendeten bestimmt. Ein ähnlicher Test wurde durchgeführt, für Chlorophyll Autofluoreszenz-Bildgebung. Belichtung der Probe zwischen 3 min Abständen wurde in Zeitraffer Bildbearbeitungsprogramm als normalen Hellfeld Bildgebung mit maximale Belichtungszeit programmiert. Unser System (Table of Materials) konnten wir 2,5 min neben YFP, TXR und Hellfeld Bildgebung haben. Diese Einschränkung war der Hauptgrund für die Wahl einer 3-Minuten-Intervalls. Als nächstes haben wir bestätigt, dass dieses Zeitraffer Bedingung keine offensichtlichen an der Pflanzenproben Schäden und nicht dazu, ektopische leichten stressbedingten Aktivierung des pPR1 (Abbildung 3B, C veranlassen). Dies führte zu der Entwicklung des Programms in dieser Studie verwendet. So 3 min Abständen der Fluoreszenz-Bildgebung wurden als ausreichend für die Erfassung von pPR1 Dynamik bei Pst_a2-ETI9vermittelt.
Veranstalter-Reporter Konstrukte wurden genutzt, vor allem mit dem fluoreszierenden Reporter verschmolzen, die NLS von vielen Gruppen und sind leicht zugänglich von der Forschungsgemeinschaft; Wir nutzten das Konstrukt von Kubo Et Al. veröffentlicht 13. das hier beschriebene Protokoll kann so in jeder Pflanze Biologie Studie untersucht Blatt Gewebe verwendet werden, wenn entsprechende transgene Pflanzen zur Verfügung stehen. Unsere einfach und leicht Protokoll sieht vor, dass eine große Chance für Forscher, die gerne die raumzeitliche Dynamik eines biologischen Ereignisses im analysieren lässt, z. B. Immunantwort. Es ist plausibel, dass unsere Methode mit Hilfe von Klebeband Stücken eine leichte körperliche Belastung an den Proben induziert. Dieses Problem kann auch entsprechende positive und negative Kontrollen, wie mock Behandlungen in den Experimenten (Abb. 3C) gesteuert werden. Die experimentellen Bedingungen können weiter modifiziert und optimiert, indem diese Steuerelemente unter verschiedenen Bedingungen zu analysieren.
In den letzten Jahren hat die rasante Entwicklung der bildgebenden Instrumente und Techniken das Interesse der Forscher in die komplexe räumlich-zeitliche Aspekte der biologischen Ereignisse angeregt. Bei der bildgebenden Analyse sind geeignete Montage und Befestigung der Proben zu den wichtigsten Themen. Die einfache und vielseitige Methode der Montage Leben verlässt Arabidopsis entwickelt in dieser Studie kann angewendet und optimiert für verschiedene bildgebende Experimente.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde unterstützt durch die Japan Science and Technology Agency [PRESTO117665, S.B., ERATOJPMJER1502, N.N.] und von der Japan Society for Promotion of Science (Grants-in-Aid für die Forschung Tätigkeit Inbetriebnahme [22880008, S.B.] und für junge Wissenschaftler (B)] 23780040, S.B.]). Wir danken A. Senzaki, Y. Suzuki, Y. Sugisawa und E. Betsuyaku für hervorragende technische Unterstützung, J. Parker für die Bereitstellung der Pst_a2 Sorte und T. Demura für die Bereitstellung des pBGYN-Vektors.
Materialien
| Name | Company | Catalog Number | Comments |
| Bacto Agar | BD biosciences | 214010 | |
| Bacto Protease Peptone No. 3 | BD biosciences | 211693 | |
| Bacto Yeast Extract | BD biosciences | 212750 | |
| BM2 soil | Berger | ||
| Glycerol | nacalai tesque | 17017-35 | |
| Kanamycin sulfate | Wako | 113-00343 | |
| Leica M205FA with DFC365FX, LED_MCI and Leica EL6000 (Las X software-regulated) | Leica Microsystems | Yellow fluorescent protein (YFP) and Texas Red (TXR) filters installed | |
| Magnesium Chloride Hexahydrate | Wako | 135-00165 | |
| Micro Slide Glass (Size: 76 mm × 26 mm, Thickness: 1.0–1.2 mm) | MATSUNAMI | S1112 | |
| Micropore Surgical Tape (1.25 cm × 9 m) | 3M | 1530-0 | |
| Needleless 1 ml plastic syringe | Terumo | SS-01T | |
| Plastic cell plug tray (cell size: 44 mm × 44mm × 44 mm) | Tanaka sangyo, Japan | htray-bk72 | Any tray with similar sized cells can be used |
| Rifampicin | nacalai tesque | 30259-81 | |
| Plastic Tape (0.2 mm thick × 19 mm wide × 10 m long) | Yamato | No0200-19-1 | Any plastic/vinyl tape with similar thickness can be used |
Referenzen
- Tsuda, K., Somssich, I. E. Transcriptional networks in plant immunity. New Phytologist. 206 (3), 932-947 (2015).
- Mine, A., Sato, M., Tsuda, K. Toward a systems understanding of plant-microbe interactions. Frontiers in Plant Science. 5, (2014).
- Murray, S. L., Thomson, C., Chini, A., Read, N. D., Loake, G. J. Characterization of a novel, defense-related Arabidopsis mutant, cir1, isolated by luciferase imaging. Molecular Plant-Microbe Interactions. 15 (6), 557-566 (2002).
- Spoel, S. H., Johnson, J. S., Dong, X. Regulation of tradeoffs between plant defenses against pathogens with different lifestyles. Proceedings of the National Academy of Sciences of the United States of America. 104 (47), 18842-18847 (2007).
- Asai, S., Shirasu, K. Plant cells under siege: plant immune system versus pathogen effectors. Current Opinion in Plant Biology. 28, 1-8 (2015).
- Schmelzer, E., Kruger-Lebus, S., Hahlbrock, K. Temporal and Spatial Patterns of Gene Expression around Sites of Attempted Fungal Infection in Parsley Leaves. The Plant Cell. 1 (10), 993-1001 (1989).
- Ohshima, M., Itoh, H., Matsuoka, M., Murakami, T., Ohashi, Y. Analysis of stress-induced or salicylic acid-induced expression of the pathogenesis-related 1a protein gene in transgenic tobacco. The Plant Cell. 2 (2), 95-106 (1990).
- Rushton, P. J., Reinstädler, A., Lipka, V., Lippok, B., Somssich, I. E. Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen- and wound-induced signaling. The Plant Cell. 14 (4), 749-762 (2002).
- Betsuyaku, S., et al. Salicylic Acid and Jasmonic Acid Pathways are Activated in Spatially Different Domains Around the Infection Site During Effector-Triggered Immunity in Arabidopsis thaliana. Plant & Cell Physiology. 59 (1), 8-16 (2018).
- Dodds, P. N., Rathjen, J. P. Plant immunity: towards an integrated view of plant-pathogen interactions. Nature Reviews Genetics. 11 (8), 539-548 (2010).
- Katagiri, F., Thilmony, R. The Arabidopsis thaliana-Pseudomonas syringae interaction. Arabidopsis Book. , (2002).
- Zeier, J., Pink, B., Mueller, M. J., Berger, S. Light conditions influence specific defence responses in incompatible plant-pathogen interactions: uncoupling systemic resistance from salicylic acid and PR-1 accumulation. Planta. 219 (4), 673-683 (2004).
- Kubo, M., et al. Transcription switches for protoxylem and metaxylem vessel formation. Genes & Development. 19 (16), 1855-1860 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten