Method Article
一种用于阴南芥叶片安装的通用方法
摘要
我们报告了一种简单和通用的方法, 用于在较长时间内对拟南芥叶片进行荧光实时成像。我们使用转基因拟南芥植物表达荧光记者基因在免疫相关的启动子控制下作为一个例子, 以获得时空了解植物免疫反应。
摘要
与全基因组转录重新编程相关的植物免疫反应是在感染部位启动的。因此, 免疫反应在空间和时间上受到调节。在免疫相关启动子的控制下, 结合自动荧光显微镜使用荧光基因是了解植物免疫时空调控的一种简单方法。与用于各种玻璃体内荧光成像实验的根组织相比, 对于遇到一系列空气中微生物感染的叶片组织, 很少有荧光活体成像的例子。因此, 我们开发了一种简单的方法来安装拟南芥植物的叶子, 以便在较长的时间内进行活细胞成像。我们使用转基因拟南芥植物表达黄色荧光蛋白(yfp) 基因在核定位信号 (nls) 的控制下, 防御相关标记基因的启动子, 病理原学相关 1 (pr1)。我们用假单胞菌浸润了转基因叶片。番茄酱dc3000 (avrrpt2) 菌株 (Pst_a2), 并使用自动荧光立体显微镜对 yfp 信号进行了共40小时的体内延时成像。该方法不仅可用于植物免疫反应的研究, 还可用于分析叶片组织中发生的各种发育事件和环境反应。
引言
植物免疫反应涉及由多种转录因子以及植物激素1调节的动态转录再编程。转录组数据的积累为收集植物免疫系统的信息提供了机会: 例如, 信号级联2的网络结构.然而, 我们对植物免疫的时空活力的了解仍然有限, 仍然是3,4,5。
在以往的研究中, 主要采用原位杂交和β-葡萄糖尿素酶 (gus) 报告法 6、7、8对防御相关基因表达的时空调控进行了分析。这些方法使我们能够想象各种感兴趣的基因在原位的转录激活。然而, 这些程序需要对标本进行化学固定, 从而导致所有时间信息的丢失。生物事件, 如免疫, 随着时间的推移而进步。利用荧光素酶作为记者, 可以捕捉感兴趣的启动子的时间动力学 3.然而, 基于荧光素体的检测需要昂贵的基板和高度敏感的检测器。为了提高我们对植物免疫反应的时空方面的了解, 我们用一个简单的程序, 我们产生了转基因拟南芥植物表达黄色荧光蛋白(yfp) 基因融合到核定位信号 (yfp-nls) 控制下的防御相关标记基因的启动子,病理相关 1 (pr1)9。我们使用叶绿素自体荧光, 活细胞的标记, 捕捉程序性细胞死亡 (pcd) 的过程, 这往往发生在效应-触发免疫 (eti), 一种植物免疫的形式诱导特定的病原体感染9,10. 监测自由移动物体 (如活拟南芥叶) 中荧光信号强度的时间动态, 需要在内部或商业上提供复杂的图像处理软件。或者, 防止样品移动是解决问题的简单方法。在这里, 我们开发了一种多功能和简单的方法来安装转基因拟南芥植物的活叶, 以便在自动荧光立体显微镜下进行长期观察。该方法允许我们在几天内捕获土壤生长的完整植物叶子中的启动子动力学。
研究方案
注: 在延时成像过程中, 防止活叶样本的睡眠运动是很重要的。为了最大限度地减少对树叶的机械应力, 必须对叶子进行温和的固定。只有充分准备的叶片样品才能产生适合各种图像分析的延时图像。一种利用转基因拟南芥植物在pr1基因启动子 (ppr1-yfp-nls 植物) 和注射假单胞菌的控制下表达 yfp-nls融合的方案。番茄酱dc3000 (avrpt2) 应变 (Pst_a2) 是下面的一个例子。
1. 植物和病原体的制备
- 用蒸压土填充塑料电池塞盘 (材料表)。
- 每个细胞播种一个转基因拟南芥种子 (图 1a)。
- 将托盘转移到保持在23°c 的生长室, 并在连续白光下种植2-3周。
- 在病原体接种前两天, 条纹注射器假单胞菌。番茄酱从甘油库存到纽约介质 (5gl 肽) 的 dc3000 avrpt2菌株 (Pst_a2), 3 gl 酵母提取物, 20 mll 甘油, 15 gml 细菌学, ph 7.0), 含有 100 mg/l 利福平和 50 mg l 卡霉素, 在28°c 孵育48小时。
- 用塑料尖端收集出现在培养基表面的细菌细胞, 将其转移到含有 10 mm mgcl2的塑料管中, 然后重新悬浮。以600纳米 (od 600) 的速度测量溶液的光学密度 (od)。将细菌细胞的最终细胞浓度调整为 10个 8个菌落形成单元 (cfu)/ml, 通常相当于 od600 = 0.2 11.
2. 病原体接种
- 小心地剪下一个细胞插头, 里面有一个2-3周的工厂, 而不会损坏植物。将电池设置在空单元插入式托盘中 (2 x 2 单元就足够了), 以保持良好的平衡 (图 1b)。
- 选择一个明显健康的叶子进行接种。一般来说, 从植物底部的第三、第四和第五叶 (#3、#4 和 #5, 分别如图 1c) 很容易处理。在一组实验中使用同一位置的叶子, 以获得更好的重现性。在接种前给抱着植物的土壤浇水, 以便进行长期延时成像。
- 或者, 在分析抗压反应促进剂 (如 ppr1)的情况下, 为了确保植物不会自然受到压力, 在病原体接种之前检查荧光立体显微镜下的叶子, 以验证是否没有 yfp 信号。排除实验中显示 yfp 信号的叶子。
- 在渗透前戴上一次性乳胶手套, 避免与病原体直接接触。使用1毫升无针塑料注射器, 用细菌悬浮液 (108 cfuml) 11 (图 1d)仔细浸润叶片的背面。在一半的叶子上接种一小部分, 可以很好地显示ppr1的活性;与剩余的叶子相比, 浸润的区域在颜色上变得更深的绿色。在渗透过程中, 要非常小心, 不要对叶子造成任何机械损坏。
注: 确保浸润区域中的所有细胞间空间完全 (垂直) 与病原体悬浮液一起完成;否则, pcd 域将很难在荧光立体显微镜下可视化。这可以简单地通过在浸润区域完成黑暗绿化来证实。 - 用软纸巾从浸润叶片浸润段周围吸收多余的细菌悬浮液。
3. 安装接种的叶子
- 接种后, 立即使用手术胶带 (材料表) 将玻璃滑块固定在塑料托盘上, 使浸润的叶子位于玻璃滑块的中心。确保接种的叶片完全安装在玻璃滑块内 (图 2a)。
- 准备双层塑料胶带 (在0.2 毫米厚的胶带的情况下, 见材料表), 并将其切割成两片 (图 2b; 片1和 2), 以适应沿浸润叶片的叶柄的空间。排列这两个部分的长度,用图 2b中的双向箭头表示, 以适应图 2a 所示的双向箭头的长度。
注: 从两个部分中的每一个角落剪掉一个角落有助于避免对叶片造成损坏 (图 2b, 箭头; 另见下面的步骤 3.4)。任何一种厚度相似的塑料胶带都适合在叶柄上做一座桥。在下面描述的过程中, 塑料胶带的刚度对于易于操作非常重要。 - 使用一对精细的推子, 将胶带件1和2粘在叶柄的两侧, 使每一块的切角与叶片的底部对齐 (图 2c)。确保胶带片不接触叶柄或叶片。
注: 这些双层塑料胶带件在叶片的底部作为间隔, 并防止物理应力在叶柄在安装过程中。 - 准备另一块双层塑料胶带 (图 2b, 一块 3), 以适应图2 b 中双向箭头的大小, 并将其贴在胶带件1和2的顶部, 形成一个桥在叶柄(图 2d, e)。要非常小心, 不要直接抓住叶柄和叶片之间的磁带件在图2d, e中箭头指示的位置。
- 轻轻地将一小块手术胶带 (图 2f, 一块 4) 贴在叶片尖端上方的玻璃滑梯上, 使叶片非常柔软地固定在玻璃滑梯上。只需牢固地按下直接接触玻璃滑梯的手术胶带部分 (图 2f, 用虚线勾画的区域), 而不是覆盖叶子的另一部分。
- 轻轻地将另一小块手术胶带 (图 2g, 一块 5) 贴在叶柄和塑料胶带片 (1, 2 和 3) 的边界上, 使叶柄非常柔和地固定在玻璃滑梯和塑料胶带片上。仅牢固地将直接接触玻璃滑块的部分连接到玻璃滑梯和塑料胶带件上 (图 2g, 用虚线概述的区域), 而不是在叶柄上的另一部分。
- 防止相邻的叶子使用200μl 移液器吸头进入显微镜的视场 (图 2h)。将移液器吸头插入土壤中, 轻轻地将相邻的叶子从浸润的叶子上固定起来。注意不要在土壤中插入过深的尖端, 以免根部受损。
注: 制备的植物现在已准备好进行荧光立体显微镜成像。
4. 微观延时观测
- 打开荧光立体显微镜。
注: 在这里, 使用的是配备了高度敏感的140万像素单色单色数码相机在12位模式下的自动立体显微镜 (材料表)。显微镜应放置在装有空调装置的黑暗房间或通风良好的黑暗柜子中, 以便在延时成像期间将室温保持在23°c。 - 将植物放置在上面空间的立体显微镜的物镜下进行成像。
- 设置延时成像的参数 (请参见表1中的示例)。确保在延时成像的间隔期间对光线照射步骤进行编程, 因为光线对植物免疫有重大影响.
- 使用传统的 yfp 滤波器 (励磁500-520 纳米; 发射 500-520 nm) 可视化 yfp 信号。
- 使用 texas red (txr) 滤光片 (激发 540-580 nm; 发射 610 nm 长通) 可视化叶绿素自体荧光, 以便 pcd 域可以看到作为一个黑暗区域 (无自荧光), 周围有 yfp 阳性细胞层 9 (图 3)a)。
- 使用传统的自我明亮的现场设置来执行额外的光曝光步骤。
注: 实验前, 测量信亮光源的功率, 并将其调整到自己的植物生长条件水平。
- 运行延时成像程序。对于几天的长期观察, 考虑对植物进行适当的浇水, 例如, 在光暴露步骤中。
- 在图像采集后, 在数据集中的时间间隔 (对应于表1中的通道 3-8) 中省略用于光线照射的额外通道。使用不同的图像分析软件 (如斐济 9), 使用各种方法 (如感兴趣区域(roi) 分析) 分析数据。
结果
在这里, 我们使用Pst_a2诱导的 eti 作为延时成像的示例。延时数据是作为一系列图像获得的, 其中一些图像如图 3b所示, 以及作为延时电影 (补充电影 1)9。在Pst_a2诱导的 eti 中使用 ppr1-yfp-nls 的成功实验中, 在 pPR1 域周围的几层细胞中观察到了ppr1的瞬态激活, 从 yfp 表达焦点中可以看出这一点 (图 3b)9. ppr1 在 pPR1 域周围细胞中的激活通常在接种后约5小时开始 (hpi), 高峰约为 12 hpi, 持续长达 40 hpi (图 3b)9。由于图像是使用表皮荧光系统获得的, 因此这里获得的 yfp 信号来自几个轴向细胞层, 包括表皮和上叶肉细胞。

图 1: 用于细菌病原体浸润到拟南芥 叶.(a) 在细胞塞盘中种植了两周至三周的拟南芥植物。(b) 将含有用于接种和观察的选定植物的一个单元插头切掉, 放入空的电池塞盘中, 以保持平衡。(c)第三、第四和第五叶 (分别为 #3、#4 和 #5) 适用于图像分析。(d) 使用无针注射器将病原体悬浮液浸入选定的叶片中。渗透区域可以根据其比剩余的叶子深绿色来识别。请点击这里查看此图的较大版本.

图 2: 用于安装浸润的方法拟南芥叶延时成像.(a)拟南芥植物的照片, 在接种的叶子下固定有玻璃滑梯。渗透的叶子被放置在玻璃滑梯的中心。双向箭头指示塑料胶带垫片的长度。(b) 塑料胶带垫片和桥梁的准备。为间隔机切割双层塑料胶带, 将其切割成两片 (1 和 2), 并将另一块 (3, 用虚线勾勒出) 切割成两块, 以准备一座桥梁。双头箭头的长度与 (a) 中双头箭头的长度几乎相同。用箭头表示的1和2块的四个角中的一个被剪掉了。(c) 用一对细的推子将两片双层塑料胶带 (编号为1和 2) 小心地粘贴到滑玻璃上, 而不与叶柄和叶片直接接触。(d) 在两个基部间隔 (1 和 2) 上放置另一块双层塑料胶带 (编号为 3), 在叶柄上形成一座桥梁, 同时确保不在1和2之间捕获叶柄胶带1和 2, 在用箭头表示的位置。(e) 显示带胶带的叶柄的照片。重要的是不要直接在塑料胶带块之间捕捉植物组织, 位置用箭头表示。(f) 在叶片尖端周围的玻璃滑梯上轻轻粘贴一小块手术胶带 (编号为 4)。只有虚线所概述的区域被牢牢地压在玻璃滑梯上。(g) 另一小块手术胶带 (编号为 5) 轻轻粘贴在叶柄和塑料胶带的边界。只有虚线所概述的区域被按下, 以便轻轻地将叶柄固定在滑动玻璃和塑料胶带上。(h) 使用了两个一次性移液器吸头, 以防止相邻的叶子进入立体显微镜的视野。移液器吸头被直接插入土壤在适当的位置。请点击这里查看此图的较大版本.
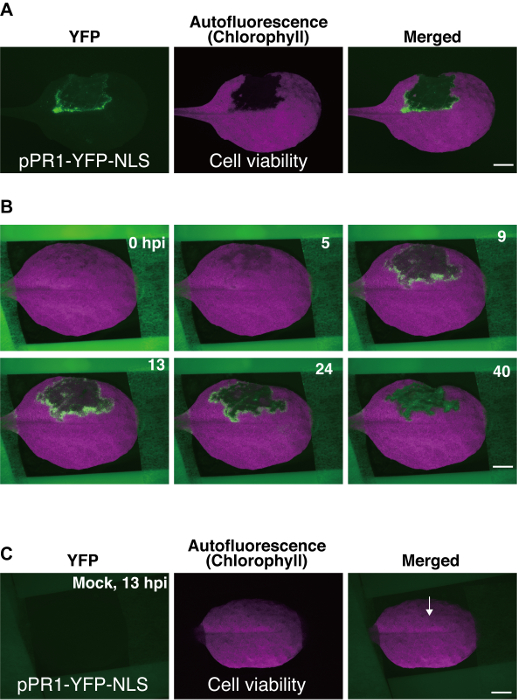
图 3: 具有代表性的结果使用拟南芥叶安装方法.(a) 转基因拟南芥叶 (ppr1-yfp-nls 植物) 的荧光立体显微图像。叶的一部分在其背面用Pst_a2 (108 cbuml) 浸润, 并在接种后 22小时 (hpi) 拍摄图像。利用 yfp 滤光片检测ppr1启动子的核, 并利用德州红 (txr) 滤光片, 根据叶绿素自体荧光的损失检测编程细胞死亡 (pPR1)。缩放条 = 2.5 mm (b) 从使用此处描述的协议获得的800张图像集合中选择的几个延时图像。这些数据为 40 hpi ppr1活性的时空动力学提供了体内概述。显示了 yfp 和 txr 图像的合并图像。鳞片棒 = 2.5 毫米 (c) 转基因叶片 (ppr1-yfp-nls 植物) 的模拟浸润。在模拟浸润中, 10 mm mgcl2浸润到叶片的背面, 然后进行延时成像。模拟处理不会引起异位ppr1活性, 也不会干扰 13 hpi 的叶绿素自体荧光。箭头指示模拟渗透的位置。刻度杆 = 2.5 毫米.这些图像是从以前的一项研究9中修改的。请点击这里查看此图的较大版本.
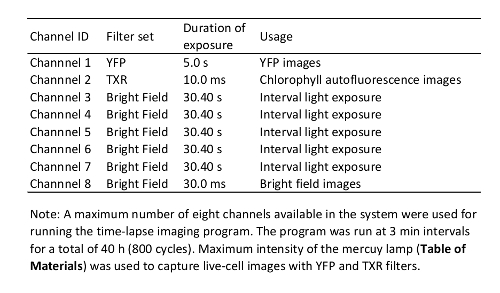
表 1:本研究中使用的延时成像程序.
补充电影 1: 延时电影, 显示时空动态ppr1在转基因中激活拟南芥作用-触发免疫 (eti) 诱导的Pst_a2接种.携带 ppr1-yfp-nls结构的转基因叶片背面的一部分与 Pst_a2 (108 chu/ml) 浸润。图像每隔3分钟获得, 总共40小时。显示的时间戳的格式为 d:h:h:m:mm. sss。这部电影是根据以前的研究修改的。请点击这里观看此视频。(右键单击下载.
讨论
在这里, 我们报告了一个简单的方法, 安装一个活的拟南芥叶, 表达荧光记者基因的控制下, 一个有兴趣的启动子长期观察使用自动荧光立体显微镜。荧光记者的延时成像经常在根部组织中进行;然而, 只有少数类似的研究已经在叶片组织中进行。这很可能是因为叶子能够在太空中自由移动, 而根部通常被埋在固体琼脂介质中并固定。
在本报告中, 我们重点研究了由 Pst_a2诱导的eti 期间 ppr1活性的时空动力学。除了上面详述的叶子的温和固定, 清楚地想象细胞事件的时空动力学, 如启动子激活和 pcd 是很重要的。如果显示 ppr1 活性的细胞与 pPR1 之间的区别不明显, 请确保浸润区域中的所有细胞间空间都完全充满了病原体悬浮液 (见步骤 2.4)。这在使用广域荧光立体显微镜时至关重要, 因为这些显微镜可捕获沿样品相同垂直位置的所有可检测信号。从 pcd 域中的细胞上方或下方存活的细胞产生叶绿素自体荧光, 很容易掩盖不存在自体荧光的死细胞。yfp 信号也是如此。
在不同的实验条件下, 需要通过几个初步实验来仔细确定延时成像的条件。延时成像的参数取决于几个因素, 如微观系统、转基因植物和病原体.为了得到这些参数, 我们首先分析了 7 hpi 浸润叶片中 yfp 信号强度的各种曝光时间, 这几乎与ppr1的初始激活相吻合。根据本研究中使用的立体显微镜, 确定了5的接触情况, 以捕获 yfp 信号。对叶绿素自体荧光的成像进行了类似的试验。将样品在3分钟间隔之间暴露在光线下的时间被编程为具有最大曝光时间的正常明亮场成像程序。我们的系统 (材料表) 使我们除了 yfp、txr 和明亮的现场成像外, 还有2.5 分钟的时间。此约束是选择3分钟间隔的主要原因。接下来, 我们确认这种延时条件不会对植物样品造成明显损害, 也没有诱导与异位光应力相关的ppr1激活 (图 3b, c)。这导致了本研究中使用的程序的发展。因此, 3分钟的荧光成像间隔被认为足以捕捉ppr1动力学在Pst_a2介导的eti 9。
宣传员的结构, 特别是与荧光记者融合到 nls, 已被许多群体所利用, 并容易从研究界获得;我们使用了库博等人出版的结构。13. 因此, 如果有适当的转基因植物, 这里所述的协议可用于检查叶片组织的任何植物生物学研究。我们简单易用的协议为热衷于分析树叶中发生的任何生物事件的时空动态的研究人员提供了一个很好的机会, 如免疫反应。我们使用磁带片的方法会在样品上产生轻微的物理应力, 这是有道理的。但是, 可以通过在实验中加入适当的正负控制 (如模拟处理) 来控制此问题 (图 3c)。通过对不同条件下的控制, 可以进一步修改和优化实验条件。
近年来, 成像仪器和技术的迅速发展激发了研究人员对生物事件复杂时空方面的兴趣。在任何成像分析中, 适当安装和固定样品都是最重要的问题。本研究开发的简单通用的拟南芥活叶安装方法可应用于各种成像实验并进行优化。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了日本科学技术署 [presto117665 至 s. b.、ERATOJPMJER1502 至 n. n.] 和日本科学促进协会 (研究活动启动赠款援助额 [22880008 至 s. b.] 和青年科学家协会 (b) 的支持 [23780040至 s. b.])。我们感谢 a. senzaki、y. suzuki、y. sugisawa 和 e. betsuyaku 提供了出色的技术援助, j. parker 提供了 Pst_a2 应变, t. demura 提供了 pbgyn 矢量。
材料
| Name | Company | Catalog Number | Comments |
| Bacto Agar | BD biosciences | 214010 | |
| Bacto Protease Peptone No. 3 | BD biosciences | 211693 | |
| Bacto Yeast Extract | BD biosciences | 212750 | |
| BM2 soil | Berger | ||
| Glycerol | nacalai tesque | 17017-35 | |
| Kanamycin sulfate | Wako | 113-00343 | |
| Leica M205FA with DFC365FX, LED_MCI and Leica EL6000 (Las X software-regulated) | Leica Microsystems | Yellow fluorescent protein (YFP) and Texas Red (TXR) filters installed | |
| Magnesium Chloride Hexahydrate | Wako | 135-00165 | |
| Micro Slide Glass (Size: 76 mm × 26 mm, Thickness: 1.0–1.2 mm) | MATSUNAMI | S1112 | |
| Micropore Surgical Tape (1.25 cm × 9 m) | 3M | 1530-0 | |
| Needleless 1 ml plastic syringe | Terumo | SS-01T | |
| Plastic cell plug tray (cell size: 44 mm × 44mm × 44 mm) | Tanaka sangyo, Japan | htray-bk72 | Any tray with similar sized cells can be used |
| Rifampicin | nacalai tesque | 30259-81 | |
| Plastic Tape (0.2 mm thick × 19 mm wide × 10 m long) | Yamato | No0200-19-1 | Any plastic/vinyl tape with similar thickness can be used |
参考文献
- Tsuda, K., Somssich, I. E. Transcriptional networks in plant immunity. New Phytologist. 206 (3), 932-947 (2015).
- Mine, A., Sato, M., Tsuda, K. Toward a systems understanding of plant-microbe interactions. Frontiers in Plant Science. 5, (2014).
- Murray, S. L., Thomson, C., Chini, A., Read, N. D., Loake, G. J. Characterization of a novel, defense-related Arabidopsis mutant, cir1, isolated by luciferase imaging. Molecular Plant-Microbe Interactions. 15 (6), 557-566 (2002).
- Spoel, S. H., Johnson, J. S., Dong, X. Regulation of tradeoffs between plant defenses against pathogens with different lifestyles. Proceedings of the National Academy of Sciences of the United States of America. 104 (47), 18842-18847 (2007).
- Asai, S., Shirasu, K. Plant cells under siege: plant immune system versus pathogen effectors. Current Opinion in Plant Biology. 28, 1-8 (2015).
- Schmelzer, E., Kruger-Lebus, S., Hahlbrock, K. Temporal and Spatial Patterns of Gene Expression around Sites of Attempted Fungal Infection in Parsley Leaves. The Plant Cell. 1 (10), 993-1001 (1989).
- Ohshima, M., Itoh, H., Matsuoka, M., Murakami, T., Ohashi, Y. Analysis of stress-induced or salicylic acid-induced expression of the pathogenesis-related 1a protein gene in transgenic tobacco. The Plant Cell. 2 (2), 95-106 (1990).
- Rushton, P. J., Reinstädler, A., Lipka, V., Lippok, B., Somssich, I. E. Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen- and wound-induced signaling. The Plant Cell. 14 (4), 749-762 (2002).
- Betsuyaku, S., et al. Salicylic Acid and Jasmonic Acid Pathways are Activated in Spatially Different Domains Around the Infection Site During Effector-Triggered Immunity in Arabidopsis thaliana. Plant & Cell Physiology. 59 (1), 8-16 (2018).
- Dodds, P. N., Rathjen, J. P. Plant immunity: towards an integrated view of plant-pathogen interactions. Nature Reviews Genetics. 11 (8), 539-548 (2010).
- Katagiri, F., Thilmony, R. The Arabidopsis thaliana-Pseudomonas syringae interaction. Arabidopsis Book. , (2002).
- Zeier, J., Pink, B., Mueller, M. J., Berger, S. Light conditions influence specific defence responses in incompatible plant-pathogen interactions: uncoupling systemic resistance from salicylic acid and PR-1 accumulation. Planta. 219 (4), 673-683 (2004).
- Kubo, M., et al. Transcription switches for protoxylem and metaxylem vessel formation. Genes & Development. 19 (16), 1855-1860 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。