A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل نظائرها حمض الأيوفينوكسيك في النمس الهندي الصغير (الهربساتوبوتوس)سيرا لاستخدامها كعلامة بيولوجية التطعيم داء الكلب عن طريق الفم
In This Article
Summary
قدمنا النمس الأسير لقاح داء الكلب عن طريق الفم الطعوم مع حمض الإيثيل أو ميثيل iophenoxic كعلامة حيوية والتحقق من تناول الطعم باستخدام الكروماتوغرافيا السائلة الجديدة مع قياس الطيف الكتلي جنبا إلى جنب (LC-MS /MS) طريقة.
Abstract
النمس الهندي الصغير (الهربسأوروبوتوس)هو خزان من فيروس داء الكلب (RABV) في بورتوريكو، ويضم أكثر من 70٪ من حالات داء الكلب الحيوانيالمبلغ عنها سنويا. وعادة ما يتم التحكم في دوران رابف في خزانات الحياة البرية من خلال استراتيجية للتطعيم عن طريق الفم ضد داء الكلب (ORV). ولا يوجد حاليا ً أي برنامج لـ ORV للحياة البرية في بورتوريكو. وقد أجريت بحوث في لقاحات داء الكلب الفموي وأنواع الطعم المختلفة للنمس بنتائج واعدة. يعتمد رصد نجاح ORV على تقدير تناول الطعم من قبل الأنواع المستهدفة، والذي ينطوي عادة على تقييم تغيير في RABV تحييد الأجسام المضادة (RVNA) بعد التطعيم. وقد يكون من الصعب تفسير هذه الاستراتيجية في المناطق التي يوجد فيها برنامج نشط للأحياء البرية أو في المناطق التي يكون فيها هذا البرنامج غير صحيح، وتوجد مستويات خلفية من RVNA في أنواع المكامن. وفي مثل هذه الحالات، قد يكون من المفيد وضع علامة بيولوجية مدمجة مع اللقاح أو مصفوفة الطعم. قدمنا 16 النمس الأسير الطعوم الغفل ORV التي تحتوي على حمض إيثيل iophenoxic (et-IPA) في تركيزات من 0.4٪ و 1٪ داخل الطعم و 0.14٪ في مصفوفة الطعم الخارجي. كما قدمنا 12 النمس الأسير ORV الطعوم التي تحتوي على حمض ميثيل iophenoxic (me-IPA) في تركيزات 0.035٪، 0.07٪ و 0.14٪ في مصفوفة الطعم الخارجي. جمعنا عينة مصل قبل تقديم الطعم ومن ثم أسبوعيا لمدة تصل إلى ثمانية أسابيع بعد العرض. لقد استخرجنا أحماض الأيوفينوكسيوك من سيرا إلى أسيتاتونيتريل وكمي باستخدام الكروماتوغرافيا السائلة/قياس الطيف الكتلي. قمنا بتحليل سيرا لET-IPA أو me-IPA عن طريق قياس الطيف الكتلي اللوني السائل. وجدنا قدرة كافية على وضع العلامات لمدة ثمانية وأربعة أسابيع على الأقل لـ ET-and me-IPA، على التوالي. ويمكن أن يكون كل من مشتقات وكالة تشجيع الاستثمار مناسبة للتقييم الميداني لطعم ORV في النمس. نظرا لطول العمر من علامة في النمس سيرا، يجب الحرص على عدم الخلط بين النتائج باستخدام نفس مشتق IPA خلال التقييمات المتتالية.
Introduction
فيروس داء الكلب (RABV) هو شعور سلبي واحد الذين تقطعت بهم السبل ليسافيروس، ويدور بين الأنواع المتنوعة من خزانات الحياة البرية داخل أوامر Carnivora وChiroptera. أنواع متعددة من النمس هي خزانات RABV، والنمس الهندي الصغير (الهربسauropunctatus)هو الخزان الوحيدفي بورتوريكو والجزر الكاريبية الأخرى في نصف الكرة الغربي 1،2،3 . وعادة ما يتم التحكم في دوران رابف في خزانات الحياة البرية من خلال استراتيجية للتطعيم عن طريق الفم ضد داء الكلب (ORV). في الولايات المتحدة (الولايات المتحدة)، يتم تنسيق هذا النشاط الإداري من قبل وزارة الزراعة الأمريكية / APHIS / خدمات الحياة البرية الوطنية إدارة البرنامج (NRMP)4. ولا يوجد حاليا ً أي برنامج لـ ORV للحياة البرية في بورتوريكو. وقد أجريت البحوث في لقاحات داء الكلب وأنواع الطعم المختلفة للنمس مع نتائج واعدة تشير إلى برنامج ORV للنمس ممكن5،6،7،8.
يعتمد رصد تأثير ORV على تقدير تناول الطعم من قبل الأنواع المستهدفة، والذي ينطوي عادة على تقييم تغيير في الانتشار المصلي للجسم المضاد للفيروسات القهقرية. ومع ذلك، قد تكون هذه الاستراتيجية صعبة في المناطق التي توجد فيها برامج نشطة للفيروسات القهقرية أو في المناطق التي تكون فيها RV هي الإنزوتيك ومستويات خلفية من الأجسام المضادة لتحييد RABV (RVNA) موجودة في أنواع المكامن. وفي مثل هذه الحالات، قد يكون من المفيد وضع علامة بيولوجية مدرجة في الطعم أو مصفوفة الطعم الخارجي.
وقد استخدمت علامات بيولوجية مختلفة لرصد تناول الطعم في العديد من الأنواع، بما في ذلك الراكون(Procyon lotor)9،10، stoats (Mustelaermine)11،12، الشارات الأوروبية ( ميليس ميليس) 13، الخنازير البرية (سوس سكروفيه)14، النمس الهندي الصغير15 والكلاب البراري (Cynomysludovicianus)16،17، من بين أمور أخرى. في الولايات المتحدة، غالبا ما تشمل الطعوم ORV التشغيلية 1٪ التتراسيكلين biomarker في مصفوفة الطعم لرصد الطعم التناول18،19. ومع ذلك، فإن العيوب في استخدام التتراسيكلين تشمل القلق المتزايد بشأن توزيع المضادات الحيوية في البيئة، وأن الكشف عن التتراسيكلين هو عادة الغازية، مما يتطلب استخراج الأسنان أو تدمير الحيوان للحصول على العظام عينات20. وقد تم تقييم Rhodamine B كعلامة في مجموعة متنوعة من الأنسجة ويمكن الكشف عنها باستخدام الأشعة فوق البنفسجية (UV) الضوء والفلورة في الشعر وشعيرات10،21.
حمض الايوفينوكسيك (IPA) هو مسحوق أبيض بلوري تم استخدامه لتقييم استهلاك الطعم في القيوط(كانيس لاترانس)22، ثعلب القطب الشمالي (فولبيسلاغوبوس)23، الثعلب الأحمر (الفرج الفرج)24، الراكون 9 , 25، الخنزير البري14، الغزلان الحمراء(سيرفوس elaphus scoticus)26، الشارات الأوروبية12 وferrets (M.furo)27، من بين العديد من الأنواع الثدييات الأخرى. أوقات الاحتفاظ من IPA يختلف حسب الأنواع من أقل من أسبوعين في بعض marsupials28،29، إلى ما لا يقل عن 26 أسبوعا في ungulates26 وأكثر من 52 أسبوعا في الكلاب المنزلية (كانيس الذئبةfamiliaris)30. قد تكون أوقات الاحتفاظ أيضا تعتمد على الجرعة31. حمض Iophenoxic يربط بقوة إلى الزلال المصل واكتشفت تاريخيا عن طريق قياس مستويات اليود في الدم32. وحلت محل هذا النهج غير المباشر أساليب التصوير اللوني السائل عالية الأداء (HPLC) لقياس تركيزات حمض الفينوإكسيوك مباشرة مع الكشف عن الأشعة فوق البنفسجية33،وفي نهاية المطاف مع الكروماتوغرافيا السائلة وقياس الطيف الكتلي (LCMS) 34و35 . ولهذه الدراسة، تم تطوير التصوير اللوني السائل شديد الحساسية والانتقائية مع طريقة قياس الطيف الكتلي جنباً إلى جنب (LC-MS/MS) التي تستخدم رصد التفاعل المتعدد (MRM) لتحديد نظائرها من حمض الأيوفينوك. كان هدفنا هو استخدام طريقة LC-MS/MS هذه لتقييم قدرة وضع العلامات على حمض البربانويك 2-(3-هيدروكسي-2,4,6-triiodobenzyl) (ميثيل-IPA أو me-IPA) و2-(3-هيدروكسي-2,4,6-ترييودوبنزل) حمض البوتانويك (إيثيل-IPA أو et-IPA) وعند تسليمها في ORV الطعم إلى النمس الأسير.
تم القبض على النمس الحية في الفخاخ قفص الطعم مع النقانق المدخنة المتاحة تجاريا وزيت السمك. تم إيواء النمس في أقفاص فردية 60 سم × 60 سم × 40 سم من الفولاذ المقاوم للصدأ وتغذية حصة يومية من حوالي 50 غرام من أغذية القطط الجافة التجارية، تستكمل مرتين في الأسبوع مع فخذ الدجاج المتاحة تجاريا. المياه كانت متاحة ad libitum. سلمنا اثنين من مشتقات IPA، إيثيل-IPA وميثيل-IPA، إلى النمس الأسير في الطعوم ORV الغفل. وكانت جميع الطعوم تتكون من 28 مم × 20 مم × 9 مم احباط حزمة نفطة مع طلاءخارجي (فيما يلي "مصفوفة الطعم") التي تحتوي على مسحوق بيض الدجاج والجيلاتين (جدول المواد). تحتوي الطعوم على 0.7 مل من الماء أو مشتق IPA وتزن حوالي 3 غرام، منها حوالي 2 غرام كانت مصفوفة الطعم الخارجي.
عرضنا 16 النمس الأسير وIPA في ثلاثة تركيزات: 0.14٪ (2.8 ملغ وIPA في مصفوفة الطعم ~ 2 غرام؛ 3 الذكور [م] ، 3 الإناث [و])، 0.4٪ (2.8 ملغ ET IPA في 0.7 مل حجم حزمة نفطة؛ 3M، 3F)، و 1.0٪ (7.0 ملغ إيثيل IPA في 0.7 مل حجم حزمة نفطة؛ 2M ، 2و). الجرعة الإجمالية من 2.8 ملغ يتوافق مع معدل جرعة من 5 ملغ /كغ27,36 ويستند إلى متوسط وزن النمس من 560 غرام في بورتوريكو. اخترنا 1٪ كأعلى تركيز كما تشير البحوث النفور من الذوق لبعض المؤشرات الحيوية قد تحدث في تركيزات >1٪ في بعض الأنواع37. قدمنا فقط جرعة 1٪ في حزمة نفطة كما منع التفلطاب من ذوبان في المذيب بما فيه الكفاية ليتم دمجها بالتساوي في مصفوفة الطعم. تلقت مجموعة تحكم واحدة (2M، 1f) الطعوم مليئة بالماء المعقمة وليس IPA. عرضنا الطعوم على النمس في الصباح (حوالي 8 صباحا) أثناء أو قبل تغذية حصص الصيانة اليومية الخاصة بهم. وأُزيلت بقايا الطعم بعد حوالي 24 ساعة. جمعنا عينات الدم قبل العلاج، يوم واحد بعد العلاج ومن ثم أسبوعيا تصل إلى 8 أسابيع بعد العلاج. نحن النمس التخدير عن طريق استنشاق غاز isoflurane وجمعما ما يصل إلى 1.0 مل من الدم كله عن طريق الوريد من الوريد الجمجمة كافا كما هو موضح للنمس38. قمنا بالطرد المركزي لعينات الدم بأكملها، ونقلنا سيرا إلى الفيارير اتّساها في -80 درجة مئوية حتى التحليل. لم يتم أخذ عينات من جميع الحيوانات خلال جميع الفترات الزمنية لتقليل آثار الدم المتكرر على صحة الحيوانات. تم أخذ عينات من الحيوانات السيطرة في اليوم 0، ثم أسبوعيا لمدة تصل إلى 8 أسابيع بعد العلاج.
قدمنا لي-IPA في ثلاثة تركيزات: 0.035٪ (0.7 ملغ)، 0.07٪ (1.4 ملغ) و 0.14٪ (2.8 ملغ)، وكلها أدرجت في مصفوفة الطعم، مع 2 الذكور و 2 الإناث لكل مجموعة العلاج. تلقى ذكران وامرأتان طعوم مليئة بالماء المعقم وليس وكالة تشجيع الاستثمار. يتم وصف الطعم الذي يقدم الأوقات وتخدير النمس أعلاه. جمعنا عينات الدم قبل العلاج في اليوم الأول، ثم الأسبوعية لمدة تصل إلى 4 أسابيع بعد العلاج.
اختبرنا بيانات تركيز المصل للطبيعية والوسائل المقدرة لتركيزات IPA المصل من مجموعات العلاج المختلفة. استخدمنا نموذج ًا خطيًا مختلطًا لمقارنة تركيزات المصل وIPA المتوسطة المجمعة عبر الأفراد. نوع الطعم (مصفوفة / حزمة نفطة) كان تأثير ثابت بالإضافة إلى اليوم التجريبي، في حين أن هوية الحيوان كان تأثير عشوائي. تم تشغيل جميع الإجراءات باستخدامالبرمجيات الإحصائية المشتركة (جدول المواد) وتم تقييم الأهمية في α = 0.05.
Protocol
تمت الموافقة على جميع الإجراءات من قبل اللجنة المؤسسية لرعاية الحيوانات واستخدامها التابعة للمركز الوطني لبحوث الحياة البرية التابع لوزارة الزراعة الأميركية بموجب بروتوكول البحوث المعتمد QA-2597.
ملاحظة: يصف البروتوكول التالي إجراء التحليل للكشف عن حمض ميثيل ايوفينوكيوك في مصل النمس. هذه الطريقة هي النسخة النهائية من عملية متكررة التي بدأت مع تحليل حمض الإيثيل iophenoxic في مصل النمس. وأثناء التقييم الأولي لحمض الإيثيل - الأيوفينوكي، أُدخلت تعديلات طفيفة على الأساليب، مما أسفر عن البروتوكول النهائي الوارد أدناه. وتشمل النتائج التمثيلية تلك التي تم الحصول عليها أثناء كلا التكرارين.
1- إعداد الحلول والمعايير
- شراء لي IPA وآخرون IPA.
- للمرحلة المتنقلة A، إعداد 1 لتر من 0.1٪ (V / v) حمض الفورميك في الماء عن طريق الجمع بين 1 مل من حمض الفورميك مع 1 لتر من المياه النقية (≥ 18 MΩ). للمرحلة المتنقلة B، إعداد 1 لتر من 0.1٪ (V / v) حمض الفورميك في أسيتوتريل (ACN) عن طريق الجمع بين 1 مل من حمض الفورميك مع 1 لتر من ACN.
- للتخفيف، إعداد 200 مل من 0.5٪ (V / v) حمض ثلاثي الفلوروسيتيك (TFA) في ACN عن طريق الجمع بين 1 مل من TFA مع 200 مل من ACN.
- إعداد حلول مخزون IPA المركزة من ME-IPA وet-IPA في ACN بتركيزات تبلغ حوالي 1000 ميكروغرام/مل.
- تزن ما يقرب من 10 ملغ من لي IPA على التوازن الدقيق وتسجيل الكتلة إلى ± 0.0001 ملغ. Sonicate 1 دقيقة لإذابة جميع المواد الصلبة، ومن ثم جلب إلى حجم مع ACN.
- نقل ~ 8 مل من كل مخزون إلى قوارير زجاجية العنبر 8 مل مع بولي رباعي فلوروإيثيلين (PTFE) مبطنة قبعات. يخزن في درجة حرارة الغرفة (RT). نقل المخزون المتبقي إلى النفايات الخطرة.
- بالنسبة لمخزون me-IPA 25x-7 (الجدول1)،قم بإعداد مخزون من me-IPA في ACN بحوالي 200 ميكروغرام/مل. على سبيل المثال: نقل 1 مل من الأسهم المركزة me-IPA من الخطوة 1.4.2 إلى قارورة حجمية من الفئة A 5 مل باستخدام حقنة زجاجية 1000 ميكرولتر. تمييع إلى حجم مع ACN. نقل المخزون إلى قارورة زجاجية العنبر 8 مل مع غطاء PTFE مبطنة. متجر في RT.
- إعداد ستة أسهم إضافية 25x ME-IPA الوارد وصفها في الجدول 1. لكل مخزون، والجمع بين وحدات التخزين المشار إليها باستخدام pipettor تكرار في العنبر 8 مل قناب الكهرماني قارورة مع غطاء PTFE مبطنة. تخزين كل الأسهم في RT.
- بالنسبة للمخزون البديل 25x، قم بإعداد مخزون بديل من ME-IPA في ACN بحوالي 10 ميكروغرام/مل من المخزون المركز المعد في الخطوة 1.4.2. نقل 0.100 مل من الأسهم مركزة لي IPA إلى قارورة حجمية 10 مل الفئة A باستخدام حقنة زجاجية 100 درجة مئوية، ومن ثم تخفيف لحجم مع ACN.
- نقل ~ 8 مل إلى قارورة الزجاج العنبر 8 مل مع غطاء PTFE مبطنة. تخزين في RT. نقل المخزون المتبقي إلى النفايات الخطرة.
- إعداد 4X الأسهم التي تحتوي على كل من analytes في 2 مل المسمار أعلى الزجاج autosampler قارورة كما هو موضح في الجدول2.
- على سبيل المثال، لإعداد المخزون 4x-7، إلى قارورة 2 مل، إضافة 0.20 مل من الأسهم 25x-7 me-IPA من الخطوة 1.5 باستخدام pipettor تكرار مع 0.5 مل قدرة تلميح. إضافة 0.20 مل من 25x البديل et-IPA الأسهم من الخطوة 1.7 باستخدام pipettor تكرار مع 0.5 مل قدرة تلميح.
- إضافة 0.85 مل من ACN باستخدام pipettor تكرار مع 1 مل قدرة تلميح. قم بتعبئة القارورة بأمان وعكس 5x للخلط.
- إعداد منحنى القياسية في 2 مل المسمار الأعلى قارورة autosampler كما هو موضح في الجدول3.
- على سبيل المثال، لإعداد معيار 7 (Std 7)، إلى قارورة 2 مل، إضافة 0.20 مل من المخزون 4x-7 من الخطوة 1.8.2 باستخدام pipettor تكرار مع طرف سعة 0.5 مل. إضافة 0.60 مل من المياه DI فائقة النقي ة باستخدام pipettor تكرار مع 1 مل قدرة طرف. قم بتعبئة القارورة بأمان وعكس 5x للخلط.
2. إعداد عينة
تحذير: يجب أن يكون الموظفون الذين يقومون بهذا الإجراء قد تلقوا السلسلة الكاملة من الوقاية من داء الكلب قبل التعرض وأن يكون لديهم جسم مضاد موثق لداء الكلب فوق 0.5 وحدة IU من مرفق طبي اتحادي معين للصحة المهنية. يجب على الموظفين ارتداء معاطف المختبر وحماية العين في جميع الأوقات أثناء إجراء عملية الاستخراج. تحذير: تنفيذ الخطوات 2.3-2.6 في خزانة السلامة الأحيائية من الفئة الثانية.
- لكل عينة، قم بإعداد أنبوب الطرد المركزي الصغير 1.5 مل يحتوي على 200-300 ملغ من NaCl.Arrange الأنابيب في رف من البلاستيك 80 وضع. توضع جانباً للاستخدام في الخطوة 2.6.
ملاحظة: يوصى بمغرفة صغيرة (أو جهاز قياس صغير آخر) لأعداد كبيرة من العينات. - لكل عينة، تسمية اثنين من أنابيب الطرد المركزي الصغيرة 1.5 مل: واحد باسم "A" والآخر باسم "B". ترتيب الأنابيب في رف من البلاستيك 80 موقف.
- وضع المواد والمعدات التالية اللازمة لاستخراج المصل في خزانة السلامة الأحيائية من الفئة الثانية: أنابيب الطرد المركزي الدقيقة (في الرفوف) المعدة في الخطوتين 2-1 و2.2، وخلاط الدوامة، وتكرار الأنابيب مع 0.5 مل و 5 أطراف سعة مل، وإزاحة الهواء 100-1000 ميكرولتر ماصة مع 1000 ميكروغرام نصائح، حاويات مع ما يقرب من 100 مل كل من الماء DI مخفف وفائقة النقاء، وحاوية النفايات الخطرة بيولوجيا.
- إزالة عينات المصل من التخزين المجمدة ودافئة إلى RT في مجلس الوزراء السلامة البيولوجية. خلط دوامة كل عينة المصل قبل أخذ العينات.
- باستخدام pipettor تكرار مع 0.5 مل قدرة تلميح، الاستغناء عن 0.050 مل من مصل النمس في أنبوب "A" وإضافة 0.050 مل من 25X الأسهم البديلة. ثم إضافة 0.950 مل من مخفف إلى أنبوب "A" باستخدام pipettor تكرار مع 5 مل قدرة تلميح. غطاء آمن ودوامة مزيج لمدة 10-15 s.
- قم بالاستغناء عن حمض الكلس المغطى مسبقًا من الخطوة 2.1 إلى الأنبوب "A" ومزيج الدوامة 3x لـ 8−12 s. مسح الأسطح الخارجية لرف القارورة الذي يحتوي على أنبوب "A" باستخدام 70% (v/v) isopropanol.
ملاحظة: قد تتم الآن إزالة رف العينات من خزانة السلامة الأحيائية من الفئة الثانية. - أنبوب الطرد المركزي "A" في 12،000 × ز لمدة دقيقة واحدة لفصل المراحل المائية وACN. ماصة 0.80 مل من المرحلة ACN العليا إلى أنبوب "B" باستخدام ماصة إزاحة الهواء 100-1000 درجة مئوية. نقل الحل المتبقي في الأنبوب "ألف" إلى النفايات الخطرة والتخلص من الأنبوب الفارغ في حاوية نفايات خطرة بيولوجياً.
- إزالة ACN وTFA من أنبوب "B" مع تدفق لطيف من الغاز N2 في حمام مائي 45 درجة مئوية.
- أضف 0.250 مل من ACN إلى الأنبوب "B" باستخدام أنبوب تكرار، ومزيج دوامة لمدة 4−5 ثوان، ثم الطرد المركزي لفترة وجيزة (2−4 s) عند 12000 × ز لجمع السائل في أسفل الأنبوب.
- أضف 0.750 مل من مياه DI فائقة النقاء إلى الأنبوب "B" باستخدام أنبوب تكرار مع طرف سعة 5 مل، ومزيج دوامة لمدة 4−5 s، ثم الطرد المركزي لمدة دقيقة واحدة عند 12000 × ز لتوضيح العينة.
- نقل 0.75 مل من supernatant إلى قارورة autosampler باستخدام ماصة 1000 ميكرولتر إزاحة الهواء. تجاهل نصائح الماصات في حاوية النفايات الخطرة بيولوجيا.
- كاب قارورة autosampler بشكل آمن وتحليلها من قبل LC-MS / MS (القسم 4). نقل الحل المتبقي في الأنبوب "باء" إلى النفايات الخطرة والتخلص من الأنبوب الفارغ إلى حاوية نفايات خطرة بيولوجياً. التخلص من جميع النفايات الخطرة بيولوجياً عن طريق التعقيم أو الحرق.
3. عينات مراقبة الجودة
تحذير: اتبع البيانات التحذيرية الموضحة في القسم 2.
ملاحظة: يصف الإجراء التالي الحد الأدنى لعدد عينات مراقبة الجودة (QC) المطلوبة لتحليل. ينصح بتكرار في كل مستوى إذا كان المصل النمس التحكم كافية متاحة.
- إعداد أربعة أنابيب الطرد المركزي الدقيقة 1.5 مل تحتوي على 200-300 ملغ من حمض الكلس. ترتيب الأنابيب في رف من البلاستيك 80 موقف.
- لكل عينة مراقبة الجودة، تسمية اثنين من أنابيب الطرد المركزي الصغيرة 1.5 مل: واحد باسم "A" والآخر باسم "B". ترتيب الأنابيب في رف من البلاستيك 80 موقف.
- كرر الخطوة 2.3.
- إزالة مصل النمس السيطرة من التخزين المجمدة ودافئة إلى RT في مجلس الوزراء السلامة البيولوجية. دوامة خلط مصل التحكم قبل أخذ العينات.
- الاستغناء عن 0.050 مل من مصل النمس التحكم في أربعة 1.5 مل "A" أنابيب باستخدام pipettor تكرار مع 0.5 مل قدرة تلميح.
- تحصين كل من عينات مراقبة الجودة الأربعة كما هو محدد في الجدول 4 باستخدام pipettor تكرار مع طرف سعة 0.5 مل. قم بتعبئة كل عينة من عينات مراقبة الجودة بشكل آمن ومزيج الدوامة لمدة 10-15 s.
- تنفيذ إجراء الاستخراج كما هو موضح في الخطوات 2.6-2.12.
4. LC-MS / MS التحليل
- تكوين LC-MS/MS مع كافة المعلمات الموضحة في الجدول 5. قم بتشغيل LC-MS/MS والسماح للعمود بالوصول إلى 70 درجة مئوية قبل تعيين معدل التدفق إلى 0.800 مل/دقيقة.
- إعداد تسلسل في برنامج الحصولعلى البيانات (جدول المواد) لحقن المنحنى القياسي قبل وبعد كل دفعة تتكون من عينات مراقبة الجودة وعينات غير معروفة.
- حقن جميع المعايير والعينات والحصول على مخططات كروماتوية أيونية MRM باستخدام المعلمات المدرجة في الجدول5.
- بعد الانتهاء من التسلسل، إيقاف تشغيل LC-MS/MS والتخلص من جميع قارورة autosampler كنفايات خطرة.
5- القياس الكمي
- استخدم برنامج تحليل البيانات لإنشاء منحنى معايرة للاستجابات النسبية مقابل التركيزات النسبية لـ me-IPA باستخدام وكالة تشجيع الاستثمار باستخدام وكالة تشجيع الاستثمار كمعيار داخلي. حساب الاستجابات النسبية من انتقال MRM الكمية لme-IPA (556.6 → 428.7) مقسوماً على انتقال MRM لـ ET-IPA (570.7 → 442.7). قم بإنشاء منحنى معايرة من 7 مستويات باستخدام دالة ربعية من الدرجة الثانية مرجحة 1/x وتتجاهل الأصل.
- حساب تركيز المصل(المصلC) من me-IPA باستخدام المعادلة التالية:
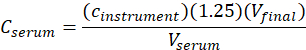
حيثc الصك هو التركيز الذي يحدده الصك من منحنى المعايرة في وحدات من ميكروغرام /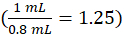 مل، 1.25 هو عامل التخفيف، Vالنهائي هو حجم العينة النهائية (1.0 مل)، والمصل الخامس هو حجم المصل في مل ( 0.050 مل الاسمية).
مل، 1.25 هو عامل التخفيف، Vالنهائي هو حجم العينة النهائية (1.0 مل)، والمصل الخامس هو حجم المصل في مل ( 0.050 مل الاسمية).
النتائج
وترد في الشكل 1مخططات الألوان الأيونية التمثيلية من تحليل me-IPA . مصل النمس التحكم (الشكل1A)يوضح وقت الاحتفاظ ET-IPA (analyte البديلة) وعدم وجود me-IPA في وقت الاحتفاظ المشار إليه. توضح عينة مراقبة الجودة (الشكل1B)الفصل الأساسي بين i-IPA وet...
Discussion
وقد استخدمت طريقة LC-MS/MS التي تم تطويرها للدراسات انتقائية رصد ردود الفعل المتعددة لتحديد كمية البيانات والإبأعلى نحو دقيق في مصل النمس. كما سمحت الانتقائية للكشف عن مرض التصلب العصبي المتعدد/MS لبروتوكول تنظيف بسيط يعتمد فقط على الأسيتاتونيتريل لتعجيل البروتينات من المصل قبل التحليل.
Disclosures
المؤلفين AV وSO هم موظفين بدوام كامل من الشركة المصنعة لطعم لقاح داء الكلب عن طريق الفم.
Acknowledgements
وقد تم دعم هذا البحث جزئيا من قبل برنامج البحوث داخل الجدارية من وزارة الزراعة الأمريكية، ودائرة التفتيش على صحة الحيوان والنبات، وخدمات الحياة البرية، والبرنامج الوطني لإدارة داء الكلب وIDT Biologika (Dessau-Rosslau، ألمانيا).
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile, Optima grade | Fisher | A996 | |
| Analytical balance | Mettler Toledo | XS204 | |
| C18 column, 2.1 x 50 mm, 2.5-µm particle size | Waters Corp. | 186003085 | |
| ESI Source | Agilent | G1958-65138 | |
| Ethyl-iophenoxic acid, 97 % | Sigma Aldrich | N/A | Lot MKBP5399V |
| Formic acid, LC/MS grade | Fisher | A117 | |
| LCMS software | Agilent | MassHunter Data Acquisition and Quantitative Analysis | |
| Methyl-iophenoxic acid, 97 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR0709514717 |
| Microanalytical balance | Mettler Toledo | XP6U | |
| Microcentrifuge | Eppendorf | 5415C | |
| MS/MS | Agilent | G6470A | |
| N-Evap | Organomation | 115 | |
| Oral Rabies Vaccine Baits | IDT Biologika, Dessau Rossleau, Germany | N/A | |
| Propyl-iophenoxic acid, 99 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR100612108RR |
| Repeat pipettor | Eppendorf | M4 | |
| Screw-top autosampler vial caps, PTFE-lined | Agilent | 5190-7024 | |
| Sodium chloride, Certified ACS grade | Fisher | S271 | |
| Statistical Software Package | SAS Institute, Cary, North Carolina, USA | N/A | |
| Trifluoroacetic acid, 99 % | Alfa Aesar | L06374 | |
| UPLC | Agilent | 1290 Series | |
| Vortex Mixer | Glas-Col | 099A PV6 | |
| 0.2-mL pipettor tips | Eppendorf | 30089.413 | |
| 0.5-mL pipettor tips | Eppendorf | 30089.421 | |
| 1.5-mL microcentrifuge tubes | Fisher | 14-666-325 | |
| 1250-µL capacity pipette tips | GeneMate | P-1233-1250 | |
| 1-mL pipettor tips | Eppendorf | 30089.43 | |
| 2-mL amber screw-top autosampler vials | Agilent | 5182-0716 | |
| 5-mL pipettor tips | Eppendorf | 30089.456 | |
| 80-position microcentrifuge tube rack | Fisher | 05-541-2 | |
| 8-mL amber vials with PTFE-lined caps | Wheaton | 224754 | |
| 70 % (v/v) isopropanol | Fisher | A459 | |
| 100-1000 µL air displacement pipette | Eppendorf | ES-100 |
References
- Nel, L. H., et al. Mongoose rabies in southern Africa: a re-evaluation based on molecular epidemiology. Virus Research. 109 (2), 165-173 (2005).
- Zieger, Z., et al. The phylogeography of rabies in Grenada, West Indies, and implications for control. PLOS Neglected Tropical Diseases. 8 (10), e3251 (2004).
- Monroe, B. P., et al. Rabies surveillance in the United States during 2014. Journal of the American Veterinary Medical Association. 248 (7), 777-788 (2015).
- Slate, D., et al. Status of oral rabies vaccination in wild carnivores in the United States. Virus Research. 111, 68-76 (2005).
- Blanton, J. D., et al. Vaccination of small Asian mongoose (Herpestes javanicus) against rabies. Journal of Wildlife Diseases. 42 (3), 663-666 (2006).
- Vos, A., et al. Oral vaccination of captive small Indian mongoose (Herpestes auropunctatus) against rabies. Journal of Wildlife Diseases. 49 (4), 1033-1036 (2013).
- Berentsen, A. R., Johnson, S. R., VerCauteren, K. C. Evaluation of ONRAB® bait matrix flavor preference by mongoose (Herpestes auropunctatus) in Puerto Rico: Implications for Oral Rabies Vaccination. Caribbean Journal of Science. 48 (1), 52-58 (2014).
- Ortmann, S., et al. Safety studies with the oral rabies virus vaccine strain SPBN GASGAS in the small Indian mongoose (Herpestes auropunctatus). BMC Veterinary Research. 14 (1), 90 (2018).
- Linhart, S. B., et al. A field evaluation of baits for delivering oral rabies vaccines to raccoons (Procyon lotor). Journal of Wildlife Diseases. 30 (2), 185-194 (1994).
- Fry, T. L., Atwood, T., Dunbar, M. R. Evaluation of rhodamine B as a biomarker for raccoons. Human Wildlife Interactions. 4 (2), 275-280 (2010).
- Jones, C., Moller, H., Hamilton, W. A review of potential techniques for identifying individual stoats (Mustela erminea) visiting control or monitoring stations. New Zealand Journal of Zoology. 31 (3), 193-203 (2004).
- de Leeuw, A. N. S., Smith, G. C., Woods, J. A. Use of iophenoxic acid to assess bait uptake by European badgers. Advances in Vertebrate Pest Management. 4, 243-254 (2006).
- Southey, A. K., Sleeman, D. P., Gormley, E. Sulfadimethoxine and rhodamine B as oral biomarkers for European badgers (Meles meles). Journal of Wildlife Diseases. 38 (2), 378-384 (2002).
- Massei, G., Jones, A., Platt, T., Cowan, D. P. Iophenoxic Acid as a Long-Term Marker for Wild Boar. Journal of Wildlife Management. 73 (3), 458-461 (2009).
- Creekmore, T. E., et al. Field evaluation of baits and baiting strategies for delivering oral vaccine to mongooses in Antigua, West Indies. Journal of Wildlife Diseases. 30 (4), 497-505 (1994).
- Creekmore, T. E., Rock, R. E., Hurley, J. A baiting system for delivery of an oral plague vaccine to black-tailed prairie dogs. Journal of Wildlife Diseases. 38 (1), 32-39 (2002).
- Fernandez, J. R. R., Rocke, R. E. Use of Rhodamine B as a biomarker for oral plague vaccination of prairie dogs. Journal of Wildlife Diseases. 47 (3), 765-768 (2011).
- Johnston, J. J., et al. Evaluation and significance of tetracycline stability in rabies vaccine baits. Journal of Wildlife Diseases. 41 (3), 549-558 (2005).
- Algeo, T. P., et al. Oral rabies vaccination variation in tetracycline biomarking among Ohio Raccoons. Journal of Wildlife Diseases. 49 (2), 332-337 (2013).
- Crier, J. K. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 34 (4), 829-834 (1970).
- Fisher, P. Review of using Rhodamine B as a marker for wildlife studies. Wildlife Society Bulletin. 27 (2), 318-329 (1999).
- Knowlton, F. K., Savarie, P. J., Wahlgren, C. E., Hayes, D. J., Shumake, S. A., Bullard, R. W. Physiological marks by coyotes ingesting baits containing iophenoxic acid, Mirex and Rhodamine B. Vertebrate Pest Control and Management Materials. , 141-147 (1987).
- Follmann, E. H., Savarie, P. J., Ritter, D. G., Baer, G. M. Plasma marking of arctic foxes with iophenoxic acid. Journal of Wildlife Diseases. 23 (4), 709-712 (1987).
- Saunders, G., Harris, S., Eason, C. T. Iophenoxic acid as a quantitative bait marker for foxes. Wildlife Research. 20, 297-302 (1993).
- Hadidian, J., et al. Acceptance of simulated oral rabies vaccine baits by urban raccoons. Journal of Wildlife Diseases. 25 (1), 1-9 (1989).
- Sweetapple, P. J., Nugent, G. Iophenoxic acid as a serum marker for red deer (Cervus elaphus scoticus). Wildlife Research. 25, 649-654 (1998).
- Ogilvie, S. C., Eason, C. T. Evaluation of iophenoxic acid and rhodamine B for marking feral ferrets (Mustela furo). New Zealand Journal of Zoology. 25 (2), 105-108 (1998).
- Eason, C. T., Batcheler, D., Frampton, C. M. Comparative pharmacokinetics of iophenoxic acid in cats and brushtail possums. Wildlife Research. 21, 377-380 (1994).
- Fisher, P. M., Marks, C. A. Evaluation of iophenoxic acid as a biomarker for swamp wallabies (Wallabia bicolor). Wildlife Research. 24, 97-103 (1997).
- Baer, G. M., Shaddock, J. H., Hayes, D. J., Savarie, P. Iophenoxic acid as a serum marker in carnivores. Journal of Wildlife Management. 49 (1), 49-51 (1985).
- Spurr, E. B. Iophenoxic acid as a systemic blood marker for assessment of bait acceptance by stoats (Mustela ermine) and weasels (Mustela nivalis). New Zealand Journal of Zoology. 29 (2), 135-142 (2002).
- Mudge, G. H., Strewler, G. J., Desbiens, N., Berndt, W. O., Wade, D. N. Excretion and distribution of iophenoxic acid. Journal of Pharmacology and Experimental Therapeutics. 178 (1), 159-172 (1971).
- Jones, A. High-performance liquid chromatographic determination of iophenoxic acid in serum. Journal of Chromatography B: Biomedical Sciences and Applications. 654 (2), 293-296 (1994).
- Wiles, M. C., Campbell, T. A. Liquid chromatography-electrospray ionization mass spectrometry for direct identification and quantification of iophenoxic acid in serum. Journal of Chromatography B. 832 (1), 144-157 (2006).
- Ballesteros, C., et al. Analysis by LC/ESI-MS of iophenoxic acid derivatives and evaluation as markers of oral baits to deliver pharmaceuticals to wildlife. Journal of Chromatography B. 878 (22), 1997-2002 (2010).
- Purdey, D. C., Petcu, M., King, C. M. A simplified protocol for detecting two systemic bait markers (Rhodamine B and iophenoxic acid) in small mammals. New Zealand Journal of Zoology. 30 (3), 175-184 (2003).
- Tobin, M. E., Koehler, A. E., Sugihara, R. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 60 (1), 202-207 (1996).
- Briscoe, J. A., Syring, R. Techniques for emergency airway and vascular access in special species. Seminars in Avian and Exotic Pet Medicine. 13 (3), 118-131 (2004).
- Eason, C. T., Frampton, C. M. The plasma pharmacokinetics of iophenoxic and iopanoic acids in goat. Xenobiotica. 2 (2), 185-189 (1992).
- Hilton, H. E., Dunn, A. M. S. . Mongooses: their natural history. , (1967).
- Stevens, C. E., Hume, I. D. . Comparative physiology of the vertebrate digestive system. Second edition. , (1995).
- National Rabies Management Program (NRMP). . Oral rabies vaccination draft operations manual. , (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved