È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Analisi degli analoghi dell'acido iofenostico nella piccola mangusta indiana (Herpestes Auropunctatus) Sera per l'uso come marcatore biologico di vaccinazione della rabbia orale
In questo articolo
Riepilogo
Abbiamo offerto esche da vaccino per la rabbia placebo delle manguste in cetticone con acido iofenico etilico o metilico come biomarcatore e l'assorbimento verificato delle esche utilizzando una nuova cromatografia liquida con spettrometria di massa tandem (metodo LC-MS/MS).
Abstract
La piccola mangusta indiana(Herpestes auropunctatus) è un serbatoio di virus della rabbia (RABV) a Porto Rico e comprende oltre il 70% dei casi di rabbia animale segnalati annualmente. Il controllo della circolazione RABV nei serbatoi di fauna selvatica è in genere realizzato da una strategia di vaccinazione orale alla rabbia (ORV). Attualmente non esiste alcun programma ORV di fauna selvatica a Porto Rico. È stata condotta una ricerca sui vaccini per la rabbia orale e vari tipi di esche per le manguste con risultati promettenti. Il monitoraggio del successo dell'ORV si basa sulla stima dell'assorbimento delle esche da parte delle specie bersaglio, che in genere comporta la valutazione di un cambiamento negli anticorpi di neutralizzazione RABV (RVNA) dopo la vaccinazione. Questa strategia può essere difficile da interpretare in aree con un programma attivo ORV di fauna selvatica o in aree in cui RABV è enzootico e i livelli di fondo di RVNA sono presenti nelle specie di bacino. In tali situazioni, un biomarcatore incorporato con il vaccino o la matrice di esche può essere utile. Abbiamo offerto 16 manguste in cattività esche placebo ORV contenenti acido etilico-iofenico (et-IPA) in concentrazioni dello 0,4% e 1% all'interno dell'esca e dello 0,14% nella matrice esterna dell'esca. Abbiamo anche offerto 12 manguste in cattività esche ORV contenenti acido metilico-fenossia (me-IPA) in concentrazioni di 0,035%, 0,07% e 0,14% nella matrice di esca esterna. Abbiamo raccolto un campione di siero prima dell'offerta di esche e poi settimanalmente per un massimo di otto settimane dopo l'offerta. Abbiamo estratto gli acidi iofenossia dalla sera in acetonitrile e quantificato usando cromatografia liquida/spettrometria di massa. Abbiamo analizzato sera per et-IPA o me-IPA da spettrometria di cromatografia-massa liquida. Abbiamo trovato un'adeguata capacità di marcatura per almeno otto e quattro settimane rispettivamente per et- e me-IPA. Entrambi i derivati IPA potrebbero essere adatti per la valutazione sul campo dell'assorbimento delle esche ORV nelle manguste. A causa della longevità del marcatore in mangusta sera, bisogna fare attenzione a non confondere i risultati utilizzando lo stesso derivato IPA durante le valutazioni consecutive.
Introduzione
Il virus della rabbia (RABV) è un lyssavirus singolo spiaggiato e circola tra diverse specie di bacini naturali all'interno degli ordini Carnivora e Chiroptera. Molteplici specie di manguste sono serbatoi di RABV, e la piccola mangusta indiana (Herpestes auropunctatus) è l'unico serbatoio in Porto Rico e altre isole caraibiche nell'emisfero occidentale1,2,3 . Il controllo della circolazione RABV nei serbatoi di fauna selvatica è in genere realizzato attraverso una strategia di vaccinazione orale della rabbia (ORV). Negli Stati Uniti (STATI Uniti), questa attività di gestione è coordinata dal USDA/APHIS/Wildlife Services National Rabies Management Program (NRMP)4. Attualmente non esiste alcun programma ORV di fauna selvatica a Porto Rico. La ricerca sui vaccini sulla rabbia e vari tipi di esche per le manguste è stata condotta con risultati promettenti suggerendo un programma ORV per le manguste è possibile5,6,7,8.
Il monitoraggio dell'impatto dell'ORV si basa sulla stima dell'assorbimento delle esche da parte delle specie bersaglio, che in genere comporta la valutazione di un cambiamento nella sieroprevalenza dell'anticorpo RV. Tuttavia, questa strategia può essere difficile nelle aree con programmi ORV di fauna selvatica attivi o in aree in cui la rV è enzootica e i livelli di fondo degli anticorpi di neutralizzazione RABV (RVNA) sono presenti nelle specie di bacino. In tali situazioni, un biomarcatore incluso nell'esca o nella matrice esterna dell'esca può essere utile.
Vari marcatori biologici sono stati utilizzati per monitorare l'assorbimento di esche in numerose specie, tra cui procioni ( lottoProcyon)9,10,stoats (Mustela ermina)11,12, tassi europei ( Meles meles) 13, cinghiali (Sus scrofa)14, piccole manguste indiane15 e cani della prateria (Cynomysludovicianus)16,17, tra gli altri. Negli Stati Uniti, le esche ORV operative spesso includono un biomarcatore tetraciclino dell'1% nella matrice delle esche per monitorare l'assorbimento delle esche18,19. Tuttavia, gli inconvenienti all'uso della tetraciclina includono una crescente preoccupazione per la distribuzione di antibiotici nell'ambiente e che l'individuazione della tetraciclina è tipicamente invasiva, richiedendo l'estrazione dei denti o la distruzione dell'animale per ottenere l'osso campioni20. La rhodamina B è stata valutata come marcatore in una varietà di tessuti e può essere rilevata utilizzando la luce ultravioletta (UV) e la fluorescenza nei capelli e nei baffi10,21.
L'acido iofenosssia (IPA) è una polvere cristallina bianca che è stata utilizzata per valutare il consumo di esche nei coyote (Canis latrans)22, volpe artica (Vulpes lagopus)23, volpe rossa (Vulpes vulpes)24, procioni 9 (in vie , 25, cinghiale14, cervo rosso (Cervus elaphus scoticus)26, tassi europei12 e furetti (M. furo)27, tra diverse altre specie di mammiferi. I tempi di ritenzione dell'IPA variano a seconda delle specie da meno di due settimane in alcuni marsupiali28,29, ad almeno 26 settimane in ungulates26 e oltre 52 settimane in cani domestici (Canis lupus familiaris)30. Tempi di ritenzione possono anche essere dose-dipendente31. L'acido iofenostico si lega fortemente all'albumina del siero ed è stato storicamente rilevato misurando i livelli di iodio nel sangue32. Questo approccio indiretto è stato soppiantato da metodi di cromatografia liquida ad alte prestazioni (HPLC) per misurare direttamente le concentrazioni di acido iofenossia con rilevamento UV33, e alla fine con cromatografia liquida e spettrometria di massa (LCMS) 34,35. Per questo studio, è stata sviluppata una cromatografia liquida altamente sensibile e selettiva con spettrometria di massa tandem (LC-MS/MS) che utilizza il monitoraggio della reazione multipla (MRM) per quantificare due analoghi di acido iofenosco. Il nostro obiettivo era quello di utilizzare questo metodo LC-MS/MS per valutare la capacità di marcatura di 2-(3-idrossi-2,4,6-triiodobenzyl)acido propanoico (metil-IPA o me (3-idrossi-2,4,6-triiodobenzyl)acido butanoico (ethyl-IPA o et-IPA) e quando consegnato in un ORV esca alle manguste in cattività.
Le manguste sono state catturate dal vivo in trappole a gabbia esche con salsicce affumicate e olio di pesce disponibili in commercio. Le manguste erano alloggiate in gabbie in acciaio inossidabile da 60 cm x 60 cm x 40 cm e alimentate con una razione giornaliera di cibo per gatti secchi commerciali da 50 g, completate due volte a settimana con una coscia di pollo disponibile in commercio. L'acqua era disponibile ad libitum. Abbiamo consegnato due derivati di IPA, ethyl-IPA e metil-IPA, alle manguste in cattività nelle esche ORV placebo. Tutte le esche erano composte da una confezione di blister di 28 mm x 20 mm x 9 mm con un rivestimento esterno (qui dopo "matrice di esca") contenente uova di gallina in polvere e gelatina (Tabella deimateriali). Le esche contenevano 0,7 mL di acqua o derivato IPA e pesavano circa 3 g, di cui 2 g era la matrice di esche esterne.
Abbiamo offerto 16 manguste in cattività et-IPA in tre concentrazioni: 0.14% (2.8 mg et-IPA in matrice di esche da 2 g; 3 maschi [m], 3 femmine [f]), 0,4% (2,8 mg et-IPA in 0,7 ml di volume blister; 3m, 3f) e 1,0% (7,0 mg ethyl-IPA in 0,7 ml volume blister; 2m , 2f). La dose complessiva di 2,8 mg corrisponde a un tasso di dose di 5 mg/kg27,36 e si basa su un peso medio mangusta di 560 g a Porto Rico. Abbiamo selezionato l'1% come la concentrazione più alta come la ricerca suggerisce avversione al gusto per alcuni biomarcatori può verificarsi a concentrazioni >1% in alcune specie37. Abbiamo offerto solo la dose dell'1% nella confezione del blister come flocculazione ha impedito al soluto di sciogliersi nel solvente sufficientemente da essere incorporato uniformemente nella matrice dell'esca. Un gruppo di controllo (2m, 1f) ha ricevuto esche piene di acqua sterile e senza IPA. Abbiamo offerto esche alle manguste al mattino (8 a.m.) durante o prima dell'alimentazione della loro razione di mantenimento giornaliero. I resti di esca sono stati rimossi dopo circa 24 ore. Abbiamo raccolto campioni di sangue prima del trattamento, un giorno dopo il trattamento e poi settimanalmente fino a 8 settimane dopo il trattamento. Abbiamo anetizzato manguste per inalazione di gas isoflurano e raccolto fino a 1,0 mL di sangue intero da venipuncture della vena cava cranica come descritto per i furetti38. Abbiamo centrifugato campioni interi di sangue, trasferito sera ai crioviali e li abbiamo conservati a -80 gradi fino all'analisi. Non tutti gli animali sono stati campionati durante tutti i periodi di tempo per ridurre al minimo l'impatto del sangue ripetuto attinge alla salute degli animali. Gli animali di controllo sono stati campionati il giorno 0, poi settimanalmente per un massimo di 8 settimane dopo il trattamento.
Abbiamo consegnato me-IPA in tre concentrazioni: 0.035% (0.7 mg), 0.07% (1.4 mg) e 0.14% (2.8 mg), tutti incorporati nella matrice esca, con 2 maschi e 2 femmine per gruppo di trattamento. Due maschi e due femmine hanno ricevuto esche piene di acqua sterile e senza IPA. Esca che offre tempi e anestesia mangusta sono descritti sopra. Abbiamo raccolto campioni di sangue prima del trattamento il giorno 1, e poi settimanalmente fino a 4 settimane dopo il trattamento.
Abbiamo testato i dati sulla concentrazione del siero per verificare la normalità e i mezzi stimati per le concentrazioni di IPA del siero di diversi gruppi di trattamento. Abbiamo usato un modello misto lineare per confrontare le concentrazioni medie di siero et-IPA raggruppate tra gli individui. Il tipo di esca (matrice/blister pack) era un effetto fisso oltre al giorno sperimentale, mentre l'ID animale era un effetto casuale. Tutte le procedure sono state eseguite utilizzando un software statistico comune (Tabella dei materiali) e la significatività è stata valutata a 0,05 USD.
Protocollo
Tutte le procedure sono state approvate dal Comitato istituzionale per la cura e l'uso degli animali dell'USDA National Wildlife Research Center nell'ambito del protocollo di ricerca QA-2597.
NOTA: Il seguente protocollo descrive la procedura di analisi per rilevare l'acido metilico-fenossia nel siero di mangusta. Questo metodo è la versione finale di un processo iterativo che ha avuto inizio con l'analisi dell'acido etilico-fenofenico nel siero mangusta. Durante la valutazione iniziale dell'acido etilico-iofenico sono state apportate piccole modifiche ai metodi, con conseguente protocollo finale presentato di seguito. I risultati rappresentativi includono quelli ottenuti durante entrambe le iterazioni.
1. Preparazione di soluzioni e standard
- Acquista me-IPA ed et-IPA.
- Per la fase mobile A, preparare 1 L di 0,1% (v/v) acido formica in acqua combinando 1 mL di acido formico con 1 L di acqua ultrapura (a 18 M. Per la fase mobile B, preparare 1 L dello 0,1% (v/v) acido formico in acetonitrile (ACN) combinando 1 mL di acido formica con 1 L di ACN.
- Per diluenti, preparare 200 mL di 0,5% (v/v) acido trifluoroacetico (TFA) in ACN combinando 1 mL di TFA con 200 mL di ACN.
- Preparare le soluzioni concentrate per le scorte IPA di me-IPA ed et-IPA in ACN a concentrazioni di circa 1.000 g/mL.
- Pesare circa 10 mg di me-IPA su un microequilibrio e registrare la massa a 0.0001 mg. Quantitatively trasferire il me-IPA a un flascco volumetrico di classe 10 mL utilizzando 45 mL ACN. Sonicare 1 min per sciogliere tutti i solidi, e poi portare a volume con ACN.
- Trasferire 8 mL di ogni brodo su fiale di vetro ambrate da 8 mL con tappi rivestiti in poli-tetrafluoreetilene (PTFE). Conservare a temperatura ambiente (RT). Trasferire lo stock rimanente ai rifiuti pericolosi.
- Per il titolo 25x-7 me-IPA (Tabella 1), preparare uno stock di me-IPA in ACN a circa 200 g/mL. Esempio: Trasferire 1 mL dello stock concentrato me-IPA dal passaggio 1,4.2 a un flacone volumetrico di classe 5 mL utilizzando una siringa di vetro da 1.000 . Diluire al volume con ACN. Trasferire il brodo su una fiala di vetro ambra da 8 mL con tappo rivestito IN PTFE. Store presso RT.
- Preparare i sei stock aggiuntivi 25x me-IPA descritti nella Tabella 1. Per ogni stock, combinare i volumi indicati utilizzando un pipettor a ripetizione in una fiala di vetro ambrato ambrato 8 mL con tappo rivestito IN PTFE. Conservare ogni azione in RT.
- Per il brodo surrogato 25x, preparare uno stock surrogato di me-IPA in ACN a circa 10 g/mL dal brodo concentrato preparato al punto 1.4.2. Trasferire 0,100 mL del brodo concentrato me-IPA in un flacone volumetrico di classe A da 10 mL utilizzando una siringa di vetro da 100 L, quindi didiulare al volume con ACN.
- Trasferire 8 mL in una fiala di vetro ambra da 8 mL con tappo rivestito in PTFE. Conservare presso RT. Trasferire il materiale rimanente ai rifiuti pericolosi.
- Preparare 4 volte le scorte contenenti entrambi gli analiti in fiale di vetro a vite da 2 mL, come descritto nella tabella 2.
- Ad esempio, per preparare il magazzino 4x-7, a una fiala da 2 mL, aggiungere 0,20 mL del magazzino 25x-7 me-IPA dal passaggio 1,5 utilizzando un pipettor ripetuto con una punta di capacità di 0,5 mL. Aggiungere 0,20 mL del brodo 25x surrogato et-IPA del passaggio 1,7 utilizzando un pipettor ripetuto con una punta di capacità di 0,5 mL.
- Aggiungere 0,85 mL di ACN utilizzando un pipettor ripetuto con 1 mL di capacità. Chiudere la fiala in modo sicuro e invertire 5x per mescolare.
- Preparare la curva standard in fiale autocampionatori a vite da 2 mL, come descritto nella Tabella 3.
- Ad esempio, per preparare lo standard 7 (Std 7), a una fiala da 2 mL, aggiungere 0,20 mL del magazzino 4x-7 dal passaggio 1.8.2 utilizzando un pipettor ripetuto con una punta di capacità di 0,5 mL. Aggiungere 0,60 mL di acqua di diuso ultrapura utilizzando un pipettor di ripetizione con 1 mL di capacità. Chiudere la fiala in modo sicuro e invertire 5x per mescolare.
2. Preparazione del campione
AVVISO: il personale che esegue questa procedura deve aver ricevuto l'intera serie di profilassi pre-esposizione della rabbia e avere un titolo documentato antirabbico superiore a 0,5 IU da una struttura medica designata per la salute professionale federale. Il personale deve indossare sempre i camici da laboratorio e la protezione degli occhi durante l'esecuzione dell'estrazione. DESTRA: eseguire i passi 2.3.2.6 in un mobile di biosicurezza di classe II.
- Per ogni campione, preparate un tubo di microcentrismo da 1,5 mL contenente 200-300 mg di NaCl.Disporre i tubi in un rack di plastica a 80 posizioni. Mettere da parte per l'uso nel passaggio 2.6.
NOTA: Per un numero elevato di campioni è consigliato un micro misurino (o un altro piccolo dispositivo di misura). - Per ogni campione, etichettare due tubi di microcentrifuga da 1,5 mL: uno come "A" e l'altro come "B". Disporre i tubi in una griglia di plastica a 80 posizioni.
- Collocare i seguenti materiali e attrezzature necessari per l'estrazione del siero in un armadietto di biosicurezza di classe II: tubi di microcentrifuga (in rack) preparati nei passaggi 2.1 e 2.2, un mixer vortice, pipettor ripetuto con punte di capacità di 0,5 mL e 5 mL, 100-1.000 postidi spostamento dell'aria con 1.000 punte, contenitori con circa 100 mL ciascuno di acqua DI diluente e ultrapura, e un contenitore di rifiuti biorischi.
- Rimuovere i campioni di siero dal deposito congelato e riscaldare a RT nell'armadietto della biosicurezza. Il vortice mescola ogni campione di siero prima del campionamento.
- Utilizzando un pipettor ripetuto con una punta di capacità di 0,5 mL, erogare 0,050 mL di siero di mangusta nel tubo "A" e aggiungere 0,050 mL di 25x brodo surrogato. Quindi aggiungere 0,950 mL di diluente al tubo "A" utilizzando un pipettor ripetuto con una punta di capacità di 5 mL. Cappuccio in modo sicuro e vortice mix per 10-15 s.
- Distribuisci il NaCl prepesato dal passo 2.1 al tubo "A" e il mix di vortice 3x per 8s12 s. Pulire le superfici esterne del tubo contenente fiala contenente "A" utilizzando il 70% (v/v) isopropanol.
NOTA: il rack di campioni può ora essere rimosso dall'armadietto di biosicurezza di classe II. - Tubo di centrifuga "A" a 12.000 x g per 1 min per separare le fasi acquose e ACN. Pipetta 0,80 mL della fase Superiore ACN al tubo "B" utilizzando una pipetta di spostamento dell'aria da 100 a 1.000. Trasferire la soluzione rimanente nel tubo "A" ai rifiuti pericolosi e scartare il tubo vuoto in un contenitore di rifiuti biopericolosi.
- Rimuovere ACN e TFA dal tubo "B" con un flusso delicato di gas N2 in un bagno d'acqua a 45 gradi centigradi.
- Aggiungete 0,250 mL di ACN al tubo "B" usando un pipettor di ripetizione, un mix di vortice per 4 s e poi centrificatere brevemente (2-4 s) a 12.000 x g per raccogliere il liquido nella parte inferiore del tubo.
- Aggiungete 0,750 mL di acqua ULTRApura DI al tubo "B" utilizzando un pipettor di ripetizione con punta di capacità di 5 mL, la miscela di vortice per 4s5 s, quindi centrificatevi per 1 min a 12.000 x g per chiarire il campione.
- Trasferire 0,75 mL del supernatante in una fiala autocampionatore utilizzando una pipetta di spostamento dell'aria da 1.000 . Scartare le punte delle pipette nel contenitore dei rifiuti di pericolo biologico.
- Cap autosampler fiale in modo sicuro e analizzare da LC-MS/MS (sezione 4). Trasferire la soluzione rimanente nel tubo "B" ai rifiuti pericolosi e scartare il tubo vuoto in un contenitore di rifiuti biopericolosi. Smaltire tutti i rifiuti biopericolosi mediante autoclaving o incenerimento.
3. Campioni di controllo qualità
INFORMATIVA: Seguire le istruzioni di avvertenza descritte nella sezione 2.
NOTA:La procedura seguente descrive il numero minimo di campioni di controllo qualità (QC) necessari per un'analisi. Le repliche ad ogni livello sono raccomandate se è disponibile un siero di mangusta di controllo sufficiente.
- Preparare quattro tubi di microcentrismo da 1,5 ml contenenti 200-300 mg di NaCl. Disporre i tubi in una griglia di plastica a 80 posizioni.
- Per ogni campione di QC, etichettare due tubi di microcentrifuga da 1,5 mL: uno come "A" e l'altro come "B". Disporre i tubi in una griglia di plastica a 80 posizioni.
- Ripetere il passaggio 2.3.
- Rimuovere il siero di mangusta di controllo dal deposito congelato e riscaldare a RT nell'armadio di biosicurezza. Vortex mescolare il siero di controllo prima del campionamento.
- Distribuisce 0,050 mL di siero di mangusta di controllo nei quattro tubi "A" da 1,5 ml utilizzando un pipettor di ripetizione con una punta di capacità di 0,5 mL.
- Fortificare ciascuno dei quattro campioni QC come specificato nella tabella 4 utilizzando un pipettor di ripetizione con una mancia di capacità di 0,5 mL. Capovolgi ogni campione QC in modo sicuro e mescolare vortice per 10-15 s.
- Eseguire la procedura di estrazione come descritto nei passaggi 2.6.2.12.
4. Analisi LC-MS/MS
- Configurare LC-MS/MS con tutti i parametri descritti nella tabella 5. Accendere l'LC-MS/MS e consentire alla colonna di raggiungere i 70 gradi centigradi prima di impostare la portata su 0,800 mL/min.
- Impostare una sequenza nel software di acquisizione dei dati (Tabella dei materiali) per iniettare la curva standard prima e dopo ogni lotto costituito da campioni di controllo qualità e campioni sconosciuti.
- Iniettare tutti gli standard e i campioni e acquisire i cromatogrammi ioni di MRM utilizzando i parametri elencati nella tabella 5.
- Dopo il completamento della sequenza, spegnere l'LC-MS/MS e smaltire tutte le fiale autocampionatore come rifiuti pericolosi.
5. Quantificazione
- Utilizzare il software di analisi dei dati per generare una curva di calibrazione delle risposte relative rispetto alle concentrazioni relative per me-IPA utilizzando et-IPA come standard interno. Calcolare le risposte relative dalla transizione di MRM quantificatore per me-IPA (556,6 x 428,7) diviso per la transizione DI gestione record di messaggistica per et-IPA (570.7 . Costruire una curva di calibrazione a 7 livelli utilizzando una funzione quadratica di secondo ordine ponderata 1/x e che ignora l'origine.
- Calcolare la concentrazione di siero(sieroC ) di me-IPA utilizzando la seguente equazione:
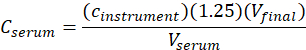
dove lostrumento c è la concentrazione determinata dallo strumento dalla curva di calibrazione in unità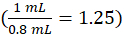 di g/mL, 1,25 è il fattore di diluizione, Vfinale è il volume del campione finale (1,0 mL), e Vsiero è il volume del siero in mL ( 0,050 mL nominale).
di g/mL, 1,25 è il fattore di diluizione, Vfinale è il volume del campione finale (1,0 mL), e Vsiero è il volume del siero in mL ( 0,050 mL nominale).
Risultati
I cromatogrammi ionici rappresentativi da un'analisi me-IPA sono presentati nella Figura 1. Il siero di manguste di controllo (Figura 1A) illustra il tempo di conservazione di et-IPA (analitico surrogato) e l'assenza di me-IPA al tempo di conservazione indicato. L'esempio di controllo qualità (Figura 1B) illustra la separazione di base di me-IPA da et-IPA, nonché le transizioni di quantificatore e ...
Discussione
Il metodo LC-MS/MS sviluppato per gli studi ha utilizzato la selettività del monitoraggio della reazione multipla per quantificare con precisione me-IPA ed et-IPA nel siero di mangusta. La selettività del rilevamento MS/MS ha anche permesso un semplice protocollo di pulizia basato esclusivamente sull'acetonitrile per far precipitare le proteine dal siero prima dell'analisi.
Gli acidi ifenossia sono solubili in ACN ma sono praticamente insolubili in acqua. Per escludere l'acqua dall'estrazion...
Divulgazioni
Gli autori AV e SO sono dipendenti a tempo pieno di un produttore di esche vaccino rabbia orale.
Riconoscimenti
Questa ricerca è stata sostenuta in parte dal programma di ricerca intramurale del Dipartimento dell'Agricoltura degli Stati Uniti, servizio di ispezione della salute animale e vegetale, servizi naturali, programma nazionale di gestione della rabbia e IDT Biologika (Dessau-Rosslau, Germania).
Materiali
| Name | Company | Catalog Number | Comments |
| Acetonitrile, Optima grade | Fisher | A996 | |
| Analytical balance | Mettler Toledo | XS204 | |
| C18 column, 2.1 x 50 mm, 2.5-µm particle size | Waters Corp. | 186003085 | |
| ESI Source | Agilent | G1958-65138 | |
| Ethyl-iophenoxic acid, 97 % | Sigma Aldrich | N/A | Lot MKBP5399V |
| Formic acid, LC/MS grade | Fisher | A117 | |
| LCMS software | Agilent | MassHunter Data Acquisition and Quantitative Analysis | |
| Methyl-iophenoxic acid, 97 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR0709514717 |
| Microanalytical balance | Mettler Toledo | XP6U | |
| Microcentrifuge | Eppendorf | 5415C | |
| MS/MS | Agilent | G6470A | |
| N-Evap | Organomation | 115 | |
| Oral Rabies Vaccine Baits | IDT Biologika, Dessau Rossleau, Germany | N/A | |
| Propyl-iophenoxic acid, 99 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR100612108RR |
| Repeat pipettor | Eppendorf | M4 | |
| Screw-top autosampler vial caps, PTFE-lined | Agilent | 5190-7024 | |
| Sodium chloride, Certified ACS grade | Fisher | S271 | |
| Statistical Software Package | SAS Institute, Cary, North Carolina, USA | N/A | |
| Trifluoroacetic acid, 99 % | Alfa Aesar | L06374 | |
| UPLC | Agilent | 1290 Series | |
| Vortex Mixer | Glas-Col | 099A PV6 | |
| 0.2-mL pipettor tips | Eppendorf | 30089.413 | |
| 0.5-mL pipettor tips | Eppendorf | 30089.421 | |
| 1.5-mL microcentrifuge tubes | Fisher | 14-666-325 | |
| 1250-µL capacity pipette tips | GeneMate | P-1233-1250 | |
| 1-mL pipettor tips | Eppendorf | 30089.43 | |
| 2-mL amber screw-top autosampler vials | Agilent | 5182-0716 | |
| 5-mL pipettor tips | Eppendorf | 30089.456 | |
| 80-position microcentrifuge tube rack | Fisher | 05-541-2 | |
| 8-mL amber vials with PTFE-lined caps | Wheaton | 224754 | |
| 70 % (v/v) isopropanol | Fisher | A459 | |
| 100-1000 µL air displacement pipette | Eppendorf | ES-100 |
Riferimenti
- Nel, L. H., et al. Mongoose rabies in southern Africa: a re-evaluation based on molecular epidemiology. Virus Research. 109 (2), 165-173 (2005).
- Zieger, Z., et al. The phylogeography of rabies in Grenada, West Indies, and implications for control. PLOS Neglected Tropical Diseases. 8 (10), e3251 (2004).
- Monroe, B. P., et al. Rabies surveillance in the United States during 2014. Journal of the American Veterinary Medical Association. 248 (7), 777-788 (2015).
- Slate, D., et al. Status of oral rabies vaccination in wild carnivores in the United States. Virus Research. 111, 68-76 (2005).
- Blanton, J. D., et al. Vaccination of small Asian mongoose (Herpestes javanicus) against rabies. Journal of Wildlife Diseases. 42 (3), 663-666 (2006).
- Vos, A., et al. Oral vaccination of captive small Indian mongoose (Herpestes auropunctatus) against rabies. Journal of Wildlife Diseases. 49 (4), 1033-1036 (2013).
- Berentsen, A. R., Johnson, S. R., VerCauteren, K. C. Evaluation of ONRAB® bait matrix flavor preference by mongoose (Herpestes auropunctatus) in Puerto Rico: Implications for Oral Rabies Vaccination. Caribbean Journal of Science. 48 (1), 52-58 (2014).
- Ortmann, S., et al. Safety studies with the oral rabies virus vaccine strain SPBN GASGAS in the small Indian mongoose (Herpestes auropunctatus). BMC Veterinary Research. 14 (1), 90 (2018).
- Linhart, S. B., et al. A field evaluation of baits for delivering oral rabies vaccines to raccoons (Procyon lotor). Journal of Wildlife Diseases. 30 (2), 185-194 (1994).
- Fry, T. L., Atwood, T., Dunbar, M. R. Evaluation of rhodamine B as a biomarker for raccoons. Human Wildlife Interactions. 4 (2), 275-280 (2010).
- Jones, C., Moller, H., Hamilton, W. A review of potential techniques for identifying individual stoats (Mustela erminea) visiting control or monitoring stations. New Zealand Journal of Zoology. 31 (3), 193-203 (2004).
- de Leeuw, A. N. S., Smith, G. C., Woods, J. A. Use of iophenoxic acid to assess bait uptake by European badgers. Advances in Vertebrate Pest Management. 4, 243-254 (2006).
- Southey, A. K., Sleeman, D. P., Gormley, E. Sulfadimethoxine and rhodamine B as oral biomarkers for European badgers (Meles meles). Journal of Wildlife Diseases. 38 (2), 378-384 (2002).
- Massei, G., Jones, A., Platt, T., Cowan, D. P. Iophenoxic Acid as a Long-Term Marker for Wild Boar. Journal of Wildlife Management. 73 (3), 458-461 (2009).
- Creekmore, T. E., et al. Field evaluation of baits and baiting strategies for delivering oral vaccine to mongooses in Antigua, West Indies. Journal of Wildlife Diseases. 30 (4), 497-505 (1994).
- Creekmore, T. E., Rock, R. E., Hurley, J. A baiting system for delivery of an oral plague vaccine to black-tailed prairie dogs. Journal of Wildlife Diseases. 38 (1), 32-39 (2002).
- Fernandez, J. R. R., Rocke, R. E. Use of Rhodamine B as a biomarker for oral plague vaccination of prairie dogs. Journal of Wildlife Diseases. 47 (3), 765-768 (2011).
- Johnston, J. J., et al. Evaluation and significance of tetracycline stability in rabies vaccine baits. Journal of Wildlife Diseases. 41 (3), 549-558 (2005).
- Algeo, T. P., et al. Oral rabies vaccination variation in tetracycline biomarking among Ohio Raccoons. Journal of Wildlife Diseases. 49 (2), 332-337 (2013).
- Crier, J. K. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 34 (4), 829-834 (1970).
- Fisher, P. Review of using Rhodamine B as a marker for wildlife studies. Wildlife Society Bulletin. 27 (2), 318-329 (1999).
- Knowlton, F. K., Savarie, P. J., Wahlgren, C. E., Hayes, D. J., Shumake, S. A., Bullard, R. W. Physiological marks by coyotes ingesting baits containing iophenoxic acid, Mirex and Rhodamine B. Vertebrate Pest Control and Management Materials. , 141-147 (1987).
- Follmann, E. H., Savarie, P. J., Ritter, D. G., Baer, G. M. Plasma marking of arctic foxes with iophenoxic acid. Journal of Wildlife Diseases. 23 (4), 709-712 (1987).
- Saunders, G., Harris, S., Eason, C. T. Iophenoxic acid as a quantitative bait marker for foxes. Wildlife Research. 20, 297-302 (1993).
- Hadidian, J., et al. Acceptance of simulated oral rabies vaccine baits by urban raccoons. Journal of Wildlife Diseases. 25 (1), 1-9 (1989).
- Sweetapple, P. J., Nugent, G. Iophenoxic acid as a serum marker for red deer (Cervus elaphus scoticus). Wildlife Research. 25, 649-654 (1998).
- Ogilvie, S. C., Eason, C. T. Evaluation of iophenoxic acid and rhodamine B for marking feral ferrets (Mustela furo). New Zealand Journal of Zoology. 25 (2), 105-108 (1998).
- Eason, C. T., Batcheler, D., Frampton, C. M. Comparative pharmacokinetics of iophenoxic acid in cats and brushtail possums. Wildlife Research. 21, 377-380 (1994).
- Fisher, P. M., Marks, C. A. Evaluation of iophenoxic acid as a biomarker for swamp wallabies (Wallabia bicolor). Wildlife Research. 24, 97-103 (1997).
- Baer, G. M., Shaddock, J. H., Hayes, D. J., Savarie, P. Iophenoxic acid as a serum marker in carnivores. Journal of Wildlife Management. 49 (1), 49-51 (1985).
- Spurr, E. B. Iophenoxic acid as a systemic blood marker for assessment of bait acceptance by stoats (Mustela ermine) and weasels (Mustela nivalis). New Zealand Journal of Zoology. 29 (2), 135-142 (2002).
- Mudge, G. H., Strewler, G. J., Desbiens, N., Berndt, W. O., Wade, D. N. Excretion and distribution of iophenoxic acid. Journal of Pharmacology and Experimental Therapeutics. 178 (1), 159-172 (1971).
- Jones, A. High-performance liquid chromatographic determination of iophenoxic acid in serum. Journal of Chromatography B: Biomedical Sciences and Applications. 654 (2), 293-296 (1994).
- Wiles, M. C., Campbell, T. A. Liquid chromatography-electrospray ionization mass spectrometry for direct identification and quantification of iophenoxic acid in serum. Journal of Chromatography B. 832 (1), 144-157 (2006).
- Ballesteros, C., et al. Analysis by LC/ESI-MS of iophenoxic acid derivatives and evaluation as markers of oral baits to deliver pharmaceuticals to wildlife. Journal of Chromatography B. 878 (22), 1997-2002 (2010).
- Purdey, D. C., Petcu, M., King, C. M. A simplified protocol for detecting two systemic bait markers (Rhodamine B and iophenoxic acid) in small mammals. New Zealand Journal of Zoology. 30 (3), 175-184 (2003).
- Tobin, M. E., Koehler, A. E., Sugihara, R. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 60 (1), 202-207 (1996).
- Briscoe, J. A., Syring, R. Techniques for emergency airway and vascular access in special species. Seminars in Avian and Exotic Pet Medicine. 13 (3), 118-131 (2004).
- Eason, C. T., Frampton, C. M. The plasma pharmacokinetics of iophenoxic and iopanoic acids in goat. Xenobiotica. 2 (2), 185-189 (1992).
- Hilton, H. E., Dunn, A. M. S. . Mongooses: their natural history. , (1967).
- Stevens, C. E., Hume, I. D. . Comparative physiology of the vertebrate digestive system. Second edition. , (1995).
- National Rabies Management Program (NRMP). . Oral rabies vaccination draft operations manual. , (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon