Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Análisis de análogos de ácido iophenoxic en pequeña mangosta india (Herpestes Auropunctatus) Sera para su uso como un marcador biológico de vacunación de rabia oral
En este artículo
Resumen
Ofrecimos mongooses placebo cebos de vacuna de rabia oral con ácido etil o metilio-ifenoxico como biomarcador y verificamos la aceptación de cebos utilizando una novedosa cromatografía líquida con espectrometría de masas en tándem (LC-MS/MS) método.
Resumen
La pequeña mangosta india (Herpestes auropunctatus) es un reservorio del virus de la rabia (RABV) en Puerto Rico y comprende más del 70% de los casos de rabia animal reportados anualmente. El control de la circulación rabosa en los embalses de vida silvestre se logra típicamente mediante una estrategia de vacunación oral contra la rabia (ORV). Actualmente no existe ningún programa de ORV de vida silvestre en Puerto Rico. Se han llevado a cabo investigaciones sobre vacunas orales contra la rabia y varios tipos de cebos para la mangosta sin demonios con resultados prometedores. El monitoreo del éxito del ORV se basa en la estimación de la aceptación de cebos por especies objetivo, lo que normalmente implica evaluar un cambio en los anticuerpos neutralizantes rabv (RVNA) después de la vacunación. Esta estrategia puede ser difícil de interpretar en áreas con un programa activo de ORV de vida silvestre o en áreas donde RABV es enzoótico y los niveles de fondo de RVNA están presentes en las especies de reservorios. En tales situaciones, un biomarcador incorporado con la vacuna o la matriz de cebo puede ser útil. Ofrecemos 16 cebos orV placebo de mangostas cautivas que contienen ácido etil-iofenoxic (et-IPA) en concentraciones de 0.4% y 1% dentro del cebo y 0.14% en la matriz de cebo externo. También ofrecimos 12 cebos ORV de mangostas cautivas que contienen ácido metil-iofenoxic (me-IPA) en concentraciones de 0.035%, 0.07% y 0.14% en la matriz de cebo externo. Recogimos una muestra de suero antes de la oferta de cebo y luego semanalmente hasta ocho semanas después de la oferta. Extrajimos ácidos iofenoxicos de los sueros en acetonitrilo y cuantificamos mediante cromatografía líquida/espectrometría de masas. Analizamos los sueros para et-IPA o me-IPA por cromatografía líquida-espectrometría de masas. Encontramos una capacidad de marcado adecuada durante al menos ocho y cuatro semanas para et- y me-IPA, respectivamente. Ambos derivados del IPA podrían ser adecuados para la evaluación sobre el terreno de la ingesta de cebo ORV en mangostas. Debido a la longevidad del marcador en la mangosta sera, se debe tener cuidado de no confundir los resultados mediante el uso de la misma derivada IPA durante evaluaciones consecutivas.
Introducción
El virus de la rabia (RABV) es un lyssavirus de una sola cadena de sentido negativo, y circula entre diversas especies de embalses de vida silvestre dentro de los órdenes Carnivora y Chiroptera. Múltiples especies de mangosta son reservorios de RABV, y la pequeña mangosta india (Herpestes auropunctatus) es el único reservorio en Puerto Rico y otras islas del Caribe en el hemisferio occidental1,2,3 . El control de la circulación rabosa en los embalses de vida silvestre se realiza típicamente a través de una estrategia de vacunación oral contra la rabia (ORV). En los Estados Unidos (EE.UU.), esta actividad de gestión está coordinada por el Programa Nacional de Gestión de La Rabia (NRMP)4del USDA/APHIS/Wildlife Services. Actualmente no existe ningún programa de ORV de vida silvestre en Puerto Rico. Se ha llevado a cabo investigaciones sobre vacunas antirrábicas y varios tipos de cebos para mangostas con resultados prometedores que sugieren que un programa de ORV para mangostas es posible5,6,7,8.
El monitoreo del impacto de la ORV se basa en la estimación de la aceptación del cebo por especies objetivo, lo que normalmente implica evaluar un cambio en la seroprevalencia de anticuerpos RV. Sin embargo, esta estrategia puede ser difícil en áreas con un programa activo de ORV de vida silvestre o en áreas donde rv es enzoótico y los niveles de fondo de anticuerpos neutralizantes RABV (RVNA) están presentes en las especies de reservorios. En tales situaciones, un biomarcador incluido en el cebo o la matriz de cebo externa puede ser útil.
Varios marcadores biológicos se han utilizado para monitorear la adopción de cebos en numerosas especies, incluyendo mapaches (Procyon lotor)9,10,stoats (Mustela ermine)11,12, tejones europeos ( Meles meles) 13, jabalíes (Sus scrofa)14, pequeñas mangostas indias15 y perros de la pradera (Cynomysludovicianus)16,17, entre otros. En los Estados Unidos, los cebos ORV operativos a menudo incluyen un biomarcador de tetraciclina del 1% en la matriz de cebos para monitorear la toma de cebo18,19. Sin embargo, los inconvenientes en el uso de la tetraciclina incluyen una creciente preocupación por la distribución de antibióticos en el medio ambiente y que la detección de tetraciclina es típicamente invasiva, lo que requiere la extracción dental o la destrucción del animal para obtener hueso muestras20. Rhodamine B ha sido evaluado como un marcador en una variedad de tejidos y se puede detectar utilizando luz ultravioleta (UV) y fluorescencia en el cabello y bigotes10,21.
El ácido iofenoxic (IPA) es un polvo blanco y cristalino que se ha utilizado para evaluar el consumo de cebo en coyotes (Canis latrans)22, zorro ártico (Vulpes lagopus)23, zorro rojo (Vulpes vulpes)24, mapaches 9 , 25, jabalí14, venado rojo (Cervus elaphus scoticus)26, tejones europeos12 y hurones (M. furo)27, entre varias otras especies de mamíferos. Los tiempos de retención de IPA varían según la especie de menos de dos semanas en algunos marsupiales28,29, a al menos 26 semanas en ungulados26 y más de 52 semanas en perros domésticos (Canis lupus familiaris)30. Los tiempos de retención también pueden depender de la dosis31. El ácido iofenoxico se une fuertemente a la albúmina sérica y fue detectado históricamente por la medición de los niveles de yodo en sangre32. Este enfoque indirecto fue suplantado por métodos de cromatografía líquida de alto rendimiento (HPLC) para medir directamente las concentraciones de ácido crianoxórico con detección UV33,y finalmente con cromatografía líquida y espectrometría de masas (LCMS) 34,35. Para este estudio, se desarrolló un método de cromatografía líquida altamente sensible y selectiva con espectrometría de masas en tándem (LC-MS/MS) que utiliza monitoreo de reacción múltiple (MRM) para cuantificar dos análogos del ácido iofenoxico. Nuestro objetivo era utilizar este método LC-MS/MS para evaluar la capacidad de marcado de ácido 2-(3-hidroxi-2,4,6-triiodobenzyl)propanoico (metil-IPA o me-IPA) y 2-(3-hidroxi-2,4,6-triiodobenzyl)ácido butanoico (etil-IPA o et-IPA) y cuando se entrega en un ORV (etil-IPA o et-IPA) y cuando se entrega en un ORV (etil-IPA o et-IPA) y cuando se entrega en un ORV cebo a las mangostas cautivas.
Las mangostas fueron capturadas en vivo en trampas de jaulas con salchichas ahumadas disponibles en el mercado y aceite de pescado. Las mangostas se alojaban en jaulas individuales de acero inoxidable de 60 cm x 60 cm x 40 cm y alimentaban una ración diaria de 50 g de comida seca para gatos, complementada dos veces por semana con un muslo de pollo disponible en el comercio. El agua estaba disponible ad libitum. Entregamos dos derivados de IPA, etil-IPA y metil-IPA, a mangostas cautivas en cebos ORV placebo. Todos los cebos estaban compuestos por un blíster de lámina de 28 mm x 20 mm x 9 mm con un recubrimiento externo (en adelante "matriz de cebo") que contiene huevo de pollo en polvo y gelatina (Tabla de materiales). Los cebos contenían 0,7 ml de agua o derivado de IPA y pesaban aproximadamente 3 g, de los cuales 2 g era la matriz de cebo externa.
Ofrecimos 16 mangostas cautivas y-IPA en tres concentraciones: 0,14% (2,8 mg et-IPA en matriz de cebo de 2 g; 3 machos [m], 3 hembras [f]), 0,4% (2,8 mg et-IPA en 0,7 ml de volumen de envase blíster; 3 m, 3f) y 1,0% (7,0 mg de etil-IPA en 0,7 ml de volumen de blíster; , 2f). La dosis global de 2,8 mg corresponde a una dosis de 5 mg/kg27,36 y se basa en un peso medio de mangosta de 560 g en Puerto Rico. Seleccionamos el 1% como la concentración más alta como la investigación sugiere que la aversión al sabor a algunos biomarcadores puede ocurrir en concentraciones >1% en algunas especies37. Sólo ofrecimos la dosis del 1% en el blíster, ya que la floculación impidió que el soluto se disolviera en el disolvente lo suficiente como para incorporarse uniformemente a la matriz de cebo. Un grupo de control (2m, 1f) recibió cebos llenos de agua estéril y sin IPA. Ofrecimos cebos a las mangostas por la mañana (8 a.m.) durante o antes de alimentar su ración de mantenimiento diario. Los restos de cebo fueron retirados después de aproximadamente 24 horas. Recogimos muestras de sangre antes del tratamiento, un día después del tratamiento y luego semanalmente hasta 8 semanas después del tratamiento. Hemos anestesiado las mangostas por inhalación de gas isoflurano y recolectamos hasta 1,0 ml de sangre entera por venopunción de la vena cava craneal como se describe para hurones38. Centrifugamos muestras de sangre entera, transferimos sueros a crioviales y las almacenamos a -80 oC hasta su análisis. No todos los animales fueron muestreados durante todos los períodos de tiempo para minimizar los impactos de las extracciones repetidas de sangre en la salud de los animales. Los animales de control se tomaron muestras el día 0, luego semanalmente hasta 8 semanas después del tratamiento.
Entregamos me-IPA en tres concentraciones: 0,035% (0,7 mg), 0,07% (1,4 mg) y 0,14% (2,8 mg), todo ello incorporado a la matriz de cebo, con 2 machos y 2 hembras por grupo de tratamiento. Dos machos y dos hembras recibieron cebos llenos de agua estéril y sin IPA. Los tiempos de ofrenda de cebo y la anestesia de mangosta se describen anteriormente. Recogimos muestras de sangre antes del tratamiento el día 1, y luego semanalmente hasta 4 semanas después del tratamiento.
Probamos los datos de concentración sérica para la normalidad y los medios estimados para las concentraciones séricas de IPA de diferentes grupos de tratamiento. Utilizamos un modelo mixto lineal para comparar las concentraciones medias de suero y IPA agrupadas entre individuos. El tipo de cebo (matriz/blister pack) era un efecto fijo además del día experimental, mientras que la identificación animal era un efecto aleatorio. Todos los procedimientos se ejecutaron utilizando un software estadístico común (Tablade materiales)y la importancia se evaluó en el valor de 0,05.
Protocolo
Todos los procedimientos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales del Centro Nacional de Investigación de Vida Silvestre del USDA bajo el protocolo de investigación aprobado QA-2597.
NOTA: El siguiente protocolo describe el procedimiento de análisis para detectar el ácido metil-iofenoxic en suero de mangosta. Este método es la versión final de un proceso iterativo que comenzó con el análisis del ácido etil-iofenoxic en suero de mangosta. Durante la evaluación inicial del ácido etil-iofenoxic se realizaron modificaciones menores en los métodos, dando como resultado el protocolo final que se presenta a continuación. Los resultados representativos incluyen los obtenidos durante ambas iteraciones.
1. Preparación de soluciones y normas
- Comprar me-IPA y et-IPA.
- Para la fase móvil A, preparar 1 L de ácido fórmico del 0,1% (v/v) en agua combinando 1 ml de ácido fórmico con 1 L de agua ultrapura (18 M). Para la fase móvil B, preparar 1 L de 0,1% (v/v) ácido fórmico en acetonitrilo (ACN) combinando 1 ml de ácido fórmico con 1 L de ACN.
- Para diluyente, preparar 200 ml de ácido trifluoroacético (TFA) al 0,5% (v/v) en ACN combinando 1 ml de TFA con 200 ml de ACN.
- Preparar soluciones concentradas de ipA de me-IPA y et-IPA en ACN a concentraciones de aproximadamente 1.000 g/ml.
- Pesar aproximadamente 10 mg de me-IPA en un microbalance y registrar la masa en 0.0001 mg. Transfiera cuantitativamente el me-IPA a un matraz volumétrico de 10 ml Clase A utilizando 45 ml de ACN. Sonicar 1 min para disolver todos los sólidos, y luego llevar al volumen con ACN.
- Transfiera 8 ml de cada material a viales de vidrio ámbar de 8 ml con tapas forradas de politetrafluoroetileno (PTFE). Conservar a temperatura ambiente (RT). Transfiera el stock restante a residuos peligrosos.
- Para el stock de 25x-7me-IPA (Tabla 1), prepare un stock de me-IPA en ACN a aproximadamente 200 g/ml. Ejemplo: Transfiera 1 ml del material concentrado me-IPA del paso 1.4.2 a un matraz volumétrico de clase A de 5 ml utilizando una jeringa de vidrio de 1.000 ml. Diluir al volumen con ACN. Transfiera el caldo a un vial de vidrio ámbar de 8 ml con tapa forrada de PTFE. Almacenar en RT.
- Prepare las seis existencias 25x me-IPA adicionales descritas en la Tabla1. Para cada material, combine los volúmenes indicados utilizando un pipeteador repetido en un vial de vidrio ámbar de 8 ml de ámbar con tapa forrada de PTFE. Almacene cada acción en RT.
- Para la población sustituta de 25x, prepare un stock suplente de me-IPA en ACN a aproximadamente 10 g/ml a partir de la población concentrada preparada en el paso 1.4.2. Transfiera 0,100 ml de la culata me-IPA concentrada a un matraz volumétrico de 10 ml clase A utilizando una jeringa de vidrio de 100 ml y, a continuación, diluya al volumen con ACN.
- Transfiera 8 ml a un vial de vidrio ámbar de 8 ml con tapa forrada de PTFE. Almacenar en RT. Transfiera el material restante a residuos peligrosos.
- Prepare 4 existencias que contengan ambos analitos en viales de automuestreador de vidrio atornillado de 2 ml como se describe en la Tabla2.
- Por ejemplo, para preparar el material 4x-7, a un vial de 2 ml, agregue 0,20 ml del material de 25x-7 me-IPA del paso 1.5 utilizando un pipeteador repetido con punta de capacidad de 0,5 ml. Agregue 0,20 ml del material suplente de 25x y-IPA del paso 1.7 utilizando un pipeteador repetido con punta de capacidad de 0,5 ml.
- Añadir 0,85 ml de ACN utilizando un pipeteador repetido con punta de capacidad de 1 ml. Tapar el vial de forma segura e invertir 5x para mezclar.
- Prepare la curva estándar en viales de automuestreador atornillado de 2 ml como se describe en la Tabla3.
- Por ejemplo, para preparar la norma 7 (Std 7), a un vial de 2 ml, añada 0,20 ml del stock 4x-7 del paso 1.8.2 utilizando un pipeteador repetido con punta de capacidad de 0,5 ml. Añadir 0,60 ml de agua DI ultrapura utilizando un pipeteador repetido con punta de capacidad de 1 ml. Tapar el vial de forma segura e invertir 5x para mezclar.
2. Preparación de la muestra
ADVERTENCIA: El personal que realiza este procedimiento debe haber recibido la serie completa de profilaxis previa a la exposición a la rabia y tener un título documentado de anticuerpos contra la rabia por encima de 0,5 UI de un centro médico designado por Salud Ocupacional Federal. El personal debe usar batas de laboratorio y protección ocular en todo momento mientras realiza la extracción. ADVERTENCIA: Realice los pasos 2.3-2.6 en un gabinete de bioseguridad de clase II.
- Para cada muestra, prepare un tubo de microcentrífuga de 1,5 ml que contenga 200 a 300 mg de NaCl.Organice los tubos en un bastidor de plástico de 80 posiciones. Reservar para su uso en el paso 2.6.
NOTA: Se recomienda una micro primicia (u otro dispositivo de medición pequeño) para un gran número de muestras. - Para cada muestra, etiquete dos tubos de microcentrífuga de 1,5 ml: uno como "A" y el otro como "B". Coloque los tubos en un estante de plástico de 80 posiciones.
- Coloque los siguientes materiales y equipos necesarios para la extracción de suero en un armario de bioseguridad de clase II: tubos de microcentrífuga (en bastidores) preparados en los pasos 2.1 y 2.2, un mezclador de vórtice, un pipeteador repetido con 0,5 ml y 5 ml de capacidad, puntas de 100 a 1.000 ol de desplazamiento de aire pipeta con puntas de 1.000 l, recipientes con aproximadamente 100 ml cada uno de agua DI diluyente y ultrapura, y un contenedor de residuos de biorhazard.
- Retire las muestras de suero del almacenamiento congelado y caliente a RT en el gabinete de bioseguridad. Los vórtices mezclan cada muestra de suero antes del muestreo.
- Usando un pipeteador repetido con punta de capacidad de 0,5 ml, dispensar 0,050 ml de suero de mangosta en el tubo "A" y añadir 0,050 ml de material sustituta 25x. A continuación, añadir 0,950 ml de diluyente al tubo "A" utilizando un pipeteador repetido con punta de capacidad de 5 ml. Tapa de forma segura y mezcla de vórtice para 10 x 15 s.
- Dispensar el NaCl prepesado del paso 2.1 en el tubo "A" y la mezcla de vórtice 3x para 8 x 12 s. Limpie las superficies exteriores del bastidor del vial que contiene el tubo "A" usando 70% (v/v) isopropanol.
NOTA: El bastidor de muestras ahora se puede retirar del gabinete de bioseguridad de clase II. - Tubo centrífugo "A" a 12.000 x g durante 1 min para separar las fases acuosa y ACN. Pipeta de 0,80 ml de la fase ACN superior al tubo "B" utilizando una pipeta de desplazamiento de aire de 100 a 1.000 ml. Transfiera la solución restante en el tubo "A" a residuos peligrosos y deseche el tubo vacío en un contenedor de residuos biopeligrosos.
- Retire ACN y TFA del tubo "B" con un flujo suave de N2 gas en un baño de agua de 45 oC.
- Añadir 0,250 ml de ACN al tubo "B" utilizando un pipetador repetido, mezcla de vórtice durante 4 x 5 s, y luego centrifugar brevemente (2 x 4 s) a 12.000 x g para recoger el líquido en la parte inferior del tubo.
- Añadir 0,750 ml de agua DI ultrapura al tubo "B" utilizando un pipetador repetido con punta de capacidad de 5 ml, mezcla de vórtice para 4 x 5 s, y luego centrifugar durante 1 min a 12.000 x g para aclarar la muestra.
- Transfiera 0,75 ml del sobrenadante a un vial de automuestreador utilizando una pipeta de desplazamiento de aire de 1.000 ml. Deseche las puntas de las pipetas en un contenedor de residuos de riesgo biológico.
- Tapa de los viales del automuestreador de forma segura y analizarlos mediante LC-MS/MS (sección 4). Transfiera la solución restante en el tubo "B" a residuos peligrosos y deseche el tubo vacío en un contenedor de residuos biopeligrosos. Deseche todos los residuos biopeligrosos mediante autoclave o incineración.
3. Muestras de control de calidad
ADVERTENCIA: Siga las declaraciones de precaución descritas en la sección 2.
NOTA:El siguiente procedimiento describe el número mínimo de muestras de control de calidad (QC) necesarias para un análisis. Se recomiendan réplicas en cada nivel si hay suficiente suero de mangosta de control disponible.
- Preparar cuatro tubos de microcentrífuga de 1,5 ml que contengan 200 a 300 mg de NaCl. Coloque los tubos en un estante de plástico de 80 posiciones.
- Para cada muestra de control de calidad, etiquete dos tubos de microcentrífuga de 1,5 ml: uno como "A" y el otro como "B". Coloque los tubos en un estante de plástico de 80 posiciones.
- Repita el paso 2.3.
- Retire el suero de mangosta de control del almacenamiento congelado y caliente a RT en el gabinete de bioseguridad. El vórtice mezcla el suero de control antes del muestreo.
- Dispensar 0,050 ml de suero de mangosta de control en los cuatro tubos "A" de 1,5 ml utilizando un pipeteador repetido con punta de capacidad de 0,5 ml.
- Fortalezca cada una de las cuatro muestras de control de calidad especificadas en la Tabla 4 utilizando un pipeteador repetido con punta de capacidad de 0,5 ml. Tapar cada muestra de control de calidad de forma segura y mezcla de vórtice para 10 a 15 s.
- Realice el procedimiento de extracción como se describe en los pasos 2.6 a 2.12.
4. Análisis LC-MS/MS
- Configure el LC-MS/MS con todos los parámetros descritos en el Cuadro5. Encienda el LC-MS/MS y permita que la columna alcance los 70 oC antes de ajustar el caudal a 0,800 ml/min.
- Configure una secuencia en el software de adquisición de datos (Tablade materiales)para inyectar la curva estándar antes y después de cada lote que consista en muestras de control de calidad y muestras desconocidas.
- Inyectar todas las normas y muestras y adquirir cromatógramas de iones MRM utilizando los parámetros enumerados en la Tabla5.
- Después de la finalización de la secuencia, apague el LC-MS/MS y deseche todos los viales del muestreador automático como residuos peligrosos.
5. Cuantificación
- Utilice el software de análisis de datos para generar una curva de calibración de respuestas relativas frente a concentraciones relativas para me-IPA utilizando et-IPA como estándar interno. Calcule las respuestas relativas de la transición mrm cuantificador para me-IPA (556,6 a 428,7) divididas por la transición MRM para et-IPA (570,7 a 442,7). Construya una curva de calibración de 7 niveles utilizando una función cuadrática de segundo orden que se pondera 1/x e ignora el origen.
- Calcule la concentración sérica(sueroC) de me-IPA utilizando la siguiente ecuación:
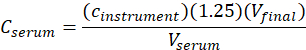
donde el instrumento c es la concentración determinada por el instrumento a partir de la curva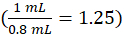 de calibración en unidades de g/ml, 1,25 es el factor de dilución, Vfinal es el volumen final de la muestra (1,0 ml), y suero V es el volumen sérico en ml ( 0,050 ml nominal).
de calibración en unidades de g/ml, 1,25 es el factor de dilución, Vfinal es el volumen final de la muestra (1,0 ml), y suero V es el volumen sérico en ml ( 0,050 ml nominal).
Resultados
En la Figura 1se presentan cromatogramas iónicos representativos de un análisis me-IPA. El suero de mangosta de control (Figura1A)ilustra el tiempo de retención de et-IPA (analito suplente) y la ausencia de me-IPA en el tiempo de retención indicado. La muestra de control de calidad (Figura1B)ilustra la separación de línea de base de me-IPA de et-IPA, así como las transiciones de cuantificador ...
Discusión
El método LC-MS/MS desarrollado para los estudios utilizó la selectividad de la monitorización de reacciones múltiples para cuantificar con precisión me-IPA y et-IPA en suero de mangosta. La selectividad de la detección de MS/MS también permitió un protocolo de limpieza simple que dependía únicamente de acetonitrilo para precipitar proteínas del suero antes del análisis.
Los ácidos iophenoxic son solubles en ACN pero son prácticamente insolubles en agua. Para excluir el agua de l...
Divulgaciones
Los autores AV y SO son empleados a tiempo completo de un fabricante de cebos de vacunas contra la rabia oral.
Agradecimientos
Esta investigación fue apoyada en parte por el programa de investigación intramuros del Departamento de Agricultura, Servicio de Inspección de Sanidad Animal y Vegetal de los Estados Unidos, Servicios de Vida Silvestre, Programa Nacional de Gestión de la Rabia y IDT Biologika (Dessau-Rosslau, Alemania).
Materiales
| Name | Company | Catalog Number | Comments |
| Acetonitrile, Optima grade | Fisher | A996 | |
| Analytical balance | Mettler Toledo | XS204 | |
| C18 column, 2.1 x 50 mm, 2.5-µm particle size | Waters Corp. | 186003085 | |
| ESI Source | Agilent | G1958-65138 | |
| Ethyl-iophenoxic acid, 97 % | Sigma Aldrich | N/A | Lot MKBP5399V |
| Formic acid, LC/MS grade | Fisher | A117 | |
| LCMS software | Agilent | MassHunter Data Acquisition and Quantitative Analysis | |
| Methyl-iophenoxic acid, 97 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR0709514717 |
| Microanalytical balance | Mettler Toledo | XP6U | |
| Microcentrifuge | Eppendorf | 5415C | |
| MS/MS | Agilent | G6470A | |
| N-Evap | Organomation | 115 | |
| Oral Rabies Vaccine Baits | IDT Biologika, Dessau Rossleau, Germany | N/A | |
| Propyl-iophenoxic acid, 99 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR100612108RR |
| Repeat pipettor | Eppendorf | M4 | |
| Screw-top autosampler vial caps, PTFE-lined | Agilent | 5190-7024 | |
| Sodium chloride, Certified ACS grade | Fisher | S271 | |
| Statistical Software Package | SAS Institute, Cary, North Carolina, USA | N/A | |
| Trifluoroacetic acid, 99 % | Alfa Aesar | L06374 | |
| UPLC | Agilent | 1290 Series | |
| Vortex Mixer | Glas-Col | 099A PV6 | |
| 0.2-mL pipettor tips | Eppendorf | 30089.413 | |
| 0.5-mL pipettor tips | Eppendorf | 30089.421 | |
| 1.5-mL microcentrifuge tubes | Fisher | 14-666-325 | |
| 1250-µL capacity pipette tips | GeneMate | P-1233-1250 | |
| 1-mL pipettor tips | Eppendorf | 30089.43 | |
| 2-mL amber screw-top autosampler vials | Agilent | 5182-0716 | |
| 5-mL pipettor tips | Eppendorf | 30089.456 | |
| 80-position microcentrifuge tube rack | Fisher | 05-541-2 | |
| 8-mL amber vials with PTFE-lined caps | Wheaton | 224754 | |
| 70 % (v/v) isopropanol | Fisher | A459 | |
| 100-1000 µL air displacement pipette | Eppendorf | ES-100 |
Referencias
- Nel, L. H., et al. Mongoose rabies in southern Africa: a re-evaluation based on molecular epidemiology. Virus Research. 109 (2), 165-173 (2005).
- Zieger, Z., et al. The phylogeography of rabies in Grenada, West Indies, and implications for control. PLOS Neglected Tropical Diseases. 8 (10), e3251 (2004).
- Monroe, B. P., et al. Rabies surveillance in the United States during 2014. Journal of the American Veterinary Medical Association. 248 (7), 777-788 (2015).
- Slate, D., et al. Status of oral rabies vaccination in wild carnivores in the United States. Virus Research. 111, 68-76 (2005).
- Blanton, J. D., et al. Vaccination of small Asian mongoose (Herpestes javanicus) against rabies. Journal of Wildlife Diseases. 42 (3), 663-666 (2006).
- Vos, A., et al. Oral vaccination of captive small Indian mongoose (Herpestes auropunctatus) against rabies. Journal of Wildlife Diseases. 49 (4), 1033-1036 (2013).
- Berentsen, A. R., Johnson, S. R., VerCauteren, K. C. Evaluation of ONRAB® bait matrix flavor preference by mongoose (Herpestes auropunctatus) in Puerto Rico: Implications for Oral Rabies Vaccination. Caribbean Journal of Science. 48 (1), 52-58 (2014).
- Ortmann, S., et al. Safety studies with the oral rabies virus vaccine strain SPBN GASGAS in the small Indian mongoose (Herpestes auropunctatus). BMC Veterinary Research. 14 (1), 90 (2018).
- Linhart, S. B., et al. A field evaluation of baits for delivering oral rabies vaccines to raccoons (Procyon lotor). Journal of Wildlife Diseases. 30 (2), 185-194 (1994).
- Fry, T. L., Atwood, T., Dunbar, M. R. Evaluation of rhodamine B as a biomarker for raccoons. Human Wildlife Interactions. 4 (2), 275-280 (2010).
- Jones, C., Moller, H., Hamilton, W. A review of potential techniques for identifying individual stoats (Mustela erminea) visiting control or monitoring stations. New Zealand Journal of Zoology. 31 (3), 193-203 (2004).
- de Leeuw, A. N. S., Smith, G. C., Woods, J. A. Use of iophenoxic acid to assess bait uptake by European badgers. Advances in Vertebrate Pest Management. 4, 243-254 (2006).
- Southey, A. K., Sleeman, D. P., Gormley, E. Sulfadimethoxine and rhodamine B as oral biomarkers for European badgers (Meles meles). Journal of Wildlife Diseases. 38 (2), 378-384 (2002).
- Massei, G., Jones, A., Platt, T., Cowan, D. P. Iophenoxic Acid as a Long-Term Marker for Wild Boar. Journal of Wildlife Management. 73 (3), 458-461 (2009).
- Creekmore, T. E., et al. Field evaluation of baits and baiting strategies for delivering oral vaccine to mongooses in Antigua, West Indies. Journal of Wildlife Diseases. 30 (4), 497-505 (1994).
- Creekmore, T. E., Rock, R. E., Hurley, J. A baiting system for delivery of an oral plague vaccine to black-tailed prairie dogs. Journal of Wildlife Diseases. 38 (1), 32-39 (2002).
- Fernandez, J. R. R., Rocke, R. E. Use of Rhodamine B as a biomarker for oral plague vaccination of prairie dogs. Journal of Wildlife Diseases. 47 (3), 765-768 (2011).
- Johnston, J. J., et al. Evaluation and significance of tetracycline stability in rabies vaccine baits. Journal of Wildlife Diseases. 41 (3), 549-558 (2005).
- Algeo, T. P., et al. Oral rabies vaccination variation in tetracycline biomarking among Ohio Raccoons. Journal of Wildlife Diseases. 49 (2), 332-337 (2013).
- Crier, J. K. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 34 (4), 829-834 (1970).
- Fisher, P. Review of using Rhodamine B as a marker for wildlife studies. Wildlife Society Bulletin. 27 (2), 318-329 (1999).
- Knowlton, F. K., Savarie, P. J., Wahlgren, C. E., Hayes, D. J., Shumake, S. A., Bullard, R. W. Physiological marks by coyotes ingesting baits containing iophenoxic acid, Mirex and Rhodamine B. Vertebrate Pest Control and Management Materials. , 141-147 (1987).
- Follmann, E. H., Savarie, P. J., Ritter, D. G., Baer, G. M. Plasma marking of arctic foxes with iophenoxic acid. Journal of Wildlife Diseases. 23 (4), 709-712 (1987).
- Saunders, G., Harris, S., Eason, C. T. Iophenoxic acid as a quantitative bait marker for foxes. Wildlife Research. 20, 297-302 (1993).
- Hadidian, J., et al. Acceptance of simulated oral rabies vaccine baits by urban raccoons. Journal of Wildlife Diseases. 25 (1), 1-9 (1989).
- Sweetapple, P. J., Nugent, G. Iophenoxic acid as a serum marker for red deer (Cervus elaphus scoticus). Wildlife Research. 25, 649-654 (1998).
- Ogilvie, S. C., Eason, C. T. Evaluation of iophenoxic acid and rhodamine B for marking feral ferrets (Mustela furo). New Zealand Journal of Zoology. 25 (2), 105-108 (1998).
- Eason, C. T., Batcheler, D., Frampton, C. M. Comparative pharmacokinetics of iophenoxic acid in cats and brushtail possums. Wildlife Research. 21, 377-380 (1994).
- Fisher, P. M., Marks, C. A. Evaluation of iophenoxic acid as a biomarker for swamp wallabies (Wallabia bicolor). Wildlife Research. 24, 97-103 (1997).
- Baer, G. M., Shaddock, J. H., Hayes, D. J., Savarie, P. Iophenoxic acid as a serum marker in carnivores. Journal of Wildlife Management. 49 (1), 49-51 (1985).
- Spurr, E. B. Iophenoxic acid as a systemic blood marker for assessment of bait acceptance by stoats (Mustela ermine) and weasels (Mustela nivalis). New Zealand Journal of Zoology. 29 (2), 135-142 (2002).
- Mudge, G. H., Strewler, G. J., Desbiens, N., Berndt, W. O., Wade, D. N. Excretion and distribution of iophenoxic acid. Journal of Pharmacology and Experimental Therapeutics. 178 (1), 159-172 (1971).
- Jones, A. High-performance liquid chromatographic determination of iophenoxic acid in serum. Journal of Chromatography B: Biomedical Sciences and Applications. 654 (2), 293-296 (1994).
- Wiles, M. C., Campbell, T. A. Liquid chromatography-electrospray ionization mass spectrometry for direct identification and quantification of iophenoxic acid in serum. Journal of Chromatography B. 832 (1), 144-157 (2006).
- Ballesteros, C., et al. Analysis by LC/ESI-MS of iophenoxic acid derivatives and evaluation as markers of oral baits to deliver pharmaceuticals to wildlife. Journal of Chromatography B. 878 (22), 1997-2002 (2010).
- Purdey, D. C., Petcu, M., King, C. M. A simplified protocol for detecting two systemic bait markers (Rhodamine B and iophenoxic acid) in small mammals. New Zealand Journal of Zoology. 30 (3), 175-184 (2003).
- Tobin, M. E., Koehler, A. E., Sugihara, R. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 60 (1), 202-207 (1996).
- Briscoe, J. A., Syring, R. Techniques for emergency airway and vascular access in special species. Seminars in Avian and Exotic Pet Medicine. 13 (3), 118-131 (2004).
- Eason, C. T., Frampton, C. M. The plasma pharmacokinetics of iophenoxic and iopanoic acids in goat. Xenobiotica. 2 (2), 185-189 (1992).
- Hilton, H. E., Dunn, A. M. S. . Mongooses: their natural history. , (1967).
- Stevens, C. E., Hume, I. D. . Comparative physiology of the vertebrate digestive system. Second edition. , (1995).
- National Rabies Management Program (NRMP). . Oral rabies vaccination draft operations manual. , (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados