Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Analyse von Iophenoxic Acid Analoga in Small Indian Mongoose (Herpestes Auropunctatus) Sera zur Verwendung als orale Tollwut-Impfung Biologischer Marker
In diesem Artikel
Zusammenfassung
Wir boten in Gefangenschaft Mongooses Placebo orale Tollwut-ImpfstoffKöder mit Ethyl- oder Methyl-Iophenoxsäure als Biomarker und verifizierte Köderaufnahme mit einer neuartigen Flüssigchromatographie mit Tandem-Massenspektrometrie (LC-MS/MS) Methode an.
Zusammenfassung
Die kleine indische Gänse (Herpestes auropunctatus) ist ein Reservoir des Tollwutvirus (RABV) in Puerto Rico und umfasst über 70% der jährlich gemeldeten Tollwutfälle. Die Kontrolle des RABV-Kreislaufs in Wildtierreservoirs erfolgt in der Regel durch eine Strategie der oralen Tollwutimpfung (ORV). Derzeit gibt es kein OrV-Programm für Wildtiere in Puerto Rico. Die Forschung an oralen Tollwut-Impfstoffen und verschiedenen Ködertypen für Gänse wurde mit vielversprechenden Ergebnissen durchgeführt. Die Überwachung des Erfolgs von ORV beruht auf der Schätzung der Köderaufnahme durch Zielarten, was in der Regel die Bewertung einer Änderung der RABV-Neutralisierungsantikörper (RVNA) nach der Impfung beinhaltet. Diese Strategie kann in Gebieten mit einem aktiven ORV-Programm für Wildtiere oder in Gebieten, in denen RABV enzootisch ist und die Hintergrundniveaus von RVNA bei Reservoirarten vorhanden sind, schwierig sein. In solchen Situationen kann ein Biomarker, der mit dem Impfstoff oder der Ködermatrix aufgenommen wurde, nützlich sein. Wir boten 16 gefangene Mongos Placebo ORV Köder mit Ethyl-Iophenoxsäure (et-IPA) in Konzentrationen von 0,4% und 1% innerhalb des Köders und 0,14% in der externen Ködermatrix an. Wir boten auch 12 in Gefangenschaft gehaltene Mongos ORV Köder an, die Methyl-Iophenoxsäure (me-IPA) in Konzentrationen von 0,035%, 0,07% und 0,14% in der externen Ködermatrix enthalten. Wir sammelten eine Serumprobe vor dem Köder-Angebot und dann wöchentlich für bis zu acht Wochen Post-Angebot. Wir extrahierten Iophenoxic Säuren aus Seren in Acetonitril und quantifizierten mit flüssiger Chromatographie/Massenspektrometrie. Wir analysierten sera für et-IPA oder me-IPA mittels Flüssigchromatographie-Massenspektrometrie. Wir fanden eine ausreichende Markierungsfähigkeit für mindestens acht bzw. vier Wochen für et- bzw. me-IPA. Beide IPA-Derivate könnten für die Feldbewertung der ORV-Köderaufnahme in Mongos geeignet sein. Aufgrund der Langlebigkeit des Markers in mongoose sera ist darauf zu achten, dass die Ergebnisse nicht durch die Verwendung desselben IPA-Derivats während aufeinander folgender Auswertungen verwirrt werden.
Einleitung
Das Tollwutvirus (RABV) ist ein einsträngiges Lyssavirus mit negativem Sinn und zirkuliert zwischen verschiedenen Tierreservoirarten innerhalb der Ordnungen Carnivora und Chiroptera. Mehrere Arten von Mongoose sind Reservoirs von RABV, und die kleine indische Mongoose (Herpestes auropunctatus) ist das einzige Reservoir in Puerto Rico und anderen karibischen Inseln in der westlichen Hemisphäre1,2,3 . Die Kontrolle der RABV-Zirkulation in Wildtierreservoirs erfolgt in der Regel durch eine Strategie der oralen Tollwutimpfung (ORV). In den Vereinigten Staaten (USA) wird diese Management-Aktivität vom USDA/APHIS/Wildlife Services National Tollwut Management Program (NRMP)4koordiniert. Derzeit gibt es kein OrV-Programm für Wildtiere in Puerto Rico. Die Forschung an Tollwut-Impfstoffen und verschiedenen Ködertypen für Gänse wurde mit vielversprechenden Ergebnissen durchgeführt, die darauf hindeuten, dass ein ORV-Programm für Gänse möglich ist5,6,7,8.
Die Überwachung der Auswirkungen von ORV beruht auf der Schätzung der Köderaufnahme durch Zielarten, was in der Regel die Bewertung einer Veränderung der RV-Antikörperseroprävalenz beinhaltet. Diese Strategie kann jedoch in Gebieten mit aktiven ORV-Programmen für Wildtiere oder in Gebieten, in denen RV enzootisch ist und die Hintergrundniveaus von RABV-neutralisierenden Antikörpern (RVNA) in Reservoir-Arten vorhanden sind, eine Herausforderung darstellen. In solchen Situationen kann ein Biomarker, der im Köder oder in der externen Ködermatrix enthalten ist, nützlich sein.
Verschiedene biologische Marker wurden verwendet, um die Aufnahme von Ködern bei zahlreichen Arten zu überwachen, einschließlich Waschbären (Procyon Lotor)9,10, Stoats (Mustela ermine)11,12, Europäische Dachse ( Meles meles) 13, Wildschweine (Sus scrofa)14, kleine indische Gänse15 und Präriehunde (Cynomysludovicianus)16,17, u.a. In den USA enthalten operative ORV-Köder oft einen 1% Tetracyclin-Biomarker in der Ködermatrix, um die Köderaufnahme18,19zu überwachen. Zu den Nachteilen bei der Verwendung von Tetracyclin gehört jedoch die wachsende Sorge über die Verteilung von Antibiotika in die Umwelt und dass der Nachweis von Tetracyclin typischerweise invasiv ist, was eine Zahnextraktion oder -zerstörung des Tieres erfordert, um Knochen zu erhalten. Proben20. Rhodamine B wurde als Marker in einer Vielzahl von Geweben bewertet und kann mit ultraviolettem (UV) Licht und Fluoreszenz in Haaren und Schnurrhaaren10,21nachgewiesen werden.
Iophenoxsäure (IPA) ist ein weißes, kristallines Pulver, das verwendet wurde, um köderlichen Verbrauch in Kojoten zu bewerten (Canis latrans)22, polarer Fuchs (Vulpes lagopus)23, Rotfuchs (Vulpes vulpes)24, Waschbären 9 , 25, Wildschwein14, Rotwild (Cervus elaphus scoticus)26, Europäische Dachse12 und Frettchen (M. furo)27, unter mehreren anderen Säugetierarten. Retentionszeiten von IPA variiert nach Arten von weniger als zwei Wochen in einigen Beuteltieren28,29, bis mindestens 26 Wochen in Huftieren26 und über 52 Wochen bei Haushunden (Canis lupus familiaris)30. Retentionszeiten können auch dosisabhängigsein 31. Iophenoxsäure bindet stark an Serumalbumin und wurde historisch durch Messung des Jodspiegels im Blut32nachgewiesen. Dieser indirekte Ansatz wurde durch Hochleistungsmethoden zur Flüssigchromatographie (HPLC) zur direkten Messung der Iophenoxsäurekonzentrationen mit UV-Detektion33und schließlich mit Flüssigchromatographie und Massenspektrometrie (LCMS) ersetzt. 34,35. Für diese Studie wurde eine hochempfindliche und selektive Flüssigchromatographie mit Tandem-Massenspektrometrie (LC-MS/MS)-Methode entwickelt, die multiple Reaction Monitoring (MRM) nutzt, um zwei Analoga von Iophenoxsäure zu quantifizieren. Unser Ziel war es, mit dieser LC-MS/MS-Methode die Markierungsfähigkeit von 2-(3-Hydroxy-2,4,6-Triiodobenzyl)Propansäure (Methyl-IPA oder me-IPA) und 2-(3-hydroxy-2,4,6-triiodobenzyl)butansäure (ethyl-IPA oder et-IPA) und Köder an gefangene Gänse.
Die Gänse wurden in Käfigfallen, die mit handelsüblichen Räucherwürsten und Fischöl geködert wurden, live gefangen. Die Gänse wurden in einzelnen 60 cm x 60 cm x 40 cm Edelstahlkäfigen untergebracht und mit einer täglichen Ration von 50 g gewerblichem Trockenkatzenfutter von 50 g gefüttert, zweimal pro Woche mit einem handelsüblichen Hühnerschenkel ergänzt. Wasser war verfügbar ad libitum. Wir lieferten zwei Derivate von IPA, Ethyl-IPA und Methyl-IPA, an gefangene Mongos in Placebo-ORV-Ködern. Alle Köder setzten sich aus einer 28 mm x 20 mm x 9 mm Folienblisterpackung mit einer externen Beschichtung(nachfolgend "Ködermatrix") mit pulverisiertem Hühnerei und Gelatine (Materialtabelle) zusammen. Köder enthielten 0,7 ml Wasser oder IPA-Derivat und wogen etwa 3 g, von denen 2 g die externe Ködermatrix war.
Wir boten 16 in Gefangenschaft gehaltene Mongooses et-IPA in drei Konzentrationen an: 0,14% (2,8 mg et-IPA in 2 g Ködermatrix; 3 Männchen [m], 3 Weibchen [f]), 0,4% (2,8 mg et-IPA in 0,7 ml Blisterpackungvolumen; 3m, 3f) und 1,0% (7,0 mg Ethyl-IPA in 0,7 ml Blisterpackung; 2 , 2f). Die Gesamtdosis von 2,8 mg entspricht einer Dosis von 5 mg/kg27,36 und basiert auf einem durchschnittlichen Gänsegewicht von 560 g in Puerto Rico. Wir wählten 1% als höchste Konzentration, da die Forschung darauf hindeutet, dass Geschmacksaversion zu einigen Biomarkern in Konzentrationen von >1% bei einigen Arten auftreten kann37. Wir boten nur die 1%-Dosis in der Blisterpackung an, da die Flockung verhinderte, dass sich die Lösung im Lösungsmittel ausreichend auflöste, um gleichmäßig in die Ködermatrix eingearbeitet zu werden. Eine Kontrollgruppe (2m, 1f) erhielt Köder, die mit sterilem Wasser und ohne IPA gefüllt waren. Wir boten Den Gänsen morgens (ca. 8 Uhr) während oder vor der Fütterung ihrer täglichen Pflegeration Köder an. Köderreste wurden nach etwa 24 Stunden entfernt. Wir sammelten Blutproben vor der Behandlung, einen Tag nach der Behandlung und dann wöchentlich bis zu 8 Wochen nach der Behandlung. Wir anästhetisierten Mongooses durch Einatmen von Isoflurangas und sammelten bis zu 1,0 ml Vollblut durch Venipunktion der Schädelvenenhöhle, wie für Frettchen beschrieben38. Wir zentrifugierten Vollblutproben, übertrugen Seren auf Kryovials und lagerten sie bis zur Analyse bei -80 °C. Nicht alle Tiere wurden in allen Zeiträumen beprobt, um die Auswirkungen wiederholter Blutentnahmen auf die Gesundheit der Tiere zu minimieren. Kontrolltiere wurden am Tag 0, dann wöchentlich für bis zu 8 Wochen nach der Behandlung beprobt.
Wir lieferten me-IPA in drei Konzentrationen: 0,035% (0,7 mg), 0,07% (1,4 mg) und 0,14% (2,8 mg), alle in die Ködermatrix integriert, mit 2 Männern und 2 Frauen pro Behandlungsgruppe. Zwei Männchen und zwei Weibchen erhielten Köder, die mit sterilem Wasser und ohne IPA gefüllt waren. Köder, die Zeiten und Mongooseanästhesie anbieten, werden oben beschrieben. Wir sammelten Blutproben vor der Behandlung am ersten Tag, und dann wöchentlich bis zu 4 Wochen nach der Behandlung.
Wir haben Serumkonzentrationsdaten auf Normalität und geschätzte Mittel für Serum-IPA-Konzentrationen verschiedener Behandlungsgruppen getestet. Wir verwendeten ein lineares gemischtes Modell, um mittlere Serum- und IPA-Konzentrationen zu vergleichen, die über Individuen gepoolt wurden. Der Ködertyp (Matrix/Blisterpackung) war neben dem Versuchstag ein fester Effekt, während die tierische ID ein Zufallseffekt war. Alle Prozeduren wurden mit einer gemeinsamen statistischen Software (Tabelle der Materialien) durchgeführt und die Signifikanz wurde mit 0,05 bewertet.
Protokoll
Alle Verfahren wurden vom institutionellen Animal Care and Use Committee des USDA National Wildlife Research Center gemäß dem genehmigten Forschungsprotokoll QA-2597 genehmigt.
HINWEIS: Das folgende Protokoll beschreibt das Analyseverfahren zum Nachweis von Methyl-Iophenoxsäure im Mongooseserum. Diese Methode ist die endgültige Version eines iterativen Prozesses, der mit der Analyse von Ethyl-Iophenoxsäure in Mongooseserum begann. Bei der ersten Bewertung von Ethyl-Iophenoxsäure wurden geringfügige Änderungen an den Methoden vorgenommen, was zu dem nachstehend vorgestellten endgültigen Protokoll führte. Repräsentative Ergebnisse umfassen die Ergebnisse, die während beider Iterationen erzielt wurden.
1. Erstellung von Lösungen und Standards
- Kaufen Sie me-IPA und et-IPA.
- Für die mobile Phase A 1 L 0,1% (v/v) Ameisensäure in Wasser vorbereiten, indem 1 ml Ameisensäure mit 1 L Reinstwasser (ca. 18 Mio. USD) kombiniert werden. Für die mobile Phase B 1 L 0,1% (v/v) Ameisensäure in Acetonitril (ACN) vorbereiten, indem 1 ml Ameisensäure mit 1 L ACN kombiniert werden.
- Für Verdünnungsmittel 200 ml 0,5% (v/v) Trifluoressigsäure (TFA) in ACN vorbereiten, indem 1 ml TFA mit 200 ml ACN kombiniert werden.
- Bereiten Sie konzentrierte IPA-Lagerlösungen von me-IPA und et-IPA in ACN in Konzentrationen von ca. 1.000 g/ml vor.
- Wiegen Sie ca. 10 mg me-IPA auf einer Mikrowaage und erfassen Sie die Masse auf 0,0001 mg. Übertragen Sie den me-IPA mit 45 ml ACN quantitativ auf einen 10 ml-Volumenkolben der Klasse A. 1 min beschallen, um alle Feststoffe aufzulösen, und dann mit ACN auf Volumen bringen.
- Übertragen Sie 8 ml pro Vorrat auf Bernstein 8 ml Glasfläschchen mit Poly-Tetrafluorethylen (PTFE)-gefütterten Kappen. Bei Raumtemperatur (RT) lagern. Den Restbestand in gefährliche Abfälle übertragen.
- Für den 25x-7 me-IPA Bestand (Tabelle 1) einen Bestand von me-IPA in ACN bei ca. 200 g/ml vorbereiten. Beispiel: Übertragen Sie 1 ml des me-IPA-Konzentrierten Lagerbestands von Schritt 1.4.2 auf einen 5 ml Volumenkolben der Klasse A mit einer 1.000 l Glasspritze. Mit ACN auf Volumen verdünnen. Übertragen Sie den Vorrat auf eine bernsteinfarbene 8 ml Glasdurchstechflasche mit PTFE-gefütterter Kappe. Bei RT aufbewahren.
- Bereiten Sie die sechs zusätzlichen 25x me-IPA-Bestände vor, die in Tabelle 1beschrieben sind. Kombinieren Sie für jeden Vorrat die angegebenen Volumina mit einem Repeat Pipettor in einer bernsteinfarbenen 8 ml Bernsteinglasdurchstechflasche mit PTFE-gefütterter Kappe. Bewahren Sie jeden Bestand bei RT auf.
- Für den 25-fachen Ersatzbestand einen Ersatzbestand von me-IPA in ACN zu ca. 10 g/ml aus dem in Schritt 1.4.2 hergestellten konzentrierten Bestand zubereiten. 0,100 ml des konzentrierten me-IPA-Bestands mit einer 100-L-Glasspritze auf einen 10 ml-Volumenkolben der Klasse A übertragen und dann mit ACN zu Volumen verdünnen.
- Übertragen Sie 8 ml auf eine bernsteinfarbene 8-ml-Glasdurchstechflasche mit PTFE-gefütterter Kappe. Lagern Sie bei RT. Übertragen Sie den Restbestand in gefährliche Abfälle.
- 4x Bestände mit beiden Analyten in 2 ml Schraubglas-Autosampler-Fläschchen vorbereiten, wie in Tabelle 2beschrieben.
- Um beispielsweise den Lagerbestand 4x-7 auf eine 2 ml Durchstechflasche vorzubereiten, fügen Sie 0,20 ml des 25x-7 me-IPA-Lagers ab Schritt 1.5 mit einem Repeat Pipettor mit 0,5 ml Fassungsweite hinzu. Fügen Sie 0,20 ml des 25-fachen Ersatz-et-IPA-Bestands aus Schritt 1.7 mit einem Repeat Pipettor mit 0,5 ml Kapazitätsspitze hinzu.
- Fügen Sie 0,85 ml ACN mit einem Repeat Pipettor mit 1 ml Kapazitätsspitze hinzu. Die Durchstechflasche sicher und 5x invertieren, um sie zu mischen.
- Bereiten Sie die Standardkurve in 2 ml Schraub-Top-Autosampler-Fläschchen wie in Tabelle 3beschrieben vor.
- Um beispielsweise Standard 7 (Std 7) auf eine 2-ml-Durchstechflasche vorzubereiten, fügen Sie 0,20 ml des 4x-7 Stocks ab Schritt 1.8.2 mit einem Wiederholtpipettor mit 0,5 ml Fassungsgeld hinzu. Fügen Sie 0,60 ml reines DI-Wasser mit einem Repeat Pipettor mit 1 ml Tragfähigkeitsspitze hinzu. Die Durchstechflasche sicher und 5x invertieren, um sie zu mischen.
2. Probenvorbereitung
VORSICHT: Das Personal, das dieses Verfahren durchführt, muss die vollständige Serie von Tollwut-Präexpositionsprophylaxe erhalten haben und einen dokumentierten Tollwut-Antikörper-Titer über 0,5 IE von einer vom Bundesamt für Arbeitsmedizin benannten medizinischen Einrichtung erhalten haben. Das Personal muss bei der Extraktion jederzeit Labormäntel und Augenschutz tragen. VORSICHT: Führen Sie die Schritte 2.3-2.6 in einem Biosicherheitsschrank der Klasse II aus.
- Für jede Probe ein 1,5 ml Mikrozentrifugenrohr mit 200 bis 300 mg NaCl vorbereiten. Zur Verwendung in Schritt 2.6 beiseite stellen.
HINWEIS: Für eine große Anzahl von Proben wird ein Mikroschaufel (oder ein anderes kleines Messgerät) empfohlen. - Etikettieren Sie für jede Probe zwei 1,5 ml Mikrozentrifugenrohre: eine als "A" und die andere als "B". Ordnen Sie die Rohre in einem 80-Positionen-Kunststoff-Rack an.
- Stellen Sie die folgenden Materialien und Ausrüstungen für die Serumextraktion in einen Biosicherheitsschrank der Klasse II: Mikrozentrifugenrohre (in Racks) in den Schritten 2.1 und 2.2, einen Wirbelmischer, Repeat Pipettiergerät mit 0,5 ml und 5 ml Tragfähigkeitsspitzen, 100 x 1.000 l Luftverschiebung Pipetten mit 1.000 L-Spitzen, Behältern mit je ca. 100 ml Verdünnungs- und Ultrarinluden-DI-Wasser und einem Biogefährdungsbehälter.
- Serumproben aus der Tiefkühllagerung entfernen und im Biosicherheitsschrank auf RT warm erwärmen. Wirbel mischen Sie jede Serumprobe vor der Probenahme.
- Mit einem Repeat Pipettor mit 0,5 ml Tragfähigkeitsspitze 0,050 ml Mongoserum in Rohr "A" geben und 0,050 ml 25x Ersatzmaterial hinzufügen. Dann 0,950 ml Verdünnungsmittel in Rohr "A" mit einem Repeat Pipettor mit 5 ml Tragfähigkeit Spitze hinzufügen. Kappe sicher und Wirbel-Mix für 10-15 s.
- Geben Sie den vorgewogenen NaCl von Schritt 2.1 in das Rohr "A" und Wirbelmischung 3x für 8-12 s. Wischen Sie die Außenflächen des Durchstechflascher mit Rohr "A" mit 70% (v/v) Isopropanol nach unten.
HINWEIS: Das Musterregal kann nun aus dem Biosicherheitsschrank der Klasse II entfernt werden. - Zentrifugenrohr "A" bei 12.000 x g für 1 min, um die wässrige und ACN-Phase zu trennen. Pipette 0,80 ml der oberen ACN-Phase zu Rohr "B" mit einer Luftverschiebungspipette von 100 x 1.000 l. Die restliche Lösung in Rohr "A" in gefährliche Abfälle geben und das leere Rohr in einem biogefährlichen Abfallbehälter entsorgen.
- Entfernen Sie ACN und TFA aus Rohr "B" mit einem sanften Fluss von N2-Gas in einem 45 °C Wasserbad.
- Fügen Sie 0,250 ml ACN in das Rohr "B" mit einem Repeat Pipettor, Wirbelmischung für 4 x 5 s, und dann Zentrifugieren sie kurz (2 x 4 s) bei 12.000 x g, um die Flüssigkeit im Boden des Rohres zu sammeln.
- Fügen Sie 0,750 ml reines DI-Wasser in das Rohr "B" mit einem Repeat Pipettor mit 5 ml Fassungsgeld, Wirbelmischung für 4 x 5 s und dann Zentrifuge für 1 min bei 12.000 x g zur Klärung der Probe hinzu.
- Übertragen Sie 0,75 ml des Überstandes mit einer Luftverdrängungspipette von 1.000 l auf eine Autosampler-Durchstechflasche. Pipettenspitzen in Biohazard-Abfallbehältern entsorgen.
- Cap Autosampler Fläschchen sicher und analysieren durch LC-MS/MS (Abschnitt 4). Die restliche Lösung in Rohr "B" in gefährliche Abfälle geben und das leere Rohr in einen Bio-Abfallbehälter entsorgen. Entsorgen Sie alle biogefährlichen Abfälle durch Autoklavieren oder Verbrennung.
3. Qualitätskontrollproben
VORSICHT: Befolgen Sie die in Abschnitt 2 beschriebenen Vorsichtshinweise.
ANMERKUNG:Das folgende Verfahren beschreibt die Mindestanzahl von QC-Proben (Quality Control), die für eine Analyse erforderlich sind. Replikationen auf jeder Ebene werden empfohlen, wenn ausreichend Kontrollmongooseserum verfügbar ist.
- Bereiten Sie vier 1,5 ml Mikrozentrifugenröhrchen vor, die 200 bis 300 mg NaCl enthalten. Ordnen Sie die Rohre in einem 80-Positionen-Kunststoff-Rack an.
- Etikettieren Sie für jede QC-Probe zwei 1,5 ml Mikrozentrifugenrohre: eine als "A" und die andere als "B". Ordnen Sie die Rohre in einem 80-Positionen-Kunststoff-Rack an.
- Wiederholen Sie Schritt 2.3.
- Entfernen Sie das Kontrollmangustonserum aus der gefrorenen Lagerung und wärmen Sie sich im Biosicherheitsschrank auf RT. Vortex mischen das Steuerserum vor der Probenahme.
- Geben Sie 0,050 ml Kontrollmangustenserum in die vier 1,5-ml-"A"-Rohre mit einem Repeat Pipettor mit 0,5 ml Fassungshöhe.
- Befestigen Sie jede der vier QC-Proben gemäß Tabelle 4 mit einem Repeat Pipettor mit 0,5 ml Kapazitätsspitze. Jede QC-Probe sicher und Wirbelmischung für 10-15 s.
- Führen Sie das Extraktionsverfahren wie in den Schritten 2.6-2.12 beschrieben aus.
4. LC-MS/MS-Analyse
- Konfigurieren Sie den LC-MS/MS mit allen in Tabelle 5beschriebenen Parametern. Schalten Sie den LC-MS/MS ein und lassen Sie die Säule 70 °C erreichen, bevor Sie den Durchfluss auf 0,800 ml/min einstellen.
- Richten Sie eine Sequenz in der Datenerfassungssoftware (Materialtabelle) ein, um die Standardkurve vor und nach jeder Charge zu injizieren, die aus Qualitätskontrollproben und unbekannten Proben besteht.
- Injizieren Sie alle Normen und Proben und erfassen Sie MRM-Ionenchromatogramme anhand der in Tabelle 5aufgeführten Parameter.
- Schalten Sie nach Abschluss der Sequenz den LC-MS/MS aus und entsorgen Sie alle Autosampler-Fläschchen als Sondermüll.
5. Quantifizierung
- Verwenden Sie die Datenanalyse-Software, um eine Kalibrierungskurve relativer Antworten im Vergleich zu relativen Konzentrationen für me-IPA zu generieren, die et-IPA als internen Standard verwendet. Berechnen Sie die relativen Antworten aus dem MrM-Übergang des Quantifiers für me-IPA (556,6 x 428,7) geteilt durch den MRM-Übergang für et-IPA (570,7 x 442,7). Erstellen Sie eine 7-stufige Kalibrierkurve mit einer quadratischen Funktion zweiter Ordnung, die 1/x gewichtet ist und den Ursprung ignoriert.
- Berechnen Sie die Serumkonzentration(C-Serum) von me-IPA mit der folgenden Gleichung:
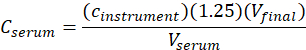
wobeic-Instrument die vom Gerät aus der Kalibrierkurve ermittelte Konzentration in Einheiten von g/ml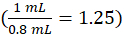 ist, 1,25 der Verdünnungsfaktor, V-Endwert das endgültige Probenvolumen (1,0 ml) und VSerum das Serumvolumen in ml ( 0,050 ml nominal).
ist, 1,25 der Verdünnungsfaktor, V-Endwert das endgültige Probenvolumen (1,0 ml) und VSerum das Serumvolumen in ml ( 0,050 ml nominal).
Ergebnisse
Repräsentative Ionenchromatogramme aus einer Me-IPA-Analyse sind in Abbildung 1dargestellt. Das Kontrollmongooseserum (Abbildung 1A) zeigt die Retentionszeit von et-IPA (Ersatzanalyt) und das Fehlen von me-IPA zur angegebenen Retentionszeit. Die Qualitätskontrollstichprobe (Abbildung 1B) veranschaulicht die basislinienliche Trennung von me-IPA von et-IPA sowie die Quantifizierer- und Qualifizierer?...
Diskussion
Die für die Studien entwickelte LC-MS/MS-Methode nutzte die Selektivität der Mehrfachreaktionsüberwachung, um me-IPA und et-IPA im Mongooseserum genau zu quantifizieren. Die Selektivität der MS/MS-Erkennung ermöglichte auch ein einfaches Bereinigungsprotokoll, das sich ausschließlich auf Acetonitril stützt, um Proteine aus Demerum vor der Analyse zu fällen.
Iophenoxsäuren sind in ACN löslich, aber praktisch unlöslich in Wasser. Um Wasser aus der ACN-Extraktion auszuschließen, wurde...
Offenlegungen
Die Autoren AV und SO sind hauptamtliche Mitarbeiter eines Herstellers von oralen Tollwut-Impfstoffködern.
Danksagungen
Diese Forschung wurde zum Teil durch das intramurale Forschungsprogramm des US Department of Agriculture, Animal and Plant Health Inspection Service, Wildlife Services, National Tollwut Management Program und IDT Biologika (Dessau-Roßlau, Deutschland) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetonitrile, Optima grade | Fisher | A996 | |
| Analytical balance | Mettler Toledo | XS204 | |
| C18 column, 2.1 x 50 mm, 2.5-µm particle size | Waters Corp. | 186003085 | |
| ESI Source | Agilent | G1958-65138 | |
| Ethyl-iophenoxic acid, 97 % | Sigma Aldrich | N/A | Lot MKBP5399V |
| Formic acid, LC/MS grade | Fisher | A117 | |
| LCMS software | Agilent | MassHunter Data Acquisition and Quantitative Analysis | |
| Methyl-iophenoxic acid, 97 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR0709514717 |
| Microanalytical balance | Mettler Toledo | XP6U | |
| Microcentrifuge | Eppendorf | 5415C | |
| MS/MS | Agilent | G6470A | |
| N-Evap | Organomation | 115 | |
| Oral Rabies Vaccine Baits | IDT Biologika, Dessau Rossleau, Germany | N/A | |
| Propyl-iophenoxic acid, 99 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR100612108RR |
| Repeat pipettor | Eppendorf | M4 | |
| Screw-top autosampler vial caps, PTFE-lined | Agilent | 5190-7024 | |
| Sodium chloride, Certified ACS grade | Fisher | S271 | |
| Statistical Software Package | SAS Institute, Cary, North Carolina, USA | N/A | |
| Trifluoroacetic acid, 99 % | Alfa Aesar | L06374 | |
| UPLC | Agilent | 1290 Series | |
| Vortex Mixer | Glas-Col | 099A PV6 | |
| 0.2-mL pipettor tips | Eppendorf | 30089.413 | |
| 0.5-mL pipettor tips | Eppendorf | 30089.421 | |
| 1.5-mL microcentrifuge tubes | Fisher | 14-666-325 | |
| 1250-µL capacity pipette tips | GeneMate | P-1233-1250 | |
| 1-mL pipettor tips | Eppendorf | 30089.43 | |
| 2-mL amber screw-top autosampler vials | Agilent | 5182-0716 | |
| 5-mL pipettor tips | Eppendorf | 30089.456 | |
| 80-position microcentrifuge tube rack | Fisher | 05-541-2 | |
| 8-mL amber vials with PTFE-lined caps | Wheaton | 224754 | |
| 70 % (v/v) isopropanol | Fisher | A459 | |
| 100-1000 µL air displacement pipette | Eppendorf | ES-100 |
Referenzen
- Nel, L. H., et al. Mongoose rabies in southern Africa: a re-evaluation based on molecular epidemiology. Virus Research. 109 (2), 165-173 (2005).
- Zieger, Z., et al. The phylogeography of rabies in Grenada, West Indies, and implications for control. PLOS Neglected Tropical Diseases. 8 (10), e3251 (2004).
- Monroe, B. P., et al. Rabies surveillance in the United States during 2014. Journal of the American Veterinary Medical Association. 248 (7), 777-788 (2015).
- Slate, D., et al. Status of oral rabies vaccination in wild carnivores in the United States. Virus Research. 111, 68-76 (2005).
- Blanton, J. D., et al. Vaccination of small Asian mongoose (Herpestes javanicus) against rabies. Journal of Wildlife Diseases. 42 (3), 663-666 (2006).
- Vos, A., et al. Oral vaccination of captive small Indian mongoose (Herpestes auropunctatus) against rabies. Journal of Wildlife Diseases. 49 (4), 1033-1036 (2013).
- Berentsen, A. R., Johnson, S. R., VerCauteren, K. C. Evaluation of ONRAB® bait matrix flavor preference by mongoose (Herpestes auropunctatus) in Puerto Rico: Implications for Oral Rabies Vaccination. Caribbean Journal of Science. 48 (1), 52-58 (2014).
- Ortmann, S., et al. Safety studies with the oral rabies virus vaccine strain SPBN GASGAS in the small Indian mongoose (Herpestes auropunctatus). BMC Veterinary Research. 14 (1), 90 (2018).
- Linhart, S. B., et al. A field evaluation of baits for delivering oral rabies vaccines to raccoons (Procyon lotor). Journal of Wildlife Diseases. 30 (2), 185-194 (1994).
- Fry, T. L., Atwood, T., Dunbar, M. R. Evaluation of rhodamine B as a biomarker for raccoons. Human Wildlife Interactions. 4 (2), 275-280 (2010).
- Jones, C., Moller, H., Hamilton, W. A review of potential techniques for identifying individual stoats (Mustela erminea) visiting control or monitoring stations. New Zealand Journal of Zoology. 31 (3), 193-203 (2004).
- de Leeuw, A. N. S., Smith, G. C., Woods, J. A. Use of iophenoxic acid to assess bait uptake by European badgers. Advances in Vertebrate Pest Management. 4, 243-254 (2006).
- Southey, A. K., Sleeman, D. P., Gormley, E. Sulfadimethoxine and rhodamine B as oral biomarkers for European badgers (Meles meles). Journal of Wildlife Diseases. 38 (2), 378-384 (2002).
- Massei, G., Jones, A., Platt, T., Cowan, D. P. Iophenoxic Acid as a Long-Term Marker for Wild Boar. Journal of Wildlife Management. 73 (3), 458-461 (2009).
- Creekmore, T. E., et al. Field evaluation of baits and baiting strategies for delivering oral vaccine to mongooses in Antigua, West Indies. Journal of Wildlife Diseases. 30 (4), 497-505 (1994).
- Creekmore, T. E., Rock, R. E., Hurley, J. A baiting system for delivery of an oral plague vaccine to black-tailed prairie dogs. Journal of Wildlife Diseases. 38 (1), 32-39 (2002).
- Fernandez, J. R. R., Rocke, R. E. Use of Rhodamine B as a biomarker for oral plague vaccination of prairie dogs. Journal of Wildlife Diseases. 47 (3), 765-768 (2011).
- Johnston, J. J., et al. Evaluation and significance of tetracycline stability in rabies vaccine baits. Journal of Wildlife Diseases. 41 (3), 549-558 (2005).
- Algeo, T. P., et al. Oral rabies vaccination variation in tetracycline biomarking among Ohio Raccoons. Journal of Wildlife Diseases. 49 (2), 332-337 (2013).
- Crier, J. K. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 34 (4), 829-834 (1970).
- Fisher, P. Review of using Rhodamine B as a marker for wildlife studies. Wildlife Society Bulletin. 27 (2), 318-329 (1999).
- Knowlton, F. K., Savarie, P. J., Wahlgren, C. E., Hayes, D. J., Shumake, S. A., Bullard, R. W. Physiological marks by coyotes ingesting baits containing iophenoxic acid, Mirex and Rhodamine B. Vertebrate Pest Control and Management Materials. , 141-147 (1987).
- Follmann, E. H., Savarie, P. J., Ritter, D. G., Baer, G. M. Plasma marking of arctic foxes with iophenoxic acid. Journal of Wildlife Diseases. 23 (4), 709-712 (1987).
- Saunders, G., Harris, S., Eason, C. T. Iophenoxic acid as a quantitative bait marker for foxes. Wildlife Research. 20, 297-302 (1993).
- Hadidian, J., et al. Acceptance of simulated oral rabies vaccine baits by urban raccoons. Journal of Wildlife Diseases. 25 (1), 1-9 (1989).
- Sweetapple, P. J., Nugent, G. Iophenoxic acid as a serum marker for red deer (Cervus elaphus scoticus). Wildlife Research. 25, 649-654 (1998).
- Ogilvie, S. C., Eason, C. T. Evaluation of iophenoxic acid and rhodamine B for marking feral ferrets (Mustela furo). New Zealand Journal of Zoology. 25 (2), 105-108 (1998).
- Eason, C. T., Batcheler, D., Frampton, C. M. Comparative pharmacokinetics of iophenoxic acid in cats and brushtail possums. Wildlife Research. 21, 377-380 (1994).
- Fisher, P. M., Marks, C. A. Evaluation of iophenoxic acid as a biomarker for swamp wallabies (Wallabia bicolor). Wildlife Research. 24, 97-103 (1997).
- Baer, G. M., Shaddock, J. H., Hayes, D. J., Savarie, P. Iophenoxic acid as a serum marker in carnivores. Journal of Wildlife Management. 49 (1), 49-51 (1985).
- Spurr, E. B. Iophenoxic acid as a systemic blood marker for assessment of bait acceptance by stoats (Mustela ermine) and weasels (Mustela nivalis). New Zealand Journal of Zoology. 29 (2), 135-142 (2002).
- Mudge, G. H., Strewler, G. J., Desbiens, N., Berndt, W. O., Wade, D. N. Excretion and distribution of iophenoxic acid. Journal of Pharmacology and Experimental Therapeutics. 178 (1), 159-172 (1971).
- Jones, A. High-performance liquid chromatographic determination of iophenoxic acid in serum. Journal of Chromatography B: Biomedical Sciences and Applications. 654 (2), 293-296 (1994).
- Wiles, M. C., Campbell, T. A. Liquid chromatography-electrospray ionization mass spectrometry for direct identification and quantification of iophenoxic acid in serum. Journal of Chromatography B. 832 (1), 144-157 (2006).
- Ballesteros, C., et al. Analysis by LC/ESI-MS of iophenoxic acid derivatives and evaluation as markers of oral baits to deliver pharmaceuticals to wildlife. Journal of Chromatography B. 878 (22), 1997-2002 (2010).
- Purdey, D. C., Petcu, M., King, C. M. A simplified protocol for detecting two systemic bait markers (Rhodamine B and iophenoxic acid) in small mammals. New Zealand Journal of Zoology. 30 (3), 175-184 (2003).
- Tobin, M. E., Koehler, A. E., Sugihara, R. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 60 (1), 202-207 (1996).
- Briscoe, J. A., Syring, R. Techniques for emergency airway and vascular access in special species. Seminars in Avian and Exotic Pet Medicine. 13 (3), 118-131 (2004).
- Eason, C. T., Frampton, C. M. The plasma pharmacokinetics of iophenoxic and iopanoic acids in goat. Xenobiotica. 2 (2), 185-189 (1992).
- Hilton, H. E., Dunn, A. M. S. . Mongooses: their natural history. , (1967).
- Stevens, C. E., Hume, I. D. . Comparative physiology of the vertebrate digestive system. Second edition. , (1995).
- National Rabies Management Program (NRMP). . Oral rabies vaccination draft operations manual. , (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten