このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
小さなインドのマングースにおけるイオフェノキ酸類似体の分析 (ヘルペステス・オーロプンクタトゥス)経口狂犬病ワクチン接種生物学的マーカーとしての使用のためのセラ
要約
バイオマーカーとしてエチルまたはメチルイオフェノシン酸を用いた捕虜マングースプラセボ経口狂犬病ワクチンを提供し、タンデム質量分析法(LC-MS/MS)法を用いた新規液体クロマトグラフィーを用いた餌取り込みを検証した。
要約
小さなインドのマングース(ヘルペステス・オーロプンクタトゥス)は、プエルトリコの狂犬病ウイルス(RABV)の貯水池であり、毎年報告される動物狂犬病症例の70%以上を占めています。野生動物貯水池におけるRABV循環の制御は、通常、口腔狂犬病ワクチン接種(ORV)の戦略によって達成される。現在、プエルトリコには野生動物ORVプログラムは存在しません。口腔狂犬病ワクチンやマングースの各種餌型の研究が有望な結果で行われました。ORVの成功のモニタリングは、標的種による餌摂取の推定に依存しており、これは通常、RABV中和抗体(RVNA)後のワクチン接種後の変化を評価することを含む。この戦略は、アクティブな野生生物ORVプログラムを有する地域、またはRABVが活性化し、RVNAのバックグラウンドレベルが貯水池種に存在する地域では解釈が困難な場合があります。このような状況では、ワクチンまたは餌マトリックスに組み込まれたバイオマーカーが有用であり得る。エチル-イオフェノク酸(et-IPA)を含む16個の捕虜マングースプラセボORV餌を、餌の中に0.4%と1%、外餌マトリックスで0.14%の濃度で提供しました。また、メチル-イオフェノク酸(me-IPA)を含む12個の捕虜マングースORV餌を、外部餌マトリックスに0.035%、0.07%、0.14%の濃度で提供しました。餌の提供の前に血清サンプルを収集し、その後、最大8週間のポストオファリングのために毎週。セラからイオフェノキ酸をアセトニトリルに抽出し、液体クロマトグラフィー/質量分析法を用いて定量した。液体クロマトグラフィー質量分析により、et-IPAまたはme-IPAのセラを分析した。et-IPAとme-IPAに対して、少なくとも8週間と4週間は適切なマーキング能力を見出した。いずれのIPA誘導体も、マングースにおけるORV餌取り込みのフィールド評価に適している可能性がある。マングースセラのマーカーの寿命が長いため、連続した評価中に同じIPA誘導体を使用して結果を混乱させないように注意する必要があります。
概要
狂犬病ウイルス(RABV)は、負の感覚一本鎖リサウイルスであり、カルニヴォラとチロプテラの順序内の多様な野生生物貯水池種の間で循環する。マングースの複数の種はRABVの貯水池であり、小さなインドのマングース(ヘルペステス・オーロプンクタトゥス)は、西半球のプエルトリコと他のカリブ海の島々で唯一の貯水池です 1,2,3.野生動物貯水池におけるRABV循環の制御は、通常、口腔狂犬病ワクチン接種(ORV)の戦略を通じて達成される。米国(米国)では、この管理活動はUSDA/APHIS/野生生物サービス国家狂犬病管理プログラム(NRMP)4によって調整されています。現在、プエルトリコには野生動物ORVプログラムは存在しません。狂犬病ワクチンとマングースの様々な餌の種類に関する研究は、マングースのためのORVプログラムが可能であることを示唆する有望な結果で行われてきました 5,6,7,8.
ORVの影響を監視することは、標的種による餌摂取の推定に依存し、これは通常、RV抗体血清の変化を評価することを含む。しかし、この戦略は、活性野生生物ORVプログラムを有する地域、またはRVが活性化し、RABV中和抗体(RVNA)のバックグラウンドレベルが貯蔵所種に存在する地域において困難である可能性がある。このような状況では、餌または外部餌マトリックスに含まれるバイオマーカーが有用であり得る。
様々な生物学的マーカーは、アライグマ(プロシオンローター)9、10、ストット(ムステラエルミン)11、12、ヨーロッパのバッジ()を含む多数の種の餌の取り込みを監視するために使用されています。メレスメレス)13、イノシシ(Ssscroofa)14,小さなインドのマングース15と草原の犬 (シノミスルドビシアヌス)16,17, とりわけ.米国では、オペレーショナルORV餌は、餌の取り込み18、19を監視するために餌マトリックスに1%テトラサイクリンバイオマーカーを含むことが多い。しかし、テトラサイクリンの使用に対する欠点は、環境への抗生物質の分布に対する懸念の高まりと、テトラサイクリンの検出は典型的に侵襲的であり、骨を得るために動物の歯の抽出または破壊を必要とする。サンプル20.ローダミンBは、種々の組織におけるマーカーとして評価されており、毛髪及びウィスカー10、21における紫外線(UV)光および蛍光を用いて検出することができる。
イオフェノキ酸(IPA)は、コヨーテ(Canislatrans)22、北極キツネ(ヴァルペス・ラゴプス)23、赤キツネ(ヴァルペス・ヴァルペス)24、アライグマの餌消費量を評価するために使用されている白色の結晶性粉末です。9,25、イノシシ14、赤鹿(セルヴス・エラフス・スコティカス)26、ヨーロッパのバッジ12およびフェレット(M.フロ)27、他のいくつかの哺乳類種の中で。IPAの保持時間は、一部のマーシャル28、29、無秩序26で少なくとも26週間、家畜犬で52週間以上(Canis lupus familiaris)30で2週間未満の種によって異なる。保持時間はまた、用量依存性31であってもよい。イオフェノキ酸は血清アルブミンに強く結合し、血中ヨウ素レベル32を測定することによって歴史的に検出された。この間接的アプローチは、UV検出33でイオフェノキ酸濃度を直接測定する高性能液体クロマトグラフィー(HPLC)法に取って代わられ、最終的には液体クロマトグラフィーおよび質量分析(LCMS)を用いた。34、35。本研究では、多重反応モニタリング(MRM)を利用してイオフェノク酸の2つの類似体を定量化する、アンデム質量分析法(LC-MS/MS)法を用いた高感度かつ選択的液体クロマトグラフィーを開発した。私たちの目的は、このLC-MS/MS法を使用して、2-(3-ヒドロキシ-2,4,6-トリヨードベンジル)プロパニン酸(メチル-IPAまたはme-IPA)および2-(3-ヒドロキシ-2,4,6-トリリオドベンジル)ブタノイン酸(エチル-IPAまたはOR-IPA)およびAl-IPAのマーキング能力を評価することにした。捕獲マングースに餌。
マングースは、市販のスモークソーセージと魚油で餌付けされたケージトラップで捕獲されました。マングースは、個々の60 cm x 60 cm x 40 cmステンレス鋼ケージに収容され、約50gの市販の乾燥キャットフードの毎日の配給を供給し、市販の鶏もも肉で週2回補充した。水はアドリビタムを利用できました。我々は、IPAの2つの誘導体、エチル-IPAおよびメチル-IPAをプラセボORV餌で捕獲マングースに送達した。すべての餌は、粉末状の鶏卵とゼラチン(材料の表)を含む外部コーティング(以下「餌マトリックス」)を含む28mm x 20mm x 9mm箔ブリスターパックで構成されました。餌は0.7mLの水またはIPA誘導体を含み、約3gの重量を量り、そのうち約2gは外部餌マトリックスであった。
我々は3つの濃度で16捕獲マングースet-IPAを提供しました: 0.14% (2.8 mg et-IPA〜2g餌マトリックス; 3 オス [m],3 メス [f]], 0.4% (0.7 mL ブリスターパック体積で 2.8 mg et-IPA; 3m, 3f), 1.0% (0.7 mL ブリスターパック体積で 7.0 mg エチル-IPA; 2m)、2f)。2.8 mgの全体的な用量は5 mg/kg 27,36の用量率に対応し、プエルトリコで560gの平均マングース重量に基づいています。我々は、研究がいくつかのバイオマーカーに対する味の嫌悪感が一部の種で発生する可能性があることを示唆しているように、最高濃度として1%を選択しました >1%は、いくつかの種37で発生する可能性があります。我々は、凝集が十分に溶媒に溶解するのを防ぎ、餌マトリックスに均等に組み込まれるのを防ぐため、ブリスターパック内の1%の用量のみを提供した。1つの対照群(2m、1f)は、無菌水とIPAなしで満たされた餌を受け取った。私たちは、毎日のメンテナンス配給の間または前に午前中(〜午前8時)にマングースに餌を提供しました。餌の残骸は約24時間後に取り除かれた。治療前に血液サンプルを採取し、治療後1日、治療後8週間まで毎週採取した。我々は、イソムランガスの吸入によってマングースを麻酔し、フェレット38について説明するように頭蓋静脈カバの静脈穿刺によって全血の1.0 mLまで集めた。全血サンプルを遠心分離し、血精膜を凍結物に移し、分析するまで-80°Cで保存した。すべての動物が、繰り返し発生する血液が動物の健康に与える影響を最小限に抑えるために、すべての期間中にサンプリングされたわけではありません。対照動物を0日目にサンプリングし、その後毎週最大8週間の治療後にサンプリングした。
私たちは、0.035%(0.7mg)、0.07%(1.4mg)、0.14%(2.8mg)の3つの濃度でme-IPAを送達し、いずれも餌マトリックスに組み込まれ、治療群当たり2人の男性と2人の女性を含む。2人の男性と2人の女性は、無菌の水で満たされた餌を受け取り、IPAはありません。餌提供時間とマングース麻酔は、上記で説明します。1日目に治療前に血液サンプルを採取し、治療後4週間まで毎週採取した。
異なる治療群の血清IPA濃度の正常性と推定手段について血清濃度データを試験した。我々は、線形混合モデルを使用して、個人間でプールされた平均血清et-IPA濃度を比較した。餌型(マトリックス/ブリスターパック)は実験日に加えて固定効果であったのに対し、動物IDはランダム効果であった。すべての手順は、共通の統計ソフトウェア(材料の表)を使用して実行され、有意性はα= 0.05で評価された。
プロトコル
すべての手順は、承認された研究プロトコルQA-2597の下でUSDA国立野生生物研究センターの機関動物ケアと使用委員会によって承認されました。
注:以下のプロトコルは、マングース血清中のメチル-イオフェノシン酸を検出するための分析手順について説明する。この方法は、マングース血清中のエチル-イオフェノシン酸の分析から始まった反復プロセスの最終版である。エチル-イオフェノキ酸のマイナーな修飾の初期評価の間に方法に行われ、結果として以下に提示される最終プロトコルが得られた。代表的な結果には、両方の反復中に得られた結果が含まれます。
1. ソリューションと標準の準備
- 私-IPAとet-IPAを購入します。
- 移動相Aの場合は、1mLのギ酸と1Lの超純水(≥18 MΩ)を組み合わせて、1Lの0.1%(v/v)ギ酸を水中に調調します。移動相Bの場合は、1mLのギ酸とACNの1Lを組み合わせてアセトニトリル(ACN)に0.1%(v/v)ギ酸の1Lを調出します。
- 希釈剤の場合は、TFAの1mLとACNの200mLを組み合わせて、ACNで0.5%(v/v)のトリフルオロ酢酸(TFA)の200mLを調調します。
- 約1,000 μg/mLの濃度でACNにiPAおよびet-IPAの濃縮IPAストック溶液を調製する。
- マイクロバランスで約10mgのme-IPAを計量し、質量を±0.0001mgに記録し、45mL ACNを用いて10mLクラスA体積フラスコに測定量を移す。すべての固体を溶解し、ACNでボリュームに持って来るために1分を超音波。
- 各ストックの約8mLを、ポリテトラフルオロエチレン(PTFE)裏地キャップを持つアンバー8 mLガラスバイアルに移します。室温(RT)で保存します。残りの在庫を有害廃棄物に移します。
- 25x-7 me-IPAストック(表1)の場合は、ACNでme-IPAのストックを約200μg/mLで準備します。例:1,000 μLガラスシリンジを使用して、me-IPA濃縮ストックの1 mLをステップ1.4.2から5 mLクラスA容積フラスコに移します。ACNで体積に希釈します。PTFEラインキャップ付きの琥珀色の8mLガラスバイアルにストックを移します。RTで保存します。
- 表 1に記載されている 6 つの追加の 25x me-IPA 株式を準備します。各ストックについて、PTFEラインキャップと琥珀色の8mLアンバーガラスバイアルでリピートピペッタを使用して示されたボリュームを組み合わせます。RTで各在庫を保存します。
- 25x代理株式の場合は、ステップ1.4.2で調製した濃縮ストックから約10μg/mLでACNでme-IPAの代理在庫を準備します。濃縮されたme-IPAストックの0.100mLを10mLクラスA体積フラスコに100μLガラスシリンジを使用して移し、ACNで体積に希釈します。
- PTFEラインキャップ付きの琥珀色の8mLガラスバイアルに~8mLを移します。RTで保管し、残りの在庫を有害廃棄物に移します。
- 表2に記載されているように、2 mLスクリュートップガラスオートサンプラーバイアルに両方の検解物を含む4xストックを準備する。
- 例えば、ストック4x-7を調製するには、2mLのバイアルに、0.5 mL容量先端を持つリピートピペッタを使用してステップ1.5から25x-7 me-IPAストックの0.20 mLを追加します。0.5 mL容量チップを持つリピートピペッタを使用して、ステップ1.7から25xサロゲートet-IPAストックの0.20 mLを追加します。
- 1 mL容量先端を持つリピートピペッタを使用してACNの0.85 mLを追加します。バイアルをしっかりとキャップし、5xを反転して混ぜます。
- 表 3に示すように、2 mL スクリュートップ オートサンプラーバイアルに標準カーブを準備します。
- たとえば、標準 7 (Std 7) を 2 mL バイアルに調製するには、0.5 mL の容量チップを持つリピート ピペッタを使用して、ステップ 1.8.2 から 4x-7 ストックの 0.20 mL を追加します。1 mL容量チップを持つリピートピペッタを使用して、0.60 mLの超純DI水を追加します。バイアルをしっかりとキャップし、5xを反転して混ぜます。
2. サンプル調製
注意:この手順を実行する担当者は、狂犬病の一連の暴露前予防を受け、連邦労働衛生指定医療施設から0.5 IU以上の文書化された狂犬病抗体のチターを持っている必要があります。担当者は、抽出を実行しながら、常にラボコートと目の保護を着用する必要があります。注意: クラス II バイオセーフティ キャビネットで手順 2.3−2.6 を実行します。
- 各サンプルについて、NaCl.80位置のプラスチックラックにチューブを配置し、200-300 mgを含む1.5 mLマイクロ遠心管を準備します。ステップ 2.6 で使用するために取っておきます。
注:マイクロスクープ(またはその他の小型測定装置)は、多数のサンプルに推奨されます。 - 各サンプルについて、2本の1.5mLマイクロ遠心分離管にラベルを付けます:1つは「A」、もう1つは「B」です。チューブを80桁のプラスチックラックに配置します。
- 血清抽出に必要な次の材料と機器をクラスIIバイオセーフティキャビネットに配置する:ステップ2.1および2.2で調製されたマイクロ遠心管(ラック内)、渦ミキサー、0.5 mLおよび5 mL容量の先端、100−1,000 μLの空気変位を繰り返すピピッタ1,000 μLの先端が付いているピペット、希釈剤および超pure DI水のそれぞれ約100 mLの容器およびバイオハザードの廃棄物の容器。
- 凍結保存から血清サンプルを取り出し、バイオセーフティキャビネット内のRTに温めます。渦はサンプリングの前に各血清サンプルを混合する。
- 0.5 mL容量先端のリピートピペッタを使用して、マングース血清の0.050 mLをチューブ「A」に分配し、25倍の代理ストックの0.050 mLを追加します。次に、5 mL容量チップを持つリピートピペッタを使用してチューブ「A」に希釈剤の0.950 mLを追加します。しっかりとキャップし、10−15秒の渦ミックス。
- ステップ2.1からチューブ「A」に予備のNaClを分配し、8−12秒の渦ミックス3xを70%(v/v)イソプロパノールを使用してチューブ「A」を含むバイアルラックの外側の表面を拭き取ります。
注:サンプルのラックは、クラスIIバイオセーフティキャビネットから取り外しできます。 - 遠心管「A」は12,000 x gで1分間、水性相とACN相を分離する。100−1,000 μL空気変位ピペットを使用してチューブ「B」に上部ACN相のピペット0.80 mL。チューブ「A」の残りの溶液を有害廃棄物に移し、空のチューブを生体有害廃棄物容器に捨てます。
- 45°Cの水浴でN2ガスの穏やかな流れで管「B」からACNおよびTFAを取り除きます。
- 繰り返しピペットを使用してチューブ「B」にACNの0.250 mLを追加し、4−5秒の渦ミックスを使用し、12,000 x gで短心分離機(2−4秒)を使用してチューブの底部に液体を集めます。
- 5 mL容量先端のリピートピペッタを使用してチューブ「B」に0.750 mLの超純物DI水を加え、4-5sの渦ミックスを使用し、12,000 x gで1分間遠心分離機を使用してサンプルを明らかにします。
- 1,000 μL空気変位ピペットを使用して、上清の0.75 mLをオートサンプラーバイアルに移します。バイオハザード廃棄物容器にピペットの先端を廃棄します。
- キャップオートサンプラーバイアルを安全にキャップし、LC-MS/MS(セクション4)で分析します。チューブ「B」の残りの溶液を有害廃棄物に移し、空のチューブを生体有害廃棄物容器に捨てます。オートクレーブまたは焼却により、すべての生体有害廃棄物を処分します。
3. 品質管理サンプル
注意: セクション 2 に記載されている注意事項に従ってください。
注:次の手順では、解析に必要な品質管理 (QC) サンプルの最小数について説明します。十分な制御マングース血清が利用可能な場合は、各レベルでの反復が推奨されます。
- NaClの200−300 mgを含む4つの1.5 mLマイクロ遠心分離管を準備する。チューブを80桁のプラスチックラックに配置します。
- QC サンプルごとに、2 つの 1.5 mL マイクロ遠心分離管にラベルを付けます: 1 つは "A" で、もう 1 つは "B" とラベル付けします。チューブを80桁のプラスチックラックに配置します。
- 手順 2.3 を繰り返します。
- 冷凍貯蔵からコントロールマングース血清を取り除き、バイオセーフティキャビネット内のRTに暖めます。渦はサンプリングの前に対照血清を混合する。
- 0.050 mLのコントロールマングース血清を0.5mL容量先端のリピートピペッタを使用して4本の1.5mL「A」チューブに分配します。
- 表 4で指定した 4 つの QC サンプルのそれぞれを、0.5 mL 容量の先端を持つリピート ピペッタを使用して増強します。各QCサンプルをしっかりとキャップし、10−15秒の渦ミックスを使用します。
- 手順 2.6−2.12に記載されているように、抽出手順を実行します。
4. LC-MS/MS解析
- 表 5に記載されているすべてのパラメーターを使用して LC-MS/MS を設定します。LC-MS/MSの電源を入れ、流量を0.800 mL/minに設定する前にカラムが70°Cに達するようにします。
- 品質管理サンプルと未知のサンプルで構成される各バッチの前後に標準曲線を注入するデータ集録ソフトウェア (材料の表)でシーケンスを設定します。
- すべての規格とサンプルを注入し、表5に記載されているパラメータを使用してMRMイオンクロマトグラムを取得します。
- シーケンス完了後、LC-MS/MSをオフにし、すべてのオートサンプラーバイアルを有害廃棄物として廃棄します。
5. 定量化
- データ解析ソフトウェアを使用して、内部標準として et-IPA を使用して me-IPA の相対応答のキャリブレーション曲線を生成します。i-IPA (556.6 → 428.7) の定量化子 MRM 遷移からの相対応答を、et-IPA (570.7 → 442.7) の MRM 遷移で割った値を計算します。1/x の重み付けされ、原点を無視する 2 次二次関数を使用して、7 レベルのキャリブレーション カーブを作成します。
- 次の式を用いてme-IPAの血清濃度(C血清)を計算します。
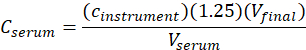
ここで、c計測器はμg/mL単位の較正曲線から計測器によって決定される濃度であり、1.25は希釈係数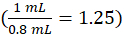 であり、V最終は最終サンプル体積(1.0mL)であり、V血清はmL(mL)の血清容積である(0.050 mL 公称)。
であり、V最終は最終サンプル体積(1.0mL)であり、V血清はmL(mL)の血清容積である(0.050 mL 公称)。
結果
me-IPA分析からの代表的なイオンクロマトグラムを図1に示す。対照マングース血清(図1A)は、et-IPA(サロゲートアナリテ)の保持時間および示された保持時間におけるme-IPAの不在を示す。品質管理サンプル(図1B)は、et-IPAからのme-IPAのベースライン分離と、me-IPAの定量子および修飾子遷移を示しています。
ディスカッション
研究のために開発されたLC-MS/MS法は、マングース血清中のme-IPAおよびet-IPAを正確に定量するために、多重反応モニタリングの選択性を利用した。MS/MS検出の選択性はまた、分析前に血清からタンパク質を沈殿させるアセトニトリルのみに依存する簡単なクリーンアッププロトコルを可能にしました。
イオフェノキ酸はACNに溶け込みますが、実質的に水中に不溶性です。ACN?...
開示事項
著者AVとSOは、口腔狂犬病ワクチン餌メーカーの正社員です。
謝辞
この研究は、米国農畜動植物衛生検査局、野生生物サービス、国立狂犬病管理プログラム、IDTビオロジカ(ドイツ・デッサウ・ロスラウ)の内部研究プログラムの一部によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Acetonitrile, Optima grade | Fisher | A996 | |
| Analytical balance | Mettler Toledo | XS204 | |
| C18 column, 2.1 x 50 mm, 2.5-µm particle size | Waters Corp. | 186003085 | |
| ESI Source | Agilent | G1958-65138 | |
| Ethyl-iophenoxic acid, 97 % | Sigma Aldrich | N/A | Lot MKBP5399V |
| Formic acid, LC/MS grade | Fisher | A117 | |
| LCMS software | Agilent | MassHunter Data Acquisition and Quantitative Analysis | |
| Methyl-iophenoxic acid, 97 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR0709514717 |
| Microanalytical balance | Mettler Toledo | XP6U | |
| Microcentrifuge | Eppendorf | 5415C | |
| MS/MS | Agilent | G6470A | |
| N-Evap | Organomation | 115 | |
| Oral Rabies Vaccine Baits | IDT Biologika, Dessau Rossleau, Germany | N/A | |
| Propyl-iophenoxic acid, 99 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR100612108RR |
| Repeat pipettor | Eppendorf | M4 | |
| Screw-top autosampler vial caps, PTFE-lined | Agilent | 5190-7024 | |
| Sodium chloride, Certified ACS grade | Fisher | S271 | |
| Statistical Software Package | SAS Institute, Cary, North Carolina, USA | N/A | |
| Trifluoroacetic acid, 99 % | Alfa Aesar | L06374 | |
| UPLC | Agilent | 1290 Series | |
| Vortex Mixer | Glas-Col | 099A PV6 | |
| 0.2-mL pipettor tips | Eppendorf | 30089.413 | |
| 0.5-mL pipettor tips | Eppendorf | 30089.421 | |
| 1.5-mL microcentrifuge tubes | Fisher | 14-666-325 | |
| 1250-µL capacity pipette tips | GeneMate | P-1233-1250 | |
| 1-mL pipettor tips | Eppendorf | 30089.43 | |
| 2-mL amber screw-top autosampler vials | Agilent | 5182-0716 | |
| 5-mL pipettor tips | Eppendorf | 30089.456 | |
| 80-position microcentrifuge tube rack | Fisher | 05-541-2 | |
| 8-mL amber vials with PTFE-lined caps | Wheaton | 224754 | |
| 70 % (v/v) isopropanol | Fisher | A459 | |
| 100-1000 µL air displacement pipette | Eppendorf | ES-100 |
参考文献
- Nel, L. H., et al. Mongoose rabies in southern Africa: a re-evaluation based on molecular epidemiology. Virus Research. 109 (2), 165-173 (2005).
- Zieger, Z., et al. The phylogeography of rabies in Grenada, West Indies, and implications for control. PLOS Neglected Tropical Diseases. 8 (10), e3251 (2004).
- Monroe, B. P., et al. Rabies surveillance in the United States during 2014. Journal of the American Veterinary Medical Association. 248 (7), 777-788 (2015).
- Slate, D., et al. Status of oral rabies vaccination in wild carnivores in the United States. Virus Research. 111, 68-76 (2005).
- Blanton, J. D., et al. Vaccination of small Asian mongoose (Herpestes javanicus) against rabies. Journal of Wildlife Diseases. 42 (3), 663-666 (2006).
- Vos, A., et al. Oral vaccination of captive small Indian mongoose (Herpestes auropunctatus) against rabies. Journal of Wildlife Diseases. 49 (4), 1033-1036 (2013).
- Berentsen, A. R., Johnson, S. R., VerCauteren, K. C. Evaluation of ONRAB® bait matrix flavor preference by mongoose (Herpestes auropunctatus) in Puerto Rico: Implications for Oral Rabies Vaccination. Caribbean Journal of Science. 48 (1), 52-58 (2014).
- Ortmann, S., et al. Safety studies with the oral rabies virus vaccine strain SPBN GASGAS in the small Indian mongoose (Herpestes auropunctatus). BMC Veterinary Research. 14 (1), 90 (2018).
- Linhart, S. B., et al. A field evaluation of baits for delivering oral rabies vaccines to raccoons (Procyon lotor). Journal of Wildlife Diseases. 30 (2), 185-194 (1994).
- Fry, T. L., Atwood, T., Dunbar, M. R. Evaluation of rhodamine B as a biomarker for raccoons. Human Wildlife Interactions. 4 (2), 275-280 (2010).
- Jones, C., Moller, H., Hamilton, W. A review of potential techniques for identifying individual stoats (Mustela erminea) visiting control or monitoring stations. New Zealand Journal of Zoology. 31 (3), 193-203 (2004).
- de Leeuw, A. N. S., Smith, G. C., Woods, J. A. Use of iophenoxic acid to assess bait uptake by European badgers. Advances in Vertebrate Pest Management. 4, 243-254 (2006).
- Southey, A. K., Sleeman, D. P., Gormley, E. Sulfadimethoxine and rhodamine B as oral biomarkers for European badgers (Meles meles). Journal of Wildlife Diseases. 38 (2), 378-384 (2002).
- Massei, G., Jones, A., Platt, T., Cowan, D. P. Iophenoxic Acid as a Long-Term Marker for Wild Boar. Journal of Wildlife Management. 73 (3), 458-461 (2009).
- Creekmore, T. E., et al. Field evaluation of baits and baiting strategies for delivering oral vaccine to mongooses in Antigua, West Indies. Journal of Wildlife Diseases. 30 (4), 497-505 (1994).
- Creekmore, T. E., Rock, R. E., Hurley, J. A baiting system for delivery of an oral plague vaccine to black-tailed prairie dogs. Journal of Wildlife Diseases. 38 (1), 32-39 (2002).
- Fernandez, J. R. R., Rocke, R. E. Use of Rhodamine B as a biomarker for oral plague vaccination of prairie dogs. Journal of Wildlife Diseases. 47 (3), 765-768 (2011).
- Johnston, J. J., et al. Evaluation and significance of tetracycline stability in rabies vaccine baits. Journal of Wildlife Diseases. 41 (3), 549-558 (2005).
- Algeo, T. P., et al. Oral rabies vaccination variation in tetracycline biomarking among Ohio Raccoons. Journal of Wildlife Diseases. 49 (2), 332-337 (2013).
- Crier, J. K. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 34 (4), 829-834 (1970).
- Fisher, P. Review of using Rhodamine B as a marker for wildlife studies. Wildlife Society Bulletin. 27 (2), 318-329 (1999).
- Knowlton, F. K., Savarie, P. J., Wahlgren, C. E., Hayes, D. J., Shumake, S. A., Bullard, R. W. Physiological marks by coyotes ingesting baits containing iophenoxic acid, Mirex and Rhodamine B. Vertebrate Pest Control and Management Materials. , 141-147 (1987).
- Follmann, E. H., Savarie, P. J., Ritter, D. G., Baer, G. M. Plasma marking of arctic foxes with iophenoxic acid. Journal of Wildlife Diseases. 23 (4), 709-712 (1987).
- Saunders, G., Harris, S., Eason, C. T. Iophenoxic acid as a quantitative bait marker for foxes. Wildlife Research. 20, 297-302 (1993).
- Hadidian, J., et al. Acceptance of simulated oral rabies vaccine baits by urban raccoons. Journal of Wildlife Diseases. 25 (1), 1-9 (1989).
- Sweetapple, P. J., Nugent, G. Iophenoxic acid as a serum marker for red deer (Cervus elaphus scoticus). Wildlife Research. 25, 649-654 (1998).
- Ogilvie, S. C., Eason, C. T. Evaluation of iophenoxic acid and rhodamine B for marking feral ferrets (Mustela furo). New Zealand Journal of Zoology. 25 (2), 105-108 (1998).
- Eason, C. T., Batcheler, D., Frampton, C. M. Comparative pharmacokinetics of iophenoxic acid in cats and brushtail possums. Wildlife Research. 21, 377-380 (1994).
- Fisher, P. M., Marks, C. A. Evaluation of iophenoxic acid as a biomarker for swamp wallabies (Wallabia bicolor). Wildlife Research. 24, 97-103 (1997).
- Baer, G. M., Shaddock, J. H., Hayes, D. J., Savarie, P. Iophenoxic acid as a serum marker in carnivores. Journal of Wildlife Management. 49 (1), 49-51 (1985).
- Spurr, E. B. Iophenoxic acid as a systemic blood marker for assessment of bait acceptance by stoats (Mustela ermine) and weasels (Mustela nivalis). New Zealand Journal of Zoology. 29 (2), 135-142 (2002).
- Mudge, G. H., Strewler, G. J., Desbiens, N., Berndt, W. O., Wade, D. N. Excretion and distribution of iophenoxic acid. Journal of Pharmacology and Experimental Therapeutics. 178 (1), 159-172 (1971).
- Jones, A. High-performance liquid chromatographic determination of iophenoxic acid in serum. Journal of Chromatography B: Biomedical Sciences and Applications. 654 (2), 293-296 (1994).
- Wiles, M. C., Campbell, T. A. Liquid chromatography-electrospray ionization mass spectrometry for direct identification and quantification of iophenoxic acid in serum. Journal of Chromatography B. 832 (1), 144-157 (2006).
- Ballesteros, C., et al. Analysis by LC/ESI-MS of iophenoxic acid derivatives and evaluation as markers of oral baits to deliver pharmaceuticals to wildlife. Journal of Chromatography B. 878 (22), 1997-2002 (2010).
- Purdey, D. C., Petcu, M., King, C. M. A simplified protocol for detecting two systemic bait markers (Rhodamine B and iophenoxic acid) in small mammals. New Zealand Journal of Zoology. 30 (3), 175-184 (2003).
- Tobin, M. E., Koehler, A. E., Sugihara, R. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 60 (1), 202-207 (1996).
- Briscoe, J. A., Syring, R. Techniques for emergency airway and vascular access in special species. Seminars in Avian and Exotic Pet Medicine. 13 (3), 118-131 (2004).
- Eason, C. T., Frampton, C. M. The plasma pharmacokinetics of iophenoxic and iopanoic acids in goat. Xenobiotica. 2 (2), 185-189 (1992).
- Hilton, H. E., Dunn, A. M. S. . Mongooses: their natural history. , (1967).
- Stevens, C. E., Hume, I. D. . Comparative physiology of the vertebrate digestive system. Second edition. , (1995).
- National Rabies Management Program (NRMP). . Oral rabies vaccination draft operations manual. , (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved