A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام "واحد جزيء فلوري في الموقع التهجين" (SM-الأسماك) إلى مرناس Quantify و Localize في "بويضات مورين"
In This Article
Summary
لعد تكاثر عدد مرناس في بويضات الفردية، صف واحد جزيء الحمض النووي الريبي في الموقع الأمثل التهجين (الحمض النووي الريبي-الأسماك) للخلايا غير ملتصقة. بويضات جمعت وتهجين مع تحقيقات محددة نسخة، وكمياً باستخدام برنامج تقدير حجم صورة.
Abstract
وتشمل الأساليب الحالية المستخدمة بشكل روتيني لتقدير مرناً في بويضات والأجنة الرقمي النسخ العكسي تفاعل البوليميراز المتسلسل (دبكر) والكمية، في الوقت الحقيقي RT-PCR (RT-qPCR) وتسلسل الحمض النووي الريبي. عندما يتم تنفيذ هذه التقنيات باستخدام واحدة من البويضات أو الأجنة، لا يتم كشف مرناس منخفضة-نسخة موثوق بها. للتغلب على هذه المشكلة، بويضات أو أجنة يمكن أن تجمع معا للتحليل؛ ومع ذلك، وهذا غالباً ما يؤدي إلى تباين عال بين العينات. في هذا البروتوكول، يصف لنا استخدام الفلورية في الموقع التهجين (الأسماك) استخدام تشعبت كيمياء الحمض النووي. ويحدد هذا الأسلوب النمط المكاني مرناس في الخلايا الفردية. عندما يقترن التقنية "العثور على الفور" وتتبع برامج الكمبيوتر، يمكن أيضا قياس وفرة مرناس في الخلية. باستخدام هذا الأسلوب، وهناك انخفاض تقلب داخل مجموعة تجريبية وعدد أقل من بويضات والأجنة هي المطلوبة للكشف عن اختلافات كبيرة بين المجموعات التجريبية. متوفرة تجارياً الحمض النووي تشعبت SM-مجموعات الأسماك قد تم الأمثل للكشف عن مرناس في مقطعة الأنسجة أو الخلايا ملتصقة على الشرائح. ومع ذلك، بويضات لا تلتزم بشكل فعال الشرائح وبعض الكواشف في المجموعة التي كانت قاسية جداً أدى إلى تفسخ البويضيه. لمنع هذا تحلل، تم إجراء تعديلات عدة لطقم السمك. على وجه التحديد، استبدال البويضيه مخازن بيرميبيليزيشن، والمياه والصرف الصحي المصممة الفلورة بويضات والأجنة في مخازن الملكية. أجريت بيرميبيليزيشن ويغسل، وإينكوبيشنز مع تحقيقات ومكبر للصوت في لوحات 6-جيدا ووضعت بويضات على الشرائح في نهاية البروتوكول باستخدام وسائل الإعلام المتزايدة. وكانت هذه التعديلات قادرة على التغلب على القيود المفروضة على عدة متاحة تجارياً، على وجه الخصوص، تحلل البويضيه. بدقة، وتكاثر عدد مرناس في بويضات الفردية، تم استخدام برامج الكمبيوتر. معا، وهذا البروتوكول يمثل بديلاً لبكر وتسلسل مقارنة التعبير عن وقائع محددة في الخلايا المفردة.
Introduction
وقد عكس المنتسخة تفاعل البوليميراز المتسلسل (PCR) معيار الذهب كوانتيتاتيون مرناً. وتستخدم حاليا فحوصات اثنين والرقمية بكر (دبكر)1 والوقت الحقيقي، والكمية بكر (qPCR)2 . تقنيات PCR اثنين، قد دبكر حساسية أكبر من قبكر مما يوحي بأنه يمكن استخدامه لقياس وفرة مرناً في الخلايا المفردة. ومع ذلك، أنتج تحليل دبكر مرناس وفرة منخفضة في برك من 5 إلى 10 بويضات كل كل عينة تجريبية في أيدينا، البيانات مع إمكانية تكرار نتائج منخفضة وعالية التباين3. ومن المرجح نتيجة لخطأ التجريبية المرتبطة باستخراج الحمض النووي الريبي وكفاءة النسخ العكسي. تسلسل الحمض النووي الريبي قد أجريت باستخدام ماوس واحدة وبويضات بشرية4،5. ويتطلب هذا الأسلوب كدنا التضخيم الخطوات المطلوبة لتوليد المكتبة مما يزيد من احتمال تقلب داخل مجموعة تجريبية. وعلاوة على ذلك، قد لا تكون النصوص وفرة منخفضة قابلة للاكتشاف. على الرغم من أن تسلسل الأسعار تراجعت في السنوات القليلة الماضية، لا يزال يمكن أن يكون تكلفة باهظة بسبب التكلفة العالية للتحليلات المعلوماتية. وأخيراً، مرناً الترجمة عملية دينامية مع التغيرات المكانية المساهمة في وظيفة البروتين6. ولذلك، نحن المبينة على اعتماد أسلوب التي ستنتج التدابير الكمية الدقيقة واستنساخه وتوطين مرناس الفردية في بويضات واحد.
تشعبت الحمض النووي بالإضافة إلى الأسفار في التهجين الموقعي تضخيم الإشارات fluorescence بدلاً من زيادة الحمض النووي الريبي/كدنا تمكين الكشف عن مرناس واحدة في الخلايا الفردية 7،،من89. الفحص يتم من خلال سلسلة من التهجين والتضخيم (باستخدام الحمض النووي تشعبت) والأسفار وسم خطوات من أجل تضخيم الإشارات fluorescence7. ويبدأ التقنية ملزمة أزواج مسبار اليغنوكليوتيد 18-25 قاعدة مكملة لمحددة مرناً3،،من810. أزواج التحقيق خمسة عشر إلى عشرين مصممة لخصوصية ضمان كل نسخة لنص الهدف. ويعقب التهجين مرناً على حدة تحقيقات ما قبل مكبر للصوت ومكبر للصوت التي تشكل تكويناً متفرع. تقريبا، ربط 400 التسمية fluorophores كل مكبر للصوت، أدى إلى زيادة 8000-fold في الأسفار يتيح الكشف عن مرناس الفردية (الشكل 1)11.
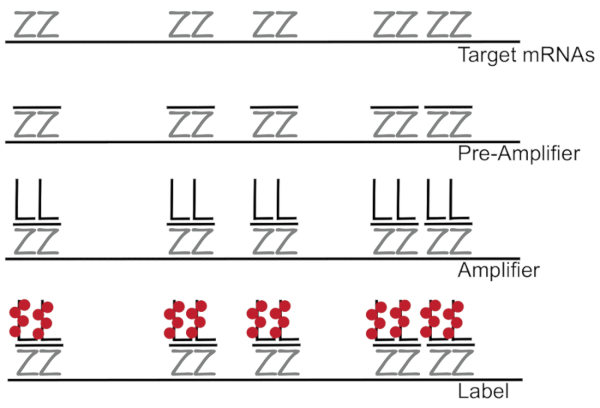
رقم 1: التخطيطي البروتوكول SM-الأسماك- التهجين متسلسلة من محاضر جلسات التحقيق المحددة، تشعبت الحمض النووي مكبر للصوت وفلوروفوري إلى هدف يرد مرناً. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
خلية الدراسات السابقة باستخدام جزيء واحد الأسفار في الموقع مرناس β-أكتين التهجين (SM-الأسماك) المترجمة في الخلايا العصبية الفردية12 وفيروس الورم الحليمي البشري الحمض النووي في سرطان عنق الرحم خطوط7. برامج الكمبيوتر "العثور على الفور" و "تتبع البرنامج" يحدد إشارة الفلورسنت الشروريه الفردية وقد استخدمت بنجاح لتقدير عدد مرناس في كل خلية3،13.
استناداً إلى نتائج الكشف مرناً في الخلايا العصبية12، افترضنا أن SM-الأسماك من شأنه أن يثبت أداة مفيدة كوانتيتاتي مستويات نسخة في بويضات مورين والأجنة بما في ذلك مرناس وفرة منخفضة. ومع ذلك، الأسلوب هو الأمثل للاستخدام مع خلايا ثابتة ملتصقة وفورمالدهايد ثابتة البارافين جزءا لا يتجزأ أقسام الأنسجة (فب). لا يمكن أن تلتزم بويضات شريحة، حتى عندما كانوا المغلفة مع بولي-L-يسين. وعلاوة على ذلك، فأكثر هشاشة من خلايا جسدية وأقسام الأنسجة الناتجة في تحلل الخلية عند التعرض لبعض المخازن المؤقتة الملكية في مجموعات المتاحة تجارياً3. للتغلب على هذه التحديات، بويضات كانت ثابتة ونقلها يدوياً بين قطرات من المخازن المؤقتة. وعلاوة على ذلك، استعيض عن مخازن بيرميبيليزيشن، والمياه والصرف الصحي في المجموعات لتقليل تحلل الخلية. المسابر المصممة مسبقاً يتم شراؤها جنبا إلى جنب مع مجموعة الأسماك أو يمكن أن يطلب إلى وقائع محددة. يتوفر كل مجموعة التحقيق الملكية في واحدة من ثلاث قنوات الفلورية (C1 و C2 و C3) للسماح بالإرسال المتعدد. في التجربة الحالية، كانت بويضات موريني المزدوج الملون وكمياً باستخدام مجس C2 نانوج وتحقيق C3 Pou5f1 . واختيرت هذه المسابر استناداً إلى التعبير عنها نانج و Pou5f1 في بويضات والأجنة. في ختام خطوات التهجين، وضعت بويضات في قطرات من تصاعد تتلاشى المضادة وسائل الإعلام لتطبيقها على الشرائح النسيجي. واستخدمت الصور [كنفوكل] للتحديد الكمي لعدد الإشارات الفلورسنت الشروريه التي تمثل مرناس الفردية. بالإضافة إلى تحديد كمية مرناس، كما أظهر تصوير التوزيع المكاني مرناً محددة في الخلية، يتم فيها أساليب القياس الكمي الحمض النووي الريبي أخرى غير قادر على تحقيق. وتبين هذه التقنية قد تقلب منخفض داخل مجموعة تجريبية تسمح باستخدام عدد أقل من بويضات في كل مجموعة تجريبية لتحديد وجود اختلافات كبيرة بين المجموعات التجريبية3.
Protocol
إجراءات الحيوان تم استعراضها والموافقة عليها برعاية الحيوان المؤسسية واستخدام اللجنة في جامعة نبراسكا-لينكولن وأجريت جميع الأساليب وفقا للمبادئ التوجيهية ذات الصلة والأنظمة. لهذه الدراسة، أووتبريد مؤتمر نزع السلاح-1 الفئران كانت متواصلة للوصول إلى تشو القوارض العادية والمياه؛ أنها استمرت في 12:12 الظلام: الضوء على دورة.
1-إعداد الوسائط المطلوبة
- قاعدة الوسائط (OMM)، إضافة 100 ملم كلوريد الصوديوم، 5 ملم بوكل، 0.5 مم خ2ص4، ومم 1.7 كاكل2-2 ح2س إلى 100 مل من الماء المعقم.
ملاحظة: يمكن تخزين متوسطة أم لمدة تصل إلى شهر واحد. - للإعلام (أوموبس)، كاملة وإضافة 20 مم 3-مورفولينوبروباني-1-سولفونيك حمض (والمماسح)، 1.2 مم مجسو4-7 ح2س، جلوكوز 0.5 مم، 6 مم L-لاكتات، علاء 1 مم-جلن، 0.1 مم التاورين، 1 x الأحماض الأمينية غير الأساسية (نيا)، مم 0.01 الإيثيلين (حمض يدتا)، حمض ألفا يبويتش ميكرومتر 10، 10 ميكروغرام/مل مخفف الجنتاميسين، 21 ملم م 1 هيدروكسيد الصوديوم، 5 مم NaHCO3، 0.2 مم بيروفات، 0.5 مم سترات، جيش صرب البوسنة 4 مغ/مل الفاف 01:10 إضعاف أم في الماء المعقم لإجمالي حجم 100 مل. تعقيم في المتوسط مع عامل تصفية 0.22 ميكرومتر.
ملاحظة: يمكن تخزين أوموبس لمدة تصل إلى أسبوع واحد. - للمتوسط القابضة (جلالة) إضافة 5% مصل بقرى الجنين إلى أوموبس. جعل 2 مل جلالة الملكة في الماوس.
- للبروتين السكري المثبط الحل إضافة 0.1 مغ/مل من البروتين السكري المثبط المستمدة من الأبقار الخصيتين، إلى 1 مل صاحبة الجلالة.
- بالنسبة للمخزن المؤقت التثبيت دمج بارافورمالدهيد 4 ٪ في 10 مل من 1 x PBS جنبا إلى جنب مع 0.1% الجنين الصف بوفيدون (حماية الأصناف النباتية)14.
- إضافة إلى إعداد 50 مل أغسل المخزن المؤقت (البنك الدولي)، الفاعل غير الأيونية 0.1% و 0.1% حماية الأصناف النباتية إلى 1 ×14من برنامج تلفزيوني.
- لإعداد 10 مل بيرميبيليزيشن المخزن المؤقت، إضافة 1% غير الأيونية الفاعل ل برنامج تلفزيوني 1 x14.
ملاحظة: استبدال مخازن المياه والصرف الصحي و permeabilization الموصوفة أعلاه في مخازن الملكية في مجموعات المتاحة تجارياً.
2-جمع بويضات أوفولاتيد من الفئران الإناث
- إعداد:
- حفز الفئران الإناث في 5-8 أسابيع عمر عن طريق الحقن (الملكية الفكرية) داخل تروج 5 وحدات دولية المشيمة الخيلي (eCG) تليها 5 وحدات دولية تروج المشيمية البشرية (hCG) ح 44-48 بعد15،16.
- تبقى تحتوي على أطباق بتري 35 مم 2 مل من جلالة الملكة على طبق الاحترار 37 درجة مئوية. "الماصة؛" واحدة، قطره 100 ميليلتر من جلالة الملكة التي تحتوي على البروتين السكري المثبط المخفف تليها ثلاثة، قطرات 50 ميليلتر من جلالة دون البروتين السكري المثبط في طبق بتري 60 ملم. وضع لوحات لوحة قطرات تحتوي على 37 درجة مئوية درجة حرارة الأرض قبل الاستخدام.
ملاحظة: ينبغي قطرات البروتين السكري المثبط فقط قبل التشريح لكل زوج قناة لمنع التبخر وتركيز العناصر لجلالة الملكة مع أو بدون البروتين السكري المثبط.
- Euthanize الفئران، ح 16 بعد حقن IP من قوات حرس السواحل الهايتية، واستخدام جرعة isoflurane متبوعاً بخلع عنق الرحم.
- قم بتنظيف الماوس باستخدام الإيثانول 70%. كشف تجويف البطن ووضع تصور للأنثى التناسلي. عقد المبيض مع الملقط وإزالة الأربطة الرحم والأنسجة الدهنية الزائدة من حول المبيض. قطع قناة من الرحم وقناة المبيض الزوج في HM الحارة في الطبق 35 ملم.
- إزالة المبيض وأي الأنسجة الدهنية المحيطة بها. المسيل للدموع ampulla منتفخة من قناة استخدام إبرة 27-مقياس نصف بوصة. دفع قناة في موقع المسيل للدموع، وسوف يطرد مجمعات الخلايا البويضيه cumulus (COCs). نقل بويضات أوفولاتيد، التي يفترض أن تكون في الطورية الثاني (MII) الانقسام الاختزالي، بانخفاض 100 ميكروليتر التي تحتوي على وسائط الإعلام جلالة مع البروتين السكري المثبط استخدام ماصة فم (الشكل 2).
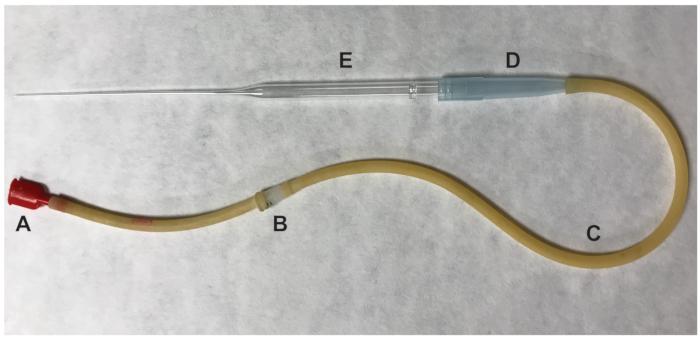
الشكل 2 : أجزاء من بيبيتور الفم تستخدم لنقل بويضات. (أ) قطعة الفم (ب) 0.22 أم، 4 مم (ج) المضخة الأنابيب (د) 1000 ميكروليتر بيبيت الفلتر (ﻫ) بيبيت باستور 9 ". الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
- "الماصة؛" مجمعات الخلايا البويضيه الركام الذااره صعودا وهبوطاً في البروتين السكري المثبط المحتوية على جلالة السلطان مع ماصة الفم لإزاحة الخلايا الركام. نقل كل البويضات، حين تكون خالية من الخلايا الركام ليغسل إسقاط جلالة الملكة التي تحتوي على فقط باستخدام ماصة الفم. كرر هذه العملية لكل قطره من المياه والصرف الصحي. لا يتم نقل15من بويضات مجزأة أو شفافة.
ملاحظة: من المهم لنقل بويضات من كل قطره في الطبق 35 مم مع كجلالة صغيرة قدر الإمكان. وهذا صحيح بالنسبة لكل عملية نقل في البروتوكول. لا يجب أن تظل بويضات صناعة المعلومات في البروتين السكري المثبط تتضمن المتوسطة HM لأكثر من دقيقة واحدة.
3-SM الأسماك تلطيخ من بويضات
- إصلاح بويضات في بئر فردية من لوحة 6-كذلك يتضمن 500 ميليلتر من "المخزن المؤقت للتثبيت". غمر بويضات 20 أو أقل في البئر. احتضان لمدة 20 دقيقة في درجة حرارة الغرفة.
ملاحظة: كل خطوة المصبوغة SM-السمك يحدث داخل بئر فردية في صفيحة مخروطية 6-جيدا. التأكد من وجود بويضات مغمورة تماما في المخازن المؤقتة ولا عائمة فوق المخزن المؤقت. يجب أن تكون كل خطوة المؤداة مع بويضات 20 أو أقل في كل بئر. - نقل بويضات الثابتة إلى 500 ميكروليتر من المخزن المؤقت للمياه والصرف الصحي (البنك الدولي هو موضح في الخطوة 1، 6) لمدة 10 دقائق. كرر 2 مرات أكثر.
- احتضان بويضات في المخزن المؤقت بيرميبيليزيشن لمدة 30 دقيقة في درجة حرارة الغرفة.
ملاحظة: يستبدل permeabilization المخزن المؤقت هو موضح في الخطوة 1، 7 المخزن المؤقت permeabilization الملاءمة.- جمع مجموعات التحقيق وتدور بسرعة منهم إلى أسفل في ميكروسينتريفوجي. الحارة المسبار كل تعيين لمدة 10 دقائق في حمام الماء 40 درجة مئوية أو حاضنة. باردة لدرجة حرارة الغرفة.
ملاحظة: يجب تنفيذ هذه الخطوة أثناء حضانة بيرميبيليزيشن
- جمع مجموعات التحقيق وتدور بسرعة منهم إلى أسفل في ميكروسينتريفوجي. الحارة المسبار كل تعيين لمدة 10 دقائق في حمام الماء 40 درجة مئوية أو حاضنة. باردة لدرجة حرارة الغرفة.
- أغسل بويضات في 500 ميليلتر من البنك الدولي لمدة 10 دقائق في درجة حرارة الغرفة.
- نقل بويضات إلى 80 ميكروليتر من "المخزن الثالث مبطلات" (متاح من kit)، الذي هو المخفف 1:8 في برنامج تلفزيوني X 1، لمدة 30 دقيقة في درجة حرارة الغرفة.
ملاحظة: حجم ميليلتر 80 كاف يغطي الجزء السفلي من بئر منفردة في لوحة 6-جيدا. - أغسل بويضات في 500 ميليلتر من البنك الدولي لمدة 10 دقائق في درجة حرارة الغرفة.
- تمييع مجموعات مسبار حرارة نانج، Pou5f1، و دابب (جين مراقبة سلبية)، 01:50 في التحقيق مخفف. احتضان بويضات في 80 ميكروليتر من التحقيقات الخاصة بنسخة لمدة ساعتين في 40 درجة مئوية.
ملاحظة: يتوفر كل مجموعة التحقيق الملكية في واحدة من ثلاث قنوات الفلورية (C1 و C2 و C3). كانت المعلمة المسابير نانج و Pou5f1 مع C2 و C3، على التوالي. - الحارة الملكية، 1 مكبر للصوت (1 أمبير)، مكبر للصوت 2 (AMP2)، 3 (AMP3) من مكبر للصوت ومكبر للصوت 4-الأسفار (أمبير 4-فلوريدا) في درجة حرارة الغرفة.
ملاحظة: يجب تنفيذ هذه الخطوة أثناء الاحتضان 2 ساعة خاصة بمحضر التحقيق. - نقل بويضات إلى 500 ميكروليتر من البنك الدولي، واحتضان لمدة 10 دقائق في درجة حرارة الغرفة.
- احتضان بويضات التتابع في المخازن المؤقتة للتضخيم.
- احتضان بويضات في 80 ميليلتر من AMP1 مدة 30 دقيقة في 40° C. نقل بويضات إلى 500 ميليلتر من البنك الدولي لمدة 10 دقائق في درجة حرارة الغرفة.
- احتضان بويضات في 80 ميليلتر من AMP2 لمدة 15 دقيقة عند 40 درجة مئوية. نقل بويضات إلى 500 ميليلتر من البنك الدولي لمدة 10 دقائق في درجة حرارة الغرفة.
- احتضان بويضات في 80 ميليلتر من AMP3 لمدة 30 دقيقة عند 40 درجة مئوية. نقل بويضات إلى 500 ميليلتر من البنك الدولي لمدة 10 دقائق في درجة حرارة الغرفة.
ملاحظة: يتم تنفيذ ما تبقى البروتوكول في الظلام لامبير-فلوريدا يحتوي فلوروفوري. عندما تعمل تحت مجهر تشريح، تقليل الضوء قدر الإمكان. - إضافة بويضات إلى 80 ميكروليتر من فلوريدا AMP4 لمدة 15 دقيقة عند 40 درجة مئوية.
ملاحظة: يتوفر كبديل فلوريدا AMP4 المخزن المؤقت-أ (Alt-أ)، ب Alt أو Alt-جيم. حدد فلوريدا AMP4 المخزن المؤقت تعتمد على الانبعاثات الطول الموجي هو المطلوب.
- أغسل بويضات في 500 ميليلتر من البنك الدولي لمدة 10 دقائق في درجة حرارة الغرفة. احتضان بويضات في 80 ميليلتر من DAPI لمدة 20 دقيقة في درجة حرارة الغرفة. أغسل بويضات في 500 ميليلتر من البنك الدولي لمدة 5 دقائق في درجة حرارة الغرفة.
- "الماصة؛" 12 ميليلتر لوسائل الإعلام يتلاشى لمكافحة تصاعد في وسط الشريحة دون إضافة فقاعات للكاشف. نقل بويضات مع البنك الدولي صغيرة قدر الإمكان في وسائل الإعلام المتزايدة وتطبيق ساترة.
- إمالة ساترة في زاوية ومكان ببطء لطف عبر السائل على الشريحة. تجنب الضغط ساترة من الصعب جداً لمنع التشويه من بويضات ومقدمة من الفقاعات.
- تخزين الشرائح في مربع الظلام للمبيت جاف في درجة حرارة الغرفة. معطف حواف الشرائح في طلاء الأظافر واضحة لختم ساترة.
- استخدام مجهر قياسية للبحث عن بويضات على الشريحة والدائرة مع علامة دائمة.
ملاحظة: هذه الخطوة غير مطلوبة، لكن يحسن بويضات تحديد موقع على الشريحة. للحصول على أفضل النتائج، سوف تبدأ شرائح الصورة 1 إلى 5 أيام كإشارة الفلورسنت تتلاشى.
4. معالجة الصورة
- صورة بويضات ثلاثي الأبعاد، باستخدام z خطوة الفحص المجهري [كنفوكل].
ملاحظة: لدقة تحليل الصور، يجب أن تكون كل خطوة ض 1.0 ميكرومتر/شريحة. - حفظ الصور [كنفوكل] nd2 مضغوطة أو الفردية. ملفات TIFF لكل البويضات. كل أنواع الصور متوافقة مع برنامج معالجة الصورة المصدر المفتوح، فيجي.
- تنزيل وتثبيت البرنامج فيجي الوصول المفتوح (https://imagej.net/Fiji/Downloads).
- اسحب الملفات nd2 في فيجي واختر هايبرستاك. إذا تم حفظ الصور [كنفوكل]. ملفات TIFF قم بالتخطي إلى الخطوة 4، 4.
ملاحظة: عندما يتم إسقاط الملف nd2 في فيجي القائمة المنسدلة هايبرستاك يجب أن تظهر تلقائياً. - انقر فوق علامة التبويب صورة ، حدد اللون، وانقر فوق تقسيم القنوات لفصل القنوات الفلورسنت من الملف nd2.
- توليد الفردية. ملفات TIFF لكل شريحة ض من البويضات في كل قناة الفلورسنت. انقر فوق علامة التبويب صورة وحدد مكدساتانقر فوق مكدس للصور. انقر فوق علامة التبويب صورة ، حدد نوع، وانقر فوق لون RGB لتحويل كل شريحة z إلى صورة لون RGB فردية.
ملاحظة: لون RGB مصطنع ويمكن أن يكون تم اختيارها كالمطلوب لكل طول موجي الانبعاثات. - حفظ كل صورة تم تحويلها. ملف TIFF. ضع الصور من البويضيه واحد لكل قناة الفلورسنت في مجلد جديد لتجنب الارتباك أثناء خياطة (الخطوة 4، 3).
- اسحب الملفات nd2 في فيجي واختر هايبرستاك. إذا تم حفظ الصور [كنفوكل]. ملفات TIFF قم بالتخطي إلى الخطوة 4، 4.
- تطبيع كل منهما. صورة TIFF Pou5f1 و نانج استخدام الصور السلبية التحكم (دابب).
ملاحظة: يتم التطبيع باستخدام برنامج تحرير صور. تأكد من إزالة نفس مستويات الخلفية الفلورية من كل عنصر تحكم الصورة. - فتح كل تطبيع. ملف TIFF في فيجي لغرزة معا جميع z-شرائح لكل البويضات في كل طول موجي.
- انقر فوق علامة التبويب ملحقات ، حدد ستيتشينج، وانقر فوق الشبكة/جمع (الشكل 3A). حدد صور متسلسلة من القائمة المنسدلة و انقر فوق موافق (الشكل 3B).
- استعراض الدليل وحدد المجلد الذي يحتوي على جميع الصور z-شرائح البويضيه فردية في طول موجي واحد (راجع الخطوة 4.3.4). انقر فوق "موافق".
- حرك مربع التمرير في الجزء السفلي من الصورة مخيط في قناة اللون المناسب لطول الموجه المستخدمة وخلق صورة RGB مخيط النهائية بواسطة النقر فوق الصورة، وتحديد نوع، وانقر فوق لون RGB.
ملاحظة: سيتم استخدام هذه الصورة للأسفار كوانتيتيشن هو موضح في الخطوة 4، 6 أدناه.
- تحويل الصورة مخيط بالصورة المتوقعة الحد الأقصى 32-بت. انقر فوق الصورة، حدد نوع، وانقر فوق 32 بت (الشكل 3). حفظ هذه الصورة الجديدة. ملف TIFF.
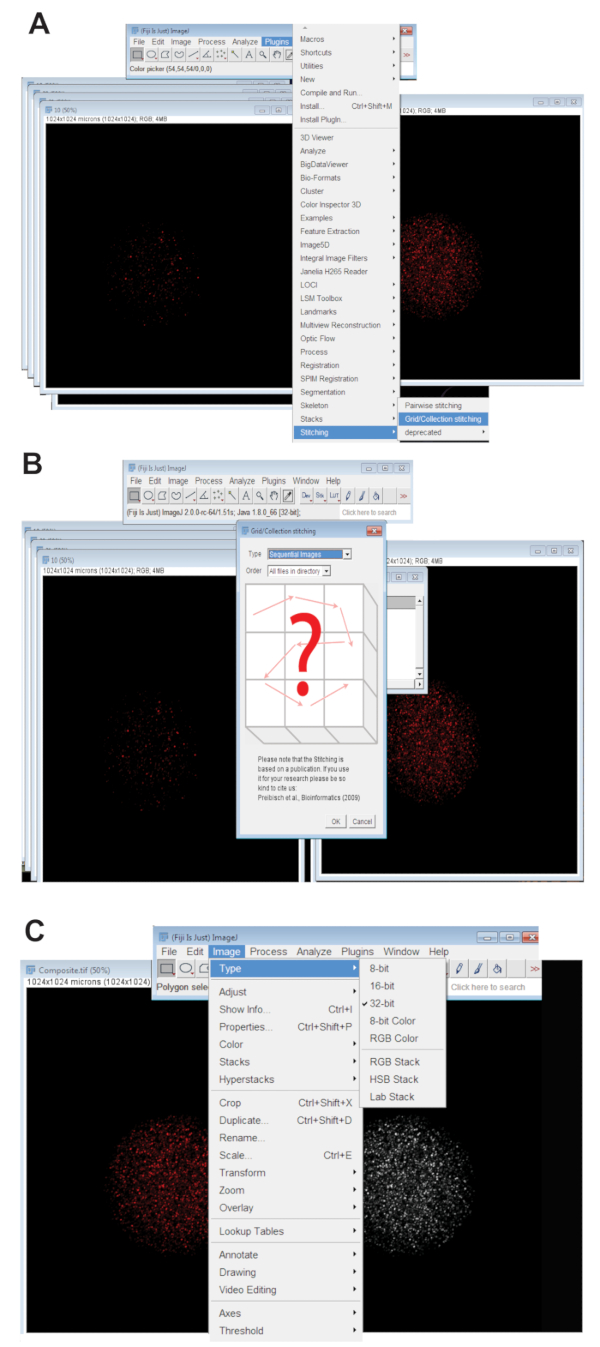
الشكل 3 : خياطة معا الصور [كنفوكل] ض سلسلة من بويضات. (أ) لقطة شاشة عرض أداة جمع "المكونات في" الشبكة في فيجي الذي تم استخدامه لإنتاج الصور المركبة للبويضات. (ب) يستخدم "صور متسلسلة" fluorescence التداخل بين متسلسلة. ملفات TIFF لتوليد صورة مركبة. (ج) تم حفظ صورة مركبة 32-بت. ملف TIFF. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
- تنزيل وتثبيت العثور على الفور وتتبع البرنامج13، الذي يتوفر من موقع د. لارسون، محقق في المعاهد من معهد الصحة الوطني الوطني السرطان (https://ccr.cancer.gov/Laboratory-of-Receptor-Biology-and-Gene-Expression/daniel-r-larson). تنزيل وتثبيت الجهاز الظاهري الوصول المفتوح لنظام التشغيل واللغة (IDL) البيانات التفاعلية التي مطلوب لتشغيل العثور على الفور وتتبع البرنامج (http://www.spacewx.com/pdf/idlvm.pdf).
- قم بفتح الصورة 32-بت، مخيط، والتي تم إنشاؤها في الخطوة 4، 6 (الشكل 4 أ)، في العثور على الفور وتتبع البرنامج. حدد Localize القائمة المنسدلة ثم انقر فوق Localize (الشكل 4 باء)، التي تقوم بحساب عدد البقع الموجودة في الصورة.
ملاحظة: كل بقعة عد يمثل مرناً فردية. يتم عرض إعدادات عتبة تمرير وفوتون الفرقة في الصورة (الشكل 4 باء). لهذا البروتوكول، تم استخدام الإعداد الافتراضي لكل إعداد عتبة. ويرد الممثل إيجابية والبقع الخلفية (الشكل 4).

الشكل 4 : التحديد الكمي مرناس استخدام "مكتشف البقعة" وتتبع. (أ) الصور الفردية ض سلسلة مخيط معا كما هو موضح في الشكل 3 وحفظها كحد أقصى 32 بت المتوقعة. ملف TIFF. (ب) فتح الصورة المركبة في الباحث عن بقعة وتتبع. تعريب استخدمت لحساب عدد البقع الفلورسنت (المربع الأحمر). يتم الإشارة إلى عتبة النجاح وفوتون الفرقة بالمربع الأزرق. (ج) السهم الأزرق يشير إلى إشارة إيجابية (العتبة). السهم الأبيض يظهر الفلورسنت بقعة تحت العتبة و، ولذلك لا تحسب. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
النتائج
عند انتهاء البروتوكول، وسوف تكون النتيجة صور منفردة من سلسلة z [كنفوكل] (4A الشكل و الشكل 5)، مخيط الصور (الشكل 4)، وتحسب مرناً (الشكل 4)- عندما يتم إجراء الإرسال المتعدد، سيكون هناك أ?...
Discussion
سوف تضمن سلسلة من الخطوات البسيطة خلال البروتوكول fluorescence ناجحة ودقيقة تهم مرناس. أولاً، يجب إجراء البروتوكول فورا بعد جمع والتثبيت لبويضات. لاحظ أن تتم إضافة حماية الأصناف النباتية إلى المخزن المؤقت التثبيت بارافورمالدهيد 4% لمنع بويضات من الالتصاق ببعضها البعض. وجدنا أنه من الضروري إجرا...
Disclosures
الكتاب لا تمت بصلة إلى إعلان
Acknowledgements
ونحن نشكر الدكتور دانييل ر. لارسون لمساعدته السخية مع تركيب واستخدام ل العثور على الفور وتتبع البرنامج 13 والدعم التقني لجامعة نبراسكا لنكولن مجهرية الأساسية للتصوير المجهري [كنفوكل]. هذه الدراسة يمثل مساهمة من جامعة "نبراسكا شعبة البحوث الزراعية"، لينكولن في نبراسكا، وتدعمها "أموال هاتش نتحدث عنه" (NEB-26-206/الانضمام رقم-232435 ورقم NEB-26-231/الانضمام-1013511).
Materials
| Name | Company | Catalog Number | Comments |
| (±)-α-Lipoic acid | Sigma-Aldrich | T1395 | Alpha Lipoic Acid |
| Albumin, Bovine Serum, Low Fatty Acid | MP Biomedicals, LLC | 199899 | FAF BSA |
| BD 10mL TB Syringe | Becton, Dickinson and Company | 309659 | 10 mL syringe |
| BD PrecisionGlide Needle | Becton, Dickinson and Company | 305109 | 27 1/2 gauge needle |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | CaCl2-2H2O |
| Citric acid | Sigma-Aldrich | C2404 | Citrate |
| D-(+)-Glucose | Sigma-Aldrich | G6152 | Glucose |
| Disodium phosphate | Na2HPO4 | ||
| Easy Grip Petri Dish | Falcon Corning | 351008 | 35 mm dish |
| Edetate Disodium | Avantor | 8994-01 | EDTA |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | Straight, Sharp/Sharp, non-serrated, 13mm cutting edge scissors |
| Fetal Bovine Serum | Atlanta biologicals | S10250 | FBS |
| Gentamicin Reagent Solution | gibco | 15710-064 | Gentamicin |
| GlutaMAX-I (100X) | gibco | 35050-061 | Glutamax |
| Gold Seal Micro Slides | Gold Seal | 3039 | 25 x 75mm slides |
| Gonadotropin, From Pregnant Mares' Serum | Sigma | G4877 | eCG |
| hCG recombinant | NHPP | AFP8456A | hCG |
| Hyaluronidase, Type IV-S: From Bovine Testes | Sigma-Aldrich | H3884 | Hyaluronidase |
| Jewelers Style Forceps | Integra | 17-305X | Forceps 4-3/8", Style 5F, Straight, Micro Fine Jaw |
| L-(+)-Lactic Acid, free acid | MP Biomedicals, LLC | 190228 | L-Lactate |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M2773 | MgSO4-7H2O |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | NEAA |
| Microscope Cover Glass | Fisher Scientific | 12-542-C | 25 x 25x 0.15 mm cover slips |
| Mm-Nanog-O2-C2 RNAscope Probe | Advanced Cell Diagnostics | 501891-C2 | Nanog Probe |
| Mm-Pou5f1-O1-C3 RNAscope Probe | Advanced Cell Diagnostics | 501611-C3 | Pou5f1 Probe |
| MOPS | Sigma-Aldrich | M3183 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | Paraformaldehyde |
| PES 0.22 um Membrane -sterile | Millex-GP | SLGP033RS | 0.22 um filters |
| Polyvinylpyrrolidone | Sigma-Aldrich | P0930 | PVP |
| Potassium chloride | Sigma-Aldrich | 60128 | KCl |
| Potassium phosphate monobasic | Sigma-Aldrich | 60218 | KH2PO4 |
| Prolong Gold antifade reagent | invitrogen | P36934 | Antifade reagent without DAPI |
| RNAscope DAPI | Advanced Cell Diagnostics | 320858 | DAPI |
| RNAscope FL AMP 1 | Advanced Cell Diagnostics | 320852 | Amplifier 1 |
| RNAscope FL AMP 2 | Advanced Cell Diagnostics | 320853 | Amplifier 2 |
| RNAscope FL AMP 3 | Advanced Cell Diagnostics | 320854 | Amplifier 3 |
| RNAscope FL AMP 4 ALT A | Advanced Cell Diagnostics | 320855 | Amplifier 4 ALT A |
| RNAscope FL AMP 4 ALT B | Advanced Cell Diagnostics | 320856 | Amplifier 4 ALT B |
| RNAscope FL AMP 4 ALT C | Advanced Cell Diagnostics | 320857 | Amplifier 4 ALT C |
| RNAscope Fluorescent Multiplex Detection Reagents Kit | Advanced Cell Diagnostics | 320851 | FISH Reagent Kit |
| RNAscope Probe 3-plex Negative Control Probe | Advanced Cell Diagnostics | 320871 | Negative Control |
| RNAscope Probe 3-plex Positive Control | Advanced Cell Diagnostics | 320881 | Positive Control |
| RNAscope Probe Diluent | Advanced Cell Diagnostics | 300041 | Probe Diluent |
| RNAscope Protease III | Advanced Cell Diagnositics | 322337 | Protease III |
| RNAscope Protease III & IV Reagent Kit | Advanced Cell Diagnostics | 322340 | FISH Protease Kit |
| RNAscope Protease IV | Advanced Cell Diagnostics | 322336 | Protease IV |
| S/S Needle with Luer Hub 30G | Component Supply Co. | NE-301PL-50 | blunt 30 gauge needle |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma-Aldrich | S6191 | NaCl |
| Sodium hydroxide | Sigma-Aldrich | 306576 | NaOH |
| Sodium pyruvate, >= 99% | Sigma-Aldrich | P5280 | Pyruvate |
| Solution 6 Well Dish | Agtechinc | D18 | 6 well dish |
| Taurine | Sigma-Aldrich | T8691 | Taurine |
| Tissue Culture Dish | Falcon Corning | 353002 | 60 mm dish |
| Triton X-100 | Sigma-Aldrich | X100 | Triton X-100 |
References
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proceedings of the National Academy of Sciences. 96 (16), 9236-9241 (1999).
- MacK, E. M., Smith, J. E., Kurz, S. G., Wood, J. R. CAMP-dependent regulation of ovulatory response genes is amplified by IGF1 due to synergistic effects on Akt phosphorylation and NF-kB transcription factors. Reproduction. 144 (5), 595-602 (2012).
- Xie, F., Timme, K. A., Wood, J. R. Using Single Molecule mRNA Fluorescent in Situ Hybridization (RNA-FISH) to Quantify mRNAs in Individual Murine Oocytes and Embryos. Scientific Reports. 8 (1), 7930 (2018).
- Ruebel, M. L., et al. Obesity modulates inflammation and lipidmetabolism oocyte gene expression: A single-cell transcriptome perspective. Journal of Clinical Endocrinology and Metabolism. 102 (6), 2029-2038 (2017).
- Borensztein, M., Syx, L., Servant, N., Heard, E. . Mouse Oocyte Development. 1818, 51-65 (2018).
- Jansova, D., Tetkova, A., Koncicka, M., Kubelka, M., Susor, A. Localization of RNA and translation in the mammalian oocyte and embryo. PLoS ONE. 13 (3), 1-25 (2018).
- Player, A. N., Shen, L. P., Kenny, D., Antao, V. P., Kolberg, J. A. Single-copy gene detection using branched DNA (bDNA) in situ hybridization. Journal of Histochemistry and Cytochemistry. 49 (5), 603-611 (2001).
- Wang, F., et al. RNAscope: A novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Itzkovitz, S., van Oudenaarden, A. Validating transcripts with probes and imaging technology. Nature Methods. 8 (4), S12-S19 (2011).
- Derti, A., et al. ProbeDesigner: for the design of probesets for branched DNA (bDNA) signal amplification assays. Bioinformatics. 15 (5), 348-355 (1999).
- Larson, B., Malayter, D., Shure, M. Multiplexed Detection of Cytokine Cancer Biomarkers using Fluorescence RNA In Situ Hybridization and Cellular Imaging. BioTek Application Notes. , 1-5 (2016).
- Buxbaum, A. R., Wu, B., Singer, R. H. Single β-Actin mRNA Detection in Neurons Reveals a Mechanism for Regulating Its Translatability. Science. 343 (6169), 419-422 (2014).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Herrick, J. R., Paik, T., Strauss, K. J., Schoolcraft, W. B., Krisher, R. L. Building a better mouse embryo assay: effects of mouse strain and in vitro maturation on sensitivity to contaminants of the culture environment. Journal of Assisted Reproduction and Genetics. 33 (2), 237-245 (2016).
- Pohlmeier, W. E., Xie, F., Kurz, S. G., Lu, N., Wood, J. R. Progressive obesity alters the steroidogenic response to ovulatory stimulation and increases the abundance of mRNAs stored in the ovulated oocyte. Molecular Reproduction and Development. 81 (8), 735-747 (2014).
- Xie, F., Anderson, C. L., Timme, K. R., Kurz, S. G., Fernando, S. C., Wood, J. R. Obesity-dependent increases in oocyte mRNAs are associated with increases in proinflammatory signaling and gut microbial abundance of lachnospiraceae in female mice. Endocrinology. 157 (4), 1630-1643 (2016).
- Hirao, Y., Yanagimachi, R. Detrimental effect of visible light on meiosis of mammalian eggs in vitro. Journal of Experimental Zoology. , (1978).
- Takenaka, M., Horiuchi, T., Yanagimachi, R. Effects of light on development of mammalian zygotes. Proceedings of the National Academy of Sciences. 104 (36), 14293-14293 (2007).
- Komminoth, P., Werner, M. Target and signal amplification: Approaches to increase the sensitivity of in situ hybridization. Histochemistry and Cell Biology. 108 (4-5), 325-333 (1997).
- Hornick, J. E., Duncan, F. E., Shea, L. D., Woodruff, T. K. Multiple follicle culture supports primary follicle growth through paracrine-acting signals. Reproduction. 145 (1), 19-32 (2013).
- Vlasova-St. Louis, I., Bohjanen, P. Feedback Regulation of Kinase Signaling Pathways by AREs and GREs. Cells. 5 (1), 4 (2016).
- Gilbert, C., Svejstrup, J. Q. RNA Immunoprecipitation for Determining RNA-Protein Associations In Vivo. Current Protocols in Molecular Biology. 75 (1), 27.4.1-27.4.11 (2006).
- Kwon, S., Chin, K., Nederlof, M., Gray, J. W. Quantitative, in situ analysis of mRNAs and proteins with subcellular resolution. Scientific Reports. 7 (1), 16459 (2017).
- Voigt, F., et al. Single-Molecule Quantification of Translation-Dependent Association of mRNAs with the Endoplasmic Reticulum. Cell Reports. 21 (13), 3740-3753 (2017).
- Halstead, J. M., Wilbertz, J. H., Wippich, F., Lionnet, T., Ephrussi, A., Chao, J. A. TRICK: A Single-Molecule Method for Imaging the First Round of Translation in Living Cells and Animals. Methods in Enzymology. 572, (2016).
- Cookson, W., Liang, L., Abecasis, G., Moffatt, M., Lathrop, M. Mapping complex disease traits with global gene expression. Nature Reviews Genetics. 10 (3), 184-194 (2009).
- Houle, D., Govindaraju, D. R., Omholt, S. Phenomics: the next challenge. Nature Reviews Genetics. 11, 855 (2010).
- Freimer, N., Sabatti, C. The Human Phenome Project. Nature Genetics. 34, 15 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved