需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
单分子荧光原位杂交 (SM-FISH) 在小鼠卵母细胞中 Mrna 的定量和定位
摘要
为了可重复地计数单个卵母细胞中的 Mrna 数量, 对非粘附细胞的单分子 RNA 荧光原位杂交 (RNA-FISH) 进行了优化。卵母细胞被收集, 与转录特异性探针杂交, 并使用图像定量软件进行量化。
摘要
目前用于量化卵母细胞和胚胎中 mRNA 的方法包括数字逆转录聚合酶链反应 (dPCR)、定量、实时 RT-PCR (RT-qPCR) 和 RNA 测序。当使用单个卵母细胞或胚胎进行这些技术时, 低拷贝 Mrna 无法可靠地检测到。为了克服这个问题, 卵母细胞或胚胎可以聚集在一起进行分析;然而, 这往往会导致样品之间的高变异性。在这个协议中, 我们描述了使用分支 DNA 化学的荧光原位杂交 (FISH) 的使用。此技术标识单个单元格中 Mrna 的空间模式。当该技术与现场查找和跟踪计算机软件相结合时, 细胞中 Mrna 的丰度也可以量化。使用这种技术, 实验组内的变异性降低, 检测实验组之间显著差异所需的卵母细胞和胚胎较少。商用分枝 dna SM-FISH 试剂盒已经过优化, 可检测切片组织或幻灯片上粘附细胞中的 Mrna。然而, 卵母细胞不能有效地粘附在滑块和一些试剂盒中的一些试剂过于苛刻, 导致卵母细胞裂解。为了防止这种裂解, 对 FISH 试剂盒进行了一些修改。具体而言, 为卵母细胞和胚胎的免疫荧光而设计的卵母细胞渗透和洗涤缓冲液取代了专有的缓冲液。在6孔板中进行了具有探头和放大器的渗透、洗涤和孵化, 并在协议末尾使用安装介质将卵母细胞放置在幻灯片上。这些修改能够克服商业上可获得的试剂盒的限制, 特别是卵母细胞裂解。为了准确、可重复地计算单个卵母细胞中 Mrna 的数量, 使用了计算机软件。该协议共同代表了 PCR 和测序的替代方案, 用于比较单个细胞中特定转录的表达。
引言
逆转录酶聚合酶链反应 (PCR) 已成为 mRNA 定量的黄金标准。目前使用的是数字 PCR (dPCR)1和定量实时 Pcr( qpcr) 2 两种检测方法。在两种 PCR 技术中, dPCR 的灵敏度高于 qPCR, 表明它可用于测量单个细胞中的 mRNA 丰度。然而, 在我们手中, dPCR 分析低丰度 Mrna 池5至10个卵母细胞每个实验样本产生的数据具有低重现性和高变异3。这可能是由于与 RNA 提取和逆转录酶效率相关的实验错误。Rna 测序也使用单个小鼠和人类卵母细胞4,5进行。这种技术需要图书馆生成所需的 cDNA 扩增步骤, 这可能会增加实验组内的可变性。此外, 低丰度成绩单可能无法检测到。虽然测序价格在过去几年有所下降, 但由于生物信息学分析的成本很高, 测序价格仍然可能高得令人望而却步。最后, mRNA 定位是一个动态过程, 空间变化对蛋白质功能有影响。因此, 我们开始采用一种技术, 将产生准确和可重复的定量措施和定位单个卵母细胞中的单个 Mrna。
分支 dna 与荧光原位杂交结合, 可放大荧光信号, 而不是放大 nnacdna, 从而能够检测单个细胞7,8,9中的单个 mrna。该检测是通过一系列的杂交, 扩增 (使用分支 DNA), 和荧光标记步骤, 以放大荧光信号7。该技术从结合 18---------------------------------------------------------------------------------------------为每个转录记录设计了15到20对探针对, 以确保目标转录的特殊性。Mrna 特异性杂交之后是前放大器和放大器探头, 形成分支配置。大约400个标签荧光与每个放大器结合在一起, 从而使荧光增加 8000倍, 从而可以检测到单个 Mrna (图 1)11。
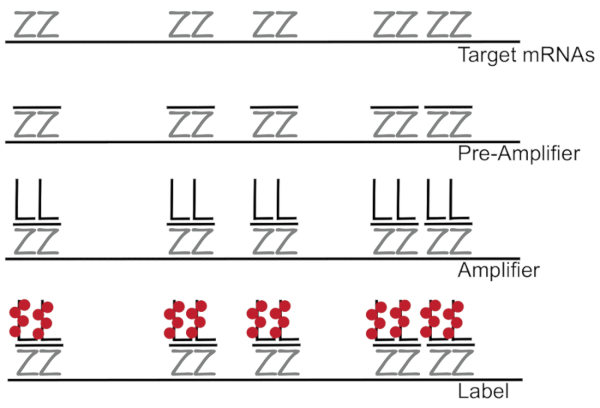
图 1: sm-fish 协议的原理图.结果显示了转录特异性探针、分支 DNA 放大器和荧光体与靶向 mRNA 的顺序杂交。请点击这里查看此图的较大版本.
以往的研究使用单分子荧光原位杂交 ( SM - FISH ) 局部β - 肌动蛋白 Mrna 在单个神经元 12 和人状瘤病毒 dna 在宫颈癌细胞系 7。计算机软件 "现场查找和跟踪程序" 可识别单个点点荧光信号, 并已成功地用于量化每个单元3、13 中的 mrna 数量。
根据神经元12中 mrna 检测的结果, 我们假设 sm-fish 将被证明是一个有用的工具, 用于定量小鼠卵母细胞和胚胎的转录水平, 包括低丰度 mrna。然而, 该技术是优化使用与粘附固定细胞和甲醛固定石蜡嵌入 (FFPE) 组织切片。卵母细胞不能粘附在滑块上, 即使它们被涂上多-l-赖氨酸。此外, 当在市售的试剂盒3中使用一些专有缓冲液时, 它们比体细胞和组织切片更脆弱, 从而导致细胞裂解。为了克服这些挑战, 卵母细胞被固定, 并在缓冲液滴之间手动转移。此外, 还更换了试剂盒中的渗透和洗涤缓冲液, 以减少细胞裂解。预先设计的探头与 FISH 套件一起购买, 或可以要求提供具体的成绩单。每个专有探针集都可以在三个荧光通道 (C1、C2 和 C3) 中的一个中使用, 以允许多路复用。在目前的实验中, 使用 C2 Nanog 探针和 C3 Pou5f1 探针对小鼠卵母细胞进行了双重染色和定量。这些探针是根据报道的纳诺格和Pou5f1在卵母细胞和胚胎中的表达情况选择的。在杂交步骤结束时, 卵母细胞被放置在防褪色安装介质的滴中, 用于组织学幻灯片。共聚焦图像被用来量化表示单个 Mrna 的点点荧光信号的数量。除了对 Mrna 进行量化外, 成像还显示了细胞中特定 mRNA 的空间分布, 而其他 RNA 定量方法是无法实现的。这项技术被证明在实验组中具有较低的变异性, 允许在每个实验组中使用较少数量的卵母细胞来识别实验组3之间的显著差异。
Access restricted. Please log in or start a trial to view this content.
研究方案
内布拉斯加州林肯大学动物护理和使用机构委员会审查并批准了动物程序, 所有方法都是按照相关准则和条例进行的。在这项研究中, CD-1 外繁殖的小鼠有正常的啮齿类动物食物和水;它们保持在12:12 的黑暗周期: 光循环中。
1. 准备所需的介质
- 对于基介质 (OMM), 加入 100 mM 氯化钠、5 mM KCl、0.5 mM kh 2 po 4 和 1.7Mm cl-2H 2o 至 100 ml无菌水.
注: OMM 介质最多可以存储1个月。 - 对于完整介质 (OMOPS), 添加 20 mM 3-吗啡-1-磺酸 (MM), 1.2 Mmmmmmmg4-7h2o,0.5 mm 葡萄糖, 6 mm l-乳酸, 1 mm ala-gln, 0.1 mm taurine, 1x 非必需氨基酸 (neaa), 0.01 mm 乙二胺四乙酸 (EDTA), 10μm α脂酸, 10μgml 未稀释庆大霉素, 21 mM 1 M NaOH, 5 mM NaHCO 3, 0.2 mm Pyruvate, 0.5 mm Cituate, 4mgml faf BSA 到 1:10 稀释 Omm 在无菌水中, 总体积为100毫升.用0.22μm 滤光片对介质进行灭菌。
注: OMOPS 最多可以存储1周。 - 对于持有培养基 (HM), 将5% 的胎牛血清添加到 OMOPS 中。每只老鼠做2毫升的 HM。
- 对于透明质酸酶溶液, 将从牛睾丸中提取的透明质酸酶添加 0.1 mgl, 达到1毫升 hm。
- 对于固定缓冲液, 将 1x PBS 10 毫升中4% 的甲醛与0.1% 的胚胎级聚乙烯醇吡咯烷酮 (PVP)14结合。
- 要制备50毫升洗涤缓冲液 (WB), 将0.1% 的非离子表面活性剂和0.1% 的 PVP 添加到 1x PBS14。
- 制备10毫升渗透缓冲液, 在 1x PBS14中加入1% 的非离子表面活性剂。
注: 上述洗涤和渗透缓冲液取代了商业上可获得的套件中的专有缓冲器。
2. 从雌性小鼠中收集排卵卵母细胞
- 制备:
- 在5-8 时, 通过腹腔内注射 5 iu 马绒毛膜促性腺激素 (ecg) 刺激雌性小鼠, 然后是5 iu 人绒毛膜促性腺激素 (hcg) 15-48小时后 15,16。
- 将含有2毫升 hm 的35毫米 Petri 培养皿放在37°c 的加热盘上。移液器一, 100μl 滴的 HM 含有稀释的透明质酸酶, 然后是 3, 50μl 滴的 HM, 没有透明质酸酶在60毫米的培养皿中。使用前, 请将含有滴的板材放在37°c 的加热板上。
注: 透明质酸酶滴量应在每个输卵管对解剖之前进行, 以防止有或没有透明质酸酶的 hm 成分的蒸发和浓度。
- 安乐死小鼠, 16小时后的 Ip 注射 hCG, 使用异氟醚过量后, 其次是宫颈脱位。
- 使用70% 乙醇清洁鼠标。暴露腹腔, 显示女性生殖道。用钳子握住卵巢, 从卵巢周围取出子宫韧带和多余的脂肪组织。将输卵管从子宫中切下来, 并将输卵管对放置在35毫米的温暖的 HM 中。
- 取出卵巢和任何周围的脂肪组织。用半英寸27规格的针撕开输卵管肿胀的壶腹。将输卵管推到撕裂部位, 将排出积液细胞卵母细胞复合物 (Coc)。将被排卵的卵母细胞 (假定为减数分裂中期 ii (MII)) 转移到含有透明质酸酶的 hm 介质的100μl 滴 (图 2)。
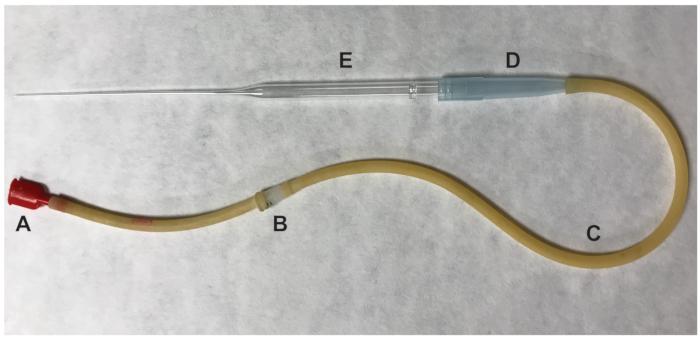
图 2: 用于转移卵母细胞的口腔移液器的一部分。(A)口片 (b) 0.22 um, 4mm 过滤器 (c)吸气管(d) 1000μl 管头(e) 9 "巴斯德管。请点击这里查看此图的较大版本.
- 在含有 HM 的透明质酸酶中, 将 MII 卵母细胞复合物向上和向下移液, 将口移液器移出积液细胞。将每个卵母细胞转移, 一旦它们没有积液细胞, 就会只使用口腔移液器将其转移到含有 HM 的洗碗液中。对每个洗液液滴重复此操作。不要转移碎裂或透明的卵母细胞15。
注: 重要的是要转移卵母细胞从每滴35毫米菜与尽可能少的 hm。这适用于协议中的每个传输。MII 卵母细胞不得在含有 HM 培养基的透明质酸酶中停留超过一分钟。
3. 小卵母细胞的染色
- 将卵母细胞固定在含有500μl 固定缓冲的6孔板的单个井中。将20个卵母细胞或更少的卵母细胞浸入井中。在室温下孵化20分钟。
注: 每个 SM-FISH 染色步骤发生在一个单独的井在一个6井圆锥形板。确保卵母细胞完全淹没在缓冲液中, 而不是漂浮在缓冲液的顶部。每个步骤应在每口井中使用20个或更少的卵母细胞执行。 - 将固定卵母细胞转移到500μl 的洗涤缓冲液 (步骤1.6 中描述的 WB), 每次10分钟。再重复2次。
- 在室温下将卵母细胞在渗透缓冲液中培养30分钟。
注: 步骤1.7 中描述的渗透缓冲液取代了适当的渗透缓冲。- 收集探头组, 并在微型离心机中快速旋转它们。在40°c 的水浴或孵化器中加热每个探头10分钟。冷却到室温。
注: 此步骤应在渗透培养过程中执行
- 收集探头组, 并在微型离心机中快速旋转它们。在40°c 的水浴或孵化器中加热每个探头10分钟。冷却到室温。
- 在室温下将 500Μl WB 中的卵母细胞洗干净10分钟。
- 将卵母细胞转移到80μl 的蛋白酶 III 缓冲液 (可从试剂盒中获得), 即在 1X PBS 中稀释 1:8, 在室温下30分钟。
注: 80μl 体积充分覆盖了6孔板中单个油井的底部。 - 在室温下将 500Μl WB 中的卵母细胞洗干净10分钟。
- 稀释加热探针组的 Nanog, Pou5f1和dapb (一个负控制基因), 1:50 在探针稀释。在40°c 条件下, 将转录特异性探针的80Μl 中培养2小时的卵母细胞。
注: 每个专有探针集可在三个荧光通道 (C1、C2 和 C3) 中的一个。分别用 C2 和 C3 标记了Nanog和Pou5f1探针。 - 在室温下加热专有放大器 1 (AMP 1)、放大器 2 (AMP2)、放大器 3 (AMP3) 和放大器4荧光 (AMP 4-FLUORESCENCE)。
注: 此步骤应在2小时的转录特异性探针培养过程中执行。 - 将卵母细胞转移到500Μl 的 WB, 并在室温下孵育10分钟。
- 在扩增缓冲液中依次培养卵母细胞。
- 在40°c 条件下, 将卵母细胞在 80μl AMP1 中培养 30分钟, 在室温下将卵母细胞转移到 500μl WB 10分钟。
- 在40°c 条件下, 将卵母细胞在 80Μl amp2 中培养15分钟。在室温下将卵母细胞转移到500Μl 的 WB, 10分钟。
- 在40°c 条件下, 将卵母细胞在 80ΜL amp3 中培养30分钟。在室温下将卵母细胞转移到500Μl 的 WB, 10分钟。
注: 协议的其余部分是在黑暗中执行的, 因为 AMP-FL 包含荧光体。在解剖显微镜下工作时, 尽量减少光线。 - 在40°c 下, 将卵母细胞加入80Μl 的 Amp4-fl 15分钟。
注: AMP4-FL 作为备选缓冲区 a (Alt-A)、Alt-A 或 Alt-A 提供。根据所需的发射波长选择 amp4-fl 缓冲区。
- 在室温下将 500Μl WB 中的卵母细胞洗干净10分钟。在室温下将卵母细胞在80Μl 的 DAPI 中培养20分钟。在室温下将 500Μl WB 中的卵母细胞洗干净5分钟。
- 将防褪色安装介质的液管12Μl 放在幻灯片的中心, 而不会在试剂中添加气泡。将尽可能少 WB 的卵母细胞转移到安装介质中, 并应用盖板。
- 将盖板倾斜一个角度, 然后慢慢轻轻地将其放置在滑块上的液体上。避免将盖板压得太紧, 以防止卵母细胞变形和气泡的引入。
- 将幻灯片存放在一个黑暗的盒子里, 在室温下过夜。将幻灯片的边缘涂上透明的指甲油, 以密封盖板。
- 使用标准显微镜在幻灯片和圆圈上找到卵母细胞, 并使用永久标记。
注: 此步骤不是必需的, 但可以改进在幻灯片上定位卵母细胞。为了获得最佳效果, 图像会在1至5天内滑动, 因为荧光信号将开始褪色。
4. 图像处理
- 图像的三维卵母细胞, 使用 z 步共聚焦显微镜。
注: 要准确分析图像, 每个 z 步骤应为1.0 微米切片。 - 将共聚焦图像另存为压缩的 nd2 或单个图像。每个卵母细胞的 TIFF 文件。这两种图像类型都与斐济的开源图像处理程序兼容。
- 下载并安装开放访问斐济软件 (https://imagej.net/Fiji/Downloads)。
- 将 nd2 文件拖到斐济, 然后选择超堆栈。如果共聚焦图像被保存为。TIFF 文件跳到步骤4.4。
注: 当 nd2 文件被放置到斐济时, 超堆栈下拉列表应自动显示。 - 单击 "图像" 选项卡, 选择颜色, 然后单击 "拆分通道" 以分隔 nd2 文件的荧光通道。
- 生成单个。每个荧光通道中卵母细胞的每个 z 片的 TIFF 文件。单击 "图像" 选项卡, 选择"堆栈", 然后单击 "堆叠到图像"。单击 "图像" 选项卡, 选择 "类型", 然后单击 " rgb 颜色", 将每个 z 切片转换为单独的 rgb 颜色图像。
注: RGB 颜色是人为的, 可根据需要为每个发射波长选择。 - 将每个转换后的图像另存为。TIFF 文件。将每个荧光通道的单个卵母细胞中的图像放在一个新文件夹中, 以避免在拼接过程中出现混淆 (步骤 4.3)。
- 将 nd2 文件拖到斐济, 然后选择超堆栈。如果共聚焦图像被保存为。TIFF 文件跳到步骤4.4。
- 将每个都归一化。使用负控制图像 (dapb) 为Pou5f1和nanog提供 tiff 图像。
注: 规范化是使用照片编辑程序执行的。确保从每个控制图像中删除相同级别的背景荧光。 - 打开每个规范化。TIFF 文件在斐济缝合所有 z 片的每个卵母细胞在每个波长。
- 单击 "插件" 选项卡, 选择"拼接", 然后单击"网格/集合" (图 3a)。从下拉菜单中选择"顺序图像" , 然后单击 "确定" (图 3 b)。
- 浏览目录并选择包含单个卵母细胞的所有 z 切片图像的文件夹 (请参阅步骤 4.3.4)。单击"确定"。
- 将拼接图像底部的滑块移动到所使用波长的相应颜色通道, 并通过单击 "图像"、"类型"和 " rgb 颜色" 来创建最终的 rgb 拼接图像。
注: 此图像将用于下文步骤4.6 中所述的荧光定量。
- 将拼接的图像转换为32位最大投影图像。单击 "图像", 选择 "类型", 然后单击 " 32位" (图 3c)。将此图像另存为新图像。TIFF 文件。
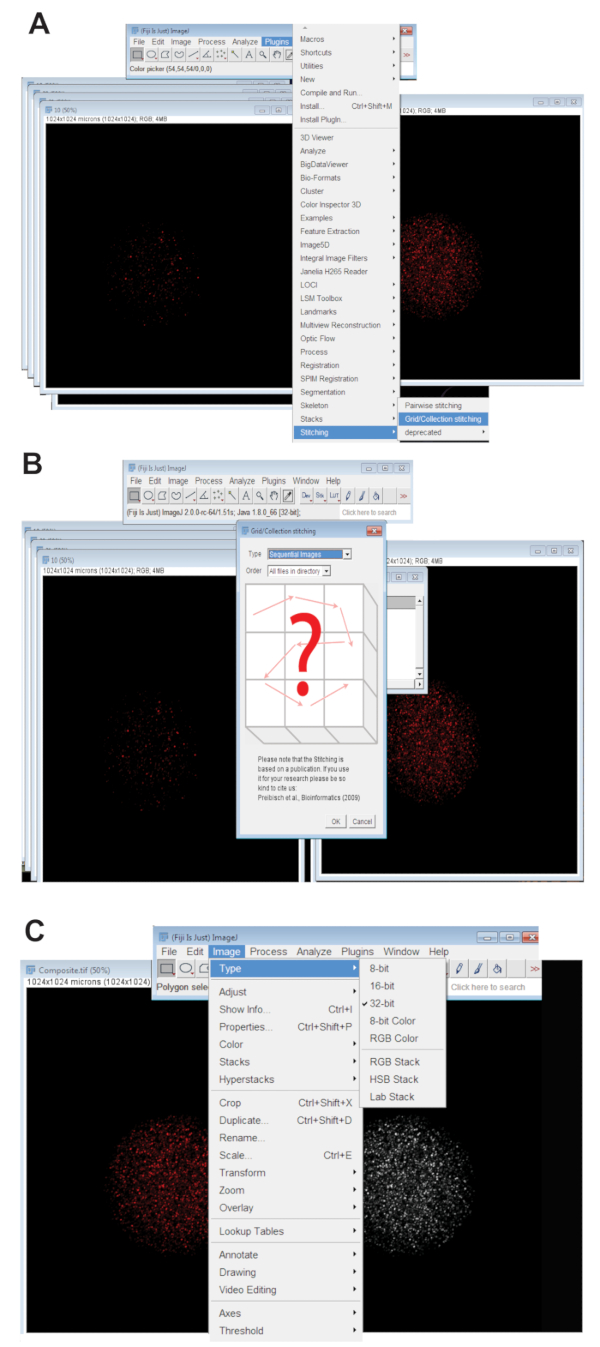
图 3: 将卵母细胞的共聚焦系列图像拼接在一起。(A)显示斐济插入式 gridw 收集工具的屏幕截图, 用于生成卵母细胞的复合图像。(B)序列图像使用荧光在顺序之间重叠。TIFF 文件生成复合映像。(C)复合映像保存为32位。TIFF 文件。请点击这里查看此图的较大版本.
- 下载并安装现场发现和跟踪计划 13, 该计划可在网站上提供给 d. r. 拉尔森, 美国国立卫生研究院 (https://ccr.cancer.gov/Laboratory-of-Receptor-Biology-and-Gene-Expression/daniel-r-larson) 的调查员。下载并安装交互式数据语言 (IDL) 操作系统的开放访问虚拟机, 该操作系统是运行现场查找和跟踪程序 (http://www.spacewx.com/pdf/idlvm.pdf) 所必需的。
- 打开在步骤 4.6 (图 4 a) 中生成的32位拼接图像, 在现场查找和跟踪程序中。选择 "本地化" 下拉列表, 然后单击 "本地化" (图 4b), 它将计算在图像中找到的数字点。
注: 每个点计数代表一个单独的 mRNA。带通和光子阈值设置显示在屏幕截图中 (图 4b)。对于此协议, 对每个阈值设置都使用默认值。显示了代表性的阳性和背景点 (图 4c)。

图 4: 使用现场查找器和跟踪对 Mrna 进行定量。(A)如图 3所示, 将单个 z 系列图像拼接在一起, 并保存为32位最大投影。TIFF 文件。(B)在 "点查找器" 和 "跟踪" 中打开了复合图像。局部化是用来计算荧光斑点 (红盒) 的。带通和光子阈值由蓝色框表示。(C)蓝色箭头指向正信号 (高于阈值)。白色箭头显示阈值以下的荧光点, 因此不计算在内。请点击这里查看此图的较大版本.
Access restricted. Please log in or start a trial to view this content.
结果
协议完成后, 结果将是来自共聚焦 z 系列(图 4 a 和图 5)、拼接图像(图 4A)和 mrna 计数(图 4A) 的单个图像。执行多路复用时, 还将有显示两个不同 Mrna 标签的合并图像(图 5)。MRNA 计数是使用斐济生成的缝合图像
Access restricted. Please log in or start a trial to view this content.
讨论
该协议中的一系列小步骤将确保 Mrna 的成功荧光和准确计数。首先, 在收集和固定卵母细胞后, 必须立即执行该协议。请注意, PVP 被添加到4% 的甲醛固定缓冲液中, 以防止卵母细胞相互粘附。我们发现, 在卵母细胞的收集和固定后, 有必要立即进行实验。任何延迟都会导致更低的荧光信号, 从而导致笔录的低估。这在一定程度上是由于 RNA 降解。一次不应将超过20个卵母细胞转移到6井板中的一个井, 每...
Access restricted. Please log in or start a trial to view this content.
披露声明
提交人没有什么可声明的
致谢
我们感谢 Daniel R. Larson 博士在安装和使用现场查找和跟踪计划13方面提供的慷慨帮助, 并感谢内布拉斯加州林肯大学显微镜核心公司为共聚焦显微镜成像提供的技术支持。这项研究是内布拉斯加州林肯市内布拉斯加州林肯大学农业研究司的一项贡献, 并得到 UNL 舱口基金的支持 (Neb-26-206 加入号-232435 和 Neb-26-23加入号-1013511)。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| (±)-α-Lipoic acid | Sigma-Aldrich | T1395 | Alpha Lipoic Acid |
| Albumin, Bovine Serum, Low Fatty Acid | MP Biomedicals, LLC | 199899 | FAF BSA |
| BD 10mL TB Syringe | Becton, Dickinson and Company | 309659 | 10 mL syringe |
| BD PrecisionGlide Needle | Becton, Dickinson and Company | 305109 | 27 1/2 gauge needle |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | CaCl2-2H2O |
| Citric acid | Sigma-Aldrich | C2404 | Citrate |
| D-(+)-Glucose | Sigma-Aldrich | G6152 | Glucose |
| Disodium phosphate | Na2HPO4 | ||
| Easy Grip Petri Dish | Falcon Corning | 351008 | 35 mm dish |
| Edetate Disodium | Avantor | 8994-01 | EDTA |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | Straight, Sharp/Sharp, non-serrated, 13mm cutting edge scissors |
| Fetal Bovine Serum | Atlanta biologicals | S10250 | FBS |
| Gentamicin Reagent Solution | gibco | 15710-064 | Gentamicin |
| GlutaMAX-I (100X) | gibco | 35050-061 | Glutamax |
| Gold Seal Micro Slides | Gold Seal | 3039 | 25 x 75mm slides |
| Gonadotropin, From Pregnant Mares' Serum | Sigma | G4877 | eCG |
| hCG recombinant | NHPP | AFP8456A | hCG |
| Hyaluronidase, Type IV-S: From Bovine Testes | Sigma-Aldrich | H3884 | Hyaluronidase |
| Jewelers Style Forceps | Integra | 17-305X | Forceps 4-3/8", Style 5F, Straight, Micro Fine Jaw |
| L-(+)-Lactic Acid, free acid | MP Biomedicals, LLC | 190228 | L-Lactate |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M2773 | MgSO4-7H2O |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | NEAA |
| Microscope Cover Glass | Fisher Scientific | 12-542-C | 25 x 25x 0.15 mm cover slips |
| Mm-Nanog-O2-C2 RNAscope Probe | Advanced Cell Diagnostics | 501891-C2 | Nanog Probe |
| Mm-Pou5f1-O1-C3 RNAscope Probe | Advanced Cell Diagnostics | 501611-C3 | Pou5f1 Probe |
| MOPS | Sigma-Aldrich | M3183 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | Paraformaldehyde |
| PES 0.22 um Membrane -sterile | Millex-GP | SLGP033RS | 0.22 um filters |
| Polyvinylpyrrolidone | Sigma-Aldrich | P0930 | PVP |
| Potassium chloride | Sigma-Aldrich | 60128 | KCl |
| Potassium phosphate monobasic | Sigma-Aldrich | 60218 | KH2PO4 |
| Prolong Gold antifade reagent | invitrogen | P36934 | Antifade reagent without DAPI |
| RNAscope DAPI | Advanced Cell Diagnostics | 320858 | DAPI |
| RNAscope FL AMP 1 | Advanced Cell Diagnostics | 320852 | Amplifier 1 |
| RNAscope FL AMP 2 | Advanced Cell Diagnostics | 320853 | Amplifier 2 |
| RNAscope FL AMP 3 | Advanced Cell Diagnostics | 320854 | Amplifier 3 |
| RNAscope FL AMP 4 ALT A | Advanced Cell Diagnostics | 320855 | Amplifier 4 ALT A |
| RNAscope FL AMP 4 ALT B | Advanced Cell Diagnostics | 320856 | Amplifier 4 ALT B |
| RNAscope FL AMP 4 ALT C | Advanced Cell Diagnostics | 320857 | Amplifier 4 ALT C |
| RNAscope Fluorescent Multiplex Detection Reagents Kit | Advanced Cell Diagnostics | 320851 | FISH Reagent Kit |
| RNAscope Probe 3-plex Negative Control Probe | Advanced Cell Diagnostics | 320871 | Negative Control |
| RNAscope Probe 3-plex Positive Control | Advanced Cell Diagnostics | 320881 | Positive Control |
| RNAscope Probe Diluent | Advanced Cell Diagnostics | 300041 | Probe Diluent |
| RNAscope Protease III | Advanced Cell Diagnositics | 322337 | Protease III |
| RNAscope Protease III & IV Reagent Kit | Advanced Cell Diagnostics | 322340 | FISH Protease Kit |
| RNAscope Protease IV | Advanced Cell Diagnostics | 322336 | Protease IV |
| S/S Needle with Luer Hub 30G | Component Supply Co. | NE-301PL-50 | blunt 30 gauge needle |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma-Aldrich | S6191 | NaCl |
| Sodium hydroxide | Sigma-Aldrich | 306576 | NaOH |
| Sodium pyruvate, >= 99% | Sigma-Aldrich | P5280 | Pyruvate |
| Solution 6 Well Dish | Agtechinc | D18 | 6 well dish |
| Taurine | Sigma-Aldrich | T8691 | Taurine |
| Tissue Culture Dish | Falcon Corning | 353002 | 60 mm dish |
| Triton X-100 | Sigma-Aldrich | X100 | Triton X-100 |
参考文献
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proceedings of the National Academy of Sciences. 96 (16), 9236-9241 (1999).
- MacK, E. M., Smith, J. E., Kurz, S. G., Wood, J. R. CAMP-dependent regulation of ovulatory response genes is amplified by IGF1 due to synergistic effects on Akt phosphorylation and NF-kB transcription factors. Reproduction. 144 (5), 595-602 (2012).
- Xie, F., Timme, K. A., Wood, J. R. Using Single Molecule mRNA Fluorescent in Situ Hybridization (RNA-FISH) to Quantify mRNAs in Individual Murine Oocytes and Embryos. Scientific Reports. 8 (1), 7930(2018).
- Ruebel, M. L., et al. Obesity modulates inflammation and lipidmetabolism oocyte gene expression: A single-cell transcriptome perspective. Journal of Clinical Endocrinology and Metabolism. 102 (6), 2029-2038 (2017).
- Borensztein, M., Syx, L., Servant, N., Heard, E. Mouse Oocyte Development. 1818, 51-65 (2018).
- Jansova, D., Tetkova, A., Koncicka, M., Kubelka, M., Susor, A. Localization of RNA and translation in the mammalian oocyte and embryo. PLoS ONE. 13 (3), 1-25 (2018).
- Player, A. N., Shen, L. P., Kenny, D., Antao, V. P., Kolberg, J. A. Single-copy gene detection using branched DNA (bDNA) in situ hybridization. Journal of Histochemistry and Cytochemistry. 49 (5), 603-611 (2001).
- Wang, F., et al. RNAscope: A novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Itzkovitz, S., van Oudenaarden, A. Validating transcripts with probes and imaging technology. Nature Methods. 8 (4), S12-S19 (2011).
- Derti, A., et al. ProbeDesigner: for the design of probesets for branched DNA (bDNA) signal amplification assays. Bioinformatics. 15 (5), 348-355 (1999).
- Larson, B., Malayter, D., Shure, M. Multiplexed Detection of Cytokine Cancer Biomarkers using Fluorescence RNA In Situ Hybridization and Cellular Imaging. BioTek Application Notes. , https://www.biotek.com/resources/application-notes/multiplexed-detection-of-cytokine-cancer-biomarkers-using-fluorescence-rna-in-situ-hybridization-and-cellular-imaging/ 1-5 (2016).
- Buxbaum, A. R., Wu, B., Singer, R. H. Single β-Actin mRNA Detection in Neurons Reveals a Mechanism for Regulating Its Translatability. Science. 343 (6169), 419-422 (2014).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Herrick, J. R., Paik, T., Strauss, K. J., Schoolcraft, W. B., Krisher, R. L. Building a better mouse embryo assay: effects of mouse strain and in vitro maturation on sensitivity to contaminants of the culture environment. Journal of Assisted Reproduction and Genetics. 33 (2), 237-245 (2016).
- Pohlmeier, W. E., Xie, F., Kurz, S. G., Lu, N., Wood, J. R. Progressive obesity alters the steroidogenic response to ovulatory stimulation and increases the abundance of mRNAs stored in the ovulated oocyte. Molecular Reproduction and Development. 81 (8), 735-747 (2014).
- Xie, F., Anderson, C. L., Timme, K. R., Kurz, S. G., Fernando, S. C., Wood, J. R. Obesity-dependent increases in oocyte mRNAs are associated with increases in proinflammatory signaling and gut microbial abundance of lachnospiraceae in female mice. Endocrinology. 157 (4), 1630-1643 (2016).
- Hirao, Y., Yanagimachi, R. Detrimental effect of visible light on meiosis of mammalian eggs in vitro. Journal of Experimental Zoology. , (1978).
- Takenaka, M., Horiuchi, T., Yanagimachi, R. Effects of light on development of mammalian zygotes. Proceedings of the National Academy of Sciences. 104 (36), 14293-14293 (2007).
- Komminoth, P., Werner, M. Target and signal amplification: Approaches to increase the sensitivity of in situ hybridization. Histochemistry and Cell Biology. 108 (4-5), 325-333 (1997).
- Hornick, J. E., Duncan, F. E., Shea, L. D., Woodruff, T. K. Multiple follicle culture supports primary follicle growth through paracrine-acting signals. Reproduction. 145 (1), 19-32 (2013).
- Vlasova-St. Louis, I., Bohjanen, P. Feedback Regulation of Kinase Signaling Pathways by AREs and GREs. Cells. 5 (1), 4(2016).
- Gilbert, C., Svejstrup, J. Q. RNA Immunoprecipitation for Determining RNA-Protein Associations In Vivo. Current Protocols in Molecular Biology. 75 (1), 27.4.1-27.4.11 (2006).
- Kwon, S., Chin, K., Nederlof, M., Gray, J. W. Quantitative, in situ analysis of mRNAs and proteins with subcellular resolution. Scientific Reports. 7 (1), 16459(2017).
- Voigt, F., et al. Single-Molecule Quantification of Translation-Dependent Association of mRNAs with the Endoplasmic Reticulum. Cell Reports. 21 (13), 3740-3753 (2017).
- Halstead, J. M., Wilbertz, J. H., Wippich, F., Lionnet, T., Ephrussi, A., Chao, J. A. TRICK: A Single-Molecule Method for Imaging the First Round of Translation in Living Cells and Animals. Methods in Enzymology. 572, Elsevier Inc. (2016).
- Cookson, W., Liang, L., Abecasis, G., Moffatt, M., Lathrop, M. Mapping complex disease traits with global gene expression. Nature Reviews Genetics. 10 (3), 184-194 (2009).
- Houle, D., Govindaraju, D. R., Omholt, S. Phenomics: the next challenge. Nature Reviews Genetics. 11, 855(2010).
- Freimer, N., Sabatti, C. The Human Phenome Project. Nature Genetics. 34, 15(2003).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。