A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام الارتجاع العصبي القائم على التصوير بالرنين المغناطيسي الوظيفي في الوقت الفعلي لتقليل تنظيم القشرة المعزولة لدى المدخنين المدمنين على النيكوتين
In This Article
Summary
في التصوير بالرنين المغناطيسي الوظيفي في الوقت الفعلي (rtfMRI) ، يتم التلاعب بنشاط الدماغ تجريبيا كمتغير مستقل ، ويتم قياس السلوك كمتغير تابع. يركز البروتوكول المقدم هنا على الاستخدام العملي للتصوير بالرنين المغناطيسي RTFكأداة علاجية للاضطرابات النفسية مثل إدمان النيكوتين.
Abstract
لقد مر أكثر من عقد من الزمان منذ أن تم تنفيذ أول نهج للارتجاع العصبي القائم على التصوير بالرنين المغناطيسي الوظيفي (fMRI) بنجاح. منذ ذلك الحين ، أظهرت دراسات مختلفة أنه يمكن للمشاركين تعلم التحكم الطوعي في منطقة الدماغ المقيدة. وبالتالي ، قدم التصوير بالرنين المغناطيسي الوظيفي في الوقت الفعلي (rtfMRI) فرصة جديدة لدراسة تعديلات السلوك بسبب التلاعب بنشاط الدماغ. ومن ثم ، فإن التقارير عن تطبيقات rtfMRI لتدريب التنظيم الذاتي لنشاط الدماغ والتعديلات المصاحبة في الحالات السلوكية والسريرية مثل الاضطرابات العصبية والنفسية [على سبيل المثال ، الفصام ، اضطراب الوسواس القهري (OCD) ، السكتة الدماغية] قد زادت بسرعة.
أظهرت دراسات التصوير العصبي في أبحاث الإدمان أن القشرة الحزامية الأمامية والقشرة الأمامية الأمامية والقشرة الجبهية المدارية والقشرة المعزولة يتم تنشيطها أثناء تقديم الإشارات المرتبطة بالمخدرات. أيضا ، ثبت أن النشاط في كل من القشرة المعزولة اليمنى واليسرى يرتبط ارتباطا وثيقا بالرغبة في تناول المخدرات عندما يتعرض المشاركون لإشارات إثارة الرغبة الشديدة. ومن ثم ، فإن الإنسولا الثنائية لها أهمية خاصة في البحث عن الرغبة في تعاطي المخدرات والإدمان نظرا لدورها في تمثيل الحالات الجسدية (الإدراكية الداخلية). تستكشف هذه الدراسة استخدام الارتجاع العصبي للرنين المغناطيسي rtfلتقليل النشاط المعتمد على مستوى الأكسجين في الدم (BOLD) في القشرة المعزولة الثنائية للمشاركين المدمنين على النيكوتين. تختبر الدراسة أيضا ما إذا كانت هناك تعديلات مرتبطة بتدريب الارتجاع العصبي في المواقف الضمنية للمشاركين تجاه إشارات الرغبة الشديدة في النيكوتين وسلوك الرغبة الصريحة في النيكوتين.
Introduction
الارتجاع العصبي هو إجراء تكييف فعال يمكن للبشر أو من خلاله تعلم تعديل النشاط العصبي في منطقة واحدة أو أكثر من مناطق الدماغ. يؤدي التدريب عادة إلى تعديلاتسلوكية 1. من حيث المبدأ ، يتم تحويل إشارات الدماغ من منطقة واحدة أو أكثر من مناطق الدماغ المقيدة إلى ردود فعل حسية (على سبيل المثال ، ردود الفعل البصرية أو السمعية أو اللمسية) ، والتي يتم توفيرها للمشارك للتحكم في نشاط الدماغ عن طريق التكييف الفعال أو أشكال أخرى من التعلم. في انعكاس نموذج التصوير العصبي التقليدي ، تعدل دراسات الارتجاع العصبي نشاط الدماغ كمتغير مستقل وتقيس السلوك كمتغير تابع. وبالتالي ، يوفر الارتجاع العصبي نهجا جديدا للتحقيق في تورط مناطق الدماغ في الوظائف المعرفية المختلفة وكيف يمكن أن يؤدي فرط أو نقص نشاط مناطق الدماغ هذه إلى سلوك غير طبيعي.
تم استخدام الارتجاع العصبي مع طرق التصوير العصبي المختلفة مثل التصوير بالرنين المغناطيسي الوظيفي (fMRI) ، وتخطيط كهربية الدماغ (EEG) ، والتحليل الطيفي الوظيفي للأشعة تحت الحمراء القريبة (fNIRS). تتميز نماذج الارتجاع العصبي القائمة على مخطط كهربية الدماغ و fNIRS بمزايا الدقة الزمنية العالية والقدرة على تحمل التكاليف وقابلية النقل2،3. ومع ذلك ، فهي تتميز بدقة مكانية منخفضة وعدم القدرة على الوصول إلى مناطق الدماغ الأعمق. بالإضافة إلى ذلك ، فإن مخطط كهربية الدماغ لديه التعقيد الحسابي للمشكلة العكسية لتحديد مصدر التنشيطات العصبية من إشارات مخطط كهربية الدماغ السطحية4. ومع ذلك ، مع التطورات الأخيرة في التصوير بالرنين المغناطيسي الوظيفي في الوقت الفعلي (rtfMRI) ، من الممكن الوصول إلى إشارات ديناميكية الدم من جميع أجزاء الدماغ ، بدقة مكانية جيدة (على سبيل المثال ، 2 مم3) ودقة زمنية تبلغ 720 مللي ثانية5. وبالتالي ، يتغلب التصوير بالرنين المغناطيسي الوظيفي على القيود المذكورة أعلاه التي تمتلكها تقنيات fNIRS و EEG.
يعد إدمان النيكوتين أحد الأسباب الرئيسية للوفاة في جميع أنحاء العالم بسبب عدد من الأمراض المرتبطة بالتدخين6. العوامل المعترف بها التي تؤدي إلى إدمان النيكوتين هي الاجتماعية والبيئية والنفسية7 والقابلية الوراثية8. على المستوى العصبي البيولوجي ، أظهرت الدراسات تنشيطا في القشرة الحزامية الأمامية (ACC) ، والقشرة الأمامية المدارية (OFC) ، والمنطقة السقيفية البطنية (VTA) ، والمخطط البطني ، واللوزة الدماغية ، والحصين ، وقشرة الفص الجبهي (PFC) ، والقشرة المعزولة أثناء تقديم الإشارات المرتبطة بالمخدرات على عكس إشارات التحكم المحايدة9،10،11،12،13،14. يرتبط النشاط في كل من الأنسول الأيمن والأيسر ارتباطا وثيقا بالرغبة في التدخين عندما نظر المدخنون إلى الإشارات المرتبطة بالمخدرات15،16. تلعب الإنسولا دورا مهما في إثارة سلوك الرغبةالشديدة 17،18،19،20،21 ، لأنها مسؤولة عن إدراك الحالة الجسدية. تم الإبلاغ عن أن المدخنين الذين يعانون من آفات في قشراتهم المعزولة كانوا أكثر عرضة للإقلاع عن التدخين من المدخنين الذين يعانون من تلف في الدماغ لا يشمل الإنسولا18.
أحد أكبر التحديات في طرق الإقلاع عن التدخين الحالية هو ارتفاع معدل الانتكاس22. أكثر من 80٪ من المدخنين ينتكسون خلال الأشهر القليلة الأولى بعد الإقلاع عن التدخين23. يعد التعرض للإشارات المرتبطة سابقا بتعاطي المخدرات سببا رئيسيا لارتفاع معدل الانتكاس في إدمان النيكوتين24. هذه الآلية تسمى تأثير الحضانة. تم تطوير البروتوكول الحالي لاستهداف تأثير الحضانة الذي تم تقييمه من خلال مهمة تحضيرية عاطفية. أظهرت الدراسات السابقة أن الممتنعين عن التدخين لديهم مواقف ضمنية سلبية تجاه الإشارات المتعلقة بالتدخين25،26،27،28. في مهمة التحضير العاطفي النموذجية ، تقوم محفزات التحضير العاطفي بتعديل معالجة الهدف العاطفي بحيث يتم تغيير وقت رد الفعل ودقةالاستجابات 29. بمعنى آخر ، إذا كانت المحفزات الأولية والمستهدفة من نفس التكافؤ ، فإن وقت رد الفعل استجابة للمنبهات المستهدفة سيكون أسرع ، والعكس صحيح.
في الدراسة الحالية ، يفترض أن تقليل تنظيم القشرة المعجزرة الأمامية الثنائية سيقلل من الرغبة الشديدة ، وبالتالي ، فإن تكافؤ الإشارات المحفزة للرغبة الشديدة سيتغير من سلبي إلى محايد ، حيث أن التحيز الانتباهي والترابطي سيبتعد عن الإشارات المتعلقة بالتدخين30. مهمة السلوك الضمني هي مهمة تحضيرية عاطفية مقتبسة في الأصل من Czyzewska و Graham31. بناء على الفرضية المذكورة أعلاه ، من المتوقع ملاحظة انخفاض في وقت رد الفعل استجابة لمزيج من الكلمات الأولية (صورة الرغبة الشديدة أو الصورة النظيرة لها المحايدة) والكلمات المستهدفة ذات التكافؤ الإيجابي بعد كتلة التنظيم المنخفض مقارنة بكتلة خط الأساس. تتكون مهمة التحضير (الشكل 2 ب) من صورة أولية (أي صورة تثير الرغبة الشديدة أو نظيرتها المحايدة الصورة32) وكلمة مستهدفة ذات تكافؤ إيجابي أو سلبي. يتم تقديم الصورة الأولية لمدة 200 مللي ثانية ، متبوعة بكلمة مستهدفة معروضة لمدة ثانية واحدة. عدم التزامن في بداية التحفيز (SOA) هو 250 مللي ثانية. ثم يطلب من المشاركين الحكم على تكافؤ الكلمة المستهدفة (إيجابية أو سلبية) والرد بالضغط على زر بأسرع ما يمكن ودقة.
يتكون نظام rtfMRI (الشكل 1) من الأنظمة الفرعية التالية: (1) مشارك ، (2) اكتساب الإشارة ، (3) تحليل الإشارات عبر الإنترنت ، و (4) ردود فعل الإشارة. يتم الحصول على الإشارة باستخدام ماسح ضوئي لكامل الجسم 3.0T Siemens Trio باستخدام تسلسل التصوير المستوي الصدى (EPI)33. يتم تنفيذ إجراءات مثل إعادة بناء الصورة وتصحيح التشويه وحساب متوسط الإشارة على كمبيوتر الماسح الضوئي. بمجرد إعادة بناء الصور ومعالجتها مسبقا ، يتم تصديرها إلى النظام الفرعي لتحليل الإشارة. يتم تنفيذ النظام الفرعي لتحليل الإشارات باستخدام Turbo Brain Voyager (TBV) 34. يسترجع TBV الصور المعاد بناؤها ويقوم بمعالجة البيانات التي تتضمن تصحيح الحركة ثلاثي الأبعاد والتحليل الإحصائي في الوقت الفعلي باستخدام النموذج الخطيالعام 35. يسمح TBV للمستخدم برسم مناطق الاهتمام (ROIs) عبر فوكسل متعددة على الصور الوظيفية واستخراج متوسط قيم BOLD لعائد الاستثمار بعد كل وقت تكرار (TR). ثم يتم تصدير السلاسل الزمنية لعائد الاستثمار المحدد إلى البرنامج النصي MATLAB الذي يحسب ويعرض الملاحظات للمشارك.
يتم توفير التغذية الراجعة المرئية لنشاط الدماغ للمشاركين في شكل مقياس حرارة متحرك بيانيا ، مع تغيير أشرطته بما يتناسب مع النسبة المئوية للتغيرات الجريئة في عائد الاستثمار. استخدمت العديد من الدراسات التغذية الراجعة المتقطعة (التغذية الراجعة المقدمة إلى المشارك بعد عدد من TRs لتسلسل EPI) لتدريب المشاركين36،37. ومع ذلك ، في الدراسة الحالية ، كان من المتوقع أن يواجه المشاركون صعوبة أكبر في تقليل تنظيم إشارة BOLD في الأنسولا الأمامية مع ردود فعل مستمرة بسبب دور الجزيرة في التكامل الحسي والمشاركة في معالجة معلومات التغذية الراجعة المرئية38. ومن ثم ، كان من المفترض أن التغذية الراجعة المستمرة ستؤدي إلى تعارض بين عمليتين في القشرة المعزولة ، إحداهما تزيد من الإشارة بسبب التغذية الراجعة الخارجية ، والأخرى تقلل من الإشارة بسبب تدريب الارتجاع العصبي. ومن ثم ، في هذه الدراسة ، نقدم ملاحظات فقط في نهاية كل كتلة من كتل التنظيم المنخفض (التعليقات المتأخرة). يتم عرض نص للمشاركين (على سبيل المثال ، 0.87 يورو) كملاحظات مرئية (الشكل 2 أ ، ج) يشير إلى مقدار المال الذي كسبوه (مكافأة نقدية). تتناسب هذه المكافأة مع النسبة المئوية للتعديل المنخفض الذي تم تحقيقه في كتلة التنظيم.
RtfMRI هي تقنية عصبية جديدة قد تكون قادرة على التغلب على المشكلات في الأساليب العلاجية لعلاج الإدمان وقد توفر تدخلات أكثر موثوقية وفعالية للحد من الانتكاس. الأهداف طويلة المدى للدراسة الحالية هي ثلاثة أضعاف: 1) لاختبار ما إذا كان بإمكان مدمني النيكوتين تعلم تقليل تنظيم إشارات BOLD في الأنسولا الأمامية أثناء وجود محفزات تثير سلوك الرغبة الشديدة. 2) لفحص ما إذا كان تدريب الارتجاع العصبي يؤدي إلى تعديلات في سلوك الرغبة الشديدة ؛ و 3) لاستكشاف ما إذا كانت التغييرات في مستويات الرغبة الشديدة أثناء تدريب الارتجاع العصبي لتقليل تنظيم الأنسولا مستمرة بعد ستة أشهر من التدريب دون أي تدخل آخر. تقدم هذه المقالة وصفا تفصيليا للبروتوكول التجريبي للرنين المغناطيسي rtfMRI ومكوناته المختلفة. كما يتم تقديم عينة من البيانات من الدراسة ومناقشة التحديات المستقبلية لهذه الطريقة وإمكاناتها بالإضافة إلى البحث. تم تصميم البروتوكول المقدم للتحقيق فيما إذا كان يمكن استخدام تدريب الارتجاع العصبي القائم على التصوير بالرنين المغناطيسي الوظيفي لدراسة الانخفاضات في نشاط الدماغ في القشرة المعزولة لمدخني السجائر. بالإضافة إلى ذلك ، يهدف البروتوكول إلى دراسة العلاقات بين تنشيط القشرة المعزولة وسلوكيات الرغبة الشديدة لدى مدخني السجائر.
Access restricted. Please log in or start a trial to view this content.
Protocol
وافقت لجنة الأخلاقيات التابعة لكلية الطب بجامعة توبنغن والجامعة البابوية الكاثوليكية في تشيلي على بروتوكول rtfMRI التالي.
1. إعداد الأجهزة
- يتم إعداد الأجهزة الممثلة في الشكل 1 مرة واحدة فقط لإعداد التصدير في الوقت الفعلي لبيانات التصوير بالرنين المغناطيسي.
- تحضير غرفة التصوير بالرنين المغناطيسي هو نفس القياس التقليدي للرنين المغناطيسي الوظيفي. تجهيز غرفة التصوير بالرنين المغناطيسي قبل وصول المشارك.
- قم بتوصيل ملف الرأس المكون من 32 أو 20 قناة بالماسحة الضوئية.
- قم بتوصيل كابل VGA / HDMI الخاص بجهاز العرض وجهاز الاستجابة المتوافق مع MR (صندوق الأزرار) بكمبيوتر التحفيز.
ملاحظة: في معظم إعداد MR ، يقوم جهاز الاستجابة بتوصيل مشغل TR إلى كمبيوتر التحفيز. يساعد هذا المشغل على مزامنة عرض التحفيز والحصول على البيانات.
2. تحضير المشارك خارج الماسح الضوئي
- قم بإعداد نموذج الموافقة والاستبيانات التي يحتاج المشاركون إلى تعبئتها قبل وصولهم.
- بمجرد وصول المشارك ، اشرح التجربة وتقنية التصوير بالرنين المغناطيسي الوظيفي. أيضا ، قم بإرشاد المشارك حول كيفية أداء المهمة (على سبيل المثال ، أثناء التجربة ، يجب على المشاركين إبقاء أعينهم مفتوحة والنظر دائما إلى الصور على الشاشة ، ويجب أن يحاولوا عدم تحريك رؤوسهم داخل الماسح الضوئي).
- اطلب من المشارك التوقيع على نموذج الموافقة وملء الاستبيانات المطلوبة لتقييم مستويات الرغبة الشديدة.
- اطلب من المشاركين ملء الاستبيانات التالية: 1) VAS-C: مقياس التناظرية المرئية ، الرغبة39 ، 2) QSU-b: استبيان الرغبات في التدخين - إصدار موجز40 ، و 3) السجائر يوميا.
- اطلب من المشارك الزفير من خلال جهاز قياس أول أكسيد الكربون (CO).
ملاحظة: يشير قياس ثاني أكسيد الكربون41 إلى ما إذا كان المشارك يمتنع عن التدخين قبل 3 ساعات على الأقل من الوصول إلى جلسة الارتجاع العصبي. يقاس ثاني أكسيد الكربون بجزء في المليون (أجزاء في المليون). تشير قيم ثاني أكسيد الكربون المنخفضة إلى أن المشارك لم يدخن لمدة ساعتين على الأقل قبل الوصول. يجب أن يطلب من المشاركين الامتناع عن التدخين حتى تثير إشارات الرغبة الشديدة الرغبة الشديدة أثناء التجربة. سيتم تحذير المشاركين الذين لديهم قيم عالية من ثاني أكسيد الكربون قبل جلسة الارتجاع العصبي المستقبلية للتأكد من امتناعهم عن التدخين قبل جلسة التصوير بالرنين المغناطيسي RTF. يجب استبعاد المشاركين الذين لا يمتنعون عن التدخين مرتين من الدراسة.
3. تحديد موقع المشاركين
ملاحظة: يشبه إجراء وضع المشارك على طاولة الماسحة الضوئية تجربة الرنين المغناطيسي الوظيفي التقليدية.
- اطلب من المشارك إزالة جميع الأشياء المعدنية من جيوبه قبل دخول غرفة التصوير بالرنين المغناطيسي.
- اطلب من المشارك إدخال سدادات الأذن قبل أن يستلقي على طاولة الماسح الضوئي في وضع ضعيف.
- استخدم الوسادات لإصلاح موضع رأس المشارك داخل ملف الرأس. تساعد هذه الخطوة على تقليل حركة الرأس أثناء القياس.
- قفل الجزء العلوي من ملف الرأس وتثبيت المرآة على ملف الرأس.
- أعط جهاز الاستجابة للمشارك وضع جهاز الاستجابة حسب راحة المشارك.
- اطلب من المشارك أن يغمض عينيه وحدد موضع الرأس المرجعي للمشارك بين الحاجبين باستخدام ضوء الليزر.
- حرك طاولة الماسح الضوئي لوضع الموضع المحدد في منتصف تجويف التصوير بالرنين المغناطيسي.
- تأكد مع المشارك من أنه في وضع مريح وأنه يمكنه رؤية المحفزات المرئية المعروضة على الشاشة خلف الماسح الضوئي باستخدام المرآة. اضبط المرآة إذا لزم الأمر.
4. الحصول على البيانات
- أثناء الفحوصات الأولية ، اطلب من المشارك أن يغمض عينيه وحاول عدم تحريك الرأس.
- ابدأ القياس بتسلسل نبض المترجم. يستخدم هذا التسلسل عادة لتحديد موضع الشريحة للمسح التشريحي الذي يتم تشغيله لاحقا وعمليات المسح الوظيفية (تسلسل EPI).
- حدد مجال الرؤية (FOV) للمسح التشريحي باستخدام المعلمات التالية: TR = 11.5 مللي ثانية ، TE = 5 مللي ثانية ، 176 شريحة بدون فجوة شريحة ، مجال الرؤية = 240 × 240 مم2 ، مصفوفة = 256 × 256 ، زاوية الوجه = 18 درجة ، توفر 1 مم3 فوكسل متناحية. سيغطي مجال الرؤية للتسلسل رأس المشارك بالكامل.
- يتم محاذاة مجال الرؤية للمسح الوظيفي (تسلسل EPI) مع خط الكومسوير الأمامي / الخلفي (خط AC-PC). اضبط موضع الشرائح لتغطية المنطقة المستهدفة ذات الاهتمام. معلمات التسلسل هي كما يلي: TR = 1.5 ، مجال الرؤية = 192 مم ، 25 شريحة ، فوكسل = 3 مم × 3 مم × 3 مم ، زاوية الوجه = 70 درجة.
5. الارتجاع العصبي FMRI
- تنبيه المشارك بأن تشغيل الارتجاع العصبي يبدأ وكرر التعليمات المقدمة سابقا (على سبيل المثال ، أنه أثناء خط الأساس ، يتم تمثيل الكتلة بعلامة "+").
ملاحظة: يجب على المشارك مراقبة الصورة على شاشة العرض. من ناحية أخرى ، أثناء كتلة التنظيم ، ممثلة بسهم في اتجاه هبوطي ، يجب على المشاركين محاولة فصل أنفسهم عن الرغبة الشديدة باستخدام بعض الاستراتيجيات المعرفية. يمثل مبلغ المال المعروض في نهاية كل كتلة تنظيمية أدائهم. يمثل المبلغ الأعلى من المال أداء أفضل. - قم بإجراء تشغيل الارتجاع العصبي الذي تتناوب فيه كتل خط الأساس والتنظيم (30 ثانية لكل منهما. الشكل 2).
- على كمبيوتر التحفيز ، قم بتشغيل برنامج العرض التقديمي المكتوب لرمز التحفيز واضغط على الزر Enter بعد ظهور جاهز على الشاشة. تنتظر التعليمات البرمجية للعرض التقديمي الآن المشغل لبدء تشغيل الارتجاع العصبي.
ملاحظة: الرمز متزامن مع مشغلات TR القادمة من الماسح الضوئي. لذلك ، فهي الخطوة الأولى في التحضير لتشغيل تشغيل الارتجاع العصبي. - على كمبيوتر التحليل ، قم بتشغيل صندوق أدوات MATLAB الداخلي و turbo brain voyager (TBV).
- في مربع أدوات MATLAB، أدخل المعلومات الخاصة بالمشارك، مثل معرف المريض ورقم تشغيل الارتجاع العصبي.
- اضغط على إنشاء ملفات بروتوكول لإعداد ملف البروتوكول باستخدام المعلومات المدرجة في الخطوة 5.5.
ملاحظة: يحتوي ملف البروتوكول على معلومات تتعلق بتوقيت الحالة (على سبيل المثال ، الوقت الذي يجب أن تبدأ فيه حالة معينة TR وأي حافز يجب تقديمه). سيتم استخدامه من قبل كل من صندوق أدوات MATLAB و TBV. - اضغط على زر التنفيذ على واجهة المستخدم الرسومية لمربع أدوات MATLAB. ينتظر الرمز الآن تلقي البيانات من TBV.
- في TBV، حدد ملف البروتوكول الذي تم إنشاؤه في الخطوة 5.6. بالإضافة إلى ذلك، حدد ملف .roi الذي تم إنشاؤه من جلسات الارتجاع العصبي السابقة.
ملاحظة: يعد تحديد ملف عائد استثمار أمرا مهما ، لأنه سيتجنب تعطل برنامج TBV خلال الفترة الأولية (10 TRs) من تشغيل الارتجاع العصبي. - إعداد تسلسل EPI ليتم تنفيذه في الكمبيوتر المضيف MR. اضغط على زر البدء في TBV.
- أعد رسم عائد الاستثمار المستهدف في برنامج TBV وفقا للمعالم التشريحية. يستخدم شكل البطينين في الدماغ وحجمهما كمعالم لتحديد الجزيرة الأمامية. بالإضافة إلى ذلك ، يتم استخدام الشكل المتموج للقشرة المعزولة لتحديد الفوكسيل المتعلقة بالجزرة الأمامية الثنائية.
- ارسم عائد استثمار على المنطقة الحركية الأولية (M1) باستخدام التلم المركزي كمعلم تشريحي. تعمل منطقة المحرك الأساسية كعائد استثمار مرجعي لإزالة تأثير الزيادات الجريئة العالمية والتقلبات الجريئة بسبب حركة الرأس.
- في نهاية كل جلسة ارتجاع عصبي ، اسأل المشارك ، "ما هي الإستراتيجية المعرفية التي كنت تستخدمها أثناء كتلة التنظيم؟". بالإضافة إلى ذلك ، اسأل المشارك عن مستوى راحته وما إذا كان يرغب في مواصلة التجربة أم لا.
- بعد أربع عمليات تشغيل للارتجاع العصبي، حدد زر الاختيار نعم لتشغيل النقل.
ملاحظة: يشبه تشغيل النقل تشغيل الارتجاع العصبي. ومع ذلك ، يقوم المشاركون بإجراء التنظيم الذاتي في حالة عدم وجود تعليقات. يساعد هذا في تحديد ما إذا كان التنظيم الذاتي المكتسب قد تم نقله إلى الموقف الذي لن يتلقى فيه المشارك الارتجاع العصبي (على سبيل المثال ، خارج الماسح الضوئي).
6. مجموعة التحكم
- قم بتوجيه المشاركين في المجموعة الضابطة بنفس الطريقة التي يقدمها المشاركون في المجموعة التجريبية. ومع ذلك ، قدم ملاحظات صفار للمشاركين.
ملاحظة: في ردود الفعل المثبتة ، يظل متوسط مقدار التعزيز (المال) في كل من المجموعات التجريبية والضابطة كما هو. الفرق الوحيد بين المجموعتين هو حالة التغذية الراجعة المقدمة للمشاركين. بالنسبة للمشاركين في المجموعة الضابطة ، يتم توزيع المبلغ الإجمالي للتعزيز (المال) بين 40٪ من تجارب التنظيم المنخفض المخصصة عشوائيا. ومع ذلك ، في ال 60٪ الأخرى من التجارب ، يتلقى المشاركون ردود فعل سلبية (صفر يورو). وبالتالي ، لا يحصل المشاركون في المجموعة الضابطة على تعليقات طارئة.
7. التحليل دون اتصال بالإنترنت
- المعالجة المسبقة لبيانات الرنين المغناطيسي الوظيفي
- استخدم مربع أدوات التعيين الإحصائي المعلمي (SPM) للمعالجة المسبقة لبيانات التصويرات بالرنين المغناطيسي الوظيفي (https://www.fil.ion.ucl.ac.uk/spm/ext/).
- قم بتحويل بيانات الرنين المغناطيسي الوظيفي بتنسيق DICOM إلى تنسيق NIFTI باستخدام أداة تحويل التنسيق لوظيفة دفعة SPM.
- قم بإزالة عمليات المسح الأولية ال 10 من كل بيانات تشغيل الارتجاع العصبي لتجنب تأثيرات توازن التدرج42.
- قم بإجراء عملية إعادة المحاذاة لإزالة عناصر الحركة ومحاذاة جميع وحدات التخزين مع المجلد الأول من الجلسة. بالإضافة إلى ذلك ، قم بإجراء تصحيح شريحة زمنية للتعويض عن تأخير الحصول علىالشريحة 43.
- إجراء تجزئة للمسح التشريحي ، والتسجيل المشترك لبيانات تسلسل EPI والبيانات التشريحية ، والتطبيع لتعيين بيانات مساحة الموضوع إلى قالب الدماغ القياسي لمعهد مونتريال للأعصاب (MNI)44.
- باستخدام كود MATLAB الداخلي الخاص بنا ، استخرج إشارات BOLD من عائد الاستثمار على شكل مكعب تم إنشاؤه حول إحداثيات MNI المقابلة للإنسولا الأمامية الثنائية والقشرة الحركية الأولية.
- حساب النسبة المئوية للتغير في إشارة BOLD
- احسب النسبة المئوية للتغير في إشارة BOLD بناء على متوسط التغير في إشارة BOLD لكل عائد استثمار أثناء كتلة التنظيم مقارنة بكتلة خط الأساس السابقة. معادلة النسبة المئوية للتغير في إشارة BOLD هي كما يلي:
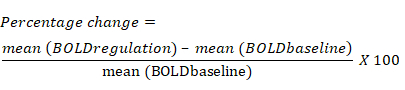
- احسب النسبة المئوية للتغير في إشارة BOLD بناء على متوسط التغير في إشارة BOLD لكل عائد استثمار أثناء كتلة التنظيم مقارنة بكتلة خط الأساس السابقة. معادلة النسبة المئوية للتغير في إشارة BOLD هي كما يلي:
- تحليل سلوك التدخين الصريح للمشاركين
- استيراد ردود المشاركين على الاستبيانات (مثل QSU-b و VAS-C و CO MEASURE والسجائر يوميا) إلى MATLAB.
- اختبار الطبيعة الطبيعية للبيانات باستخدام اختبار Kolmogorov-Smirnov المكون من عينة واحدة من MATLAB.
- يجب استخدام اختبار t من عينة واحدة لمقارنة إجابات الاستبيانات المختلفة لكل مشارك ، واختبار t للعينة المزدوجة لمقارنة الدرجات بين المجموعات التجريبية والضابطة.
- تحليل الموقف الضمني تجاه إشارات الرغبة الشديدة
- استخرج وقت رد الفعل (RT) لتجارب التحضير العاطفي لكل مشارك من ملفات السجل التي تم إنشاؤها بواسطة برنامج العرض التقديمي.
- إزالة القيم المتطرفة استنادا إلى RT (على سبيل المثال، لا تدرج التجارب ذات RT أطول من 2x الانحراف المعياري لمتوسط RT للمشارك).
- اختبار الطبيعة الطبيعية للبيانات باستخدام اختبار Kolmogorov-Smirnov المكون من عينة واحدة من MATLAB.
- قارن تأثيرات التنظيم المنخفض على متوسط أوقات رد الفعل لمجموعات فريدة من الأعداد الأولية (الصور المحفزة للرغبة الشديدة والمحايدة) والأهداف (الكلمات الإيجابية والسلبية) لكل مشارك ، وقارن بين المجموعات التجريبية والضابطة باستخدام اختبار t الحكيم المزدوج.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم تجنيد أربعة مرضى بناء على درجاتهم في استبيان اختبار Fagerström لإدمان النيكوتين (FTND) 45 لإدمان النيكوتين على المستوى المتوسط (درجة FTND >4) وعدد السجائر التي يتم تدخينها يوميا (>15). بالإضافة إلى ذلك ، تم التأكد من أن المشاركين ليس لديهم أي وشم أو غرسات معدنية وفقا لتدابير س...
Access restricted. Please log in or start a trial to view this content.
Discussion
تظهر النتائج من أربعة مشاركين إمكانية أن يتعلم مدخنو السجائر تقليل تنظيم التنشيط في الأنسوليا الأمامية الثنائية في وجود إشارات مثيرة للرغبة الشديدة. قد تكون التغييرات في سلوكيات التدخين الضمنية والصريحة بعد تدريب الارتجاع العصبي في المشارك في العينة مرتبطة بتقليل الت...
Access restricted. Please log in or start a trial to view this content.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة من قبل اللجنة الوطنية للأبحاث العلمية والتقنية في شيلي (Conicyt) من خلال Fondo Nacional de Desarrollo Científico y Tecnológico، ومنحة ما بعد الدكتوراه (رقم 3100648) Fondecyt Regular(المشروعان رقم 1171313 ورقم 1171320) و CONICYT PIA / Anillo de Investigación en Ciencia y Tecnología ACT172121.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| MATHSWORK | MATLAB version 2014a | ||
| Presentation - Neurobehavioral Systems | Presentation version 18.0 | ||
| Brain Innovation B.V. | Turbo Brain Voyager Version 2.6 or 3.0 |
References
- Fernandez, T., et al. EEG and behavioral changes following neurofeedback treatment in learning disabled children. Clinical Electroencephalography. 34, 145-152 (2003).
- Scarapicchia, V., Brown, C., Mayo, C., Gawryluk, J. R. Functional Magnetic Resonance Imaging and Functional Near-Infrared Spectroscopy: Insights from Combined Recording Studies. Frontiers in Human Neuroscience. 11, 419(2017).
- Hinault, T., Larcher, K., Zazubovits, N., Gotman, J., Dagher, A. Spatio-temporal patterns of cognitive control revealed with simultaneous electroencephalography and functional magnetic resonance imaging. Human Brain Mapping. , (2018).
- Grech, R., et al. Review on solving the inverse problem in EEG source analysis. Journal of NeuroEngineering and Rehabilitation. 5, 25(2008).
- Van Essen, D. C., et al. The Human Connectome Project: a data acquisition perspective. NeuroImage. 62, 2222-2231 (2012).
- World Health Organization. WHO Report on the Global Tobacco Epidemic, 2017. , Geneva: World Health Organization. (2017).
- Ringlever, L., Otten, R., de Leeuw, R. N., Engels, R. C. Effects of parents' education and occupation on adolescent smoking and the mediating role of smoking-specific parenting and parent smoking. European Addiction Research. 17, 55-63 (2011).
- Malaiyandi, V., Sellers, E. M., Tyndale, R. F. Implications of CYP2A6 genetic variation for smoking behaviors and nicotine dependence. Clinical Pharmacology and Therapeutics. 77, 145-158 (2005).
- Brody, A. L., et al. Neural substrates of resisting craving during cigarette cue exposure. Biological Psychiatry. 62, 642-651 (2007).
- Childress, A. R., et al. Cue reactivity and cue reactivity interventions in drug dependence. NIDA Research Monography. 137, 73-95 (1993).
- Claus, E. D., Kiehl, K. A., Hutchison, K. E. Neural and behavioral mechanisms of impulsive choice in alcohol use disorder. Alcoholism, Clinical and Experimental Research. 35, 1209-1219 (2011).
- Franklin, T. R., et al. Limbic activation to cigarette smoking cues independent of nicotine withdrawal: a perfusion fMRI study. Neuropsychopharmacology. 32, 2301-2309 (2007).
- Grusser, S. M., et al. Cue-induced activation of the striatum and medial prefrontal cortex is associated with subsequent relapse in abstinent alcoholics. Psychopharmacology. 175, 296-302 (2004).
- Buhler, M., et al. Nicotine dependence is characterized by disordered reward processing in a network driving motivation. Biological Psychiatry. 67, 745-752 (2010).
- Bonson, K. R., et al. Neural systems and cue-induced cocaine craving. Neuropsychopharmacology. 26, 376-386 (2002).
- Brody, A. L., et al. Brain metabolic changes during cigarette craving. Archives of General Psychiatry. 59, 1162-1172 (2002).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318, 655-658 (2007).
- Naqvi, N. H., Rudrauf, D., Damasio, H., Bechara, A. Damage to the insula disrupts addiction to cigarette smoking. Science. 315, 531-534 (2007).
- Hollander, J. A., Lu, Q., Cameron, M. D., Kamenecka, T. M., Kenny, P. J. Insular hypocretin transmission regulates nicotine reward. Proceedings of the National Academy of Sciences of the United States of America. 105, 19480-19485 (2008).
- Forget, B., Pushparaj, A., Le Foll, B. Granular insular cortex inactivation as a novel therapeutic strategy for nicotine addiction. Biological Psychiatry. 68, 265-271 (2010).
- Scott, D., Hiroi, N. Deconstructing craving: dissociable cortical control of cue reactivity in nicotine addiction. Biological Psychiatry. 69, 1052-1059 (2011).
- Buczkowski, K., Marcinowicz, L., Czachowski, S., Piszczek, E. Motivations toward smoking cessation, reasons for relapse, and modes of quitting: results from a qualitative study among former and current smokers. Patient Prefer Adherence. 8, 1353-1363 (2014).
- Hughes, J. R., Stead, L. F., Hartmann-Boyce, J., Cahill, K., Lancaster, T. Antidepressants for smoking cessation. Cochrane Database of Systematic Reviews. , CD000031(2014).
- Bedi, G., et al. Incubation of cue-induced cigarette craving during abstinence in human smokers. Biological Psychiatry. 69, 708-711 (2011).
- Bassett, J. F., Dabbs, J. M. Jr A portable version of the go/no-go association task (GNAT). Behavior Research Methods. 37, 506-512 (2005).
- Huijding, J., de Jong, P. J., Wiers, R. W., Verkooijen, K. Implicit and explicit attitudes toward smoking in a smoking and a nonsmoking setting. Addictive Behaviors. 30, 949-961 (2005).
- Sherman, S. J., Rose, J. S., Koch, K., Presson, C. C., Chassin, L. Implicit and explicit attitudes towards cigarette smoking: The effect of context and motivation. Journal of Social and Clinical Psychology. 22, 13-39 (2003).
- Swanson, J. E., Rudman, L. A., Greenwald, A. G. Using the Implicit Association Test to investigate attitude- behavior consistency for stigmatized behavior. Cognition and Emotion. 15, 207-230 (2001).
- Asgaard, G. L., Gilbert, D. G., Malpass, D., Sugai, C., Dillon, A. Nicotine primes attention to competing affective stimuli in the context of salient alternatives. Experimental and Clinical Psychopharmacology. 18, 51-60 (2010).
- Gilbert, D. G., et al. Effects of nicotine on brain responses to emotional pictures. Nicotine & Tobacco Research. 6, 985-996 (2004).
- Czyzewska, M., Graham, R. Implicit and explicit attitudes to high- and low-calorie food in females with different BMI status. Eating Behaviors. 9, 303-312 (2008).
- Gilbert, D. G., Rabinovich, N. E. International smoking images series (with neutral counterparts). , Southern Illinois University: Integrative Neuroscience Laboratory, Department of Psychology. (1999).
- Bandettini, P. A., Wong, E. C., Hinks, R. S., Tikofsky, R. S., Hyde, J. S. Time course EPI of human brain function during task activation. Magnetic Resonance Medicine. 25, 390-397 (1992).
- Goebel, R. BrainVoyager - past, present, future. NeuroImage. 62, 748-756 (2012).
- Poline, J. B., Worsley, K. J., Holmes, A. P., Frackowiak, R. S., Friston, K. J. Estimating smoothness in statistical parametric maps: variability of p values. Journal of Computer Assisted Tomography. 19, 788-796 (1995).
- Johnson, K. A., et al. Intermittent "real-time" fMRI feedback is superior to continuous presentation for a motor imagery task: a pilot study. Journal of Neuroimaging. 22, 58-66 (2012).
- Yoo, S. S., Jolesz, F. A. Functional MRI for neurofeedback: feasibility study on a hand motor task. Neuroreport. 13, 1377-1381 (2002).
- Craig, A. D. How do you feel--now? The anterior insula and human awareness. Nature reviews. Neuroscience. 10, 59-70 (2009).
- Cox, L. S., Tiffany, S. T., Christen, A. G. Evaluation of the brief questionnaire of smoking urges (QSU-brief) in laboratory and clinical settings. Nicotine & Tobacco Research. 3, 7-16 (2001).
- Wewers, M. E., Rachfal, C., Ahijevych, K. A psychometric evaluation of a visual analogue scale of craving for cigarettes. Western Journal of Nursing Research. 12, 672-681 (1990).
- Allen, D. R., Browse, N. L., Rutt, D. L., Butler, L., Fletcher, C. The effect of cigarette smoke, nicotine, and carbon monoxide on the permeability of the arterial wall. Journal of Vascular Surgery. 7, 139-152 (1988).
- Weiskopf, N., et al. Real-time functional magnetic resonance imaging: methods and applications. Magnetic Resonance Imaging. 25, 989-1003 (2007).
- Sladky, R., et al. Slice-timing effects and their correction in functional MRI. NeuroImage. 58, 588-594 (2011).
- Mazziotta, J., et al. A probabilistic atlas and reference system for the human brain: International Consortium for Brain Mapping (ICBM). Philosophical Transactions of the Royal Society of London: Series B, Biological Sciences. 356, 1293-1322 (2001).
- Heatherton, T. F., Kozlowski, L. T., Frecker, R. C., Fagerstrom, K. O. The Fagerstrom Test for Nicotine Dependence: a revision of the Fagerstrom Tolerance Questionnaire. British Journal of Addiction. 86, 1119-1127 (1991).
- Myrick, H., et al. Differential brain activity in alcoholics and social drinkers to alcohol cues: relationship to craving. Neuropsychopharmacology. 29, 393-402 (2004).
- Tapert, S. F., Brown, G. G., Baratta, M. V., Brown, S. A. fMRI BOLD response to alcohol stimuli in alcohol dependent young women. Addictive Behaviors. 29, 33-50 (2004).
- Kilts, C. D., Gross, R. E., Ely, T. D., Drexler, K. P. The neural correlates of cue-induced craving in cocaine-dependent women. American Journal of Psychiatry. 161, 233-241 (2004).
- Li, Q., et al. Assessing cue-induced brain response as a function of abstinence duration in heroin-dependent individuals: an event-related fMRI study. PloS One. 8, e62911(2013).
- Frank, S., Kullmann, S., Veit, R. Food related processes in the insular cortex. Front Hum Neurosci. 7, 499(2013).
- deCharms, R. C., et al. Control over brain activation and pain learned by using real-time functional MRI. Proceedings of the National Academy of Sciences of the United States of America. 102, 18626-18631 (2005).
- Ruiz, S., Birbaumer, N., Sitaram, R. Abnormal Neural Connectivity in Schizophrenia and fMRI-Brain-Computer Interface as a Potential Therapeutic Approach. Frontiers in Psychiatry. 4, 17(2013).
- Habes, I., et al. Pattern classification of valence in depression. NeuroImage. Clinical. 2, 675-683 (2013).
- Li, X., et al. Volitional reduction of anterior cingulate cortex activity produces decreased cue craving in smoking cessation: a preliminary real-time fMRI study. Addiction Biology. 18, 739-748 (2013).
- Lubar, J. F., Swartwood, M. O., Swartwood, J. N., O'Donnell, P. H. Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Biofeedback and Self-Regulation. 20, 83-99 (1995).
- Janssen, T. W., et al. A randomized controlled trial into the effects of neurofeedback, methylphenidate, and physical activity on EEG power spectra in children with ADHD. Journal of Child Psychology and Psychiatry. 57, 633-644 (2016).
- Mayer, K., Wyckoff, S. N., Fallgatter, A. J., Ehlis, A. C., Strehl, U. Neurofeedback as a nonpharmacological treatment for adults with attention-deficit/hyperactivity disorder (ADHD): study protocol for a randomized controlled trial. Trials. 16, 174(2015).
- Gevensleben, H., et al. Distinct EEG effects related to neurofeedback training in children with ADHD: a randomized controlled trial. International Journal of Psychophysiology. 74, 149-157 (2009).
- Ramos-Murguialday, A., et al. Brain-machine interface in chronic stroke rehabilitation: a controlled study. Annals of Neurology. 74, 100-108 (2013).
- Biasiucci, A., et al. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nature Communication. 9, 2421(2018).
- Du, J., et al. Effects of repetitive transcranial magnetic stimulation on motor recovery and motor cortex excitability in patients with stroke: a randomized controlled trial. European Journal of Neurology. 23, 1666-1672 (2016).
- Ang, K. K., et al. Facilitating effects of transcranial direct current stimulation on motor imagery brain-computer interface with robotic feedback for stroke rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, S79-S87 (2015).
- Wolbrecht, E. T., Chan, V., Reinkensmeyer, D. J., Bobrow, J. E. Optimizing compliant, model-based robotic assistance to promote neurorehabilitation. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 16, 286-297 (2008).
- Sitaram, R., et al. Closed-loop brain training: the science of neurofeedback. Nature Reviews Neuroscience. 18, 86-100 (2017).
- Simkin, D. R., Thatcher, R. W., Lubar, J. Quantitative EEG and neurofeedback in children and adolescents: anxiety disorders, depressive disorders, comorbid addiction and attention-deficit/hyperactivity disorder, and brain injury. Child and Adolescent Psychiatric Clinics of North America. 23, 427-464 (2014).
- Pascual-Marqui, R. D., et al. Assessing interactions in the brain with exact low-resolution electromagnetic tomography. Philosophical transactions: Series A, Mathematical, physical, and engineering sciences. , 3768-3784 (2011).
- Meir-Hasson, Y., Kinreich, S., Podlipsky, I., Hendler, T., Intrator, N. An EEG Finger-Print of fMRI deep regional activation. NeuroImage. 102, 128-141 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved