A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש בנוירופידבק מבוסס הדמיית תהודה מגנטית פונקציונלית בזמן אמת כדי להפחית את ויסות קליפת המוח האינסולרית אצל מעשנים מכורים לניקוטין
In This Article
Summary
בהדמיית תהודה מגנטית תפקודית בזמן אמת (rtfMRI), פעילות המוח עוברת מניפולציה ניסויית כמשתנה בלתי תלוי, וההתנהגות נמדדת כמשתנה תלוי. הפרוטוקול המוצג כאן מתמקד בשימוש המעשי ב-rtfMRI ככלי טיפולי להפרעות פסיכיאטריות כגון התמכרות לניקוטין.
Abstract
עבר יותר מעשור מאז שיושמה בהצלחה גישת הנוירופידבק הראשונה המבוססת על דימות תהודה מגנטית תפקודי (fMRI). מאז, מחקרים שונים הראו כי משתתפים יכולים ללמוד לשלוט מרצון באזור מוגבל במוח. כתוצאה מכך, fMRI בזמן אמת (rtfMRI) סיפק הזדמנות חדשה לחקור שינויים בהתנהגות עקב מניפולציה של פעילות המוח. לפיכך, הדיווחים על יישומי rtfMRI לאימון ויסות עצמי של פעילות המוח והשינויים הנלווים במצבים התנהגותיים וקליניים כגון הפרעות נוירולוגיות ופסיכיאטריות [למשל, סכיזופרניה, הפרעה טורדנית כפייתית (OCD), שבץ מוחי] גדלו במהירות.
מחקרי הדמיה מוחית בחקר התמכרויות הראו כי פיתול החגורה הקדמי, קליפת המוח האורביטופרונטלית וקליפת המוח האינסולרית מופעלים במהלך הצגת רמזים הקשורים לתרופות. כמו כן, הוכח כי פעילות בקליפת המוח השמאלית והימנית נמצאת בקורלציה גבוהה עם דחפים לסמים כאשר המשתתפים נחשפים לרמזים מעוררי השתוקקות. לפיכך, לאינסולה הדו-צדדית יש חשיבות מיוחדת בחקר דחפים והתמכרות לסמים בשל תפקידה בייצוג מצבים גופניים (אינטרוספטיביים). מחקר זה בוחן את השימוש בנוירופידבק rtfMRI להפחתת הפעילות התלויה ברמת החמצן בדם (BOLD) בקליפת המוח האינסולרית הדו-צדדית של משתתפים מכורים לניקוטין. המחקר גם בודק אם ישנם שינויים הקשורים לאימון נוירופידבק בעמדות המרומזות של המשתתפים כלפי רמזים של השתוקקות לניקוטין והתנהגות השתוקקות מפורשת.
Introduction
נוירופידבק הוא הליך התניה אופרנטי שבאמצעותו בני אדם או בעלי חיים יכולים ללמוד לווסת את הפעילות העצבית באזור אחד או יותר במוח. אימון מוביל בדרך כלל לשינויים התנהגותיים1. באופן עקרוני, אותות מוחיים מאזור מוח מוגבל אחד או יותר הופכים למשוב חושי (למשל, משוב חזותי, שמיעתי או מישושי), המסופק למשתתף לשליטה בפעילות המוח על ידי התניה אופרנטית או צורות אחרות של למידה. בהיפוך פרדיגמת ההדמיה הנוירולוגית המסורתית, מחקרי נוירופידבק מווסתים את פעילות המוח כמשתנה בלתי תלוי ומודדים התנהגות כמשתנה תלוי. לפיכך, נוירופידבק מספק גישה חדשה לחקירת המעורבות של אזורי מוח בתפקודים קוגניטיביים שונים וכיצד פעילות יתר או היפואקטיביות של אזורי מוח אלה יכולה להוביל להתנהגות חריגה.
נוירופידבק שימש בשיטות דימות נוירולוגיות שונות כמו דימות תהודה מגנטית תפקודי (fMRI), אלקטרואנצפלוגרפיה (EEG) וספקטרוסקופיה תפקודית של אינפרא אדום קרוב (fNIRS). לפרדיגמות נוירופידבק מבוססות EEG ו-fNIRS יש את היתרונות של רזולוציה זמנית גבוהה יותר, במחיר סביר וניידות 2,3. עם זאת, הם מאופיינים ברזולוציה מרחבית נמוכה ובחוסר יכולת לגשת לאזורי מוח עמוקים יותר. בנוסף, ל-EEG יש את המורכבות החישובית של הבעיה ההפוכה לקביעת מקור להפעלות עצביות מאותות EEG על פני השטח4. עם זאת, עם ההתפתחויות האחרונות ב-fMRI בזמן אמת (rtfMRI), ניתן לגשת לאותות המודינמיים מכל חלקי המוח, עם רזולוציה מרחבית טובה (למשל, 2 מ"מ3) ורזולוציה זמנית של 720 אלפיות השנייה5. לפיכך, fMRI מתגבר על המגבלות שהוזכרו לעיל שיש לטכניקות fNIRS ו-EEG.
התמכרות לניקוטין היא אחד מגורמי המוות העיקריים ברחבי העולם עקב מספר מחלות הקשורות לעישון6. גורמים מוכרים המובילים להתמכרות לניקוטין הם חברתיים, סביבתיים, פסיכולוגיים7 ורגישות גנטית8. ברמה הנוירו-ביולוגית, מחקרים הראו הפעלה בפיתול החגורה הקדמי (ACC), קליפת המוח האורביטופרונטלית (OFC), האזור הטגמנטלי הגחוני (VTA), הסטריאטום הגחוני, האמיגדלה, ההיפוקמפוס, קליפת המוח הקדם-מצחית (PFC) וקליפת המוח האינסולרית במהלך הצגת רמזים הקשורים לתרופות בניגוד לרמזי בקרה ניטרליים 9,10,11,12,13,14 . פעילות באינסולה שמאלית וימנית נמצאת בקורלציה גבוהה עם דחפי עישון כאשר מעשנים ראו רמזים הקשורים לסמים15,16. האינסולה ממלאת תפקיד חשוב ביצירת התנהגות השתוקקות 17,18,19,20,21, מכיוון שהיא אחראית על תפיסת המצב הגופני. דווח כי מעשנים עם נגעים בקליפת המוח האינסולרית שלהם היו בעלי סיכוי גבוה יותר להפסיק לעשן מאשר מעשנים עם נזק מוחי שאינו קשור לאינסולה18.
אחד האתגרים הגדולים ביותר בשיטות הפסקת העישון הקיימות הוא שיעור ההישנות הגבוה22. יותר מ-80% מהמעשנים חוזרים במהלך החודשים הראשונים לאחר הפסקת העישון23. חשיפה לרמזים שהיו קשורים בעבר לשימוש בסמים היא סיבה עיקרית לשיעור ההישנות הגבוה בהתמכרות לניקוטין24. מנגנון זה נקרא אפקט הדגירה. הפרוטוקול הנוכחי פותח כדי למקד את אפקט הדגירה המוערך על ידי משימת תחול רגשית. מחקרים קודמים הראו כי לנמנעים מעישון יש עמדות שליליות מרומזות כלפי רמזים הקשורים לעישון 25,26,27,28. במשימת ההתחלה הרגשית הטיפוסית, גירויים רגשיים משנים את העיבוד של מטרה רגשית כך שזמן התגובה ודיוק התגובות משתנים29. במילים אחרות, אם גירוי הראשוני וגירוי המטרה הם בעלי אותה ערכיות, זמן התגובה בתגובה לגירוי המטרה יהיה מהיר יותר, ולהיפך.
במחקר הנוכחי, ההשערה היא כי ויסות נמוך של קליפת המוח האינסולרית הקדמית הדו-צדדית יפחית את ההשתוקקות, ומכאן שהערכיות של רמזים מעוררי השתוקקות תשתנה משלילית לניטרלית, שכן הטיית קשב ואסוציאטיביות תתרחק מרמזים הקשורים לעישון30. משימת ההתנהגות המרומזת היא משימת הכנה רגשית שהותאמה במקור מ-Czyzewska ו-Graham31. בהתבסס על ההשערה הנ"ל, צפוי לראות ירידה בזמן התגובה בתגובה לשילוב של תמונה ראשונית (תשוקה מעוררת השתוקקות או תמונה מקבילה ניטרלית) ומילות מטרה עם ערכיות חיובית לאחר חסימת ויסות נמוך בהשוואה לחסימת הבסיס. מטלת ההתחלה (איור 2B) מורכבת מתמונה ראשונית (כלומר, תמונה מעוררת השתוקקות או תמונה מקבילה נייטרלית32) ומילת מטרה עם ערכיות חיובית או שלילית. התמונה הראשונית מוצגת למשך 200 אלפיות השנייה, ואחריה מילת יעד מוצגת למשך שנייה אחת. אסינכרוני התחלת גירוי (SOA) הוא 250 אלפיות השנייה. לאחר מכן המשתתפים מתבקשים לשפוט את הערכיות של מילת היעד (חיובית או שלילית) ולהגיב על ידי לחיצה על כפתור במהירות ובדייקנות האפשרית.
מערכת rtfMRI (איור 1) מורכבת מתת-המערכות הבאות: (1) משתתף, (2) קליטת אותות, (3) ניתוח אותות מקוון ו-(4) משוב אותות. רכישת האותות מתבצעת עם סורק 3.0T של סימנס Trio לכל הגוף באמצעות רצף הדמיה מישורית הד (EPI)33. הליכים כגון שחזור תמונה, תיקון עיוות ומיצוע של האות מבוצעים במחשב הסורק. לאחר שהתמונות משוחזרות ומעובדות מראש, הן מיוצאות לתת-מערכת ניתוח האותות. תת-מערכת ניתוח האותות מיושמת באמצעות Turbo Brain Voyager (TBV)34. TBV מאחזר את התמונות המשוחזרות ומבצע עיבוד נתונים הכולל תיקון תנועה תלת מימדי וניתוח סטטיסטי בזמן אמת באמצעות המודל הליניארי הכללי35. TBV מאפשר למשתמש לצייר אזורי עניין (ROI) על פני מספר ווקסלים בתמונות הפונקציונליות ולחלץ ערכי BOLD ממוצעים של החזר ה-ROI לאחר כל זמן חזרה (TR). סדרות הזמן של החזר ה-ROI שנבחרו מיוצאות לאחר מכן לסקריפט MATLAB שמחשב ומציג משוב למשתתף.
משוב חזותי של פעילות המוח מסופק למשתתפים בצורה של מדחום מונפש גרפית, כאשר הפסים שלו משתנים ביחס לאחוז השינויים המודגשים בהחזר ההשקעה. מספר מחקרים השתמשו במשוב לסירוגין (משוב שניתן למשתתף לאחר מספר ת"רים של רצף ה-EPI) לאימון משתתפים36,37. עם זאת, במחקר הנוכחי, היה צפוי כי המשתתפים יתקשו יותר להפחית את ויסות אות ה-BOLD באינסולה הקדמית עם משוב רציף בשל תפקידו של האינסולה באינטגרציה חושית ומעורבות בעיבוד מידע משוב חזותי38. לפיכך, ההנחה הייתה כי משוב רציף יביא לקונפליקט בין שני תהליכים בקליפת המוח האינסולרית, תהליך אחד מגביר את האות עקב משוב חיצוני, ואחר שמפחית את האות עקב אימון נוירופידבק. לפיכך, במחקר זה, אנו מספקים משוב רק בסוף כל בלוק ויסות נמוך (משוב מושהה). למשתתפים מוצג טקסט (למשל, אירו 0.87) כמשוב חזותי (איור 2A,C) שמציין את כמות הכסף שהם הרוויחו (תגמול כספי). תגמול זה הוא פרופורציונלי לאחוז הפחתת הרגולציה שהושגה בבלוק הרגולציה.
RtfMRI היא נוירוטכנולוגיה חדשה שעשויה להיות מסוגלת להתגבר על בעיות בגישות טיפוליות לטיפול בהתמכרות ועשויה לספק התערבויות אמינות ויעילות יותר להפחתת הישנות. המטרות ארוכות הטווח של המחקר הנוכחי הן משולשות: 1) לבדוק אם מכורים לניקוטין יכולים ללמוד להפחית את ויסות אותות ה-BOLD באינסולה הקדמית במהלך נוכחות גירויים המעוררים התנהגות השתוקקות; 2) לבחון האם אימון נוירופידבק מוביל לשינויים בהתנהגות ההשתוקקות; ו-3) לחקור האם שינויים ברמות התשוקה במהלך אימון נוירופידבק של הורדת ויסות האינסולה נמשכים לאחר שישה חודשי אימון ללא כל התערבות אחרת. מאמר זה מספק תיאור מפורט של פרוטוקול הניסוי rtfMRI ומרכיביו השונים. כמו כן מוצגים נתונים לדוגמה מהמחקר ודיון באתגרים העתידיים של שיטה זו ובפוטנציאל שלה במחקר נוסף. הפרוטוקול שהוצג נועד לחקור האם ניתן להשתמש באימון נוירופידבק מבוסס fMRI כדי לחקור ירידה בפעילות המוח בקליפת המוח האינסולרית של מעשני סיגריות. בנוסף, הפרוטוקול נועד לחקור את הקשרים בין הפעלת קליפת המוח האינסולרית לבין התנהגויות ההשתוקקות של מעשני סיגריות.
Access restricted. Please log in or start a trial to view this content.
Protocol
ועדת האתיקה של הפקולטה לרפואה של אוניברסיטת טובינגן והאוניברסיטה הקתולית של צ'ילה אישרה את פרוטוקול rtfMRI הבא.
1. הגדרת חומרה
- החומרה המיוצגת באיור 1 מוכנה פעם אחת בלבד כדי להגדיר את הייצוא בזמן אמת של נתוני ה-MRI.
- הכנת חדר ה-MRI זהה למדידת ה-fMRI המסורתית. הכינו את חדר ה-MRI לפני הגעת המשתתף.
- חבר את סליל ראש 32 או 20 הערוצים לסורק.
- חבר את כבל ה-VGA/HDMI של המקרן ואת התקן התגובה התואם MR (קופסת כפתורים) למחשב הגירוי.
הערה: ברוב מערך ה-MR, התקן התגובה מעביר את ה-TR-trigger למחשב הגירוי. טריגר זה עוזר לסנכרן את הצגת הגירוי ורכישת הנתונים.
2. הכנת המשתתפים מחוץ לסורק
- הכינו את טופס ההסכמה והשאלונים שהמשתתפים צריכים למלא לפני הגעתם.
- ברגע שהמשתתף מגיע, הסבירו את הניסוי ואת טכניקת ה-fMRI. כמו כן, הדריכו את המשתתף כיצד לבצע את המטלה (למשל, במהלך הניסוי המשתתפים צריכים לפקוח את עיניהם ולהסתכל תמיד על התמונות שעל מסך התצוגה, והם צריכים להשתדל לא להזיז את ראשם בתוך הסורק).
- בקשו מהמשתתף לחתום על טופס ההסכמה ולמלא את השאלונים הנדרשים להערכת רמות התשוקה.
- בקשו מהמשתתפים למלא את השאלונים הבאים: 1) VAS-C: סולם אנלוגי חזותי, תשוקה39, 2) QSU-b: שאלון דחפי עישון – גרסה קצרה40, ו-3) סיגריות ביום.
- בקשו מהמשתתף לנשוף דרך מכשיר מדידת הפחמן החד-חמצני (CO).
הערה: מדידת CO41 מציינת אם המשתתף נמנע מעישון לפחות 3 שעות לפני ההגעה למפגש הנוירופידבק. CO נמדד בחלקים למיליון (חלקים למיליון). ערכי CO נמוכים מצביעים על כך שהמשתתף לא עישן לפחות כמה שעות לפני ההגעה. יש לבקש מהמשתתפים להימנע מעישון כך שסימני התשוקה יעוררו תשוקה גבוהה במהלך הניסוי. משתתפים עם ערכי CO גבוהים יוזהרו לפני מפגש הנוירופידבק העתידי כדי להבטיח שהם יימנעו מעישון לפני מפגש ה-rtfMRI. יש להוציא מהמחקר משתתפים שאינם נמנעים מעישון פעמיים.
3. מיקום המשתתפים
הערה: הליך מיקום המשתתפים על שולחן הסורק דומה לניסוי ה-fMRI המסורתי.
- בקשו מהמשתתף להוציא את כל החפצים המתכתיים מכיסיו לפני הכניסה לחדר ה-MRI.
- בקשו מהמשתתף להכניס אטמי אוזניים לפני שהוא או היא שוכבים על שולחן הסורק במצב שכיבה.
- השתמש ברפידות כדי לקבע את תנוחת הראש של המשתתף בתוך סליל הראש. שלב זה עוזר להפחית את תנועת הראש במהלך המדידה.
- נעל את החלק העליון של סליל הראש וקבע את המראה לסליל הראש.
- תנו את מכשיר התגובה למשתתף והניחו את מכשיר התגובה בהתאם לנוחות המשתתף.
- בקשו מהמשתתף לעצום את עיניו ולסמן את מיקום ראש הייחוס של המשתתף בין הגבות באמצעות אור לייזר.
- הזז את טבלת הסורק כדי למקם את המיקום המסומן למרכז קדח ה-MRI.
- ודאו עם המשתתף שהוא נמצא בתנוחה נוחה ושהוא יכול לראות את הגירויים החזותיים המוקרנים על המסך מאחורי הסורק באמצעות המראה. כוונן את המראה, במידת הצורך.
4. רכישת נתונים
- במהלך הסריקות הראשוניות, בקשו מהמשתתף לעצום את עיניו ולנסות לא להזיז את הראש.
- התחל את המדידה עם רצף דופק לוקלייזר. רצף זה משמש בדרך כלל לקביעת מיקום הפרוסה של הסריקה האנטומית והסריקות הפונקציונליות (רצף EPI) המופעלות לאחר מכן.
- בחר את שדה הראייה (FOV) עבור הסריקה האנטומית עם הפרמטרים הבאים: TR = 11.5 ms, TE = 5 ms, 176 פרוסות ללא מרווח פרוסות, FOV = 240 x 240 מ"מ2, מטריצה = 256 x 256, זווית היפוך = 18°, המספקת ווקסלים איזוטרופיים של 1 מ"מ3 . ה-FOV של הרצף יכסה את כל ראשו של המשתתף.
- שדה הראייה עבור הסריקה הפונקציונלית (רצף EPI) מיושר לקו הקומיסור הקדמי/האחורי (קו AC-PC). התאם את מיקום הפרוסות כך שיכסה את אזור היעד המבוקש. הפרמטרים של הרצף הם הבאים: TR = 1.5, FOV = 192 מ"מ, 25 פרוסות, ווקסל = 3 מ"מ x 3 מ"מ x 3 מ"מ, זווית היפוך = 70°.
5. נוירופידבק FMRI
- התריעו למשתתף שריצת הנוירופידבק מתחילה וחזרו על ההוראות שניתנו קודם לכן (למשל, שבמהלך קו הבסיס, בלוק מיוצג על ידי סימן "+").
הערה: על המשתתף להתבונן בתמונה על מסך התצוגה. מצד שני, במהלך חסימת הוויסות, המיוצגת על ידי חץ בכיוון מטה, המשתתפים צריכים לנסות לנתק את עצמם מדחפי ההשתוקקות באמצעות כמה אסטרטגיות קוגניטיביות. סכום הכסף המוצג בסוף כל בלוק רגולציה מייצג את הביצועים שלהם. סכום כסף גבוה יותר מייצג ביצועים טובים יותר. - בצע את ריצת הנוירופידבק שבה קו הבסיס ואבני הוויסות מתחלפים (30 שניות כל אחד; איור 2).
- במחשב הגירוי, הפעל את תוכנת המצגת הכתובה בקוד הגירוי ולחץ על כפתור Enter לאחר הופעת Ready על המסך. קוד המצגת ממתין כעת לטריגר שיתחיל את ריצת הנוירופידבק.
הערה: הקוד מסונכרן עם הטריגרים של TR המגיעים מהסורק. לכן, זהו הצעד הראשון בהכנה להפעלת ריצת הנוירופידבק. - במחשב הניתוח, הפעל את ארגז הכלים הפנימי של MATLAB ואת הטורבו מוח וויאג'ר (TBV).
- בארגז הכלים של MATLAB, הזן את המידע הספציפי למשתתף, כגון מזהה המטופל ומספר ריצת נוירופידבק.
- לחץ על צור קבצי פרוטוקול כדי להכין את קובץ הפרוטוקול באמצעות המידע שנוסף בשלב 5.5.
הערה: קובץ הפרוטוקול מכיל מידע הקשור לתזמון המצב (למשל, הזמן שבו TR מצב ספציפי צריך להתחיל ואיזה גירוי להציג). הוא ישמש גם את ארגז הכלים של MATLAB וגם את TBV. - לחץ על הכפתור ביצוע בממשק המשתמש הגרפי של ארגז הכלים של MATLAB. הקוד ממתין כעת לקבלת נתונים מה-TBV.
- ב-TBV, בחר את קובץ הפרוטוקול שנוצר בשלב 5.6. בנוסף, בחר את קובץ ה- .roi שנוצר מהפעלות הנוירופידבק הקודמות.
הערה: בחירת קובץ ROI חשובה, מכיוון שהיא תמנע קריסה של תוכנת TBV במהלך התקופה הראשונית (10 TRs) של ריצת הנוירופידבק. - הכן את רצף ה-EPI ליישום במחשב המארח של מציאות משולבת. לחץ על כפתור ההתחלה ב-TBV.
- צייר מחדש את החזר ה-ROI של היעד בתוכנת TBV בהתאם לציוני הדרך האנטומיים. הצורה והגודל של החדרים במוח משמשים כציוני דרך לבחירת האינסולה הקדמית. בנוסף, נעשה שימוש בצורה הגלית של קליפת המוח האינסולרית בוחרים במדויק את הווקסלים הקשורים לאינסולה קדמית דו-צדדית.
- צייר החזר ROI על האזור המוטורי הראשוני (M1) תוך שימוש בחריץ המרכזי כציון דרך אנטומי. האזור המוטורי העיקרי משמש כ-ROI ייחוס כדי להסיר את ההשפעה של עליות BOLD גלובליות ותנודות BOLD עקב תנועת הראש.
- בסוף כל מפגש נוירופידבק, שאלו את המשתתף, "באיזו אסטרטגיה קוגניטיבית השתמשתם במהלך חסימת הוויסות?". בנוסף, שאלו את המשתתף על רמת הנוחות שלו והאם הוא מעוניין להמשיך בניסוי.
- לאחר ארבע הפעלות נוירופידבק, בחר בלחצן האפשרויות כן עבור הפעלת ההעברה.
הערה: ריצת העברה דומה לריצת נוירופידבק. עם זאת, המשתתפים מבצעים ויסות עצמי בהיעדר משוב. זה מסייע לקבוע אם הוויסות העצמי הנלמד מועבר למצב שבו המשתתף לא יקבל נוירופידבק (למשל, מחוץ לסורק).
6. קבוצת ביקורת
- הדריכו את המשתתפים בקבוצת הביקורת באותו אופן כמו אלה בקבוצת הניסוי. עם זאת, ספק משוב חלמון למשתתפים.
הערה: במשוב מיוק, הכמות הממוצעת של חיזוק (כסף) הן בקבוצת הניסוי והן בקבוצת הביקורת נשארת זהה. ההבדל היחיד בין שתי הקבוצות הוא מקריות המשוב שניתן למשתתפים. עבור משתתפים בקבוצת הביקורת, הסכום הכולל של חיזוק (כסף) מחולק בין 40% מהניסויים שהוקצו באופן אקראי. עם זאת, ב-60% האחרים של הניסויים, המשתתפים מקבלים משוב שלילי (אפס יורו). לפיכך, המשתתפים בקבוצת הביקורת אינם מקבלים משוב מותנה.
7. ניתוח לא מקוון
- עיבוד מקדים של נתוני fMRI
- השתמש בארגז כלים של מיפוי פרמטרי סטטיסטי (SPM) כדי לעבד מראש את נתוני ה-fMRI (https://www.fil.ion.ucl.ac.uk/spm/ext/).
- המר את נתוני ה-fMRI בפורמט DICOM לפורמט NIFTI באמצעות כלי המרת פורמט של פונקציית האצווה SPM.
- הסר את 10 הסריקות הראשוניות מכל נתוני ריצת נוירופידבק כדי למנוע השפעות שיווי משקל שיפוע42.
- בצע את תהליך היישור מחדש כדי להסיר חפצי תנועה וליישר את כל אמצעי האחסון לאמצעי האחסון הראשון של ההפעלה. בנוסף, בצע תיקון פרוסת זמן כדי לפצות על עיכוב רכישת הפרוסה43.
- ביצוע פילוח של הסריקה האנטומית, רישום משותף של נתוני רצף ה- EPI והנתונים האנטומיים, ונורמליזציה למיפוי נתוני מרחב הנושא לתבנית המוח הסטנדרטית של המכון הנוירולוגי של מונטריאול (MNI)44.
- באמצעות קוד ה-MATLAB הפנימי שלנו, חלץ את אותות ה-BOLD מהחזר ROI בצורת קובייה שנוצר סביב קואורדינטות ה-MNI המתאימות לאינסולה הקדמית הדו-צדדית ולקליפת המוח המוטורית הראשונית.
- חישוב אחוז שינוי באות BOLD
- חשב את אחוז השינוי באות BOLD בהתבסס על השינוי הממוצע באות BOLD עבור כל החזר ROI במהלך בלוק הייצוב בהשוואה לבלוק הבסיס הקודם. המשוואה לשינוי באחוזים באות BOLD היא כדלקמן:
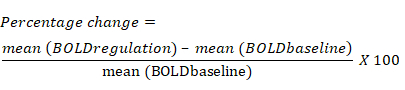
- חשב את אחוז השינוי באות BOLD בהתבסס על השינוי הממוצע באות BOLD עבור כל החזר ROI במהלך בלוק הייצוב בהשוואה לבלוק הבסיס הקודם. המשוואה לשינוי באחוזים באות BOLD היא כדלקמן:
- ניתוח התנהגות עישון מפורשת של המשתתפים
- ייבא את תשובות המשתתפים לשאלונים (כלומר, QSU-b, VAS-C, CO measure וסיגריות ליום) ל-MATLAB.
- בדוק את תקינות הנתונים באמצעות בדיקת קולמוגורוב-סמירנוב בדגימה אחת מ- MATLAB.
- יש להשתמש במבחן t של מדגם אחד כדי להשוות תשובות לשאלונים שונים עבור כל משתתף, ומבחן t מדגם זוגי כדי להשוות ציונים בין קבוצת הניסוי לקבוצת הביקורת.
- ניתוח היחס המרומז לרמזים מעוררי השתוקקות
- חלץ את זמן התגובה (RT) של ניסויי הכנה רגשית עבור כל משתתף מקבצי היומן שנוצרו על ידי תוכנת מצגת.
- הסר את החריגים על סמך ה-RT (כלומר, אל תכלול ניסויים עם RT ארוך מפי 2 מסטיית התקן של ה-RT הממוצע של המשתתף).
- בדוק את תקינות הנתונים באמצעות בדיקת קולמוגורוב-סמירנוב בדגימה אחת מ- MATLAB.
- להשוות את השפעות הוויסות על זמני התגובה החציוניים של שילובים ייחודיים של ראשוניים (תמונות מעוררות השתוקקות ותמונות ניטרליות) ומטרות (מילים חיוביות ושליליות) עבור כל משתתף, ולהשוות בין קבוצת הניסוי לקבוצת הביקורת באמצעות מבחן t חכם זוגי.
Access restricted. Please log in or start a trial to view this content.
תוצאות
ארבעה מטופלים גויסו על סמך הציונים שלהם בשאלון Fagerström לתלות בניקוטין (FTND)45 עבור תלות בניקוטין ברמה בינונית (ציון FTND >4) ומספר הסיגריות שעישנו מדי יום (>15). בנוסף, הובטח כי למשתתפים אין קעקוע או שתלים מתכתיים בהתאם לאמצעי הבטיחות של MRI של המוסד. לכל משתתף בוצעו חמישה מפג?...
Access restricted. Please log in or start a trial to view this content.
Discussion
תוצאות של ארבעה משתתפים מדגימות את האפשרות של מעשני סיגריות ללמוד להפחית את ויסות ההפעלה באינסולה הקדמית הדו-צדדית בנוכחות רמזים מעוררי השתוקקות. שינויים בהתנהגויות העישון המרומזות והמפורשות לאחר אימון נוירופידבק במשתתף המדגם עשויים להיות קשורים להורדת ויסות נלמד, מ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך על ידי Comisión Nacional de Investigación Científica y Tecnológica de Chile (Conicyt) באמצעות Fondo Nacional de Desarrollo Científico y Tecnológico, מענק פוסט-דוקטורט של Fondecyt (מס' 3100648), Fondecyt Regular (פרויקטים מס' 1171313 ומס' 1171320) ו-CONICYT PIA/Anillo de Investigación en Ciencia y Tecnología ACT172121.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| MATHSWORK | MATLAB version 2014a | ||
| Presentation - Neurobehavioral Systems | Presentation version 18.0 | ||
| Brain Innovation B.V. | Turbo Brain Voyager Version 2.6 or 3.0 |
References
- Fernandez, T., et al. EEG and behavioral changes following neurofeedback treatment in learning disabled children. Clinical Electroencephalography. 34, 145-152 (2003).
- Scarapicchia, V., Brown, C., Mayo, C., Gawryluk, J. R. Functional Magnetic Resonance Imaging and Functional Near-Infrared Spectroscopy: Insights from Combined Recording Studies. Frontiers in Human Neuroscience. 11, 419(2017).
- Hinault, T., Larcher, K., Zazubovits, N., Gotman, J., Dagher, A. Spatio-temporal patterns of cognitive control revealed with simultaneous electroencephalography and functional magnetic resonance imaging. Human Brain Mapping. , (2018).
- Grech, R., et al. Review on solving the inverse problem in EEG source analysis. Journal of NeuroEngineering and Rehabilitation. 5, 25(2008).
- Van Essen, D. C., et al. The Human Connectome Project: a data acquisition perspective. NeuroImage. 62, 2222-2231 (2012).
- World Health Organization. WHO Report on the Global Tobacco Epidemic, 2017. , Geneva: World Health Organization. (2017).
- Ringlever, L., Otten, R., de Leeuw, R. N., Engels, R. C. Effects of parents' education and occupation on adolescent smoking and the mediating role of smoking-specific parenting and parent smoking. European Addiction Research. 17, 55-63 (2011).
- Malaiyandi, V., Sellers, E. M., Tyndale, R. F. Implications of CYP2A6 genetic variation for smoking behaviors and nicotine dependence. Clinical Pharmacology and Therapeutics. 77, 145-158 (2005).
- Brody, A. L., et al. Neural substrates of resisting craving during cigarette cue exposure. Biological Psychiatry. 62, 642-651 (2007).
- Childress, A. R., et al. Cue reactivity and cue reactivity interventions in drug dependence. NIDA Research Monography. 137, 73-95 (1993).
- Claus, E. D., Kiehl, K. A., Hutchison, K. E. Neural and behavioral mechanisms of impulsive choice in alcohol use disorder. Alcoholism, Clinical and Experimental Research. 35, 1209-1219 (2011).
- Franklin, T. R., et al. Limbic activation to cigarette smoking cues independent of nicotine withdrawal: a perfusion fMRI study. Neuropsychopharmacology. 32, 2301-2309 (2007).
- Grusser, S. M., et al. Cue-induced activation of the striatum and medial prefrontal cortex is associated with subsequent relapse in abstinent alcoholics. Psychopharmacology. 175, 296-302 (2004).
- Buhler, M., et al. Nicotine dependence is characterized by disordered reward processing in a network driving motivation. Biological Psychiatry. 67, 745-752 (2010).
- Bonson, K. R., et al. Neural systems and cue-induced cocaine craving. Neuropsychopharmacology. 26, 376-386 (2002).
- Brody, A. L., et al. Brain metabolic changes during cigarette craving. Archives of General Psychiatry. 59, 1162-1172 (2002).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318, 655-658 (2007).
- Naqvi, N. H., Rudrauf, D., Damasio, H., Bechara, A. Damage to the insula disrupts addiction to cigarette smoking. Science. 315, 531-534 (2007).
- Hollander, J. A., Lu, Q., Cameron, M. D., Kamenecka, T. M., Kenny, P. J. Insular hypocretin transmission regulates nicotine reward. Proceedings of the National Academy of Sciences of the United States of America. 105, 19480-19485 (2008).
- Forget, B., Pushparaj, A., Le Foll, B. Granular insular cortex inactivation as a novel therapeutic strategy for nicotine addiction. Biological Psychiatry. 68, 265-271 (2010).
- Scott, D., Hiroi, N. Deconstructing craving: dissociable cortical control of cue reactivity in nicotine addiction. Biological Psychiatry. 69, 1052-1059 (2011).
- Buczkowski, K., Marcinowicz, L., Czachowski, S., Piszczek, E. Motivations toward smoking cessation, reasons for relapse, and modes of quitting: results from a qualitative study among former and current smokers. Patient Prefer Adherence. 8, 1353-1363 (2014).
- Hughes, J. R., Stead, L. F., Hartmann-Boyce, J., Cahill, K., Lancaster, T. Antidepressants for smoking cessation. Cochrane Database of Systematic Reviews. , CD000031(2014).
- Bedi, G., et al. Incubation of cue-induced cigarette craving during abstinence in human smokers. Biological Psychiatry. 69, 708-711 (2011).
- Bassett, J. F., Dabbs, J. M. Jr A portable version of the go/no-go association task (GNAT). Behavior Research Methods. 37, 506-512 (2005).
- Huijding, J., de Jong, P. J., Wiers, R. W., Verkooijen, K. Implicit and explicit attitudes toward smoking in a smoking and a nonsmoking setting. Addictive Behaviors. 30, 949-961 (2005).
- Sherman, S. J., Rose, J. S., Koch, K., Presson, C. C., Chassin, L. Implicit and explicit attitudes towards cigarette smoking: The effect of context and motivation. Journal of Social and Clinical Psychology. 22, 13-39 (2003).
- Swanson, J. E., Rudman, L. A., Greenwald, A. G. Using the Implicit Association Test to investigate attitude- behavior consistency for stigmatized behavior. Cognition and Emotion. 15, 207-230 (2001).
- Asgaard, G. L., Gilbert, D. G., Malpass, D., Sugai, C., Dillon, A. Nicotine primes attention to competing affective stimuli in the context of salient alternatives. Experimental and Clinical Psychopharmacology. 18, 51-60 (2010).
- Gilbert, D. G., et al. Effects of nicotine on brain responses to emotional pictures. Nicotine & Tobacco Research. 6, 985-996 (2004).
- Czyzewska, M., Graham, R. Implicit and explicit attitudes to high- and low-calorie food in females with different BMI status. Eating Behaviors. 9, 303-312 (2008).
- Gilbert, D. G., Rabinovich, N. E. International smoking images series (with neutral counterparts). , Southern Illinois University: Integrative Neuroscience Laboratory, Department of Psychology. (1999).
- Bandettini, P. A., Wong, E. C., Hinks, R. S., Tikofsky, R. S., Hyde, J. S. Time course EPI of human brain function during task activation. Magnetic Resonance Medicine. 25, 390-397 (1992).
- Goebel, R. BrainVoyager - past, present, future. NeuroImage. 62, 748-756 (2012).
- Poline, J. B., Worsley, K. J., Holmes, A. P., Frackowiak, R. S., Friston, K. J. Estimating smoothness in statistical parametric maps: variability of p values. Journal of Computer Assisted Tomography. 19, 788-796 (1995).
- Johnson, K. A., et al. Intermittent "real-time" fMRI feedback is superior to continuous presentation for a motor imagery task: a pilot study. Journal of Neuroimaging. 22, 58-66 (2012).
- Yoo, S. S., Jolesz, F. A. Functional MRI for neurofeedback: feasibility study on a hand motor task. Neuroreport. 13, 1377-1381 (2002).
- Craig, A. D. How do you feel--now? The anterior insula and human awareness. Nature reviews. Neuroscience. 10, 59-70 (2009).
- Cox, L. S., Tiffany, S. T., Christen, A. G. Evaluation of the brief questionnaire of smoking urges (QSU-brief) in laboratory and clinical settings. Nicotine & Tobacco Research. 3, 7-16 (2001).
- Wewers, M. E., Rachfal, C., Ahijevych, K. A psychometric evaluation of a visual analogue scale of craving for cigarettes. Western Journal of Nursing Research. 12, 672-681 (1990).
- Allen, D. R., Browse, N. L., Rutt, D. L., Butler, L., Fletcher, C. The effect of cigarette smoke, nicotine, and carbon monoxide on the permeability of the arterial wall. Journal of Vascular Surgery. 7, 139-152 (1988).
- Weiskopf, N., et al. Real-time functional magnetic resonance imaging: methods and applications. Magnetic Resonance Imaging. 25, 989-1003 (2007).
- Sladky, R., et al. Slice-timing effects and their correction in functional MRI. NeuroImage. 58, 588-594 (2011).
- Mazziotta, J., et al. A probabilistic atlas and reference system for the human brain: International Consortium for Brain Mapping (ICBM). Philosophical Transactions of the Royal Society of London: Series B, Biological Sciences. 356, 1293-1322 (2001).
- Heatherton, T. F., Kozlowski, L. T., Frecker, R. C., Fagerstrom, K. O. The Fagerstrom Test for Nicotine Dependence: a revision of the Fagerstrom Tolerance Questionnaire. British Journal of Addiction. 86, 1119-1127 (1991).
- Myrick, H., et al. Differential brain activity in alcoholics and social drinkers to alcohol cues: relationship to craving. Neuropsychopharmacology. 29, 393-402 (2004).
- Tapert, S. F., Brown, G. G., Baratta, M. V., Brown, S. A. fMRI BOLD response to alcohol stimuli in alcohol dependent young women. Addictive Behaviors. 29, 33-50 (2004).
- Kilts, C. D., Gross, R. E., Ely, T. D., Drexler, K. P. The neural correlates of cue-induced craving in cocaine-dependent women. American Journal of Psychiatry. 161, 233-241 (2004).
- Li, Q., et al. Assessing cue-induced brain response as a function of abstinence duration in heroin-dependent individuals: an event-related fMRI study. PloS One. 8, e62911(2013).
- Frank, S., Kullmann, S., Veit, R. Food related processes in the insular cortex. Front Hum Neurosci. 7, 499(2013).
- deCharms, R. C., et al. Control over brain activation and pain learned by using real-time functional MRI. Proceedings of the National Academy of Sciences of the United States of America. 102, 18626-18631 (2005).
- Ruiz, S., Birbaumer, N., Sitaram, R. Abnormal Neural Connectivity in Schizophrenia and fMRI-Brain-Computer Interface as a Potential Therapeutic Approach. Frontiers in Psychiatry. 4, 17(2013).
- Habes, I., et al. Pattern classification of valence in depression. NeuroImage. Clinical. 2, 675-683 (2013).
- Li, X., et al. Volitional reduction of anterior cingulate cortex activity produces decreased cue craving in smoking cessation: a preliminary real-time fMRI study. Addiction Biology. 18, 739-748 (2013).
- Lubar, J. F., Swartwood, M. O., Swartwood, J. N., O'Donnell, P. H. Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Biofeedback and Self-Regulation. 20, 83-99 (1995).
- Janssen, T. W., et al. A randomized controlled trial into the effects of neurofeedback, methylphenidate, and physical activity on EEG power spectra in children with ADHD. Journal of Child Psychology and Psychiatry. 57, 633-644 (2016).
- Mayer, K., Wyckoff, S. N., Fallgatter, A. J., Ehlis, A. C., Strehl, U. Neurofeedback as a nonpharmacological treatment for adults with attention-deficit/hyperactivity disorder (ADHD): study protocol for a randomized controlled trial. Trials. 16, 174(2015).
- Gevensleben, H., et al. Distinct EEG effects related to neurofeedback training in children with ADHD: a randomized controlled trial. International Journal of Psychophysiology. 74, 149-157 (2009).
- Ramos-Murguialday, A., et al. Brain-machine interface in chronic stroke rehabilitation: a controlled study. Annals of Neurology. 74, 100-108 (2013).
- Biasiucci, A., et al. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nature Communication. 9, 2421(2018).
- Du, J., et al. Effects of repetitive transcranial magnetic stimulation on motor recovery and motor cortex excitability in patients with stroke: a randomized controlled trial. European Journal of Neurology. 23, 1666-1672 (2016).
- Ang, K. K., et al. Facilitating effects of transcranial direct current stimulation on motor imagery brain-computer interface with robotic feedback for stroke rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, S79-S87 (2015).
- Wolbrecht, E. T., Chan, V., Reinkensmeyer, D. J., Bobrow, J. E. Optimizing compliant, model-based robotic assistance to promote neurorehabilitation. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 16, 286-297 (2008).
- Sitaram, R., et al. Closed-loop brain training: the science of neurofeedback. Nature Reviews Neuroscience. 18, 86-100 (2017).
- Simkin, D. R., Thatcher, R. W., Lubar, J. Quantitative EEG and neurofeedback in children and adolescents: anxiety disorders, depressive disorders, comorbid addiction and attention-deficit/hyperactivity disorder, and brain injury. Child and Adolescent Psychiatric Clinics of North America. 23, 427-464 (2014).
- Pascual-Marqui, R. D., et al. Assessing interactions in the brain with exact low-resolution electromagnetic tomography. Philosophical transactions: Series A, Mathematical, physical, and engineering sciences. , 3768-3784 (2011).
- Meir-Hasson, Y., Kinreich, S., Podlipsky, I., Hendler, T., Intrator, N. An EEG Finger-Print of fMRI deep regional activation. NeuroImage. 102, 128-141 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved