Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Utilisation de la rétroaction neurologique basée sur l’imagerie par résonance magnétique fonctionnelle en temps réel pour réguler à la baisse le cortex insulaire chez les fumeurs dépendants à la nicotine
Dans cet article
Résumé
Dans l’imagerie par résonance magnétique fonctionnelle en temps réel (rtfMRI), l’activité cérébrale est manipulée expérimentalement comme une variable indépendante, et le comportement est mesuré comme une variable dépendante. Le protocole présenté ici se concentre sur l’utilisation pratique de l’IRMtf comme outil thérapeutique pour les troubles psychiatriques tels que la dépendance à la nicotine.
Résumé
Cela fait plus d’une décennie que la première approche de neurofeedback basée sur l’imagerie par résonance magnétique fonctionnelle (IRMf) a été mise en œuvre avec succès. Depuis, diverses études ont démontré que les participants peuvent apprendre à contrôler volontairement une région cérébrale circonscrite. Par conséquent, l’IRMf en temps réel (rtfMRI) a fourni une nouvelle opportunité d’étudier les modifications du comportement dues à la manipulation de l’activité cérébrale. Par conséquent, les rapports d’applications de l’IRMtf pour entraîner l’autorégulation de l’activité cérébrale et les modifications concomitantes des conditions comportementales et cliniques telles que les troubles neurologiques et psychiatriques (par exemple, la schizophrénie, le trouble obsessionnel compulsif (TOC), les accidents vasculaires cérébraux) ont rapidement augmenté.
Des études de neuroimagerie dans le domaine de la toxicomanie ont montré que le cortex cingulaire antérieur, le cortex orbitofrontal et le cortex insulaire sont activés lors de la présentation de signaux associés à la drogue. De plus, il a été démontré que l’activité dans les cortex insulaires gauche et droit est fortement corrélée avec les envies de drogue lorsque les participants sont exposés à des signaux suscitant l’envie de fumer. Par conséquent, l’insula bilatérale est d’une importance particulière dans la recherche sur les pulsions de drogue et la toxicomanie en raison de son rôle dans la représentation des états corporels (intéroceptifs). Cette étude explore l’utilisation du neurofeedback rtfMRI pour la réduction de l’activité dépendante du niveau d’oxygène dans le sang (BOLD) dans les cortex insulaires bilatéraux des participants dépendants à la nicotine. L’étude teste également s’il existe des modifications associées à l’entraînement en neurofeedback dans les attitudes implicites des participants envers les signaux de manque de nicotine et le comportement de manque explicite.
Introduction
Le neurofeedback est une procédure de conditionnement opérant par laquelle les humains ou les animaux peuvent apprendre à moduler l’activité neuronale dans une ou plusieurs régions du cerveau. La formation conduit généralement à des modifications comportementales1. En principe, les signaux cérébraux provenant d’une ou de plusieurs régions cérébrales circonscrites sont transformés en rétroaction sensorielle (par exemple, visuelle, auditive ou tactile), qui est fournie au participant pour le contrôle de l’activité cérébrale par conditionnement opérant ou d’autres formes d’apprentissage. À l’inverse du paradigme traditionnel de la neuroimagerie, les études de neurofeedback modulent l’activité cérébrale en tant que variable indépendante et mesurent le comportement en tant que variable dépendante. Ainsi, le neurofeedback offre une nouvelle approche pour étudier l’implication des régions cérébrales dans différentes fonctions cognitives et comment l’hyperactivation ou l’hypoactivation de ces régions cérébrales peut conduire à un comportement anormal.
Le neurofeedback a été utilisé avec différentes modalités de neuroimagerie telles que l’imagerie par résonance magnétique fonctionnelle (IRMf), l’électroencéphalographie (EEG) et la spectroscopie fonctionnelle dans le proche infrarouge (fNIRS). Les paradigmes de neurofeedback basés sur l’EEG et la fNIRS présentent les avantages d’une résolution temporelle plus élevée, d’un prix abordable et d’une portabilité 2,3. Cependant, ils se caractérisent par une faible résolution spatiale et une incapacité à accéder aux régions cérébrales plus profondes. De plus, l’EEG présente la complexité computationnelle du problème inverse pour déterminer une source d’activations neuronales à partir de signaux EEG de surface4. Cependant, avec les développements récents de l’IRMf en temps réel (rtfMRI), il est possible d’accéder aux signaux hémodynamiques de toutes les parties du cerveau, avec une bonne résolution spatiale (par exemple, 2 mm3) et une résolution temporelle de 720 ms5. Ainsi, l’IRMf surmonte les limitations mentionnées ci-dessus possédées par les techniques fNIRS et EEG.
La dépendance à la nicotine est l’une des principales causes de décès dans le monde en raison d’un certain nombre de maladies associées autabagisme6. Les facteurs reconnus conduisant à la dépendance à la nicotine sont la susceptibilité sociale, environnementale, psychologique7 et génétique8. Sur le plan neurobiologique, des études ont montré une activation dans le cortex cingulaire antérieur (ACC), le cortex orbitofrontal (OFC), l’aire tegmentale ventrale (VTA), le striatum ventral, l’amygdale, l’hippocampe, le cortex préfrontal (PFC) et le cortex insulaire lors de la présentation de signaux associés à des médicaments, contrairement aux signaux de contrôle neutres 9,10,11,12,13,14 . L’activité des insulas gauche et droit est fortement corrélée avec les envies de fumer lorsque les fumeurs ont regardé des indices associés à la drogue15,16. L’insula joue un rôle important dans l’induction du comportement de manque 17,18,19,20,21, car elle est responsable de la perception de l’état corporel. Il a été rapporté que les fumeurs présentant des lésions dans leur cortex insulaire étaient plus susceptibles d’arrêter de fumer que les fumeurs ayant des lésions cérébrales n’impliquant pas l’insula18.
L’un des plus grands défis des méthodes actuelles de sevrage tabagique est le taux élevé de rechute22. Plus de 80 % des fumeurs rechutent dans les premiers mois suivant l’arrêt dutabac23. L’exposition à des signaux précédemment associés à la consommation de drogues est l’une des principales raisons du taux élevé de rechute de la dépendance à la nicotine24. Ce mécanisme s’appelle l’effet d’incubation. Le protocole actuel est développé pour cibler l’effet d’incubation évalué par une tâche d’amorçage affectif. Des études antérieures ont démontré que les fumeurs abstinents ont des attitudes implicites négatives à l’égard des signaux liés au tabagisme 25,26,27,28. Dans la tâche typique d’amorçage affectif, les stimuli d’amorçage émotionnel modifient le traitement d’une cible affective de sorte que le temps de réaction et la précision des réponses sont modifiés29. En d’autres termes, si les stimuli premiers et cibles sont de la même valence, le temps de réaction en réponse aux stimuli cibles sera plus rapide, et vice versa.
Dans la présente étude, on suppose que la régulation négative du cortex insulaire antérieur bilatéral réduira l’envie et, par conséquent, que la valence des signaux induisant l’envie passera de négative à neutre, car les biais attentionnels et associatifs s’éloigneront des signaux liés au tabagisme30. La tâche de comportement implicite est une tâche d’amorçage affectif adaptée à l’origine de Czyzewska et Graham31. Sur la base de l’hypothèse susmentionnée, on s’attend à observer une diminution du temps de réaction en réponse à une combinaison de mots premiers (image déclenchant l’envie ou son homologue neutre) et de mots cibles avec une valence positive après le bloc de régulation négative par rapport au bloc de base. La tâche d’amorçage (figure 2B) se compose d’un mot premier (c’est-à-dire une image déclenchant l’envie ou son homologue neutre image32) et d’un mot cible avec une valence positive ou négative. L’image première est présentée pendant 200 ms, suivie d’un mot cible présenté pendant 1 seconde. L’asynchronie d’apparition du stimulus (SOA) est de 250 ms. Les participants sont ensuite invités à juger de la valence du mot cible (positif ou négatif) et à répondre en appuyant sur un bouton aussi rapidement et précisément que possible.
Le système rtfMRI (Figure 1) se compose des sous-systèmes suivants : (1) participant, (2) acquisition de signaux, (3) analyse de signaux en ligne et (4) retour de signal. L’acquisition du signal est effectuée à l’aide d’un scanner corps entier Siemens Trio 3.0T à l’aide d’une séquence d’imagerie par écho planaire (EPI)33. Des procédures telles que la reconstruction d’image, la correction de la distorsion et le calcul de la moyenne du signal sont effectuées sur l’ordinateur du scanner. Une fois les images reconstruites et prétraitées, elles sont exportées vers le sous-système d’analyse du signal. Le sous-système d’analyse du signal est mis en œuvre à l’aide du Turbo Brain Voyager (TBV)34. TBV récupère les images reconstruites et effectue le traitement des données qui comprend la correction de mouvement 3D et l’analyse statistique en temps réel à l’aide du modèle linéaire général35. TBV permet à l’utilisateur de dessiner des régions d’intérêt (ROI) sur plusieurs voxels sur les images fonctionnelles et d’extraire des valeurs BOLD moyennes du ROI après chaque temps de répétition (TR). Les séries chronologiques des retours sur investissement sélectionnés sont ensuite exportées vers le script MATLAB qui calcule et présente les retours d’expérience au participant.
Un retour visuel de l’activité cérébrale est fourni aux participants sous la forme d’un thermomètre graphiquement animé, ses barres changeant proportionnellement au pourcentage de changements BOLD dans les ROI. Plusieurs études ont utilisé la rétroaction intermittente (rétroaction fournie à un participant après un certain nombre de TR de la séquence EPI) pour la formation des participants36,37. Cependant, dans l’étude actuelle, on s’attendait à ce que les participants aient plus de difficultés à réguler à la baisse le signal BOLD dans l’insula antérieure avec une rétroaction continue en raison du rôle de l’insula dans l’intégration sensorielle et de son implication dans le traitement de l’information de rétroaction visuelle38. Par conséquent, il a été présumé que la rétroaction continue entraînerait un conflit entre deux processus dans le cortex insulaire, l’un qui augmente le signal en raison de la rétroaction externe, et l’autre qui diminue le signal en raison de l’entraînement en neurofeedback. Par conséquent, dans cette étude, nous ne fournissons une rétroaction qu’à la fin de chaque bloc de régulation descendante (rétroaction différée). Les participants voient un texte (par exemple, 0,87 euro) en guise de retour visuel (figures 2A, C) qui indique le montant d’argent qu’ils ont gagné (récompense monétaire). Cette récompense est proportionnelle au pourcentage de régulation négative réalisé dans le bloc réglementaire.
L’IRMr est une nouvelle neurotechnologie qui pourrait être en mesure de surmonter les problèmes dans les approches thérapeutiques du traitement de la toxicomanie et pourrait fournir des interventions plus fiables et efficaces pour réduire les rechutes. Les objectifs à long terme de la présente étude sont triples : 1) tester si les toxicomanes à la nicotine peuvent apprendre à réguler à la baisse les signaux BOLD dans l’insula antérieure en présence de stimuli suscitant un comportement de manque ; 2) examiner si l’entraînement en neurofeedback entraîne des modifications du comportement de manque ; et 3) d’explorer si les changements dans les niveaux de manque pendant l’entraînement en neurofeedback de la régulation négative de l’insula persistent après six mois d’entraînement sans aucune autre intervention. Cet article fournit une description détaillée du protocole expérimental rtfMRI et de ses différentes composantes. Des exemples de données de l’étude sont également présentés et une discussion sur les défis futurs et le potentiel de cette méthode en plus de la recherche. Le protocole présenté est conçu pour déterminer si l’entraînement par neurofeedback basé sur l’IRMf peut être utilisé pour étudier les réductions de l’activité cérébrale dans le cortex insulaire des fumeurs de cigarettes. De plus, le protocole est destiné à étudier les relations entre l’activation du cortex insulaire et les comportements de manque de fumer des fumeurs de cigarettes.
Access restricted. Please log in or start a trial to view this content.
Protocole
Le Comité d’éthique de la Faculté de médecine de l’Université de Tübingen et de la Pontificia Universidad Católica de Chile a approuvé le protocole rtfMRI suivant.
1. Configuration matérielle
- Le matériel représenté à la figure 1 n’est préparé qu’une seule fois pour configurer l’exportation en temps réel des données IRM.
- La préparation de la salle d’IRM est la même que la mesure traditionnelle de l’IRMf. Préparez la salle d’IRM avant l’arrivée du participant.
- Fixez la bobine de tête à 32 ou 20 canaux au scanner.
- Connectez le câble VGA/HDMI du projecteur et le dispositif de réponse compatible MR (boîte de boutons) à l’ordinateur de stimulus.
REMARQUE : Dans la plupart des configurations IRM, le dispositif de réponse délivre le déclencheur TR à l’ordinateur de stimulus. Ce déclencheur permet de synchroniser la présentation du stimulus et l’acquisition des données.
2. Préparation des participants en dehors du scanner
- Préparez le formulaire de consentement et les questionnaires que les participants doivent remplir avant leur arrivée.
- Une fois que le participant arrive, expliquez l’expérience et la technique d’IRMf. De plus, expliquez au participant comment effectuer la tâche (par exemple, pendant l’expérience, les participants doivent garder les yeux ouverts et toujours regarder les images sur l’écran d’affichage, et ils doivent essayer de ne pas bouger la tête à l’intérieur du scanner).
- Demandez au participant de signer le formulaire de consentement et de remplir les questionnaires nécessaires pour évaluer les niveaux de fringale.
- Demandez aux participants de remplir les questionnaires suivants : 1) EVA-C : Échelle visuelle analogique, envie de fumer39, 2) QSU-b : Questionnaire sur les envies de fumer – Brève version40, et 3) cigarettes par jour.
- Demandez au participant d’expirer à l’aide de l’appareil de mesure du monoxyde de carbone (CO).
REMARQUE : La mesure de CO41 indique si le participant s’abstient ou non de fumer au moins 3 h avant l’arrivée pour la séance de neurofeedback. Le CO est mesuré en ppm (parties par million). De faibles valeurs de CO indiquent que le participant n’a pas fumé pendant au moins deux heures avant son arrivée. Les participants devraient être invités à s’abstenir de fumer afin que les signaux de manque de fumer suscitent une forte envie pendant l’expérience. Les participants ayant des valeurs élevées de CO seront avertis avant la future séance de neurofeedback de s’assurer qu’ils s’abstiennent de fumer avant la séance d’IRMrt. Les participants qui ne s’abstiennent pas de fumer deux fois doivent être exclus de l’étude.
3. Positionnement des participants
REMARQUE : La procédure de positionnement du participant sur la table du scanner est similaire à l’expérience traditionnelle d’IRMf.
- Demandez au participant de retirer tous les objets métalliques de ses poches avant d’entrer dans la salle d’IRM.
- Demandez au participant d’insérer des bouchons d’oreille avant de s’allonger sur la table du scanner en position couchée.
- Utilisez des coussinets pour fixer la position de la tête du participant à l’intérieur de la bobine de tête. Cette étape permet de réduire les mouvements de la tête pendant la mesure.
- Verrouillez la partie supérieure de la bobine de tête et fixez le miroir à la bobine de tête.
- Donnez le dispositif de réponse au participant et placez-le en fonction du confort du participant.
- Demandez au participant de fermer les yeux et de marquer la position de référence de la tête du participant entre les sourcils à l’aide d’une lumière laser.
- Déplacez la table du scanner pour placer la position marquée au centre de l’alésage de l’IRM.
- Confirmez avec le participant qu’il est dans une position confortable et qu’il peut voir les stimuli visuels projetés sur l’écran derrière le scanner à l’aide du miroir. Ajustez le rétroviseur, si nécessaire.
4. Acquisition de données
- Lors des premiers scans, demandez au participant de fermer les yeux et d’essayer de ne pas bouger la tête.
- Démarrez la mesure avec une séquence d’impulsions d’alignement de piste. Cette séquence est généralement utilisée pour déterminer la position de la coupe du balayage anatomique et du balayage fonctionnel (séquence EPI) exécutés par la suite.
- Sélectionnez le champ de vision (FOV) pour le balayage anatomique avec les paramètres suivants : TR = 11,5 ms, TE = 5 ms, 176 coupes sans écart de tranche, FOV = 240 x 240 mm2, matrice = 256 x 256, angle de retournement = 18°, fournissant des voxels isotropes de 1 mm3 . Le FOV de la séquence couvrira toute la tête du participant.
- Le champ de vision du balayage fonctionnel (séquence EPI) est aligné sur la ligne de commissure antérieure/ligne de commissure postérieure (ligne AC-PC). Ajustez la position des tranches pour couvrir la région d’intérêt cible. Les paramètres de la séquence sont les suivants : TR = 1,5, FOV = 192 mm, 25 tranches, voxel = 3 mm x 3 mm x 3 mm, angle de retournement = 70°.
5. Neurofeedback IRMf
- Alertez le participant que la course de neurofeedback commence et répétez les instructions fournies précédemment (par exemple, que pendant la ligne de base, un bloc est représenté par un signe « + »).
REMARQUE : Le participant doit observer l’image sur l’écran d’affichage. D’autre part, pendant le bloc de régulation, représenté par une flèche dans une direction descendante, les participants doivent essayer de se détacher des envies de mande en utilisant certaines stratégies cognitives. Le montant d’argent indiqué à la fin de chaque bloc réglementaire représente leur performance. Un montant d’argent plus élevé représente de meilleures performances. - Effectuez la course de neurofeedback dans laquelle les blocs de base et de régulation alternent (30 s chacun ; Figure 2).
- Sur l’ordinateur de stimulus, exécutez le logiciel de présentation écrit par code de stimulus et appuyez sur le bouton Entrée une fois que Prêt apparaît à l’écran. Le code de présentation attend maintenant le déclencheur pour démarrer l’exécution du neurofeedback.
REMARQUE : Le code est synchronisé avec les déclencheurs TR provenant du scanner. Par conséquent, il s’agit de la première étape de préparation à la course de neurofeedback. - Sur l’ordinateur d’analyse, exécutez la boîte à outils MATLAB interne et turbo brain voyager (TBV).
- Dans la boîte à outils MATLAB, saisissez les informations spécifiques au participant, telles que l’identifiant du patient et le numéro de course de neurofeedback.
- Appuyez sur Générer des fichiers de protocole pour préparer le fichier de protocole à l’aide des informations insérées à l’étape 5.5.
REMARQUE : Le fichier de protocole contient des informations relatives à la chronologie de la condition (par exemple, l’heure à laquelle le TR d’une condition spécifique doit commencer et le stimulus à présenter). Il sera utilisé à la fois par la boîte à outils MATLAB et TBV. - Appuyez sur le bouton exécuter sur l’interface graphique de la boîte à outils MATLAB. Le code est maintenant en attente de recevoir les données du TBV.
- Dans le TBV, sélectionnez le fichier de protocole généré à l’étape 5.6. De plus, sélectionnez le fichier .roi généré lors des séances précédentes de neurofeedback.
REMARQUE : La sélection d’un fichier ROI est importante, car elle évitera le plantage du logiciel TBV pendant la période initiale (10 TR) de l’exécution du neurofeedback. - Préparez la séquence EPI à implémenter dans l’ordinateur hôte MR. Appuyez sur le bouton de démarrage du TBV.
- Redessinez les retours sur investissement cibles dans le logiciel TBV en fonction des repères anatomiques. La forme et la taille des ventricules dans le cerveau sont utilisées comme points de repère pour sélectionner l’insula antérieure. De plus, la forme ondulée du cortex insulaire est utilisée pour sélectionner avec précision les voxels liés à l’insula antérieure bilatérale.
- Dessinez un retour d’intérêt sur la zone motrice primaire (M1) en utilisant le sillon central comme repère anatomique. La zone motrice primaire agit comme un retour sur investissement de référence pour éliminer l’effet des augmentations globales de BOLD et des fluctuations de BOLD dues au mouvement de la tête.
- À la fin de chaque séance de neurofeedback, demandez au participant : « Quelle stratégie cognitive utilisiez-vous pendant le bloc de régulation ? ». De plus, demandez au participant s’il est à l’aise et s’il souhaite ou non poursuivre l’expérience.
- Après quatre cycles de neurofeedback, sélectionnez le bouton radio Oui pour le cycle de transfert.
REMARQUE : Une course de transfert est similaire à la course de neurofeedback. Cependant, les participants effectuent l’autorégulation en l’absence de rétroaction. Cela permet de déterminer si l’autorégulation apprise est transférée à la situation dans laquelle le participant ne recevra pas de neurofeedback (par exemple, à l’extérieur du scanner).
6. Groupe témoin
- Instruisez les participants du groupe témoin de la même manière que ceux du groupe expérimental. Cependant, fournissez des commentaires sur le jaune aux participants.
REMARQUE : Dans le retour d’information, la quantité moyenne de renfort (argent) dans les groupes expérimental et témoin reste la même. La seule différence entre les deux groupes est la contingence de la rétroaction fournie aux participants. Pour les participants du groupe témoin, la quantité totale de renforcement (argent) est répartie entre les 40 % d’essais de régulation négative attribués au hasard. Cependant, dans les 60 % restants des essais, les participants reçoivent des commentaires négatifs (zéro euro). Ainsi, les participants du groupe témoin n’obtiennent pas de retour d’information contingent.
7. Analyse hors ligne
- Prétraitement des données IRMf
- Utilisez une boîte à outils de cartographie paramétrique statistique (SPM) pour prétraiter les données d’IRMf (https://www.fil.ion.ucl.ac.uk/spm/ext/).
- Convertissez les données IRMf au format DICOM au format NIFTI à l’aide de l’utilitaire de conversion de format de la fonction de lot SPM.
- Supprimez les 10 premiers balayages de chaque donnée d’exécution de neurofeedback pour éviter les effets d’équilibrage de gradient42.
- Effectuez le processus de réalignement pour supprimer les artefacts de mouvement et aligner tous les volumes sur le premier volume de la session. De plus, effectuez une correction de tranche de temps pour compenser le délai d’acquisition de tranche43.
- Effectuer la segmentation du balayage anatomique, le co-enregistrement des données de séquence EPI et des données anatomiques, et la normalisation pour cartographier les données de l’espace sujet selon le modèlede cerveau standard 44 de l’Institut neurologique de Montréal (INM).
- À l’aide de notre code MATLAB interne, extrayez les signaux BOLD des ROI en forme de cube créés autour des coordonnées MNI correspondant à l’insula antérieure bilatérale et au cortex moteur primaire.
- Calcul de la variation en pourcentage du signal BOLD
- Calculez la variation en pourcentage du signal BOLD en fonction de la variation moyenne du signal BOLD pour chaque retour sur investissement pendant le bloc de régulation par rapport au bloc de référence précédent. L’équation de la variation en pourcentage du signal BOLD est la suivante :
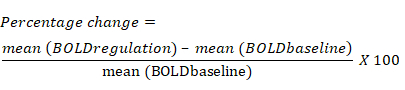
- Calculez la variation en pourcentage du signal BOLD en fonction de la variation moyenne du signal BOLD pour chaque retour sur investissement pendant le bloc de régulation par rapport au bloc de référence précédent. L’équation de la variation en pourcentage du signal BOLD est la suivante :
- Analyse du comportement tabagique explicite des participants
- Importez les réponses des participants aux questionnaires (c’est-à-dire QSU-b, VAS-C, mesure CO et cigarettes par jour) dans MATLAB.
- Testez la normalité des données à l’aide d’un test de Kolmogorov-Smirnov à un échantillon de MATLAB.
- Un test t à un échantillon doit être utilisé pour comparer les réponses de différents questionnaires pour chaque participant, et un test t à échantillon apparié pour comparer les scores entre les groupes expérimental et témoin.
- Analyse de l’attitude implicite à l’égard des signaux suscitant l’envie
- Extraire le temps de réaction (RT) des essais d’amorçage affectif pour chaque participant à partir des fichiers journaux générés par les logiciels de présentation.
- Éliminez les valeurs aberrantes basées sur le TR (c’est-à-dire n’incluez pas les essais avec un TR plus long que les 2 fois l’écart-type du TR moyen du participant).
- Testez la normalité des données à l’aide d’un test de Kolmogorov-Smirnov à un échantillon de MATLAB.
- Comparez les effets de régulation négative sur les temps de réaction médians de combinaisons uniques de nombres premiers (images induisant l’envie et neutres) et de cibles (mots positifs et négatifs) pour chaque participant, et comparez entre le groupe expérimental et le groupe témoin à l’aide d’un test t par appariement.
Access restricted. Please log in or start a trial to view this content.
Résultats
Quatre patients ont été recrutés en fonction de leurs scores au questionnaire du test de Fagerström pour la dépendance à la nicotine (FTND)45 , du questionnaire pour la dépendance à la nicotine de niveau moyen (score FTND >4) et du nombre de cigarettes fumées chaque jour (>15). De plus, il a été garanti que les participants n’avaient pas de tatouage ou d’implants métalliques, conformément aux mesures de sécurité IRM de l’institution. Cinq séances d’IRMr...
Access restricted. Please log in or start a trial to view this content.
Discussion
Les résultats de quatre participants démontrent la possibilité pour les fumeurs de cigarettes d’apprendre à réguler à la baisse l’activation dans l’insula antérieure bilatérale en présence d’un signal déclenchant l’envie de fumer. Les changements dans les comportements tabagiques implicites et explicites après l’entraînement en neurofeedback chez le participant de l’échantillon peuvent être liés à une régulation négative apprise, car le participant n’a p...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été financée par la Comisión Nacional de Investigación Científica y Tecnológica de Chile (Conicyt) par l’intermédiaire du Fondo Nacional de Desarrollo Científico y Tecnológico, de la bourse postdoctorale Fondecyt (n° 3100648), de Fondecyt Regular (projets n° 1171313 et n° 1171320) et du CONICYT PIA/Anillo de Investigación en Ciencia y Tecnología ACT172121.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| MATHSWORK | MATLAB version 2014a | ||
| Presentation - Neurobehavioral Systems | Presentation version 18.0 | ||
| Brain Innovation B.V. | Turbo Brain Voyager Version 2.6 or 3.0 |
Références
- Fernandez, T., et al. EEG and behavioral changes following neurofeedback treatment in learning disabled children. Clinical Electroencephalography. 34, 145-152 (2003).
- Scarapicchia, V., Brown, C., Mayo, C., Gawryluk, J. R. Functional Magnetic Resonance Imaging and Functional Near-Infrared Spectroscopy: Insights from Combined Recording Studies. Frontiers in Human Neuroscience. 11, 419(2017).
- Hinault, T., Larcher, K., Zazubovits, N., Gotman, J., Dagher, A. Spatio-temporal patterns of cognitive control revealed with simultaneous electroencephalography and functional magnetic resonance imaging. Human Brain Mapping. , (2018).
- Grech, R., et al. Review on solving the inverse problem in EEG source analysis. Journal of NeuroEngineering and Rehabilitation. 5, 25(2008).
- Van Essen, D. C., et al. The Human Connectome Project: a data acquisition perspective. NeuroImage. 62, 2222-2231 (2012).
- World Health Organization. WHO Report on the Global Tobacco Epidemic, 2017. , Geneva: World Health Organization. (2017).
- Ringlever, L., Otten, R., de Leeuw, R. N., Engels, R. C. Effects of parents' education and occupation on adolescent smoking and the mediating role of smoking-specific parenting and parent smoking. European Addiction Research. 17, 55-63 (2011).
- Malaiyandi, V., Sellers, E. M., Tyndale, R. F. Implications of CYP2A6 genetic variation for smoking behaviors and nicotine dependence. Clinical Pharmacology and Therapeutics. 77, 145-158 (2005).
- Brody, A. L., et al. Neural substrates of resisting craving during cigarette cue exposure. Biological Psychiatry. 62, 642-651 (2007).
- Childress, A. R., et al. Cue reactivity and cue reactivity interventions in drug dependence. NIDA Research Monography. 137, 73-95 (1993).
- Claus, E. D., Kiehl, K. A., Hutchison, K. E. Neural and behavioral mechanisms of impulsive choice in alcohol use disorder. Alcoholism, Clinical and Experimental Research. 35, 1209-1219 (2011).
- Franklin, T. R., et al. Limbic activation to cigarette smoking cues independent of nicotine withdrawal: a perfusion fMRI study. Neuropsychopharmacology. 32, 2301-2309 (2007).
- Grusser, S. M., et al. Cue-induced activation of the striatum and medial prefrontal cortex is associated with subsequent relapse in abstinent alcoholics. Psychopharmacology. 175, 296-302 (2004).
- Buhler, M., et al. Nicotine dependence is characterized by disordered reward processing in a network driving motivation. Biological Psychiatry. 67, 745-752 (2010).
- Bonson, K. R., et al. Neural systems and cue-induced cocaine craving. Neuropsychopharmacology. 26, 376-386 (2002).
- Brody, A. L., et al. Brain metabolic changes during cigarette craving. Archives of General Psychiatry. 59, 1162-1172 (2002).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318, 655-658 (2007).
- Naqvi, N. H., Rudrauf, D., Damasio, H., Bechara, A. Damage to the insula disrupts addiction to cigarette smoking. Science. 315, 531-534 (2007).
- Hollander, J. A., Lu, Q., Cameron, M. D., Kamenecka, T. M., Kenny, P. J. Insular hypocretin transmission regulates nicotine reward. Proceedings of the National Academy of Sciences of the United States of America. 105, 19480-19485 (2008).
- Forget, B., Pushparaj, A., Le Foll, B. Granular insular cortex inactivation as a novel therapeutic strategy for nicotine addiction. Biological Psychiatry. 68, 265-271 (2010).
- Scott, D., Hiroi, N. Deconstructing craving: dissociable cortical control of cue reactivity in nicotine addiction. Biological Psychiatry. 69, 1052-1059 (2011).
- Buczkowski, K., Marcinowicz, L., Czachowski, S., Piszczek, E. Motivations toward smoking cessation, reasons for relapse, and modes of quitting: results from a qualitative study among former and current smokers. Patient Prefer Adherence. 8, 1353-1363 (2014).
- Hughes, J. R., Stead, L. F., Hartmann-Boyce, J., Cahill, K., Lancaster, T. Antidepressants for smoking cessation. Cochrane Database of Systematic Reviews. , CD000031(2014).
- Bedi, G., et al. Incubation of cue-induced cigarette craving during abstinence in human smokers. Biological Psychiatry. 69, 708-711 (2011).
- Bassett, J. F., Dabbs, J. M. Jr A portable version of the go/no-go association task (GNAT). Behavior Research Methods. 37, 506-512 (2005).
- Huijding, J., de Jong, P. J., Wiers, R. W., Verkooijen, K. Implicit and explicit attitudes toward smoking in a smoking and a nonsmoking setting. Addictive Behaviors. 30, 949-961 (2005).
- Sherman, S. J., Rose, J. S., Koch, K., Presson, C. C., Chassin, L. Implicit and explicit attitudes towards cigarette smoking: The effect of context and motivation. Journal of Social and Clinical Psychology. 22, 13-39 (2003).
- Swanson, J. E., Rudman, L. A., Greenwald, A. G. Using the Implicit Association Test to investigate attitude- behavior consistency for stigmatized behavior. Cognition and Emotion. 15, 207-230 (2001).
- Asgaard, G. L., Gilbert, D. G., Malpass, D., Sugai, C., Dillon, A. Nicotine primes attention to competing affective stimuli in the context of salient alternatives. Experimental and Clinical Psychopharmacology. 18, 51-60 (2010).
- Gilbert, D. G., et al. Effects of nicotine on brain responses to emotional pictures. Nicotine & Tobacco Research. 6, 985-996 (2004).
- Czyzewska, M., Graham, R. Implicit and explicit attitudes to high- and low-calorie food in females with different BMI status. Eating Behaviors. 9, 303-312 (2008).
- Gilbert, D. G., Rabinovich, N. E. International smoking images series (with neutral counterparts). , Southern Illinois University: Integrative Neuroscience Laboratory, Department of Psychology. (1999).
- Bandettini, P. A., Wong, E. C., Hinks, R. S., Tikofsky, R. S., Hyde, J. S. Time course EPI of human brain function during task activation. Magnetic Resonance Medicine. 25, 390-397 (1992).
- Goebel, R. BrainVoyager - past, present, future. NeuroImage. 62, 748-756 (2012).
- Poline, J. B., Worsley, K. J., Holmes, A. P., Frackowiak, R. S., Friston, K. J. Estimating smoothness in statistical parametric maps: variability of p values. Journal of Computer Assisted Tomography. 19, 788-796 (1995).
- Johnson, K. A., et al. Intermittent "real-time" fMRI feedback is superior to continuous presentation for a motor imagery task: a pilot study. Journal of Neuroimaging. 22, 58-66 (2012).
- Yoo, S. S., Jolesz, F. A. Functional MRI for neurofeedback: feasibility study on a hand motor task. Neuroreport. 13, 1377-1381 (2002).
- Craig, A. D. How do you feel--now? The anterior insula and human awareness. Nature reviews. Neuroscience. 10, 59-70 (2009).
- Cox, L. S., Tiffany, S. T., Christen, A. G. Evaluation of the brief questionnaire of smoking urges (QSU-brief) in laboratory and clinical settings. Nicotine & Tobacco Research. 3, 7-16 (2001).
- Wewers, M. E., Rachfal, C., Ahijevych, K. A psychometric evaluation of a visual analogue scale of craving for cigarettes. Western Journal of Nursing Research. 12, 672-681 (1990).
- Allen, D. R., Browse, N. L., Rutt, D. L., Butler, L., Fletcher, C. The effect of cigarette smoke, nicotine, and carbon monoxide on the permeability of the arterial wall. Journal of Vascular Surgery. 7, 139-152 (1988).
- Weiskopf, N., et al. Real-time functional magnetic resonance imaging: methods and applications. Magnetic Resonance Imaging. 25, 989-1003 (2007).
- Sladky, R., et al. Slice-timing effects and their correction in functional MRI. NeuroImage. 58, 588-594 (2011).
- Mazziotta, J., et al. A probabilistic atlas and reference system for the human brain: International Consortium for Brain Mapping (ICBM). Philosophical Transactions of the Royal Society of London: Series B, Biological Sciences. 356, 1293-1322 (2001).
- Heatherton, T. F., Kozlowski, L. T., Frecker, R. C., Fagerstrom, K. O. The Fagerstrom Test for Nicotine Dependence: a revision of the Fagerstrom Tolerance Questionnaire. British Journal of Addiction. 86, 1119-1127 (1991).
- Myrick, H., et al. Differential brain activity in alcoholics and social drinkers to alcohol cues: relationship to craving. Neuropsychopharmacology. 29, 393-402 (2004).
- Tapert, S. F., Brown, G. G., Baratta, M. V., Brown, S. A. fMRI BOLD response to alcohol stimuli in alcohol dependent young women. Addictive Behaviors. 29, 33-50 (2004).
- Kilts, C. D., Gross, R. E., Ely, T. D., Drexler, K. P. The neural correlates of cue-induced craving in cocaine-dependent women. American Journal of Psychiatry. 161, 233-241 (2004).
- Li, Q., et al. Assessing cue-induced brain response as a function of abstinence duration in heroin-dependent individuals: an event-related fMRI study. PloS One. 8, e62911(2013).
- Frank, S., Kullmann, S., Veit, R. Food related processes in the insular cortex. Front Hum Neurosci. 7, 499(2013).
- deCharms, R. C., et al. Control over brain activation and pain learned by using real-time functional MRI. Proceedings of the National Academy of Sciences of the United States of America. 102, 18626-18631 (2005).
- Ruiz, S., Birbaumer, N., Sitaram, R. Abnormal Neural Connectivity in Schizophrenia and fMRI-Brain-Computer Interface as a Potential Therapeutic Approach. Frontiers in Psychiatry. 4, 17(2013).
- Habes, I., et al. Pattern classification of valence in depression. NeuroImage. Clinical. 2, 675-683 (2013).
- Li, X., et al. Volitional reduction of anterior cingulate cortex activity produces decreased cue craving in smoking cessation: a preliminary real-time fMRI study. Addiction Biology. 18, 739-748 (2013).
- Lubar, J. F., Swartwood, M. O., Swartwood, J. N., O'Donnell, P. H. Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Biofeedback and Self-Regulation. 20, 83-99 (1995).
- Janssen, T. W., et al. A randomized controlled trial into the effects of neurofeedback, methylphenidate, and physical activity on EEG power spectra in children with ADHD. Journal of Child Psychology and Psychiatry. 57, 633-644 (2016).
- Mayer, K., Wyckoff, S. N., Fallgatter, A. J., Ehlis, A. C., Strehl, U. Neurofeedback as a nonpharmacological treatment for adults with attention-deficit/hyperactivity disorder (ADHD): study protocol for a randomized controlled trial. Trials. 16, 174(2015).
- Gevensleben, H., et al. Distinct EEG effects related to neurofeedback training in children with ADHD: a randomized controlled trial. International Journal of Psychophysiology. 74, 149-157 (2009).
- Ramos-Murguialday, A., et al. Brain-machine interface in chronic stroke rehabilitation: a controlled study. Annals of Neurology. 74, 100-108 (2013).
- Biasiucci, A., et al. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nature Communication. 9, 2421(2018).
- Du, J., et al. Effects of repetitive transcranial magnetic stimulation on motor recovery and motor cortex excitability in patients with stroke: a randomized controlled trial. European Journal of Neurology. 23, 1666-1672 (2016).
- Ang, K. K., et al. Facilitating effects of transcranial direct current stimulation on motor imagery brain-computer interface with robotic feedback for stroke rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, S79-S87 (2015).
- Wolbrecht, E. T., Chan, V., Reinkensmeyer, D. J., Bobrow, J. E. Optimizing compliant, model-based robotic assistance to promote neurorehabilitation. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 16, 286-297 (2008).
- Sitaram, R., et al. Closed-loop brain training: the science of neurofeedback. Nature Reviews Neuroscience. 18, 86-100 (2017).
- Simkin, D. R., Thatcher, R. W., Lubar, J. Quantitative EEG and neurofeedback in children and adolescents: anxiety disorders, depressive disorders, comorbid addiction and attention-deficit/hyperactivity disorder, and brain injury. Child and Adolescent Psychiatric Clinics of North America. 23, 427-464 (2014).
- Pascual-Marqui, R. D., et al. Assessing interactions in the brain with exact low-resolution electromagnetic tomography. Philosophical transactions: Series A, Mathematical, physical, and engineering sciences. , 3768-3784 (2011).
- Meir-Hasson, Y., Kinreich, S., Podlipsky, I., Hendler, T., Intrator, N. An EEG Finger-Print of fMRI deep regional activation. NeuroImage. 102, 128-141 (2014).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon