Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Uso de neurofeedback basado en resonancia magnética funcional en tiempo real para regular a la baja la corteza insular en fumadores adictos a la nicotina
En este artículo
Resumen
En las imágenes de resonancia magnética funcional en tiempo real (rtfMRI), la actividad cerebral se manipula experimentalmente como una variable independiente y el comportamiento se mide como una variable dependiente. El protocolo que aquí se presenta se centra en el uso práctico de la rtfMRI como herramienta terapéutica para trastornos psiquiátricos como la adicción a la nicotina.
Resumen
Ha pasado más de una década desde que se implementó con éxito el primer enfoque de neurofeedback basado en imágenes de resonancia magnética funcional (fMRI). Desde entonces, varios estudios han demostrado que los participantes pueden aprender a controlar voluntariamente una región circunscrita del cerebro. En consecuencia, la resonancia magnética funcional en tiempo real (rtfMRI) proporcionó una nueva oportunidad para estudiar las modificaciones del comportamiento debidas a la manipulación de la actividad cerebral. Por lo tanto, los informes de aplicaciones de rtfMRI para entrenar la autorregulación de la actividad cerebral y las modificaciones concomitantes en condiciones conductuales y clínicas, como trastornos neurológicos y psiquiátricos [por ejemplo, esquizofrenia, trastorno obsesivo compulsivo (TOC), accidente cerebrovascular] han aumentado rápidamente.
Los estudios de neuroimagen en la investigación de la adicción han demostrado que la corteza cingulada anterior, la corteza orbitofrontal y la corteza insular se activan durante la presentación de señales asociadas a las drogas. Además, se ha demostrado que la actividad en las cortezas insulares izquierda y derecha está altamente correlacionada con los impulsos de drogas cuando los participantes están expuestos a señales que provocan ansiancia. Por lo tanto, la ínsula bilateral es de particular importancia en la investigación de los impulsos de drogas y la adicción debido a su papel en la representación de los estados corporales (interoceptivos). Este estudio explora el uso de la neurorretroalimentación rtfMRI para la reducción de la actividad dependiente del nivel de oxígeno en sangre (BOLD) en las cortezas insulares bilaterales de los participantes adictos a la nicotina. El estudio también prueba si hay modificaciones asociadas al entrenamiento de neurofeedback en las actitudes implícitas de los participantes hacia las señales de deseo de nicotina y el comportamiento de deseo explícito.
Introducción
El neurofeedback es un procedimiento de condicionamiento operante a través del cual los seres humanos o los animales pueden aprender a modular la actividad neuronal en una o más regiones del cerebro. El entrenamiento generalmente conduce a modificaciones de comportamiento1. En principio, las señales cerebrales de una o más regiones cerebrales circunscritas se transforman en retroalimentación sensorial (por ejemplo, retroalimentación visual, auditiva o táctil), que se proporciona al participante para el control de la actividad cerebral mediante el condicionamiento operante u otras formas de aprendizaje. En la inversión del paradigma tradicional de neuroimagen, los estudios de neurofeedback modulan la actividad cerebral como una variable independiente y miden el comportamiento como una variable dependiente. Por lo tanto, el neurofeedback proporciona un enfoque novedoso para investigar la participación de las regiones cerebrales en diferentes funciones cognitivas y cómo la hiperactivación o hipoactivación de esas regiones cerebrales puede conducir a un comportamiento anormal.
El neurofeedback se ha utilizado con diferentes modalidades de neuroimagen, como la resonancia magnética funcional (fMRI), la electroencefalografía (EEG) y la espectroscopia funcional de infrarrojo cercano (fNIRS). Los paradigmas de neurofeedback basados en EEG y fNIRS tienen las ventajas de una mayor resolución temporal, asequibilidad y portabilidad 2,3. Sin embargo, se caracterizan por una baja resolución espacial y una incapacidad para acceder a regiones cerebrales más profundas. Además, el EEG tiene la complejidad computacional del problema inverso para determinar una fuente de activaciones neuronales a partir de señales de EEG de superficie4. Sin embargo, con los recientes desarrollos en fMRI en tiempo real (rtfMRI), es posible acceder a señales hemodinámicas de todas las partes del cerebro, con buena resolución espacial (por ejemplo, 2 mm3) y una resolución temporal de 720 ms5. De este modo, la fMRI supera las limitaciones mencionadas anteriormente que poseen las técnicas fNIRS y EEG.
La adicción a la nicotina es una de las principales causas de muerte en todo el mundo debido a una serie de enfermedades asociadas con el tabaquismo6. Los factores reconocidos que conducen a la adicción a la nicotina son los sociales, ambientales, psicológicos7 y la susceptibilidad genética8. A nivel neurobiológico, los estudios han demostrado la activación en la corteza cingulada anterior (ACC), la corteza orbitofrontal (OFC), el área tegmental ventral (VTA), el cuerpo estriado ventral, la amígdala, el hipocampo, la corteza prefrontal (PFC) y la corteza insular durante la presentación de señales asociadas a fármacos en contraste con las señales de control neutras 9,10,11,12,13,14 . La actividad en las ínsulas izquierda y derecha está altamente correlacionada con los impulsos de fumar cuando los fumadores vieron señales asociadas a la droga15,16. La ínsula desempeña un papel importante en la provocación del comportamiento de deseo 17,18,19,20,21, ya que es responsable de la percepción del estado corporal. Se ha reportado que los fumadores con lesiones en sus cortezas insulares tenían más probabilidades de dejar de fumar que los fumadores con daño cerebral que no afectaba a la ínsula18.
Uno de los mayores desafíos en los métodos existentes para dejar de fumar es la alta tasa de recaída22. Más del 80% de los fumadores recaen en los primeros meses después de dejar de fumar23. La exposición a señales previamente asociadas con el consumo de drogas es una de las principales razones de la alta tasa de recaída en la adicción a la nicotina24. Este mecanismo se denomina efecto de incubación. El protocolo actual está desarrollado para dirigirse al efecto de la incubación evaluado por una tarea de cebado afectivo. Estudios previos han demostrado que los fumadores que se abstienen tienen actitudes implícitas negativas hacia las señales relacionadas con el tabaquismo 25,26,27,28. En la tarea típica de priming afectivo, los estímulos de priming emocional modifican el procesamiento de un objetivo afectivo de modo que el tiempo de reacción y la precisión de las respuestas se modifican29. En otras palabras, si los estímulos primarios y objetivo son de la misma valencia, el tiempo de reacción en respuesta a los estímulos objetivo será más rápido, y viceversa.
En el estudio actual, se plantea la hipótesis de que la regulación a la baja de la corteza insular anterior bilateral reducirá el deseo y, por lo tanto, la valencia de las señales que inducen el deseo cambiará de negativa a neutra, ya que el sesgo atencional y asociativo se alejará de las señales relacionadas con el tabaquismo30. La tarea de comportamiento implícito es una tarea de priming afectivo originalmente adaptada de Czyzewska y Graham31. Sobre la base de la hipótesis antes mencionada, se anticipa que se observará una disminución en el tiempo de reacción en respuesta a una combinación de palabras prime (imagen que provoca el anhelo o su imagen contraparte neutra) y palabras objetivo con valencia positiva después del bloque de regulación negativa en comparación con el bloque base. La tarea de priming (Figura 2B) consiste en un número primo (es decir, una imagen que provoca antojos o su contraparte neutra, la imagen32) y una palabra objetivo con valencia positiva o negativa. La imagen principal se presenta durante 200 ms, seguida de una palabra objetivo durante 1 segundo. La asincronía de inicio de estímulos (SOA) es de 250 ms. A continuación, se indica a los participantes que juzguen la valencia de la palabra objetivo (positiva o negativa) y respondan pulsando un botón de la forma más rápida y precisa posible.
El sistema rtfMRI (Figura 1) consta de los siguientes subsistemas: (1) participante, (2) adquisición de señales, (3) análisis de señales en línea y (4) retroalimentación de señales. La adquisición de la señal se lleva a cabo con un escáner de cuerpo entero Siemens Trio 3.0T utilizando una secuencia de imágenes ecoplanas (EPI)33. Procedimientos como la reconstrucción de imágenes, la corrección de la distorsión y el promedio de la señal se realizan en la computadora del escáner. Una vez que las imágenes se reconstruyen y preprocesan, se exportan al subsistema de análisis de señales. El subsistema de análisis de señales se implementa utilizando el Turbo Brain Voyager (TBV)34. TBV recupera las imágenes reconstruidas y realiza un procesamiento de datos que incluye corrección de movimiento en 3D y análisis estadístico en tiempo real utilizando el modelo lineal general35. TBV permite al usuario dibujar regiones de interés (ROI) en múltiples vóxeles en las imágenes funcionales y extraer valores BOLD promedio del ROI después de cada tiempo de repetición (TR). A continuación, las series temporales de los ROI seleccionados se exportan al script de MATLAB que calcula y presenta los comentarios al participante.
La retroalimentación visual de la actividad cerebral se proporciona a los participantes en forma de un termómetro animado gráficamente, con sus barras que cambian en proporción a los cambios porcentuales en negrita en los ROI. Varios estudios han utilizado la retroalimentación intermitente (retroalimentación proporcionada a un participante después de una serie de TR de la secuencia EPI) para entrenar a los participantes36,37. Sin embargo, en el estudio actual, se anticipó que los participantes tendrían mayores dificultades para regular a la baja la señal BOLD en la ínsula anterior con retroalimentación continua debido al papel de la ínsula en la integración sensorial y la participación en el procesamiento de la información de retroalimentación visual38. Por lo tanto, se presumió que la retroalimentación continua resultaría en un conflicto entre dos procesos en la corteza insular, un proceso que aumenta la señal debido a la retroalimentación externa y otro que disminuye la señal debido al entrenamiento de neurofeedback. Por lo tanto, en este estudio, proporcionamos retroalimentación solo al final de cada bloque de regulación a la baja (retroalimentación retrasada). A los participantes se les muestra un texto (por ejemplo, 0,87 euros) como retroalimentación visual (Figura 2A, C) que indica la cantidad de dinero que ganaron (recompensa monetaria). Esta recompensa es proporcional al porcentaje de downregulation logrado en el bloque de regulación.
La RMfR es una neurotecnología novedosa que puede superar los problemas en los enfoques terapéuticos para el tratamiento de la adicción y puede proporcionar intervenciones más fiables y eficaces para reducir las recaídas. Los objetivos a largo plazo del estudio actual son tres: 1) probar si los adictos a la nicotina pueden aprender a regular a la baja las señales BOLD en la ínsula anterior durante la presencia de estímulos que provocan un comportamiento de deseo; 2) examinar si el entrenamiento de neurofeedback conduce a modificaciones en el comportamiento de deseo; y 3) explorar si los cambios en los niveles de deseo durante el entrenamiento de neurofeedback de la regulación negativa de la ínsula persisten después de seis meses de entrenamiento sin ninguna otra intervención. Este artículo proporciona una descripción detallada del protocolo experimental rtfMRI y sus diferentes componentes. También se presentan ejemplos de datos del estudio y una discusión de los desafíos futuros y el potencial de este método, además de la investigación. El protocolo presentado está diseñado para investigar si el entrenamiento de neurofeedback basado en fMRI se puede utilizar para estudiar las reducciones en la actividad cerebral en la corteza insular de los fumadores de cigarrillos. Además, el protocolo tiene como objetivo estudiar las relaciones entre la activación de la corteza insular y los comportamientos de deseo de los fumadores de cigarrillos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
El Comité de Ética de la Facultad de Medicina de la Universidad de Tübingen y la Pontificia Universidad Católica de Chile aprobaron el siguiente protocolo de rtfMRI.
1. Configuración del hardware
- El hardware representado en la Figura 1 se prepara solo una vez para configurar la exportación en tiempo real de los datos de resonancia magnética.
- La preparación de la sala de resonancia magnética es la misma que la medición tradicional de resonancia magnética funcional. Prepare la sala de resonancia magnética antes de la llegada del participante.
- Conecte la bobina principal de 32 o 20 canales al escáner.
- Conecte el cable VGA/HDMI del proyector y el dispositivo de respuesta compatible con RM (caja de botones) a la computadora de estímulo.
NOTA: En la mayor parte de la configuración de RM, el dispositivo de respuesta entrega el disparador TR a la computadora de estímulo. Este disparador ayuda a sincronizar la presentación de estímulos y la adquisición de datos.
2. Preparación de los participantes fuera del escáner
- Prepare el formulario de consentimiento y los cuestionarios que los participantes deben completar antes de su llegada.
- Una vez que llegue el participante, explique el experimento y la técnica de resonancia magnética funcional. Además, instruya al participante sobre cómo realizar la tarea (por ejemplo, durante el experimento, los participantes deben mantener los ojos abiertos y mirar siempre las imágenes en la pantalla, y deben tratar de no mover la cabeza dentro del escáner).
- Pida al participante que firme el formulario de consentimiento y rellene los cuestionarios necesarios para evaluar los niveles de antojo.
- Pida a los participantes que llenen los siguientes cuestionarios: 1) VAS-C: Escala Visual Analógica, Craving39, 2) QSU-b: Questionnaire of Smoking Urges–Brief Version40, y 3) cigarrillos por día.
- Pida al participante que exhale a través del dispositivo de medición de monóxido de carbono (CO).
NOTA: La medición de CO41 indica si el participante se abstiene o no de fumar al menos 3 h antes de la llegada a la sesión de neurofeedback. El CO se mide en ppm (partes por millón). Los valores bajos de CO indican que el participante no fumó durante al menos un par de horas antes de la llegada. Se debe pedir a los participantes que se abstengan de fumar para que las señales de antojo provoquen un gran deseo durante el experimento. Se advertirá a los participantes con valores altos de CO antes de la futura sesión de neurofeedback para asegurarse de que se abstengan de fumar antes de la sesión de rtfMRI. Los participantes que no se abstengan de fumar dos veces deben ser excluidos del estudio.
3. Posicionamiento de los participantes
NOTA: El procedimiento de posicionamiento de los participantes en la mesa del escáner es similar al experimento tradicional de resonancia magnética funcional.
- Pida al participante que se quite todos los objetos metálicos de los bolsillos antes de entrar a la sala de resonancia magnética.
- Pida al participante que se inserte tapones para los oídos antes de acostarse en la mesa del escáner en posición supina.
- Utilice almohadillas para fijar la posición de la cabeza del participante dentro de la bobina principal. Este paso ayuda a reducir el movimiento de la cabeza durante la medición.
- Bloquee la parte superior de la bobina de la cabeza y fije el espejo a la bobina de la cabeza.
- Entregue el dispositivo de respuesta al participante y colóquelo de acuerdo con la comodidad del participante.
- Pida al participante que cierre los ojos y marque la posición de referencia de la cabeza del participante entre las cejas utilizando luz láser.
- Mueva la mesa del escáner para colocar la posición marcada en el centro del orificio de la resonancia magnética.
- Confirme con el participante que está en una posición cómoda y que puede ver los estímulos visuales proyectados en la pantalla detrás del escáner usando el espejo. Ajuste el espejo, si es necesario.
4. Adquisición de datos
- Durante las exploraciones iniciales, pida al participante que cierre los ojos y trate de no mover la cabeza.
- Inicie la medición con una secuencia de pulsos del localizador. Esta secuencia se utiliza normalmente para determinar la posición del corte de la exploración anatómica y funcional (secuencia EPI) que se realiza posteriormente.
- Seleccione el campo de visión (FOV) para el escaneo anatómico con los siguientes parámetros: TR = 11,5 ms, TE = 5 ms, 176 cortes sin espacio de corte, FOV = 240 x 240 mm2, matriz = 256 x 256, ángulo de giro = 18°, proporcionando vóxeles isotrópicos de 1 mm3 . El campo de visión de la secuencia cubrirá toda la cabeza del participante.
- El campo de visión de la gammagrafía funcional (secuencia EPI) está alineado con la línea de comisura anterior/comisura posterior (línea AC-PC). Ajuste la posición de los sectores para cubrir la región de interés de destino. Los parámetros de la secuencia son los siguientes: TR = 1,5, FOV = 192 mm, 25 cortes, vóxel = 3 mm x 3 mm x 3 mm, ángulo de giro = 70°.
5. Neurofeedback FMRI
- Alerte al participante de que la carrera de neurofeedback está comenzando y repita las instrucciones proporcionadas anteriormente (por ejemplo, que durante la línea de base, un bloque está representado por un signo "+").
NOTA: El participante debe observar la imagen en la pantalla. Por otro lado, durante el bloque de regulación, representado por una flecha en dirección descendente, los participantes deben tratar de desprenderse de los impulsos de deseo utilizando algunas estrategias cognitivas. La cantidad de dinero que se muestra al final de cada bloque reglamentario representa su rendimiento. Una mayor cantidad de dinero representa un mejor rendimiento. - Realizar la carrera de neurofeedback en la que se alternan los bloques basal y de regulación (30 s cada uno; Figura 2).
- En la computadora de estímulo, ejecute el software de presentación escrito por código de estímulo y presione el botón Enter después de que aparezca Listo en la pantalla. El código de presentación ahora está esperando el disparador para iniciar la ejecución de neurofeedback.
NOTA: El código está sincronizado con los disparadores TR procedentes del escáner. Por lo tanto, es el primer paso en la preparación de la ejecución de la carrera de neurofeedback. - En el equipo de análisis, ejecute la toolbox interna de MATLAB y turbo brain voyager (TBV).
- En la caja de herramientas de MATLAB, introduzca la información específica del participante, como el ID de paciente y el número de ejecución de neurofeedback.
- Presione Generar archivos de protocolo para preparar el archivo de protocolo utilizando la información insertada en el paso 5.5.
NOTA: El archivo de protocolo contiene información relacionada con el tiempo de la condición (por ejemplo, el momento en el que TR debe comenzar una condición específica y qué estímulo se presentará). Será utilizado tanto por la toolbox de MATLAB como por TBV. - Pulse el botón execute en la GUI de la toolbox de MATLAB. El código ahora está a la espera de recibir datos del TBV.
- En el TBV, seleccione el archivo de protocolo generado en el paso 5.6. Además, selecciona el archivo .roi generado a partir de las sesiones anteriores de neurofeedback.
NOTA: Es importante seleccionar un archivo ROI, ya que evitará el bloqueo del software TBV durante el período inicial (10 TRs) de la ejecución del neurofeedback. - Prepare la secuencia EPI que se implementará en el equipo host de RM. Presione el botón de inicio en el TBV.
- Vuelva a dibujar el ROI objetivo en el software TBV de acuerdo con los puntos de referencia anatómicos. La forma y el tamaño de los ventrículos en el cerebro se utilizan como puntos de referencia para seleccionar la ínsula anterior. Además, la forma ondulada de la corteza insular se utiliza para seleccionar con precisión los vóxeles relacionados con la ínsula anterior bilateral.
- Dibuje un ROI en el área motora primaria (M1) utilizando el surco central como punto de referencia anatómico. El área motora primaria actúa como un ROI de referencia para eliminar el efecto de los aumentos globales de BOLD y las fluctuaciones de BOLD debido al movimiento de la cabeza.
- Al final de cada sesión de neurofeedback, pregúntale al participante: "¿Qué estrategia cognitiva estabas usando durante el bloqueo de regulación?". Además, pregunte al participante sobre su nivel de comodidad y si desea o no continuar con el experimento.
- Después de cuatro ejecuciones de neurofeedback, seleccione el botón de opción Sí para la ejecución de transferencia.
NOTA: Una ejecución de transferencia es similar a la ejecución de neurofeedback. Sin embargo, los participantes realizan la autorregulación en ausencia de retroalimentación. Esto ayuda a determinar si la autorregulación aprendida se transfiere a la situación en la que el participante no recibirá neurofeedback (por ejemplo, fuera del escáner).
6. Grupo de control
- Instruya a los participantes del grupo de control de la misma manera que a los del grupo experimental. Sin embargo, proporcione comentarios sobre Yolked a los participantes.
NOTA: En la retroalimentación en yugo, la cantidad promedio de refuerzo (dinero) tanto en el grupo experimental como en el grupo de control permanece igual. La única diferencia entre los dos grupos es la contingencia de la retroalimentación proporcionada a los participantes. Para los participantes en el grupo de control, la cantidad total de refuerzo (dinero) se distribuye entre el 40% asignado aleatoriamente de los ensayos de regulación a la baja. Sin embargo, en el otro 60% de los ensayos, los participantes reciben un feedback negativo (cero euros). Por lo tanto, los participantes en el grupo de control no reciben retroalimentación contingente.
7. Análisis offline
- Preprocesamiento de datos de resonancia magnética funcional
- Utilice una caja de herramientas de mapeo estadístico paramétrico (SPM) para preprocesar los datos de fMRI (https://www.fil.ion.ucl.ac.uk/spm/ext/).
- Convierta los datos de fMRI en formato DICOM a formato NIFTI utilizando la utilidad de conversión de formato de la función de lote SPM.
- Elimine los 10 escaneos iniciales de cada datos de ejecución de neurofeedback para evitar efectos de equilibrio de gradiente42.
- Realice el proceso de realineación para eliminar los artefactos de movimiento y alinear todos los volúmenes con el primer volumen de la sesión. Además, realice la corrección del intervalo de tiempo para compensar el retraso de adquisición del corte43.
- Llevar a cabo la segmentación de la exploración anatómica, el registro conjunto de los datos de la secuencia EPI y los datos anatómicos, y la normalización para mapear los datos del espacio temático con la plantilla cerebral estándar del Instituto Neurológico de Montreal (MNI)44.
- Utilizando nuestro código interno de MATLAB, extraiga las señales BOLD de las ROI en forma de cubo creadas alrededor de las coordenadas MNI correspondientes a la ínsula anterior bilateral y la corteza motora primaria.
- Cálculo del cambio porcentual en la señal BOLD
- Calcule el cambio porcentual en la señal BOLD en función del cambio promedio en la señal BOLD para cada ROI durante el bloque de regulación en comparación con el bloque de referencia anterior. La ecuación para el cambio porcentual en la señal BOLD es la siguiente:
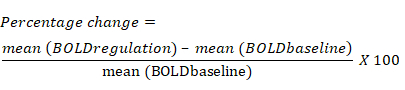
- Calcule el cambio porcentual en la señal BOLD en función del cambio promedio en la señal BOLD para cada ROI durante el bloque de regulación en comparación con el bloque de referencia anterior. La ecuación para el cambio porcentual en la señal BOLD es la siguiente:
- Análisis del comportamiento explícito de tabaquismo de los participantes
- Importe las respuestas de los participantes a los cuestionarios (es decir, QSU-b, VAS-C, medida de CO y cigarrillos por día) a MATLAB.
- Pruebe la normalidad de los datos utilizando una prueba de Kolmogorov-Smirnov de una muestra de MATLAB.
- Se debe utilizar una prueba t de una muestra para comparar las respuestas de diferentes cuestionarios para cada participante, y una prueba t de muestra emparejada para comparar las puntuaciones entre los grupos experimental y de control.
- Análisis de la actitud implícita hacia las señales que provocan el deseo
- Extraiga el tiempo de reacción (RT) de las pruebas de priming afectivo para cada participante de los archivos de registro generados por el software de presentación.
- Elimine los valores atípicos basados en el RT (es decir, no incluya ensayos con un RT mayor que 2 veces la desviación estándar del RT medio del participante).
- Pruebe la normalidad de los datos utilizando una prueba de Kolmogorov-Smirnov de una muestra de MATLAB.
- Comparar los efectos de la regulación a la baja en la mediana de los tiempos de reacción de combinaciones únicas de primos (imágenes neutras e inductoras de ansia) y objetivos (palabras positivas y negativas) para cada participante, y comparar entre los grupos experimental y de control utilizando una prueba t sabia pareada.
Access restricted. Please log in or start a trial to view this content.
Resultados
Se reclutaron cuatro pacientes en función de sus puntuaciones en el test de Fagerström para la dependencia de la nicotina (FTND)45 , cuestionario para la dependencia de la nicotina de nivel medio (puntuación FTND >4) y el número de cigarrillos fumados cada día (>15). Además, se aseguró que los participantes no tuvieran ningún tatuaje o implante metálico según las medidas de seguridad de resonancia magnética de la institución. Se realizaron cinco sesiones de rtfMRI ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Los resultados de cuatro participantes demuestran la posibilidad de que los fumadores de cigarrillos aprendan a regular a la baja la activación en la ínsula anterior bilateral en presencia de señales que provocan antojos. Los cambios en las conductas implícitas y explícitas de fumar después del entrenamiento de neurofeedback en el participante de la muestra pueden estar relacionados con la regulación negativa aprendida, ya que el participante no pasó por ninguna otra intervenció...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio contó con el apoyo de la Comisión Nacional de Investigación Científica y Tecnológica de Chile (Conicyt) a través del Fondo Nacional de Desarrollo Científico y Tecnológico, beca Fondecyt Postdoctoral (nº 3100648), Fondecyt Regular (proyectos Nº 1171313 y Nº 1171320) y CONICYT PIA/Anillo de Investigación en Ciencia y Tecnología ACT172121.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| MATHSWORK | MATLAB version 2014a | ||
| Presentation - Neurobehavioral Systems | Presentation version 18.0 | ||
| Brain Innovation B.V. | Turbo Brain Voyager Version 2.6 or 3.0 |
Referencias
- Fernandez, T., et al. EEG and behavioral changes following neurofeedback treatment in learning disabled children. Clinical Electroencephalography. 34, 145-152 (2003).
- Scarapicchia, V., Brown, C., Mayo, C., Gawryluk, J. R. Functional Magnetic Resonance Imaging and Functional Near-Infrared Spectroscopy: Insights from Combined Recording Studies. Frontiers in Human Neuroscience. 11, 419(2017).
- Hinault, T., Larcher, K., Zazubovits, N., Gotman, J., Dagher, A. Spatio-temporal patterns of cognitive control revealed with simultaneous electroencephalography and functional magnetic resonance imaging. Human Brain Mapping. , (2018).
- Grech, R., et al. Review on solving the inverse problem in EEG source analysis. Journal of NeuroEngineering and Rehabilitation. 5, 25(2008).
- Van Essen, D. C., et al. The Human Connectome Project: a data acquisition perspective. NeuroImage. 62, 2222-2231 (2012).
- World Health Organization. WHO Report on the Global Tobacco Epidemic, 2017. , Geneva: World Health Organization. (2017).
- Ringlever, L., Otten, R., de Leeuw, R. N., Engels, R. C. Effects of parents' education and occupation on adolescent smoking and the mediating role of smoking-specific parenting and parent smoking. European Addiction Research. 17, 55-63 (2011).
- Malaiyandi, V., Sellers, E. M., Tyndale, R. F. Implications of CYP2A6 genetic variation for smoking behaviors and nicotine dependence. Clinical Pharmacology and Therapeutics. 77, 145-158 (2005).
- Brody, A. L., et al. Neural substrates of resisting craving during cigarette cue exposure. Biological Psychiatry. 62, 642-651 (2007).
- Childress, A. R., et al. Cue reactivity and cue reactivity interventions in drug dependence. NIDA Research Monography. 137, 73-95 (1993).
- Claus, E. D., Kiehl, K. A., Hutchison, K. E. Neural and behavioral mechanisms of impulsive choice in alcohol use disorder. Alcoholism, Clinical and Experimental Research. 35, 1209-1219 (2011).
- Franklin, T. R., et al. Limbic activation to cigarette smoking cues independent of nicotine withdrawal: a perfusion fMRI study. Neuropsychopharmacology. 32, 2301-2309 (2007).
- Grusser, S. M., et al. Cue-induced activation of the striatum and medial prefrontal cortex is associated with subsequent relapse in abstinent alcoholics. Psychopharmacology. 175, 296-302 (2004).
- Buhler, M., et al. Nicotine dependence is characterized by disordered reward processing in a network driving motivation. Biological Psychiatry. 67, 745-752 (2010).
- Bonson, K. R., et al. Neural systems and cue-induced cocaine craving. Neuropsychopharmacology. 26, 376-386 (2002).
- Brody, A. L., et al. Brain metabolic changes during cigarette craving. Archives of General Psychiatry. 59, 1162-1172 (2002).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318, 655-658 (2007).
- Naqvi, N. H., Rudrauf, D., Damasio, H., Bechara, A. Damage to the insula disrupts addiction to cigarette smoking. Science. 315, 531-534 (2007).
- Hollander, J. A., Lu, Q., Cameron, M. D., Kamenecka, T. M., Kenny, P. J. Insular hypocretin transmission regulates nicotine reward. Proceedings of the National Academy of Sciences of the United States of America. 105, 19480-19485 (2008).
- Forget, B., Pushparaj, A., Le Foll, B. Granular insular cortex inactivation as a novel therapeutic strategy for nicotine addiction. Biological Psychiatry. 68, 265-271 (2010).
- Scott, D., Hiroi, N. Deconstructing craving: dissociable cortical control of cue reactivity in nicotine addiction. Biological Psychiatry. 69, 1052-1059 (2011).
- Buczkowski, K., Marcinowicz, L., Czachowski, S., Piszczek, E. Motivations toward smoking cessation, reasons for relapse, and modes of quitting: results from a qualitative study among former and current smokers. Patient Prefer Adherence. 8, 1353-1363 (2014).
- Hughes, J. R., Stead, L. F., Hartmann-Boyce, J., Cahill, K., Lancaster, T. Antidepressants for smoking cessation. Cochrane Database of Systematic Reviews. , CD000031(2014).
- Bedi, G., et al. Incubation of cue-induced cigarette craving during abstinence in human smokers. Biological Psychiatry. 69, 708-711 (2011).
- Bassett, J. F., Dabbs, J. M. Jr A portable version of the go/no-go association task (GNAT). Behavior Research Methods. 37, 506-512 (2005).
- Huijding, J., de Jong, P. J., Wiers, R. W., Verkooijen, K. Implicit and explicit attitudes toward smoking in a smoking and a nonsmoking setting. Addictive Behaviors. 30, 949-961 (2005).
- Sherman, S. J., Rose, J. S., Koch, K., Presson, C. C., Chassin, L. Implicit and explicit attitudes towards cigarette smoking: The effect of context and motivation. Journal of Social and Clinical Psychology. 22, 13-39 (2003).
- Swanson, J. E., Rudman, L. A., Greenwald, A. G. Using the Implicit Association Test to investigate attitude- behavior consistency for stigmatized behavior. Cognition and Emotion. 15, 207-230 (2001).
- Asgaard, G. L., Gilbert, D. G., Malpass, D., Sugai, C., Dillon, A. Nicotine primes attention to competing affective stimuli in the context of salient alternatives. Experimental and Clinical Psychopharmacology. 18, 51-60 (2010).
- Gilbert, D. G., et al. Effects of nicotine on brain responses to emotional pictures. Nicotine & Tobacco Research. 6, 985-996 (2004).
- Czyzewska, M., Graham, R. Implicit and explicit attitudes to high- and low-calorie food in females with different BMI status. Eating Behaviors. 9, 303-312 (2008).
- Gilbert, D. G., Rabinovich, N. E. International smoking images series (with neutral counterparts). , Southern Illinois University: Integrative Neuroscience Laboratory, Department of Psychology. (1999).
- Bandettini, P. A., Wong, E. C., Hinks, R. S., Tikofsky, R. S., Hyde, J. S. Time course EPI of human brain function during task activation. Magnetic Resonance Medicine. 25, 390-397 (1992).
- Goebel, R. BrainVoyager - past, present, future. NeuroImage. 62, 748-756 (2012).
- Poline, J. B., Worsley, K. J., Holmes, A. P., Frackowiak, R. S., Friston, K. J. Estimating smoothness in statistical parametric maps: variability of p values. Journal of Computer Assisted Tomography. 19, 788-796 (1995).
- Johnson, K. A., et al. Intermittent "real-time" fMRI feedback is superior to continuous presentation for a motor imagery task: a pilot study. Journal of Neuroimaging. 22, 58-66 (2012).
- Yoo, S. S., Jolesz, F. A. Functional MRI for neurofeedback: feasibility study on a hand motor task. Neuroreport. 13, 1377-1381 (2002).
- Craig, A. D. How do you feel--now? The anterior insula and human awareness. Nature reviews. Neuroscience. 10, 59-70 (2009).
- Cox, L. S., Tiffany, S. T., Christen, A. G. Evaluation of the brief questionnaire of smoking urges (QSU-brief) in laboratory and clinical settings. Nicotine & Tobacco Research. 3, 7-16 (2001).
- Wewers, M. E., Rachfal, C., Ahijevych, K. A psychometric evaluation of a visual analogue scale of craving for cigarettes. Western Journal of Nursing Research. 12, 672-681 (1990).
- Allen, D. R., Browse, N. L., Rutt, D. L., Butler, L., Fletcher, C. The effect of cigarette smoke, nicotine, and carbon monoxide on the permeability of the arterial wall. Journal of Vascular Surgery. 7, 139-152 (1988).
- Weiskopf, N., et al. Real-time functional magnetic resonance imaging: methods and applications. Magnetic Resonance Imaging. 25, 989-1003 (2007).
- Sladky, R., et al. Slice-timing effects and their correction in functional MRI. NeuroImage. 58, 588-594 (2011).
- Mazziotta, J., et al. A probabilistic atlas and reference system for the human brain: International Consortium for Brain Mapping (ICBM). Philosophical Transactions of the Royal Society of London: Series B, Biological Sciences. 356, 1293-1322 (2001).
- Heatherton, T. F., Kozlowski, L. T., Frecker, R. C., Fagerstrom, K. O. The Fagerstrom Test for Nicotine Dependence: a revision of the Fagerstrom Tolerance Questionnaire. British Journal of Addiction. 86, 1119-1127 (1991).
- Myrick, H., et al. Differential brain activity in alcoholics and social drinkers to alcohol cues: relationship to craving. Neuropsychopharmacology. 29, 393-402 (2004).
- Tapert, S. F., Brown, G. G., Baratta, M. V., Brown, S. A. fMRI BOLD response to alcohol stimuli in alcohol dependent young women. Addictive Behaviors. 29, 33-50 (2004).
- Kilts, C. D., Gross, R. E., Ely, T. D., Drexler, K. P. The neural correlates of cue-induced craving in cocaine-dependent women. American Journal of Psychiatry. 161, 233-241 (2004).
- Li, Q., et al. Assessing cue-induced brain response as a function of abstinence duration in heroin-dependent individuals: an event-related fMRI study. PloS One. 8, e62911(2013).
- Frank, S., Kullmann, S., Veit, R. Food related processes in the insular cortex. Front Hum Neurosci. 7, 499(2013).
- deCharms, R. C., et al. Control over brain activation and pain learned by using real-time functional MRI. Proceedings of the National Academy of Sciences of the United States of America. 102, 18626-18631 (2005).
- Ruiz, S., Birbaumer, N., Sitaram, R. Abnormal Neural Connectivity in Schizophrenia and fMRI-Brain-Computer Interface as a Potential Therapeutic Approach. Frontiers in Psychiatry. 4, 17(2013).
- Habes, I., et al. Pattern classification of valence in depression. NeuroImage. Clinical. 2, 675-683 (2013).
- Li, X., et al. Volitional reduction of anterior cingulate cortex activity produces decreased cue craving in smoking cessation: a preliminary real-time fMRI study. Addiction Biology. 18, 739-748 (2013).
- Lubar, J. F., Swartwood, M. O., Swartwood, J. N., O'Donnell, P. H. Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Biofeedback and Self-Regulation. 20, 83-99 (1995).
- Janssen, T. W., et al. A randomized controlled trial into the effects of neurofeedback, methylphenidate, and physical activity on EEG power spectra in children with ADHD. Journal of Child Psychology and Psychiatry. 57, 633-644 (2016).
- Mayer, K., Wyckoff, S. N., Fallgatter, A. J., Ehlis, A. C., Strehl, U. Neurofeedback as a nonpharmacological treatment for adults with attention-deficit/hyperactivity disorder (ADHD): study protocol for a randomized controlled trial. Trials. 16, 174(2015).
- Gevensleben, H., et al. Distinct EEG effects related to neurofeedback training in children with ADHD: a randomized controlled trial. International Journal of Psychophysiology. 74, 149-157 (2009).
- Ramos-Murguialday, A., et al. Brain-machine interface in chronic stroke rehabilitation: a controlled study. Annals of Neurology. 74, 100-108 (2013).
- Biasiucci, A., et al. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nature Communication. 9, 2421(2018).
- Du, J., et al. Effects of repetitive transcranial magnetic stimulation on motor recovery and motor cortex excitability in patients with stroke: a randomized controlled trial. European Journal of Neurology. 23, 1666-1672 (2016).
- Ang, K. K., et al. Facilitating effects of transcranial direct current stimulation on motor imagery brain-computer interface with robotic feedback for stroke rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, S79-S87 (2015).
- Wolbrecht, E. T., Chan, V., Reinkensmeyer, D. J., Bobrow, J. E. Optimizing compliant, model-based robotic assistance to promote neurorehabilitation. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 16, 286-297 (2008).
- Sitaram, R., et al. Closed-loop brain training: the science of neurofeedback. Nature Reviews Neuroscience. 18, 86-100 (2017).
- Simkin, D. R., Thatcher, R. W., Lubar, J. Quantitative EEG and neurofeedback in children and adolescents: anxiety disorders, depressive disorders, comorbid addiction and attention-deficit/hyperactivity disorder, and brain injury. Child and Adolescent Psychiatric Clinics of North America. 23, 427-464 (2014).
- Pascual-Marqui, R. D., et al. Assessing interactions in the brain with exact low-resolution electromagnetic tomography. Philosophical transactions: Series A, Mathematical, physical, and engineering sciences. , 3768-3784 (2011).
- Meir-Hasson, Y., Kinreich, S., Podlipsky, I., Hendler, T., Intrator, N. An EEG Finger-Print of fMRI deep regional activation. NeuroImage. 102, 128-141 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados