JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
니코틴 중독 흡연자의 섬피질을 하향 조절하기 위해 실시간 기능 자기 공명 영상 기반 뉴로피드백 사용
요약
실시간 기능적 자기공명영상(rtfMRI)에서 뇌 활동은 독립 변수로 실험적으로 조작되고 행동은 종속 변수로 측정됩니다. 여기에 제시된 프로토콜은 니코틴 중독과 같은 정신 장애에 대한 치료 도구로서 rtfMRI의 실제 사용에 중점을 둡니다.
초록
최초의 기능적 자기공명영상(fMRI) 기반 뉴로피드백 접근법이 성공적으로 구현된 지 10년이 넘었습니다. 그 이후로, 다양한 연구에서 참가자들이 제한된 뇌 영역을 자발적으로 조절하는 법을 배울 수 있다는 것이 입증되었다. 결과적으로, 실시간 fMRI(rtfMRI)는 뇌 활동의 조작으로 인한 행동 수정을 연구할 수 있는 새로운 기회를 제공했습니다. 따라서 뇌 활동의 자기 조절과 신경 및 정신 장애(예: 정신 분열증, 강박 장애(OCD), 뇌졸중]과 같은 행동 및 임상 상태의 수반되는 변형을 훈련하기 위한 rtfMRI 응용 프로그램에 대한 보고가 급격히 증가했습니다.
중독 연구의 신경 영상 연구는 전방 대상 피질(anterior cingulate cortex), 안와 전두엽 피질(orbitofrontal cortex) 및 섬 피질(insular cortex)이 약물 관련 신호를 제시하는 동안 활성화된다는 것을 보여주었습니다. 또한, 좌측 및 우측 섬피질의 활동은 참가자들이 갈망을 유발하는 신호에 노출될 때 약물 충동과 높은 상관관계가 있는 것으로 나타났습니다. 따라서 양측 insula는 신체(내부수용성) 상태를 표현하는 역할로 인해 약물 충동 및 중독을 연구하는 데 특히 중요합니다. 이 연구는 니코틴 중독 참가자의 양측 섬 피질에서 혈액 산소 수준 의존성(BOLD) 활동 감소를 위한 rtfMRI 뉴로피드백의 사용을 탐구합니다. 이 연구는 또한 니코틴을 갈망하는 신호와 명시적인 갈망 행동에 대한 참가자의 암묵적 태도에 뉴로피드백 훈련과 관련된 수정이 있는지 테스트합니다.
서문
뉴로피드백은 인간이나 동물이 하나 이상의 뇌 영역에서 신경 활동을 조절하는 방법을 배울 수 있는 조작적 조건화 절차입니다. 훈련은 일반적으로 행동 수정으로 이어진다1. 원칙적으로, 하나 이상의 외접된 뇌 영역으로부터의 뇌 신호는 감각 피드백(예: 시각적, 청각적 또는 촉각적 피드백)으로 변환되며, 이는 조작적 조건화 또는 다른 형태의 학습에 의해 뇌 활동을 제어하기 위해 참가자에게 제공됩니다. 전통적인 신경 영상 패러다임의 반전으로, 뉴로피드백 연구는 뇌 활동을 독립 변수로 조절하고 행동을 종속 변수로 측정합니다. 따라서 뉴로피드백은 다양한 인지 기능에 대한 뇌 영역의 관여와 이러한 뇌 영역의 과잉 또는 저활성화가 어떻게 비정상적인 행동으로 이어질 수 있는지 조사하는 새로운 접근 방식을 제공합니다.
뉴로피드백은 기능적 자기공명영상(fMRI), 뇌파검사(EEG) 및 기능적 근적외선 분광법(fNIRS)과 같은 다양한 신경영상 양식과 함께 사용되었습니다. EEG 및 fNIRS 기반 뉴로피드백 패러다임은 더 높은 시간 해상도, 경제성 및 휴대성의 장점이 있습니다 2,3. 그러나 공간 해상도가 낮고 더 깊은 뇌 영역에 접근할 수 없는 것이 특징입니다. 또한, EEG는 표면 EEG 신호4에서 신경 활성화의 원인을 결정하기 위한 역 문제의 계산 복잡성을 가지고 있습니다. 그러나 최근 실시간 fMRI(rtfMRI)의 발전으로 우수한 공간 해상도(예: 2mm3)와 720ms5의 시간 해상도로 뇌의 모든 부분에서 혈류역학 신호에 액세스할 수 있습니다. 따라서 fMRI는 fNIRS 및 EEG 기술이 가지고 있는 위에서 언급한 한계를 극복합니다.
니코틴 중독은 흡연과 관련된 여러 가지 질병으로 인해 전 세계적으로 주요 사망 원인 중 하나입니다6. 니코틴 중독을 유발하는 것으로 알려진 요인은 사회적, 환경적,심리적7, 유전적 감수성8이다. 신경생물학적 수준에서, 연구에 따르면 중성 대조 단서와 대조적으로 약물 관련 단서가 나타나는 동안 전방 대상피질(ACC), 안와전두피질(OFC), 복측피질영역(VTA), 복선조체, 편도체, 해마, 전전두엽 피질(PFC) 및 섬피질이 활성화되는 것으로 나타났습니다 9,10,11,12,13,14 . 좌측 및 우측 인슐라의 활성은 흡연자가 약물 관련 신호를 보았을 때 흡연 충동과 높은 상관관계가 있었다15,16. 인슐라(insula)는 갈망 행동 17,18,19,20,21을 유발하는 데 중요한 역할을 하는데, 이는 신체 상태에 대한 인식을 담당하기 때문이다. 섬피질에 병변이 있는 흡연자는 인슐라와 관련이 없는 뇌 손상을 입은 흡연자보다 금연할 가능성이 더 높다고 보고되었다18.
기존 금연 방법의 가장 큰 문제점 중 하나는 높은 재발률이다22. 흡연자의 80% 이상이 금연 후 첫 몇 달 이내에 재발합니다23. 이전에 약물 사용과 관련된 단서에 대한 노출은 니코틴 중독의 재발률이 높은 주요 원인이다24. 이 메커니즘을 배양 효과라고 합니다. 현재 프로토콜은 정서적 프라이밍 작업에 의해 평가된 배양 효과를 목표로 개발되었습니다. 이전 연구에서는 금연하는 흡연자가 흡연 관련 신호에 대해 부정적인 암묵적 태도를 가지고 있음을 보여주었습니다 25,26,27,28. 전형적인 정서적 프라이밍 과제에서, 정서적 프라이밍 자극은 반응 시간과 반응의 정확성이 변화하도록 정서적 대상의 처리를 수정한다29. 즉, 프라임 자극과 목표 자극이 동일한 원자가인 경우 목표 자극에 대한 반응 시간이 더 빨라지고 그 반대의 경우도 마찬가지입니다.
본 연구에서는 양측 전방 섬피질(anterior insular cortex)의 하향 조절이 갈망을 감소시킬 것이며, 따라서 주의집중 편향(attentional biasing)과 연상적 편향(associative biasing)이 흡연 관련 신호에서 멀어짐에 따라 갈망 유발 신호의 원자가(valence of galving-indoyous cues)가 부정에서 중립으로 바뀔 것이라는 가설을 세웠다30. 암묵적 행동 과제는 원래 Czyzewska와 Graham31에서 채택된 정서적 프라이밍 과제입니다. 앞서 언급한 가설을 바탕으로, 기준선 블록과 비교하여 하향 조절 블록 후 양의 원자가를 가진 프라임(갈망 유도 그림 또는 중립적인 대응 그림)과 대상 단어의 조합에 대한 반응으로 반응 시간의 감소를 관찰할 것으로 예상됩니다. 프라이밍 작업(그림 2B)은 소수(즉, 갈망을 유발하는 그림 또는 중립적인 그림32)와 양수 또는 음의 원자가를 가진 대상 단어로 구성됩니다. 주요 그림은 200ms 동안 제시된 후 1초 동안 목표 단어가 제시됩니다. 자극 시작 비동기식(SOA)은 250ms입니다. 그런 다음 참가자들은 대상 단어(양수 또는 음수)의 원자가를 판단하고 가능한 한 빠르고 정확하게 버튼을 눌러 응답하도록 지시받습니다.
rtfMRI 시스템(그림 1)은 (1) 참가자, (2) 신호 수집, (3) 온라인 신호 분석 및 (4) 신호 피드백의 하위 시스템으로 구성됩니다. 신호 수집은 EPI(Echo Planar Imaging) 시퀀스33을 사용하여 3.0T Siemens Trio 전신 스캐너로 수행됩니다. 이미지 재구성, 왜곡 보정 및 신호 평균화와 같은 절차는 스캐너 컴퓨터에서 수행됩니다. 이미지가 재구성되고 사전 처리되면 신호 분석 하위 시스템으로 내보내집니다. 신호 분석 하위 시스템은 TBV(Turbo Brain Voyager)34를 사용하여 구현됩니다. TBV는 재구성된 이미지를 검색하고, 일반 선형 모델(35)을 사용하여 3D 모션 보정 및 실시간 통계 분석을 포함하는 데이터 처리를 수행한다. TBV를 사용하면 기능 이미지의 여러 복셀에 걸쳐 관심 영역(ROI)을 그리고 각 반복 시간(TR) 후 ROI의 평균 굵은 글씨 값을 추출할 수 있습니다. 그런 다음 선택한 ROI의 시계열을 MATLAB 스크립트로 내보내고, 이 스크립트는 피드백을 계산하여 참가자에게 제공합니다.
뇌 활동에 대한 시각적 피드백은 그래픽으로 애니메이션된 온도계의 형태로 참가자에게 제공되며, ROI의 굵은 변화 비율에 비례하여 막대가 변경됩니다. 몇몇 연구에서는 교육 참가자를 위해 간헐적 피드백(intermittent feedback, EPI sequence의 여러 TR 후에 참가자에게 제공되는 피드백)을 사용했다 36,37. 그러나 본 연구에서는 참가자들이 감각 통합에서 인슐라의 역할과 시각적 피드백 정보 처리에 관여하기 때문에 지속적인 피드백으로 전방 인슐라의 BOLD 신호를 하향 조절하는 데 더 큰 어려움을 겪을 것으로 예상되었다38. 따라서, 지속적인 피드백은 섬피질의 두 과정, 즉 외부 피드백으로 인해 신호를 증가시키는 과정과 뉴로피드백 훈련으로 인해 신호를 감소시키는 과정 사이에 충돌을 일으킬 것으로 추정되었습니다. 따라서 이 연구에서는 각 하향 조절 블록(지연된 피드백)의 끝에서만 피드백을 제공합니다. 참가자에게는 그들이 벌어들인 금액(금전적 보상)을 나타내는 시각적 피드백(그림 2A, C)으로 텍스트(예: 유로 0.87)가 표시됩니다. 이 보상은 규제 블록에서 달성된 하향 조절 비율에 비례합니다.
RtfMRI는 중독 치료에 대한 치료적 접근의 문제를 극복할 수 있고 재발을 줄이기 위한 보다 신뢰할 수 있고 효과적인 중재를 제공할 수 있는 새로운 신경 기술입니다. 현재 연구의 장기 목표는 세 가지입니다 : 1) 니코틴 중독자가 갈망 행동을 유발하는 자극이 존재하는 동안 전방 인슐라의 대담한 신호를 하향 조절하는 방법을 배울 수 있는지 여부를 테스트합니다. 2) 뉴로피드백 훈련이 갈망 행동의 수정으로 이어지는지 조사합니다. 3) 인슐라의 하향 조절에 대한 뉴로피드백 훈련 중 갈망 수준의 변화가 다른 개입 없이 6개월 훈련 후에도 지속되는지 여부를 조사합니다. 이 문서에서는 rtfMRI 실험 프로토콜과 다양한 구성 요소에 대한 자세한 설명을 제공합니다. 또한 연구의 샘플 데이터와 이 방법의 향후 과제 및 잠재력에 대한 논의 및 추가 연구가 제공됩니다. 제시된 프로토콜은 fMRI 기반 뉴로피드백 훈련을 사용하여 담배 흡연자의 섬 피질에서 뇌 활동의 감소를 연구할 수 있는지 여부를 조사하기 위해 고안되었습니다. 또한, 이 프로토콜은 섬피질의 활성화와 흡연자의 갈망 행동 사이의 관계를 연구하기 위한 것입니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
튀빙겐 대학교(University of Tübingen)와 칠레 카톨리카 폰티피시아 대학교(Pontificia Universidad Católica de Chile) 의학부 윤리위원회는 다음과 같은 rtfMRI 프로토콜을 승인했습니다.
1. 하드웨어 설정
- 그림 1에 표시된 하드웨어는 MRI 데이터의 실시간 내보내기를 설정하기 위해 한 번만 준비됩니다.
- MRI 방의 준비는 전통적인 fMRI 측정과 동일합니다. 참가자가 도착하기 전에 MRI실을 준비합니다.
- 32 또는 20 채널 헤드 코일을 스캐너에 부착합니다.
- 프로젝터의 VGA/HDMI 케이블과 MR 호환 응답 장치(버튼 박스)를 자극 컴퓨터에 연결합니다.
참고: 대부분의 MR 설정에서 응답 장치는 TR 트리거를 자극 컴퓨터에 전달합니다. 이 트리거는 자극, 프레젠테이션 및 데이터 수집을 동기화하는 데 도움이 됩니다.
2. 스캐너 밖에서 참가자 준비
- 참가자가 도착하기 전에 작성해야 하는 동의서와 설문지를 준비합니다.
- 참가자가 도착하면 실험과 fMRI 기법에 대해 설명합니다. 또한 참가자에게 작업을 수행하는 방법을 지시합니다(예: 실험 중에 참가자는 눈을 뜨고 항상 디스플레이 화면의 그림을 보아야 하며 스캐너 내부에서 머리를 움직이지 않도록 해야 함).
- 참가자에게 동의서에 서명하고 욕구 수준을 평가하는 데 필요한 설문지를 작성하도록 요청합니다.
- 참가자들에게 다음 설문지를 작성하도록 요청합니다: 1) VAS-C: Visual Analogue Scale, Craving39, 2) QSU-b: Questionnaire of Smoking Urges–Brief Version40, 3) 하루 담배.
- 참가자에게 일산화탄소(CO) 측정 장치를 통해 숨을 내쉬도록 요청합니다.
참고: CO 측정41 은 참가자가 뉴로피드백 세션에 도착하기 최소 3시간 전에 흡연을 자제하는지 여부를 나타냅니다. CO는 ppm(백만분율)으로 측정됩니다. 낮은 CO 값은 참가자가 도착하기 전에 최소 몇 시간 동안 담배를 피우지 않았음을 나타냅니다. 참가자들은 실험 중에 갈망 신호가 높은 갈망을 이끌어낼 수 있도록 흡연을 자제하도록 요청해야 합니다. CO 값이 높은 참가자는 rtfMRI 세션 전에 흡연을 자제하도록 향후 뉴로피드백 세션 전에 주의를 기울일 것입니다. 두 번 담배를 피우지 않는 참가자는 연구에서 제외되어야 합니다.
3. 참가자 포지셔닝
참고: 스캐너 테이블에서 참가자를 배치하는 절차는 기존 fMRI 실험과 유사합니다.
- 참가자에게 MRI실에 들어가기 전에 주머니에서 모든 금속 물체를 제거하도록 요청하십시오.
- 참가자에게 누운 자세로 스캐너 테이블에 눕기 전에 귀마개를 삽입하도록 요청합니다.
- 패드를 사용하여 헤드 코일 내부에 참가자의 머리 위치를 고정합니다. 이 단계는 측정 중 머리 움직임을 줄이는 데 도움이 됩니다.
- 헤드 코일의 상부를 잠그고 미러를 헤드 코일에 고정합니다.
- 참가자에게 응답 장치를 제공하고 참가자의 편의에 따라 응답 장치를 배치합니다.
- 참가자에게 눈을 감고 레이저 광선을 사용하여 눈썹 사이에 참가자의 기준 머리 위치를 표시하도록 요청합니다.
- 스캐너 테이블을 이동하여 표시된 위치를 MRI 보어의 중앙에 배치합니다.
- 참가자가 편안한 위치에 있는지, 그리고 거울을 사용하여 스캐너 뒤의 화면에 투사된 시각적 자극을 볼 수 있는지 참가자와 함께 확인합니다. 필요한 경우 미러를 조정합니다.
4. 데이터 수집
- 초기 스캔 중에 참가자에게 눈을 감고 머리를 움직이지 않도록 요청하십시오.
- 로컬라이저 펄스 시퀀스로 측정을 시작합니다. 이 시퀀스는 일반적으로 이후에 실행되는 해부학적 스캔 및 기능적(EPI 시퀀스) 스캔의 슬라이스 위치를 결정하는 데 사용됩니다.
- TR = 11.5ms, TE = 5ms, 슬라이스 갭이 없는 176개 슬라이스, FOV = 240 x 240mm2, 매트릭스 = 256 x 256, 플립 각도 = 18°, 1mm3 등방성 복셀 제공. 시퀀스의 FOV는 참가자의 머리 전체를 덮습니다.
- 기능적(EPI 시퀀스) 스캔을 위한 시야는 전방 쇄도선/후방 퇴근선(AC-PC 선)에 정렬됩니다. 관심 대상 영역을 포함하도록 슬라이스의 위치를 조정합니다. 시퀀스의 매개 변수는 TR = 1.5, FOV = 192mm, 25 슬라이스, 복셀 = 3mm x 3mm x 3mm, 플립 각도 = 70 °입니다.
5. FMRI 뉴로피드백
- 참가자에게 뉴로피드백 실행이 시작되고 있음을 알리고 이전에 제공된 지침을 반복합니다(예: 기준선 동안 블록은 "+" 기호로 표시됨).
참고: 참가자는 디스플레이 화면의 이미지를 관찰해야 합니다. 반면에, 아래쪽 방향의 화살표로 표시되는 조절 블록 동안 참가자는 몇 가지 인지 전략을 사용하여 갈망 충동에서 벗어나려고 노력해야 합니다. 각 규정 블록의 끝에 표시된 금액은 성능을 나타냅니다. 금액이 높을수록 성능이 향상됩니다. - 기준선 블록과 조절 블록이 번갈아 가며 뉴로피드백 실행을 수행합니다(각각 30초; 그림 2).
- 자극 컴퓨터에서 자극 코드로 작성된 프레젠테이션 소프트웨어를 실행하고 화면에 Ready가 나타나면 Enter 버튼을 누릅니다. 이제 프레젠테이션 코드가 트리거가 뉴로피드백 실행을 시작할 때까지 기다리고 있습니다.
참고: 코드는 스캐너에서 오는 TR 트리거와 동기화됩니다. 따라서 뉴로피드백 실행을 준비하는 첫 번째 단계입니다. - 분석 컴퓨터에서 사 내 MATLAB 툴박스와 TBV(Turbo Brain Voyager)를 실행합니다.
- MATLAB 툴박스에서 환자 ID, 뉴로피드백 실행 번호와 같은 참가자에 대한 특정 정보를 입력합니다.
- Generate protocol files(프로토콜 파일 생성)를 눌러 5.5단계에서 삽입한 정보를 사용하여 프로토콜 파일을 준비합니다.
참고: 프로토콜 파일에는 상태 타이밍과 관련된 정보(예: 특정 조건이 TR이 시작되어야 하는 시간 및 제시될 자극)가 포함되어 있습니다. MATLAB 툴박스와 TBV 모두에서 사용됩니다. - MATLAB 툴박스의 GUI에서 execute 버튼을 누릅니다. 코드는 현재 TBV에서 데이터를 수신하기 위해 대기 중입니다.
- TBV에서 5.6단계에서 생성된 프로토콜 파일을 선택합니다. 또한 이전 뉴로피드백 세션에서 생성된 .roi 파일을 선택합니다.
참고 : ROI 파일을 선택하는 것은 neurofeedback 실행의 초기 (10 TR) 기간 동안 TBV 소프트웨어의 충돌을 방지하므로 중요합니다. - MR 호스트 컴퓨터에서 구현할 EPI 시퀀스를 준비합니다. TBV에서 시작 버튼을 누릅니다.
- 해부학적 랜드마크에 따라 TBV 소프트웨어에서 목표 ROI를 다시 그립니다. 뇌실의 모양과 크기는 전방 인슐라를 선택하는 지표로 사용됩니다. 또한, 섬피질(insular cortex)의 물결 모양이 사용되어 양측 전방 인슐라(anterior insula)와 관련된 복셀을 정확하게 선택합니다.
- 중앙 열구를 해부학적 랜드마크로 사용하여 기본 운동 영역(M1)에 대한 ROI를 그립니다. 기본 운동 영역은 머리 움직임으로 인한 전체 BOLD 증가 및 BOLD 변동의 영향을 제거하기 위한 참조 ROI 역할을 합니다.
- 각 뉴로피드백 세션이 끝날 때마다, 참가자에게 "조절 블록 동안 어떤 인지 전략을 사용했나요?"라고 물어보세요. 또한 참가자에게 자신의 편안함 수준과 실험을 계속하고 싶은지 여부를 물어보십시오.
- 뉴로피드백을 네 번 실행한 후 전송 실행에 대해 라디오 단추 예를 선택합니다.
참고: 트랜스퍼 런은 뉴로피드백 런과 유사합니다. 그러나 참가자는 피드백이 없는 상태에서 자기 조절을 수행합니다. 이는 학습된 자기 조절이 참가자가 뉴로피드백을 받지 못하는 상황(예: 스캐너 외부)으로 전달되는지 여부를 결정하는 데 도움이 됩니다.
6. 대조군
- 실험 그룹의 참가자와 동일한 방식으로 통제 그룹의 참가자를 지시합니다. 그러나 참가자에게 노른자 피드백을 제공하십시오.
참고: 멍에 피드백에서 실험 그룹과 통제 그룹 모두에서 평균 강화(돈)는 동일하게 유지됩니다. 두 그룹의 유일한 차이점은 참가자에게 제공되는 피드백의 우연성입니다. 대조군 참가자의 경우, 총 강화 금액(돈)은 하향 조절 시험의 40%에 무작위로 할당되었습니다. 그러나 다른 60%의 임상시험에서는 참가자들이 부정적인 피드백(0유로)을 받았습니다. 따라서 통제 그룹의 참가자는 우발적인 피드백을 받지 않습니다.
7. 오프라인 분석
- fMRI 데이터 전처리
- SPM(통계적 파라메트릭 매핑) 툴박스를 사용하여 fMRI 데이터(https://www.fil.ion.ucl.ac.uk/spm/ext/)를 전처리합니다.
- SPM 배치 함수의 형식 변환 유틸리티를 사용하여 DICOM 형식의 fMRI 데이터를 NIFTI 형식으로 변환합니다.
- 그래디언트 평형 효과를 피하기 위해 각 뉴로피드백 실행 데이터에서 초기 10개의 스캔을 제거합니다42.
- 재정렬 프로세스를 수행하여 모션 아티팩트를 제거하고 모든 볼륨을 세션의 첫 번째 볼륨에 정렬합니다. 또한, 슬라이스 획득 지연(43)을 보상하기 위해 시간 슬라이스 보정을 수행한다.
- 해부학적 스캔의 세분화, EPI 서열 데이터와 해부학적 데이터의 공동 정합 및 정규화를 수행하여 피험자 공간 데이터를 MNI(Montreal Neurological Institute) 표준 뇌 템플릿44에 매핑합니다.
- 사내 MATLAB 코드를 사용하여 양측 전방 인슐라와 1차 운동 피질에 해당하는 MNI 좌표 주위에 생성된 큐브 모양의 ROI에서 BOLD 신호를 추출합니다.
- BOLD 신호의 변화율 계산
- 이전 baseline 블록과 비교하여 조절 블록 동안 각 ROI에 대한 BOLD 신호의 평균 변화를 기반으로 BOLD 신호의 변화율을 계산합니다. BOLD 신호의 백분율 변화에 대한 방정식은 다음과 같습니다.
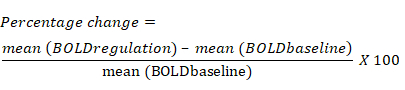
- 이전 baseline 블록과 비교하여 조절 블록 동안 각 ROI에 대한 BOLD 신호의 평균 변화를 기반으로 BOLD 신호의 변화율을 계산합니다. BOLD 신호의 백분율 변화에 대한 방정식은 다음과 같습니다.
- 참가자의 노골적인 흡연 행동 분석
- 설문지(예: QSU-b, VAS-C, CO 측정값 및 일일 담배 수)에 대한 참가자의 응답을 MATLAB으로 가져옵니다.
- MATLAB의 1-표본 Kolmogorov-Smirnov 검정을 사용하여 데이터의 정규성을 검정합니다.
- 1표본 t-검정을 사용하여 각 참가자에 대한 서로 다른 설문지의 응답을 비교하고, 쌍체 표본 t-검정을 사용하여 실험 그룹과 통제 그룹 간의 점수를 비교해야 합니다.
- 갈망-유발 신호에 대한 암묵적 태도 분석
- 프레젠테이션 소프트웨어에서 생성된 로그 파일에서 각 참가자에 대한 정서적 프라이밍 시험의 반응 시간(RT)을 추출합니다.
- RT를 기반으로 이상치를 제거합니다(즉, RT가 참가자의 평균 RT의 표준 편차의 2배보다 긴 시행을 포함하지 않음).
- MATLAB의 1-표본 Kolmogorov-Smirnov 검정을 사용하여 데이터의 정규성을 검정합니다.
- 각 참가자에 대한 프라임(갈망 유도 및 중립 이미지)과 목표(긍정적 및 부정적 단어)의 고유한 조합의 반응 시간 중앙값에 대한 하향 조절 효과를 비교하고 쌍체 현명한 t-검정을 사용하여 실험 그룹과 통제 그룹 간에 비교합니다.
Access restricted. Please log in or start a trial to view this content.
결과
4명의 환자는 중간 수준의 니코틴 의존에 대한 Fagerström 테스트(FTND)45 설문지(FTND 점수>4)와 매일 피우는 담배 수(>15)의 점수를 기반으로 모집되었습니다. 또한 참가자들이 기관의 MRI 안전 조치에 따라 문신이나 금속 임플란트를 착용하지 않았는지 확인했습니다. 각 참가자에 대해 5개의 rtfMRI 세션이 수행되었으며, 처음 4개의 세션은 2주(주당 2세션)에 걸쳐 수행되?...
Access restricted. Please log in or start a trial to view this content.
토론
4명의 참가자의 결과는 담배 흡연자가 갈망을 유발하는 신호가 있는 경우 양측 전방 인슐라의 활성화를 하향 조절하는 방법을 배울 수 있는 가능성을 보여줍니다. 표본 참가자의 뉴로피드백 훈련 후 암묵적 및 명시적 흡연 행동의 변화는 참가자가 실험 과정에서 다른 임상 또는 실험적 개입을 거치지 않았기 때문에 학습된 하향 조절과 관련이 있을 수 있습니다. 참가자의...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 연구는 Comisión Nacional de Investigación Científica y Tecnológica de Chile (Conicyt)의 지원을 받아 Fondo Nacional de Desarrollo Científico y Tecnológico, Fondecyt 박사후 연구원 보조금 (no. 3100648), Fondecyt Regular(프로젝트 번호 1171313 및 1171320) 및 CONICYT PIA/Anillo de Investigación en Ciencia y Tecnología ACT172121.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| MATHSWORK | MATLAB version 2014a | ||
| Presentation - Neurobehavioral Systems | Presentation version 18.0 | ||
| Brain Innovation B.V. | Turbo Brain Voyager Version 2.6 or 3.0 |
참고문헌
- Fernandez, T., et al. EEG and behavioral changes following neurofeedback treatment in learning disabled children. Clinical Electroencephalography. 34, 145-152 (2003).
- Scarapicchia, V., Brown, C., Mayo, C., Gawryluk, J. R. Functional Magnetic Resonance Imaging and Functional Near-Infrared Spectroscopy: Insights from Combined Recording Studies. Frontiers in Human Neuroscience. 11, 419(2017).
- Hinault, T., Larcher, K., Zazubovits, N., Gotman, J., Dagher, A. Spatio-temporal patterns of cognitive control revealed with simultaneous electroencephalography and functional magnetic resonance imaging. Human Brain Mapping. , (2018).
- Grech, R., et al. Review on solving the inverse problem in EEG source analysis. Journal of NeuroEngineering and Rehabilitation. 5, 25(2008).
- Van Essen, D. C., et al. The Human Connectome Project: a data acquisition perspective. NeuroImage. 62, 2222-2231 (2012).
- World Health Organization. WHO Report on the Global Tobacco Epidemic, 2017. , Geneva: World Health Organization. (2017).
- Ringlever, L., Otten, R., de Leeuw, R. N., Engels, R. C. Effects of parents' education and occupation on adolescent smoking and the mediating role of smoking-specific parenting and parent smoking. European Addiction Research. 17, 55-63 (2011).
- Malaiyandi, V., Sellers, E. M., Tyndale, R. F. Implications of CYP2A6 genetic variation for smoking behaviors and nicotine dependence. Clinical Pharmacology and Therapeutics. 77, 145-158 (2005).
- Brody, A. L., et al. Neural substrates of resisting craving during cigarette cue exposure. Biological Psychiatry. 62, 642-651 (2007).
- Childress, A. R., et al. Cue reactivity and cue reactivity interventions in drug dependence. NIDA Research Monography. 137, 73-95 (1993).
- Claus, E. D., Kiehl, K. A., Hutchison, K. E. Neural and behavioral mechanisms of impulsive choice in alcohol use disorder. Alcoholism, Clinical and Experimental Research. 35, 1209-1219 (2011).
- Franklin, T. R., et al. Limbic activation to cigarette smoking cues independent of nicotine withdrawal: a perfusion fMRI study. Neuropsychopharmacology. 32, 2301-2309 (2007).
- Grusser, S. M., et al. Cue-induced activation of the striatum and medial prefrontal cortex is associated with subsequent relapse in abstinent alcoholics. Psychopharmacology. 175, 296-302 (2004).
- Buhler, M., et al. Nicotine dependence is characterized by disordered reward processing in a network driving motivation. Biological Psychiatry. 67, 745-752 (2010).
- Bonson, K. R., et al. Neural systems and cue-induced cocaine craving. Neuropsychopharmacology. 26, 376-386 (2002).
- Brody, A. L., et al. Brain metabolic changes during cigarette craving. Archives of General Psychiatry. 59, 1162-1172 (2002).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318, 655-658 (2007).
- Naqvi, N. H., Rudrauf, D., Damasio, H., Bechara, A. Damage to the insula disrupts addiction to cigarette smoking. Science. 315, 531-534 (2007).
- Hollander, J. A., Lu, Q., Cameron, M. D., Kamenecka, T. M., Kenny, P. J. Insular hypocretin transmission regulates nicotine reward. Proceedings of the National Academy of Sciences of the United States of America. 105, 19480-19485 (2008).
- Forget, B., Pushparaj, A., Le Foll, B. Granular insular cortex inactivation as a novel therapeutic strategy for nicotine addiction. Biological Psychiatry. 68, 265-271 (2010).
- Scott, D., Hiroi, N. Deconstructing craving: dissociable cortical control of cue reactivity in nicotine addiction. Biological Psychiatry. 69, 1052-1059 (2011).
- Buczkowski, K., Marcinowicz, L., Czachowski, S., Piszczek, E. Motivations toward smoking cessation, reasons for relapse, and modes of quitting: results from a qualitative study among former and current smokers. Patient Prefer Adherence. 8, 1353-1363 (2014).
- Hughes, J. R., Stead, L. F., Hartmann-Boyce, J., Cahill, K., Lancaster, T. Antidepressants for smoking cessation. Cochrane Database of Systematic Reviews. , CD000031(2014).
- Bedi, G., et al. Incubation of cue-induced cigarette craving during abstinence in human smokers. Biological Psychiatry. 69, 708-711 (2011).
- Bassett, J. F., Dabbs, J. M. Jr A portable version of the go/no-go association task (GNAT). Behavior Research Methods. 37, 506-512 (2005).
- Huijding, J., de Jong, P. J., Wiers, R. W., Verkooijen, K. Implicit and explicit attitudes toward smoking in a smoking and a nonsmoking setting. Addictive Behaviors. 30, 949-961 (2005).
- Sherman, S. J., Rose, J. S., Koch, K., Presson, C. C., Chassin, L. Implicit and explicit attitudes towards cigarette smoking: The effect of context and motivation. Journal of Social and Clinical Psychology. 22, 13-39 (2003).
- Swanson, J. E., Rudman, L. A., Greenwald, A. G. Using the Implicit Association Test to investigate attitude- behavior consistency for stigmatized behavior. Cognition and Emotion. 15, 207-230 (2001).
- Asgaard, G. L., Gilbert, D. G., Malpass, D., Sugai, C., Dillon, A. Nicotine primes attention to competing affective stimuli in the context of salient alternatives. Experimental and Clinical Psychopharmacology. 18, 51-60 (2010).
- Gilbert, D. G., et al. Effects of nicotine on brain responses to emotional pictures. Nicotine & Tobacco Research. 6, 985-996 (2004).
- Czyzewska, M., Graham, R. Implicit and explicit attitudes to high- and low-calorie food in females with different BMI status. Eating Behaviors. 9, 303-312 (2008).
- Gilbert, D. G., Rabinovich, N. E. International smoking images series (with neutral counterparts). , Southern Illinois University: Integrative Neuroscience Laboratory, Department of Psychology. (1999).
- Bandettini, P. A., Wong, E. C., Hinks, R. S., Tikofsky, R. S., Hyde, J. S. Time course EPI of human brain function during task activation. Magnetic Resonance Medicine. 25, 390-397 (1992).
- Goebel, R. BrainVoyager - past, present, future. NeuroImage. 62, 748-756 (2012).
- Poline, J. B., Worsley, K. J., Holmes, A. P., Frackowiak, R. S., Friston, K. J. Estimating smoothness in statistical parametric maps: variability of p values. Journal of Computer Assisted Tomography. 19, 788-796 (1995).
- Johnson, K. A., et al. Intermittent "real-time" fMRI feedback is superior to continuous presentation for a motor imagery task: a pilot study. Journal of Neuroimaging. 22, 58-66 (2012).
- Yoo, S. S., Jolesz, F. A. Functional MRI for neurofeedback: feasibility study on a hand motor task. Neuroreport. 13, 1377-1381 (2002).
- Craig, A. D. How do you feel--now? The anterior insula and human awareness. Nature reviews. Neuroscience. 10, 59-70 (2009).
- Cox, L. S., Tiffany, S. T., Christen, A. G. Evaluation of the brief questionnaire of smoking urges (QSU-brief) in laboratory and clinical settings. Nicotine & Tobacco Research. 3, 7-16 (2001).
- Wewers, M. E., Rachfal, C., Ahijevych, K. A psychometric evaluation of a visual analogue scale of craving for cigarettes. Western Journal of Nursing Research. 12, 672-681 (1990).
- Allen, D. R., Browse, N. L., Rutt, D. L., Butler, L., Fletcher, C. The effect of cigarette smoke, nicotine, and carbon monoxide on the permeability of the arterial wall. Journal of Vascular Surgery. 7, 139-152 (1988).
- Weiskopf, N., et al. Real-time functional magnetic resonance imaging: methods and applications. Magnetic Resonance Imaging. 25, 989-1003 (2007).
- Sladky, R., et al. Slice-timing effects and their correction in functional MRI. NeuroImage. 58, 588-594 (2011).
- Mazziotta, J., et al. A probabilistic atlas and reference system for the human brain: International Consortium for Brain Mapping (ICBM). Philosophical Transactions of the Royal Society of London: Series B, Biological Sciences. 356, 1293-1322 (2001).
- Heatherton, T. F., Kozlowski, L. T., Frecker, R. C., Fagerstrom, K. O. The Fagerstrom Test for Nicotine Dependence: a revision of the Fagerstrom Tolerance Questionnaire. British Journal of Addiction. 86, 1119-1127 (1991).
- Myrick, H., et al. Differential brain activity in alcoholics and social drinkers to alcohol cues: relationship to craving. Neuropsychopharmacology. 29, 393-402 (2004).
- Tapert, S. F., Brown, G. G., Baratta, M. V., Brown, S. A. fMRI BOLD response to alcohol stimuli in alcohol dependent young women. Addictive Behaviors. 29, 33-50 (2004).
- Kilts, C. D., Gross, R. E., Ely, T. D., Drexler, K. P. The neural correlates of cue-induced craving in cocaine-dependent women. American Journal of Psychiatry. 161, 233-241 (2004).
- Li, Q., et al. Assessing cue-induced brain response as a function of abstinence duration in heroin-dependent individuals: an event-related fMRI study. PloS One. 8, e62911(2013).
- Frank, S., Kullmann, S., Veit, R. Food related processes in the insular cortex. Front Hum Neurosci. 7, 499(2013).
- deCharms, R. C., et al. Control over brain activation and pain learned by using real-time functional MRI. Proceedings of the National Academy of Sciences of the United States of America. 102, 18626-18631 (2005).
- Ruiz, S., Birbaumer, N., Sitaram, R. Abnormal Neural Connectivity in Schizophrenia and fMRI-Brain-Computer Interface as a Potential Therapeutic Approach. Frontiers in Psychiatry. 4, 17(2013).
- Habes, I., et al. Pattern classification of valence in depression. NeuroImage. Clinical. 2, 675-683 (2013).
- Li, X., et al. Volitional reduction of anterior cingulate cortex activity produces decreased cue craving in smoking cessation: a preliminary real-time fMRI study. Addiction Biology. 18, 739-748 (2013).
- Lubar, J. F., Swartwood, M. O., Swartwood, J. N., O'Donnell, P. H. Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Biofeedback and Self-Regulation. 20, 83-99 (1995).
- Janssen, T. W., et al. A randomized controlled trial into the effects of neurofeedback, methylphenidate, and physical activity on EEG power spectra in children with ADHD. Journal of Child Psychology and Psychiatry. 57, 633-644 (2016).
- Mayer, K., Wyckoff, S. N., Fallgatter, A. J., Ehlis, A. C., Strehl, U. Neurofeedback as a nonpharmacological treatment for adults with attention-deficit/hyperactivity disorder (ADHD): study protocol for a randomized controlled trial. Trials. 16, 174(2015).
- Gevensleben, H., et al. Distinct EEG effects related to neurofeedback training in children with ADHD: a randomized controlled trial. International Journal of Psychophysiology. 74, 149-157 (2009).
- Ramos-Murguialday, A., et al. Brain-machine interface in chronic stroke rehabilitation: a controlled study. Annals of Neurology. 74, 100-108 (2013).
- Biasiucci, A., et al. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nature Communication. 9, 2421(2018).
- Du, J., et al. Effects of repetitive transcranial magnetic stimulation on motor recovery and motor cortex excitability in patients with stroke: a randomized controlled trial. European Journal of Neurology. 23, 1666-1672 (2016).
- Ang, K. K., et al. Facilitating effects of transcranial direct current stimulation on motor imagery brain-computer interface with robotic feedback for stroke rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, S79-S87 (2015).
- Wolbrecht, E. T., Chan, V., Reinkensmeyer, D. J., Bobrow, J. E. Optimizing compliant, model-based robotic assistance to promote neurorehabilitation. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 16, 286-297 (2008).
- Sitaram, R., et al. Closed-loop brain training: the science of neurofeedback. Nature Reviews Neuroscience. 18, 86-100 (2017).
- Simkin, D. R., Thatcher, R. W., Lubar, J. Quantitative EEG and neurofeedback in children and adolescents: anxiety disorders, depressive disorders, comorbid addiction and attention-deficit/hyperactivity disorder, and brain injury. Child and Adolescent Psychiatric Clinics of North America. 23, 427-464 (2014).
- Pascual-Marqui, R. D., et al. Assessing interactions in the brain with exact low-resolution electromagnetic tomography. Philosophical transactions: Series A, Mathematical, physical, and engineering sciences. , 3768-3784 (2011).
- Meir-Hasson, Y., Kinreich, S., Podlipsky, I., Hendler, T., Intrator, N. An EEG Finger-Print of fMRI deep regional activation. NeuroImage. 102, 128-141 (2014).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유