このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ニコチン中毒喫煙者における島皮質をダウンレギュレートするためのリアルタイム機能的磁気共鳴画像法に基づくニューロフィードバックの使用
要約
リアルタイム機能的磁気共鳴画像法(rtfMRI)では、脳活動を独立変数として実験的に操作し、従属変数として行動を測定します。ここで紹介するプロトコルは、ニコチン依存症などの精神疾患の治療ツールとしてのrtfMRIの実用化に焦点を当てています。
要約
機能的磁気共鳴画像法(fMRI)に基づくニューロフィードバックアプローチが初めて成功裏に実施されてから10年以上が経ちました。それ以来、さまざまな研究により、参加者は限局した脳領域を自発的に制御することを学ぶことができることが示されています。その結果、リアルタイムfMRI(rtfMRI)は、脳活動の操作による行動の変化を研究する新しい機会を提供しました。したがって、脳活動の自己調節と、それに伴う神経障害や精神障害などの行動的および臨床的状態の変化を訓練するためのrtfMRIアプリケーションの報告が急速に増加しています。
依存症研究におけるニューロイメージング研究は、薬物関連の手がかりの提示中に前帯状皮質、眼窩前頭皮質、および島皮質が活性化されることを示しています。また、参加者が渇望を誘発する手がかりにさらされた場合、左右両方の島皮質の活動は薬物の衝動と高い相関があることが示されています。したがって、両側の島皮質は、身体(内受容感覚)状態の表現におけるその役割のために、薬物の衝動と中毒の研究において特に重要です。この研究では、ニコチン中毒の参加者の両側島皮質における血中酸素レベル依存性 (BOLD) 活性の低下に対する rtfMRI ニューロフィードバックの使用を調査しています。この研究では、ニコチン渇望の手がかりや明示的な渇望行動に対する参加者の潜在的態度に、ニューロフィードバックトレーニングに関連する変化があるかどうかもテストします。
概要
ニューロフィードバックは、人間や動物が1つ以上の脳領域の神経活動を調節することを学ぶことができるオペラント条件付け手順です。トレーニングは通常、行動の変更につながります1。原則として、1つ以上の限局性脳領域からの脳信号は、感覚フィードバック(例えば、視覚、聴覚、または触覚フィードバック)に変換され、オペラント条件付けまたは他の形態の学習による脳活動の制御のために参加者に提供される。従来のニューロイメージングパラダイムを逆転させるニューロフィードバック研究は、脳の活動を独立変数として調節し、従属変数として行動を測定します。したがって、ニューロフィードバックは、さまざまな認知機能における脳領域の関与と、それらの脳領域の過活動または低活性化がどのように異常な行動につながるかを調査するための新しいアプローチを提供します。
ニューロフィードバックは、機能的磁気共鳴画像法(fMRI)、脳波計(EEG)、機能的近赤外分光法(fNIRS)など、さまざまなニューロイメージングモダリティで使用されてきました。EEGおよびfNIRSベースのニューロフィードバックパラダイムには、より高い時間分解能、手頃な価格、および移植性という利点があります2,3。ただし、空間分解能が低く、脳のより深い領域にアクセスできないという特徴があります。さらに、EEGは、表面EEG信号4から神経活性化の源を決定するための逆問題の計算の複雑さを持っています。しかし、近年のリアルタイムfMRI(rtfMRI)の発展により、脳のあらゆる部分からの血行動態信号に、良好な空間分解能(例えば、2 mm3)と720 ms5の時間分解能でアクセスすることが可能になりました。このように、fMRIは、fNIRSやEEG技術が持つ上記の制限を克服します。
ニコチン依存症は、喫煙に関連する多くの病気により、世界中で主要な死因の1つです6。ニコチン依存症につながると認識されている要因は、社会的、環境的、心理的7、および遺伝的感受性8である。神経生物学的レベルでは、研究によると、中立的な制御の手がかりとは対照的に、薬物関連の手がかりの提示中に、前帯状皮質(ACC)、眼窩前頭皮質(OFC)、腹側被蓋野(VTA)、腹側線条体、扁桃体、海馬、前頭前野(PFC)、および島皮質での活性化が示されています9,10,11,12,13,14 .左右の島皮質の活動は、喫煙者が薬物関連の手がかりを見たときの喫煙衝動と高い相関がある15,16。島皮質は、身体状態の知覚に関与しているため、渇望行動17,18,19,20,21を誘発する上で重要な役割を果たします。島皮質に病変のある喫煙者は、島皮質を伴わない脳損傷のある喫煙者よりも禁煙する可能性が高かったと報告されています18。
既存の禁煙方法における最大の課題の1つは、再発率が高いことです22。喫煙者の80%以上が禁煙後数か月以内に再発します23。以前は薬物使用に関連していた手がかりへの曝露は、ニコチン中毒の再発率が高い主な理由です24。このメカニズムをインキュベーション効果といいます。現在のプロトコルは、感情的なプライミングタスクによって評価されるインキュベーション効果を標的とするために開発されています。以前の研究では、禁煙喫煙者は喫煙関連の手がかりに対して否定的な潜在的態度を持っていることが示されています25,26,27,28。典型的な感情的プライミング課題では、感情的プライミング刺激は、反応時間と反応の精度が変化するように、感情的ターゲットの処理を変更する29。つまり、プライム刺激とターゲット刺激が同じ価数であれば、ターゲット刺激に対する反応時間は速くなり、その逆もまた然りです。
現在の研究では、両側の前島皮質のダウンレギュレーションが渇望を減らし、したがって、注意と連想バイアスが喫煙関連の手がかりから離れるため、渇望を誘発する手がかりの価数が否定から中立に変化すると仮定されています30。潜在的行動課題は、もともとCzyzewskaとGraham31から適応された感情的なプライミング課題です。前述の仮説に基づいて、ベースライン ブロックと比較して、ダウンレギュレーション ブロック後のプライム (渇望誘発画像またはその中立的な対応画像) と正の原子価を持つターゲット ワードの組み合わせに応答して、反応時間の減少が観察されることが予想されます。プライミング課題(図2B)は、素数(すなわち、渇望誘発画像またはその中立的な対応画像32)と、正または負の原子価を持つ対象単語からなる。プライム ピクチャは 200 ミリ秒表示され、その後にターゲット ワードが 1 秒間表示されます。刺激開始非同期性 (SOA) は 250 ミリ秒です。次に、参加者は、ターゲット単語の価数(正または負)を判断し、できるだけ早く正確にボタンを押して応答するように指示されます。
rtfMRIシステム(図1)は、(1)参加者、(2)信号取得、(3)オンライン信号解析、(4)信号フィードバックのサブシステムで構成されています。信号取得は、エコー平面イメージング(EPI)シーケンス33を使用して、3.0T Siemens Trio全身スキャナーで実行されます。画像の再構成、歪み補正、信号の平均化などの手順は、スキャナーコンピュータ上で実行されます。イメージが再構成され、前処理されると、信号解析サブシステムにエクスポートされます。信号解析サブシステムは、Turbo Brain Voyager (TBV)34を使用して実装されます。TBVは、再構成された画像を取得し、一般的な線形モデル35を用いて、3次元運動補正及びリアルタイム統計解析を含むデータ処理を行う。TBVを使用すると、ユーザーは機能画像上の複数のボクセルに関心領域(ROI)を描画し、各繰り返し時間(TR)後のROIの平均BOLD値を抽出できます。次に、選択した ROI の時系列が MATLAB スクリプトにエクスポートされ、フィードバックが計算されて参加者に提示されます。
脳活動の視覚的なフィードバックは、グラフィカルにアニメーション化された温度計の形で参加者に提供され、そのバーはROIの太字の変化率に比例して変化します。いくつかの研究では、トレーニング参加者36,37に対して断続的フィードバック(EPIシーケンスのTRの数の後に参加者に提供されるフィードバック)が使用されています。しかし、現在の研究では、参加者は、感覚統合における島の役割と視覚フィードバック情報38の処理への関与により、連続的なフィードバックを伴う前島皮質のBOLD信号のダウンレギュレーションがより困難になると予想された。したがって、継続的なフィードバックは、島皮質の2つのプロセス、つまり外部フィードバックによって信号を増加させるプロセスと、ニューロフィードバックトレーニングによって信号を減少させるプロセスとの間に対立をもたらすと推定されました。したがって、この研究では、各ダウンレギュレーションブロックの終了時にのみフィードバックを提供します(遅延フィードバック)。参加者には、獲得した金額(金銭的報酬)を示す視覚的なフィードバック(図2A、C)としてテキスト(例:Euro 0.87)が表示されます。この報酬は、レギュレーションブロックで達成されたダウンレギュレーションの割合に比例します。
RtfMRIは、依存症治療への治療アプローチの問題を克服できる可能性のある新しいニューロテクノロジーであり、再発を減らすためのより信頼性が高く効果的な介入を提供する可能性があります。現在の研究の長期的な目標は3つあります:1)ニコチン中毒者が、渇望行動を誘発する刺激の存在中に前島でBOLDシグナルをダウンレギュレートすることを学ぶことができるかどうかをテストすること。2)ニューロフィードバックトレーニングが渇望行動の変更につながるかどうかを調べる。3) 島のダウンレギュレーションのニューロフィードバック トレーニング中の渇望レベルの変化が、他の介入なしで 6 か月のトレーニング後も持続するかどうかを調査すること。この記事では、rtfMRI実験プロトコルとそのさまざまなコンポーネントについて詳しく説明します。また、この研究からのサンプルデータと、この方法の将来の課題と可能性についての議論も紹介されています。提示されたプロトコルは、fMRIベースのニューロフィードバックトレーニングを使用して、タバコ喫煙者の島皮質の脳活動の低下を研究できるかどうかを調査するように設計されています。さらに、このプロトコルは、島皮質の活性化とタバコ喫煙者の渇望行動との関係を研究することを目的としています。
Access restricted. Please log in or start a trial to view this content.
プロトコル
テュービンゲン大学医学部およびポンティフィシア・カトリカ・デ・チリ大学の倫理委員会は、以下の rtfMRI プロトコルを承認しました。
1. ハードウェアのセットアップ
- 図 1 に示されているハードウェアは、MRI データのリアルタイム エクスポートを設定するために 1 回だけ準備されています。
- MRI室の準備は、従来のfMRI測定と同じです。参加者が到着する前にMRI室を準備してください。
- 32チャンネルまたは20チャンネルのヘッドコイルをスキャナーに取り付けます。
- プロジェクターのVGA/HDMIケーブルとMR対応レスポンスデバイス(ボタンボックス)を刺激コンピューターに接続します。
注意: ほとんどのMRセットアップでは、応答デバイスがTRトリガーを刺激コンピューターに配信します。このトリガは、スティミュラスの提示とデータ集録を同期させるのに役立ちます。
2. スキャナーの外部での参加者の準備
- 参加者が到着する前に記入する必要がある同意書とアンケートを準備します。
- 参加者が到着したら、実験とfMRI技術を説明します。また、課題の進め方を参加者に指導します(例えば、実験中は、参加者は目を開けたまま、常にディスプレイ画面上の画像を見なければならず、スキャナー内で頭を動かさないようにしてください)。
- 参加者に同意書に署名し、渇望レベルを評価するために必要なアンケートに記入するように依頼します。
- 参加者に次のアンケートに記入してもらいます: 1) VAS-C: ビジュアル アナログ スケール、渇望39、2) QSU-b: 喫煙衝動のアンケート – 簡易バージョン40、および 3) 1 日あたりのタバコ。
- 参加者に一酸化炭素(CO)測定装置から息を吐くように依頼します。
注:CO測定41 は、参加者がニューロフィードバックセッションに到着する少なくとも3時間前に喫煙を控えるかどうかを示します。COはppm(parts per million)で測定されます。CO値が低い場合は、参加者が到着前に少なくとも数時間喫煙していなかったことを示します。実験中に渇望の合図が高い渇望を引き出すように、参加者は喫煙を控えるように求められるべきです。CO値が高い参加者は、将来のニューロフィードバックセッションの前に注意を払い、rtfMRIセッションの前に喫煙を控えるようにします。2回喫煙を控えない参加者は、研究から除外されるべきです。
3. 参加者の位置づけ
注:スキャナーテーブル上での参加者の位置決め手順は、従来のfMRI実験と似ています。
- MRI室に入る前に、参加者にポケットからすべての金属物を取り出すように依頼してください。
- 参加者に耳栓を挿入するように依頼してから、スキャナーテーブルに仰向けの位置で横になります。
- パッドを使用して、ヘッドコイル内の参加者のヘッド位置を固定します。このステップは、測定中の頭の動きを減らすのに役立ちます。
- ヘッドコイルの上部をロックし、ミラーをヘッドコイルに固定します。
- 応答装置を参加者に渡し、参加者の快適さに応じて応答装置を配置します。
- 参加者に目を閉じてもらい、レーザー光を使用して眉間に参加者の基準頭の位置をマークします。
- スキャナーテーブルを動かして、マークされた位置をMRIボアの中心に配置します。
- 参加者が快適な位置にいること、およびスキャナーの後ろの画面に投影された視覚刺激がミラーを使用して見ることができることを参加者に確認します。必要に応じて、ミラーを調整します。
4. データ取得
- 最初のスキャンでは、参加者に目を閉じて頭を動かさないように依頼します。
- ローカライザのパルスシーケンスで測定を開始します。この配列は通常、その後に実行される解剖学的スキャンおよび機能的(EPI配列)スキャンのスライス位置を決定するために使用されます。
- 解剖学的スキャンの視野(FOV)を次のパラメータで選択します:TR = 11.5 ms、TE = 5 ms、スライスギャップなしの176スライス、FOV = 240 x 240mm2、マトリックス= 256 x 256、フリップ角度= 18°、1 mm3 の等方性ボクセルを提供します。シーケンスのFOVは、参加者の頭全体を覆います。
- 機能的(EPI配列)スキャンの視野は、前交連/後交連ライン(AC-PCライン)に整列しています。対象領域をカバーするようにスライスの位置を調整します。シーケンスのパラメータは、TR = 1.5、FOV = 192 mm、25スライス、ボクセル = 3 mm x 3 mm x 3 mm、フリップ角度 = 70°です。
5. FMRIニューロフィードバック
- ニューロフィードバックの実行が開始されていることを参加者に警告し、前に示した指示を繰り返します(たとえば、ベースライン中、ブロックは「+」記号で表されます)。
注:参加者は、ディスプレイ画面上の画像を確認する必要があります。一方、下方向の矢印で表される規制ブロックの間、参加者はいくつかの認知戦略を使用して渇望衝動から自分自身を切り離そうとすべきです。各レギュレーションブロックの最後に表示されている金額は、そのパフォーマンスを表しています。金額が多いほど、パフォーマンスが向上します。 - ベースラインブロックとレギュレーションブロックが交互に繰り返されるニューロフィードバックランを実行します(各30秒; 図 2)。
- 刺激コンピュータで、刺激コードで書かれたプレゼンテーションソフトウェアを実行し、画面に「準備完了」が表示されたらEnterボタンを押します。プレゼンテーション コードは、トリガーがニューロフィードバックの実行を開始するのを待機しています。
注:コードは、スキャナーからのTRトリガーと同期しています。したがって、これはニューロフィードバックランを実行する準備の最初のステップです。 - 解析コンピューターで、 社内の MATLAB ツールボックスと turbo brain voyager (TBV) を実行します。
- MATLAB ツールボックスに、患者 ID やニューロフィードバック実行番号など、参加者に固有の情報を入力します。
- [プロトコル ファイルの生成(Generate protocol files)] を押して、手順 5.5 で挿入した情報を使用してプロトコル ファイルを準備します。
注:プロトコルファイルには、条件のタイミングに関連する情報が含まれています(たとえば、特定の条件がTRを開始する時間や、どの刺激が提示されるかなど)。これは、MATLAB ツールボックスと TBV の両方で使用されます。 - MATLABツールボックスのGUIで 実行 ボタンを押します。コードは TBV からのデータの受信を待機しています。
- TBV で、手順 5.6 で生成されたプロトコル ファイルを選択します。さらに、前のニューロフィードバックセッションから生成された.roiファイルを選択します。
注:ROIファイルを選択することは、ニューロフィードバック実行の初期(10 TR)期間中にTBVソフトウェアのクラッシュを回避するため、重要です。 - MR ホスト コンピューターにインプリメントする EPI シーケンスを準備します。TBVのスタートボタンを押します。
- TBVソフトウェアで、解剖学的ランドマークに従って目標ROIを再描画します。脳内の心室の形状と大きさは、前島を選択するための目印として使用されます。さらに、島皮質の波状形状は、両側の前島に関連するボクセルを正確に選択するために使用されます。
- 解剖学的ランドマークとして中心溝を使用して、一次運動野 (M1) に ROI を描画します。一次運動野は、全体的なBOLDの増加と頭の動きによるBOLDの変動の影響を取り除くための参照ROIとして機能します。
- 各ニューロフィードバックセッションの最後に、参加者に「レギュレーションブロック中にどのような認知戦略を使用していましたか?」と尋ねます。さらに、参加者に自分の快適さのレベルと、実験を続けるかどうかについて尋ねます。
- ニューロフィードバックを 4 回実行した後、転送実行のラジオ ボタン [はい ] を選択します。
注: 転送実行は、ニューロフィードバック実行と似ています。しかし、参加者はフィードバックがないまま自己調整を行います。これは、学習した自己調節が、参加者がニューロフィードバックを受け取らない状況(スキャナーの外部など)に移行されるかどうかを判断するのに役立ちます。
6. コントロールグループ
- 対照群の参加者にも、実験群の参加者と同じ方法で指導します。ただし、参加者に Yolked のフィードバックを提供します。
注:くびき付きフィードバックでは、実験群と対照群の両方で平均強化量(お金)は同じままです。2つのグループの唯一の違いは、参加者に提供されるフィードバックの偶然性です。対照群の参加者の場合、強化の総量 (お金) は、無作為に割り当てられたダウンレギュレーション試験の 40% に分配されます。しかし、残りの60%の試験では、参加者は否定的なフィードバックを受けています(ユーロはゼロ)。したがって、対照群の参加者は偶発的なフィードバックを受けません。
7. オフライン分析
- fMRIデータの前処理
- 統計的パラメトリック マッピング (SPM) ツールボックスを使用して、fMRI データ (https://www.fil.ion.ucl.ac.uk/spm/ext/) を前処理します。
- DICOM形式のfMRIデータを、SPMバッチ機能のフォーマット変換ユーティリティを用いてNIFTI形式に変換します。
- 各ニューロフィードバック実行データから最初の10回のスキャンを削除して、勾配平衡化の影響を回避します42。
- 再調整プロセスを実行してモーションアーティファクトを削除し、すべてのボリュームをセッションの最初のボリュームに揃えます。また、スライス取得遅延43を補償するためにタイムスライス補正を行う。
- 解剖学的スキャンのセグメンテーション、EPI 配列データと解剖学的データの同時登録、および被験者の空間データをモントリオール神経学研究所 (MNI) の標準脳テンプレート44 にマッピングするための正規化を実施します。
- 社内の MATLAB コードを使用して、両側の前島と一次運動皮質に対応する MNI 座標の周囲に作成された立方体の ROI から BOLD 信号を抽出します。
- BOLD信号の変化率の計算
- 前のベースライン ブロックと比較した、レギュレーション ブロック中の各 ROI の BOLD 信号の平均変化に基づいて、BOLD 信号の変化率を計算します。BOLD 信号の変化率の式は次のとおりです。
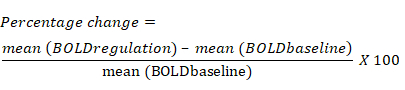
- 前のベースライン ブロックと比較した、レギュレーション ブロック中の各 ROI の BOLD 信号の平均変化に基づいて、BOLD 信号の変化率を計算します。BOLD 信号の変化率の式は次のとおりです。
- 参加者の露骨な喫煙行動の分析
- アンケート (QSU-b、VAS-C、CO メジャー、1 日あたりのタバコ数) に対する参加者の回答を MATLAB にインポートします。
- MATLAB の 1 サンプルの Kolmogorov-Smirnov 検定を使用して、データの正規性を検定します。
- 1サンプルのt検定を使用して、各参加者の異なる質問票の回答を比較し、対応のあるサンプルのt検定を使用して、実験グループと対照グループ間のスコアを比較する必要があります。
- 渇望誘発の手がかりに対する潜在的態度の分析
- プレゼンテーションソフトウェアによって生成されたログファイルから、各参加者の感情プライミング試行の反応時間(RT)を抽出します。
- RT に基づく外れ値を削除します (つまり、RT が参加者の平均 RT の標準偏差の 2 倍より長い試行は含めないでください)。
- MATLAB の 1 サンプルの Kolmogorov-Smirnov 検定を使用して、データの正規性を検定します。
- 各参加者のプライム(渇望を誘発する中立的な画像)とターゲット(陽性および否定的な単語)のユニークな組み合わせの反応時間の中央値に対するダウンレギュレーション効果を比較し、対応のある賢明なt検定を使用して実験群と対照群を比較します。
Access restricted. Please log in or start a trial to view this content.
結果
4人の患者は、中程度レベルのニコチン依存症に対するニコチン依存症のFagerströmテスト(FTND)45 アンケート(FTNDスコア>4)と毎日喫煙するタバコの数(>15)のスコアに基づいて募集されました。さらに、施設のMRI安全対策に従って、参加者が入れ墨や金属製のインプラントを持っていないことが確認されました。各参加者に対して5回のrtfMRIセッションが行われ、最?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
4人の参加者の結果は、喫煙者が渇望誘発の手がかりの存在下で両側前島での活性化をダウンレギュレートすることを学ぶ可能性を示しています。サンプル参加者のニューロフィードバックトレーニング後の暗黙的および明示的な喫煙行動の変化は、参加者が実験の過程で他の臨床的または実験的介入を受けていないため、学習されたダウンレギュレーションに関連?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は何も開示していません。
謝辞
この研究は、Comisión Nacional de Investigación Científica y Tecnológica de Chile (Conicyt) を通じて、Fondo Nacional de Desarrollo Científico y Tecnológico を通じて、Fondecyt Postdoctoral grant (no. 3100648), Fondecyt Regular(projects no. 1171313 and no. 1171320), and CONICYT PIA/Anillo de Investigación en Ciencia y Tecnología ACT172121.
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| MATHSWORK | MATLAB version 2014a | ||
| Presentation - Neurobehavioral Systems | Presentation version 18.0 | ||
| Brain Innovation B.V. | Turbo Brain Voyager Version 2.6 or 3.0 |
参考文献
- Fernandez, T., et al. EEG and behavioral changes following neurofeedback treatment in learning disabled children. Clinical Electroencephalography. 34, 145-152 (2003).
- Scarapicchia, V., Brown, C., Mayo, C., Gawryluk, J. R. Functional Magnetic Resonance Imaging and Functional Near-Infrared Spectroscopy: Insights from Combined Recording Studies. Frontiers in Human Neuroscience. 11, 419(2017).
- Hinault, T., Larcher, K., Zazubovits, N., Gotman, J., Dagher, A. Spatio-temporal patterns of cognitive control revealed with simultaneous electroencephalography and functional magnetic resonance imaging. Human Brain Mapping. , (2018).
- Grech, R., et al. Review on solving the inverse problem in EEG source analysis. Journal of NeuroEngineering and Rehabilitation. 5, 25(2008).
- Van Essen, D. C., et al. The Human Connectome Project: a data acquisition perspective. NeuroImage. 62, 2222-2231 (2012).
- World Health Organization. WHO Report on the Global Tobacco Epidemic, 2017. , Geneva: World Health Organization. (2017).
- Ringlever, L., Otten, R., de Leeuw, R. N., Engels, R. C. Effects of parents' education and occupation on adolescent smoking and the mediating role of smoking-specific parenting and parent smoking. European Addiction Research. 17, 55-63 (2011).
- Malaiyandi, V., Sellers, E. M., Tyndale, R. F. Implications of CYP2A6 genetic variation for smoking behaviors and nicotine dependence. Clinical Pharmacology and Therapeutics. 77, 145-158 (2005).
- Brody, A. L., et al. Neural substrates of resisting craving during cigarette cue exposure. Biological Psychiatry. 62, 642-651 (2007).
- Childress, A. R., et al. Cue reactivity and cue reactivity interventions in drug dependence. NIDA Research Monography. 137, 73-95 (1993).
- Claus, E. D., Kiehl, K. A., Hutchison, K. E. Neural and behavioral mechanisms of impulsive choice in alcohol use disorder. Alcoholism, Clinical and Experimental Research. 35, 1209-1219 (2011).
- Franklin, T. R., et al. Limbic activation to cigarette smoking cues independent of nicotine withdrawal: a perfusion fMRI study. Neuropsychopharmacology. 32, 2301-2309 (2007).
- Grusser, S. M., et al. Cue-induced activation of the striatum and medial prefrontal cortex is associated with subsequent relapse in abstinent alcoholics. Psychopharmacology. 175, 296-302 (2004).
- Buhler, M., et al. Nicotine dependence is characterized by disordered reward processing in a network driving motivation. Biological Psychiatry. 67, 745-752 (2010).
- Bonson, K. R., et al. Neural systems and cue-induced cocaine craving. Neuropsychopharmacology. 26, 376-386 (2002).
- Brody, A. L., et al. Brain metabolic changes during cigarette craving. Archives of General Psychiatry. 59, 1162-1172 (2002).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318, 655-658 (2007).
- Naqvi, N. H., Rudrauf, D., Damasio, H., Bechara, A. Damage to the insula disrupts addiction to cigarette smoking. Science. 315, 531-534 (2007).
- Hollander, J. A., Lu, Q., Cameron, M. D., Kamenecka, T. M., Kenny, P. J. Insular hypocretin transmission regulates nicotine reward. Proceedings of the National Academy of Sciences of the United States of America. 105, 19480-19485 (2008).
- Forget, B., Pushparaj, A., Le Foll, B. Granular insular cortex inactivation as a novel therapeutic strategy for nicotine addiction. Biological Psychiatry. 68, 265-271 (2010).
- Scott, D., Hiroi, N. Deconstructing craving: dissociable cortical control of cue reactivity in nicotine addiction. Biological Psychiatry. 69, 1052-1059 (2011).
- Buczkowski, K., Marcinowicz, L., Czachowski, S., Piszczek, E. Motivations toward smoking cessation, reasons for relapse, and modes of quitting: results from a qualitative study among former and current smokers. Patient Prefer Adherence. 8, 1353-1363 (2014).
- Hughes, J. R., Stead, L. F., Hartmann-Boyce, J., Cahill, K., Lancaster, T. Antidepressants for smoking cessation. Cochrane Database of Systematic Reviews. , CD000031(2014).
- Bedi, G., et al. Incubation of cue-induced cigarette craving during abstinence in human smokers. Biological Psychiatry. 69, 708-711 (2011).
- Bassett, J. F., Dabbs, J. M. Jr A portable version of the go/no-go association task (GNAT). Behavior Research Methods. 37, 506-512 (2005).
- Huijding, J., de Jong, P. J., Wiers, R. W., Verkooijen, K. Implicit and explicit attitudes toward smoking in a smoking and a nonsmoking setting. Addictive Behaviors. 30, 949-961 (2005).
- Sherman, S. J., Rose, J. S., Koch, K., Presson, C. C., Chassin, L. Implicit and explicit attitudes towards cigarette smoking: The effect of context and motivation. Journal of Social and Clinical Psychology. 22, 13-39 (2003).
- Swanson, J. E., Rudman, L. A., Greenwald, A. G. Using the Implicit Association Test to investigate attitude- behavior consistency for stigmatized behavior. Cognition and Emotion. 15, 207-230 (2001).
- Asgaard, G. L., Gilbert, D. G., Malpass, D., Sugai, C., Dillon, A. Nicotine primes attention to competing affective stimuli in the context of salient alternatives. Experimental and Clinical Psychopharmacology. 18, 51-60 (2010).
- Gilbert, D. G., et al. Effects of nicotine on brain responses to emotional pictures. Nicotine & Tobacco Research. 6, 985-996 (2004).
- Czyzewska, M., Graham, R. Implicit and explicit attitudes to high- and low-calorie food in females with different BMI status. Eating Behaviors. 9, 303-312 (2008).
- Gilbert, D. G., Rabinovich, N. E. International smoking images series (with neutral counterparts). , Southern Illinois University: Integrative Neuroscience Laboratory, Department of Psychology. (1999).
- Bandettini, P. A., Wong, E. C., Hinks, R. S., Tikofsky, R. S., Hyde, J. S. Time course EPI of human brain function during task activation. Magnetic Resonance Medicine. 25, 390-397 (1992).
- Goebel, R. BrainVoyager - past, present, future. NeuroImage. 62, 748-756 (2012).
- Poline, J. B., Worsley, K. J., Holmes, A. P., Frackowiak, R. S., Friston, K. J. Estimating smoothness in statistical parametric maps: variability of p values. Journal of Computer Assisted Tomography. 19, 788-796 (1995).
- Johnson, K. A., et al. Intermittent "real-time" fMRI feedback is superior to continuous presentation for a motor imagery task: a pilot study. Journal of Neuroimaging. 22, 58-66 (2012).
- Yoo, S. S., Jolesz, F. A. Functional MRI for neurofeedback: feasibility study on a hand motor task. Neuroreport. 13, 1377-1381 (2002).
- Craig, A. D. How do you feel--now? The anterior insula and human awareness. Nature reviews. Neuroscience. 10, 59-70 (2009).
- Cox, L. S., Tiffany, S. T., Christen, A. G. Evaluation of the brief questionnaire of smoking urges (QSU-brief) in laboratory and clinical settings. Nicotine & Tobacco Research. 3, 7-16 (2001).
- Wewers, M. E., Rachfal, C., Ahijevych, K. A psychometric evaluation of a visual analogue scale of craving for cigarettes. Western Journal of Nursing Research. 12, 672-681 (1990).
- Allen, D. R., Browse, N. L., Rutt, D. L., Butler, L., Fletcher, C. The effect of cigarette smoke, nicotine, and carbon monoxide on the permeability of the arterial wall. Journal of Vascular Surgery. 7, 139-152 (1988).
- Weiskopf, N., et al. Real-time functional magnetic resonance imaging: methods and applications. Magnetic Resonance Imaging. 25, 989-1003 (2007).
- Sladky, R., et al. Slice-timing effects and their correction in functional MRI. NeuroImage. 58, 588-594 (2011).
- Mazziotta, J., et al. A probabilistic atlas and reference system for the human brain: International Consortium for Brain Mapping (ICBM). Philosophical Transactions of the Royal Society of London: Series B, Biological Sciences. 356, 1293-1322 (2001).
- Heatherton, T. F., Kozlowski, L. T., Frecker, R. C., Fagerstrom, K. O. The Fagerstrom Test for Nicotine Dependence: a revision of the Fagerstrom Tolerance Questionnaire. British Journal of Addiction. 86, 1119-1127 (1991).
- Myrick, H., et al. Differential brain activity in alcoholics and social drinkers to alcohol cues: relationship to craving. Neuropsychopharmacology. 29, 393-402 (2004).
- Tapert, S. F., Brown, G. G., Baratta, M. V., Brown, S. A. fMRI BOLD response to alcohol stimuli in alcohol dependent young women. Addictive Behaviors. 29, 33-50 (2004).
- Kilts, C. D., Gross, R. E., Ely, T. D., Drexler, K. P. The neural correlates of cue-induced craving in cocaine-dependent women. American Journal of Psychiatry. 161, 233-241 (2004).
- Li, Q., et al. Assessing cue-induced brain response as a function of abstinence duration in heroin-dependent individuals: an event-related fMRI study. PloS One. 8, e62911(2013).
- Frank, S., Kullmann, S., Veit, R. Food related processes in the insular cortex. Front Hum Neurosci. 7, 499(2013).
- deCharms, R. C., et al. Control over brain activation and pain learned by using real-time functional MRI. Proceedings of the National Academy of Sciences of the United States of America. 102, 18626-18631 (2005).
- Ruiz, S., Birbaumer, N., Sitaram, R. Abnormal Neural Connectivity in Schizophrenia and fMRI-Brain-Computer Interface as a Potential Therapeutic Approach. Frontiers in Psychiatry. 4, 17(2013).
- Habes, I., et al. Pattern classification of valence in depression. NeuroImage. Clinical. 2, 675-683 (2013).
- Li, X., et al. Volitional reduction of anterior cingulate cortex activity produces decreased cue craving in smoking cessation: a preliminary real-time fMRI study. Addiction Biology. 18, 739-748 (2013).
- Lubar, J. F., Swartwood, M. O., Swartwood, J. N., O'Donnell, P. H. Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Biofeedback and Self-Regulation. 20, 83-99 (1995).
- Janssen, T. W., et al. A randomized controlled trial into the effects of neurofeedback, methylphenidate, and physical activity on EEG power spectra in children with ADHD. Journal of Child Psychology and Psychiatry. 57, 633-644 (2016).
- Mayer, K., Wyckoff, S. N., Fallgatter, A. J., Ehlis, A. C., Strehl, U. Neurofeedback as a nonpharmacological treatment for adults with attention-deficit/hyperactivity disorder (ADHD): study protocol for a randomized controlled trial. Trials. 16, 174(2015).
- Gevensleben, H., et al. Distinct EEG effects related to neurofeedback training in children with ADHD: a randomized controlled trial. International Journal of Psychophysiology. 74, 149-157 (2009).
- Ramos-Murguialday, A., et al. Brain-machine interface in chronic stroke rehabilitation: a controlled study. Annals of Neurology. 74, 100-108 (2013).
- Biasiucci, A., et al. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nature Communication. 9, 2421(2018).
- Du, J., et al. Effects of repetitive transcranial magnetic stimulation on motor recovery and motor cortex excitability in patients with stroke: a randomized controlled trial. European Journal of Neurology. 23, 1666-1672 (2016).
- Ang, K. K., et al. Facilitating effects of transcranial direct current stimulation on motor imagery brain-computer interface with robotic feedback for stroke rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, S79-S87 (2015).
- Wolbrecht, E. T., Chan, V., Reinkensmeyer, D. J., Bobrow, J. E. Optimizing compliant, model-based robotic assistance to promote neurorehabilitation. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 16, 286-297 (2008).
- Sitaram, R., et al. Closed-loop brain training: the science of neurofeedback. Nature Reviews Neuroscience. 18, 86-100 (2017).
- Simkin, D. R., Thatcher, R. W., Lubar, J. Quantitative EEG and neurofeedback in children and adolescents: anxiety disorders, depressive disorders, comorbid addiction and attention-deficit/hyperactivity disorder, and brain injury. Child and Adolescent Psychiatric Clinics of North America. 23, 427-464 (2014).
- Pascual-Marqui, R. D., et al. Assessing interactions in the brain with exact low-resolution electromagnetic tomography. Philosophical transactions: Series A, Mathematical, physical, and engineering sciences. , 3768-3784 (2011).
- Meir-Hasson, Y., Kinreich, S., Podlipsky, I., Hendler, T., Intrator, N. An EEG Finger-Print of fMRI deep regional activation. NeuroImage. 102, 128-141 (2014).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved