需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用基于实时功能磁共振成像的神经反馈下调尼古丁成瘾吸烟者的岛叶皮层
摘要
在实时功能磁共振成像 (rtfMRI) 中,大脑活动作为自变量进行实验纵,行为作为因变量进行测量。这里介绍的协议侧重于 rtfMRI 作为尼古丁成瘾等精神疾病治疗工具的实际应用。
摘要
自从第一个基于功能磁共振成像 (fMRI) 的神经反馈方法成功实施以来,已经过去了十多年。从那时起,各种研究表明,参与者可以学习自愿控制受限的大脑区域。因此,实时 fMRI (rtfMRI) 为研究由于大脑活动纵而导致的行为改变提供了新的机会。因此,rtfMRI 用于训练大脑活动的自我调节以及行为和临床状况(如神经和精神疾病 [例如,精神分裂症、强迫症 (OCD)、中风] 的随之改变的报道迅速增加。
成瘾研究中的神经影像学研究表明,前扣带皮层、眶额叶皮层和岛叶皮层在出现药物相关线索时被激活。此外,当参与者暴露于渴望诱发线索时,左右岛叶皮层的活动已被证明与药物冲动高度相关。因此,双侧岛叶在研究药物冲动和成瘾方面特别重要,因为它在身体(内感受)状态的表征中的作用。本研究探讨了使用 rtfMRI 神经反馈来降低尼古丁成瘾参与者双侧岛叶皮层的血氧水平依赖性 (BOLD) 活动。该研究还测试了参与者对尼古丁渴望线索和外显渴望行为的内隐态度是否存在与神经反馈训练相关的改变。
引言
神经反馈是一种作性条件反射程序,人类或动物可以通过该程序学习调节一个或多个大脑区域的神经活动。训练通常会导致行为改变1。原则上,来自一个或多个受限大脑区域的大脑信号被转化为感觉反馈(例如,视觉、听觉或触觉反馈),该反馈提供给参与者,以便通过作性条件反射或其他形式的学习来控制大脑活动。与传统神经影像学范式相反,神经反馈研究将大脑活动作为自变量进行调节,并将行为测量作为因变量。因此,神经反馈提供了一种新的方法来研究大脑区域参与不同的认知功能,以及这些大脑区域的过度激活或低激活如何导致异常行为。
神经反馈已用于不同的神经影像学模式,如功能性磁共振成像 (fMRI)、脑电图 (EEG) 和功能性近红外光谱 (fNIRS)。基于 EEG 和 fNIRS 的神经反馈范式具有更高的时间分辨率、可负担性和便携性 2,3。然而,它们的特点是空间分辨率低,无法进入更深的大脑区域。此外,脑电图具有逆问题的计算复杂性,用于确定表面脑电图信号的神经激活来源4。然而,随着实时 fMRI (rtfMRI) 的最新发展,可以以良好的空间分辨率(例如 2 mm3)和 720 ms5 的时间分辨率访问来自大脑各个部位的血流动力学信号。因此,fMRI 克服了 fNIRS 和 EEG 技术所具有的上述局限性。
尼古丁成瘾是全世界主要死亡原因之一,原因在于许多与吸烟相关的疾病6。导致尼古丁成瘾的公认因素是社会、环境、心理 7 (socioal)、心理7 (psychoal) 和遗传易感性8(genetic sceptibility)。在神经生物学水平上,研究表明,在呈现药物相关线索期间,前扣带皮层 (ACC)、眶额叶皮层 (OFC)、腹侧被盖区 (VTA)、腹侧纹状体、杏仁核、海马体、前额叶皮层 (PFC) 和岛叶皮层的激活与中性对照线索形成对比9、10、11、12、13、14.当吸烟者查看药物相关线索时,左侧和右侧脑岛的活动与吸烟冲动高度相关15,16。岛叶在引发渴望行为 17,18,19,20,21 中起着重要作用,因为它负责感知身体状态。据报道,岛叶皮层有病变的吸烟者比脑损伤不涉及岛叶的吸烟者更有可能戒烟18。
现有戒烟方法的最大挑战之一是高复发率22。超过 80% 的吸烟者在戒烟后的最初几个月内复发23.暴露于以前与药物使用相关的线索是尼古丁成瘾复发率高的主要原因24。这种机制称为孵化效应。目前的方案是针对由情感启动任务评估的孵化效应而开发的。以前的研究表明,戒烟者对吸烟相关线索有消极的隐性态度 25,26,27,28。在典型的情感启动任务中,情绪启动刺激会修改情感目标的处理,从而改变反应时间和反应的准确性29。换句话说,如果 prime 和 target 刺激具有相同的价态,则响应目标刺激的反应时间会更快,反之亦然。
在目前的研究中,假设双侧前岛叶皮层的下调会减少渴望,因此,诱发渴望的线索的效价将从消极变为中性,因为注意力和联想偏差将从与吸烟相关的线索中转移出来30。内隐行为任务是一个情感启动任务,最初改编自 Czyzewska 和 Graham31。基于上述假设,与基线阻滞相比,下调阻滞后,预计在下调阻滞后,响应素 (渴望引出图片或其中性对应图片) 和具有正效价的目标词的组合反应时间减少。启动任务(图 2B)由一个素数(即渴望引发图片或其中性对应图片32)和具有正或负效价的目标词组成。素色图片显示 200 毫秒,然后显示目标字 1 秒。刺激起始异步 (SOA) 为 250 毫秒。然后指导参与者判断目标词的效价(积极或消极),并通过按下按钮尽可能快速准确地做出回应。
rtfMRI 系统(图 1)由以下子系统组成:(1) 参与者,(2) 信号采集,(3) 在线信号分析,以及 (4) 信号反馈。信号采集使用 3.0T 西门子 Trio 全身扫描仪使用回波平面成像 (EPI) 序列33 进行。图像重建、失真校正和信号平均等程序在扫描仪计算机上执行。图像经过重建和预处理后,它们将被导出到信号分析子系统。信号分析子系统使用 Turbo Brain Voyager (TBV)34 实现。TBV 检索重建的图像并执行数据处理,包括使用一般线性模型35 进行 3D 运动校正和实时统计分析。TBV 允许用户在功能图像上的多个体素上绘制感兴趣区域 (ROI),并在每次重复时间 (TR) 后提取 ROI 的平均 BOLD 值。然后,所选 ROI 的时间序列将导出到 MATLAB 脚本,该脚本会计算并向参与者提供反馈。
大脑活动的视觉反馈以图形动画温度计的形式提供给参与者,其条形与 ROI 的 BOLD 百分比变化成比例。几项研究使用间歇性反馈(在 EPI 序列的多个 TR 后提供给参与者的反馈)来培训参与者36,37。然而,在目前的研究中,由于岛叶在感觉统合中的作用和参与处理视觉反馈信息,预计参与者在通过连续反馈下调前岛叶中的 BOLD 信号将更加困难38。因此,据推测,连续反馈会导致岛叶皮层中的两个过程之间发生冲突,一个过程由于外部反馈而增加信号,另一个过程由于神经反馈训练而减少信号。因此,在本研究中,我们只在每个下调模块的末尾提供反馈(延迟反馈)。向参与者展示文本(例如 0.87 欧元)作为视觉反馈(图 2A、C),表明他们赚取的金额(金钱奖励)。该奖励与调节区块中实现的下调百分比成正比。
RtfMRI 是一种新型神经技术,可能能够克服成瘾治疗方法中的问题,并可能为减少复发提供更可靠和有效的干预措施。当前研究的长期目标有三个:1) 测试尼古丁成瘾者是否可以在存在引起渴望行为的刺激时学会下调前岛叶中的 BOLD 信号;2) 检查神经反馈训练是否会导致渴望行为的改变;3) 探讨在没有任何其他干预的情况下训练六个月后,神经反馈训练期间岛叶下调的渴望水平变化是否持续存在。本文详细介绍了 rtfMRI 实验方案及其不同组成部分。此外,还介绍了该研究的样本数据,并讨论了该方法的未来挑战和额外研究的潜力。提出的协议旨在调查基于 fMRI 的神经反馈训练是否可用于研究吸烟者岛叶皮层大脑活动的减少。此外,该协议旨在研究岛叶皮层的激活与吸烟者的渴望行为之间的关系。
Access restricted. Please log in or start a trial to view this content.
研究方案
图宾根大学医学院和智利天主教大学伦理委员会批准了以下 rtfMRI 协议。
1. 硬件设置
- 图 1 中表示的硬件只需准备一次,即可设置 MRI 数据的实时导出。
- MRI 室的准备工作与传统的 fMRI 测量相同。在参与者到达之前准备 MRI 室。
- 将 32 或 20 通道磁头线圈连接到扫描仪。
- 将投影机的 VGA/HDMI 电缆和 MR 兼容响应设备(按钮框)连接到刺激计算机。
注意:在大多数 MR 设置中,响应装置将 TR 触发器传送到刺激计算机。此触发器有助于同步刺激呈现和数据采集。
2. 在扫描仪之外准备参与者
- 准备参与者在抵达前需要填写的同意书和问卷。
- 参与者到达后,解释实验和 fMRI 技术。此外,指导参与者如何执行任务(例如,在实验过程中,参与者必须睁大眼睛并始终查看显示屏上的图片,并且他们应该尽量不要在扫描仪内移动头部)。
- 要求参与者签署同意书并填写评估渴望水平所需的问卷。
- 要求参与者填写以下问卷:1) VAS-C:视觉模拟量表,渴望39,2) QSU-b:吸烟冲动问卷 - 简明版40,以及 3) 每天吸烟。
- 让参与者通过一氧化碳 (CO) 测量设备呼气。
注意:CO 测量值41 表示参与者是否在到达神经反馈会议前至少 3 小时不吸烟。CO 以 ppm(百万分之一)为单位测量。低 CO 值表明参与者在到达前至少几个小时没有吸烟。应要求参与者避免吸烟,以便渴望线索在实验期间引起高度渴望。在未来的神经反馈会议之前,将警告具有高 CO 值的参与者,以确保他们在 rtfMRI 会议之前不要吸烟。不戒烟两次的参与者应被排除在研究之外。
3. 参与者定位
注意:参与者在扫描仪台上定位的过程类似于传统的 fMRI 实验。
- 要求参与者在进入 MRI 室之前从口袋中取出所有金属物品。
- 要求参与者在仰卧位躺在扫描仪台上之前插入耳塞。
- 使用垫子将参与者的头部位置固定在头部线圈内。此步骤有助于减少测量过程中的头部移动。
- 锁定磁头线圈的上部,并将镜子固定在磁头线圈上。
- 将响应装置交给参与者,并根据参与者的舒适度放置响应装置。
- 让参与者闭上眼睛,并使用激光在眉毛之间标记参与者的参考头部位置。
- 移动扫描仪台,将标记位置放置在 MRI 孔的中心。
- 与参与者确认他或她处于舒适的位置,并且他或她可以使用镜子看到投影在扫描仪后面屏幕上的视觉刺激。如果需要,请调整镜子。
4. 数据采集
- 在初始扫描期间,请参与者闭上眼睛,尽量不要移动头部。
- 使用 LOCALIZER 脉冲序列开始测量。该序列通常用于确定随后运行的解剖扫描和功能(EPI 序列)扫描的切片位置。
- 使用以下参数选择解剖扫描的视野 (FOV):TR = 11.5 ms,TE = 5 ms,176 个切片,无切片间隙,FOV = 240 x 240mm2,矩阵 = 256 x 256,翻转角度 = 18°,提供 1 mm3 各向同性体素。序列的 FOV 将覆盖参与者的整个头部。
- 功能性(EPI 序列)扫描的视野与前连合线/后连合线(AC-PC 线)对齐。调整切片的位置以覆盖感兴趣的目标区域。序列的参数如下:TR = 1.5,FOV = 192 mm,25 个切片,体素 = 3 mm x 3 mm x 3 mm,翻转角度 = 70°。
5. FMRI 神经反馈
- 提醒参与者神经反馈运行正在开始,并重复之前提供的说明(例如,在基线期间,块由“+”号表示)。
注意: 参与者必须观察显示屏上的图像。另一方面,在调节阻滞期间,由向下箭头表示,参与者应尝试使用一些认知策略将自己从渴望冲动中分离出来。每个监管块末尾显示的金额代表他们的表现。金额越高代表性能越好。 - 执行神经反馈运行,其中基线和调节块交替(每个 30 秒; 图 2)。
- 在刺激计算机上,运行刺激代码编写的演示软件,并在屏幕上出现 Ready 后按 Enter 按钮。演示代码现在正在等待触发器开始神经反馈运行。
注意:代码与来自扫描仪的 TR 触发器同步。因此,这是准备运行神经反馈运行的第一步。 - 在分析计算机上, 运行内部 MATLAB 工具箱和 turbo brain voyager (TBV)。
- 在 MATLAB 工具箱中,输入特定于参与者的信息,例如患者 ID 和神经反馈运行号。
- 按 Generate protocol files (生成协议文件 ) 以使用步骤 5.5 中插入的信息准备协议文件。
注意:协议文件包含与条件时序相关的信息(例如,特定条件的 TR 应该开始的时间以及要呈现的刺激)。MATLAB Toolbox 和 TBV 都将使用它。 - 按下 MATLAB 工具箱 GUI 上的 按钮 execute 。代码现在正在等待从 TBV 接收数据。
- 在 TBV 中,选择步骤 5.6 中生成的协议文件。此外,选择从之前的神经反馈会话生成的 .roi 文件。
注意:选择一个 ROI 文件很重要,因为它可以避免在神经反馈运行的初始(10 个 TR)期间 TBV 软件崩溃。 - 准备要在 MR 主机中实现的 EPI 序列。按下 TBV 中的开始按钮。
- 根据解剖标志在 TBV 软件中重新绘制目标 ROI。大脑中脑室的形状和大小用作选择前岛叶的标志。此外,利用岛叶皮层的波浪形精确选择与双侧前岛叶相关的体素。
- 使用中央沟作为解剖标志,在初级运动区域 (M1) 上绘制 ROI。主要运动区域充当参考 ROI,以消除整体 BOLD 增加和头部运动引起的 BOLD 波动的影响。
- 在每次神经反馈会议结束时,问参与者:“您在调节阻滞期间使用了什么认知策略?此外,询问参与者的舒适度以及他或她是否希望继续实验。
- 在四次神经反馈运行后,选择单选按钮 Yes 进行传输运行。
注意:转移运行类似于神经反馈运行。然而,参与者在没有反馈的情况下进行自我调节。这有助于确定习得的自我调节是否转移到参与者不会接收神经反馈的情况下(例如,在扫描仪之外)。
6. 控制组
- 以与实验组相同的方式指导对照组的参与者。但是,请向参与者提供 Yolked 反馈。
注意:在 yoked feedback 中,实验组和对照组的平均强化量(钱)保持不变。两组之间的唯一区别是提供给参与者的反馈的偶然性。对于对照组的参与者,加固(金钱)的总量分配给随机分配的 40% 的下调试验。然而,在其他 60% 的试验中,参与者会收到负面反馈(零欧元)。因此,对照组的参与者不会得到或有反馈。
7. 离线分析
- fMRI 数据的预处理
- 使用统计参数映射 (SPM) 工具箱对 fMRI 数据 (https://www.fil.ion.ucl.ac.uk/spm/ext/) 进行预处理。
- 使用 SPM 批处理函数的格式转换实用程序将 DICOM 格式的 fMRI 数据转换为 NIFTI 格式。
- 从每个神经反馈运行数据中删除最初的 10 次扫描,以避免梯度平衡效应42。
- 执行重新对齐过程以删除运动伪影并将所有卷与会话的第一个卷对齐。此外,执行时间片校正以补偿切片采集延迟43。
- 进行解剖扫描的分割,EPI 序列数据和解剖数据的共同配准,并进行标准化以将主题空间数据映射到蒙特利尔神经学研究所 (MNI) 标准大脑模板44。
- 使用我们内部的 MATLAB 代码,从围绕对应于双侧前岛叶和初级运动皮层的 MNI 坐标创建的立方体形状 ROI 中提取 BOLD 信号。
- 计算 BOLD 信号的百分比变化
- 根据调节模块期间每个 ROI 的 BOLD 信号与前一个基线模块相比的平均变化,计算 BOLD 信号的百分比变化。BOLD 信号中百分比变化的公式如下:
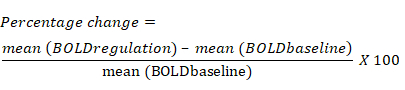
- 根据调节模块期间每个 ROI 的 BOLD 信号与前一个基线模块相比的平均变化,计算 BOLD 信号的百分比变化。BOLD 信号中百分比变化的公式如下:
- 参与者的明确吸烟行为分析
- 将参与者对问卷(即每天的 QSU-b、VAS-C、CO 测量和香烟)的回答导入 MATLAB。
- 使用 MATLAB 中的单样本 Kolmogorov-Smirnov 检验检验数据的正态性。
- 应使用单样本 t 检验来比较每个参与者的不同问卷的回答,并使用配对样本 t 检验来比较实验组和对照组之间的分数。
- 对渴望-诱发线索的隐性态度分析
- 从演示软件生成的日志文件中提取每个参与者的情感启动试验的反应时间 (RT)。
- 根据 RT 删除异常值(即,不包括 RT 长于参与者平均 RT 标准差 2 倍的试验)。
- 使用 MATLAB 中的单样本 Kolmogorov-Smirnov 检验检验数据的正态性。
- 比较每个参与者的素数(渴望诱导和中性图像)和目标(积极和消极词)的独特组合对中位反应时间的下调影响,并使用配对的 wise t 检验在实验组和对照组之间进行比较。
Access restricted. Please log in or start a trial to view this content.
结果
根据他们在中度尼古丁依赖的 Fagerström 测试 (FTND) 45 问卷 (FTND 评分 >4) 和每天吸烟次数 (>15) 的评分,招募了四名患者。此外,根据该机构的 MRI 安全措施,确保参与者没有任何纹身或金属植入物。为每位参与者进行了 5 次 rtfMRI 会议,其中前 4 次会议在 2 周内进行(每周 2 次),第五次会议在第四次会议后 6 个月进行。参与者被要求在每次会议前至少 3 ?...
Access restricted. Please log in or start a trial to view this content.
讨论
来自四名参与者的结果表明,吸烟者有可能在存在渴望诱发线索的情况下学会下调双侧前岛叶的激活。样本参与者在神经反馈训练后内隐和外显吸烟行为的变化可能与习得性下调有关,因为参与者在实验过程中没有进行任何其他临床或实验干预。参与者内隐行为的变化可能表明对渴望引发图片的注意力偏差发生了变化。积极目标词的反应时间变化表明,在下调训练后,参...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可披露的。
致谢
这项研究得到了智利国家科学和技术调查委员会 (Conicyt) 通过 Fondo Nacional de Desarrollo Científico y Tecnológico、Fondecyt 博士后资助(第 3100648 号)、 Fondecyt Regular(项目第 1171313 号和第 1171320 号)和 CONICYT PIA/Anillo de Investigación en Ciencia y Tecnología ACT172121 的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| MATHSWORK | MATLAB version 2014a | ||
| Presentation - Neurobehavioral Systems | Presentation version 18.0 | ||
| Brain Innovation B.V. | Turbo Brain Voyager Version 2.6 or 3.0 |
参考文献
- Fernandez, T., et al. EEG and behavioral changes following neurofeedback treatment in learning disabled children. Clinical Electroencephalography. 34, 145-152 (2003).
- Scarapicchia, V., Brown, C., Mayo, C., Gawryluk, J. R. Functional Magnetic Resonance Imaging and Functional Near-Infrared Spectroscopy: Insights from Combined Recording Studies. Frontiers in Human Neuroscience. 11, 419(2017).
- Hinault, T., Larcher, K., Zazubovits, N., Gotman, J., Dagher, A. Spatio-temporal patterns of cognitive control revealed with simultaneous electroencephalography and functional magnetic resonance imaging. Human Brain Mapping. , (2018).
- Grech, R., et al. Review on solving the inverse problem in EEG source analysis. Journal of NeuroEngineering and Rehabilitation. 5, 25(2008).
- Van Essen, D. C., et al. The Human Connectome Project: a data acquisition perspective. NeuroImage. 62, 2222-2231 (2012).
- World Health Organization. WHO Report on the Global Tobacco Epidemic, 2017. , Geneva: World Health Organization. (2017).
- Ringlever, L., Otten, R., de Leeuw, R. N., Engels, R. C. Effects of parents' education and occupation on adolescent smoking and the mediating role of smoking-specific parenting and parent smoking. European Addiction Research. 17, 55-63 (2011).
- Malaiyandi, V., Sellers, E. M., Tyndale, R. F. Implications of CYP2A6 genetic variation for smoking behaviors and nicotine dependence. Clinical Pharmacology and Therapeutics. 77, 145-158 (2005).
- Brody, A. L., et al. Neural substrates of resisting craving during cigarette cue exposure. Biological Psychiatry. 62, 642-651 (2007).
- Childress, A. R., et al. Cue reactivity and cue reactivity interventions in drug dependence. NIDA Research Monography. 137, 73-95 (1993).
- Claus, E. D., Kiehl, K. A., Hutchison, K. E. Neural and behavioral mechanisms of impulsive choice in alcohol use disorder. Alcoholism, Clinical and Experimental Research. 35, 1209-1219 (2011).
- Franklin, T. R., et al. Limbic activation to cigarette smoking cues independent of nicotine withdrawal: a perfusion fMRI study. Neuropsychopharmacology. 32, 2301-2309 (2007).
- Grusser, S. M., et al. Cue-induced activation of the striatum and medial prefrontal cortex is associated with subsequent relapse in abstinent alcoholics. Psychopharmacology. 175, 296-302 (2004).
- Buhler, M., et al. Nicotine dependence is characterized by disordered reward processing in a network driving motivation. Biological Psychiatry. 67, 745-752 (2010).
- Bonson, K. R., et al. Neural systems and cue-induced cocaine craving. Neuropsychopharmacology. 26, 376-386 (2002).
- Brody, A. L., et al. Brain metabolic changes during cigarette craving. Archives of General Psychiatry. 59, 1162-1172 (2002).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318, 655-658 (2007).
- Naqvi, N. H., Rudrauf, D., Damasio, H., Bechara, A. Damage to the insula disrupts addiction to cigarette smoking. Science. 315, 531-534 (2007).
- Hollander, J. A., Lu, Q., Cameron, M. D., Kamenecka, T. M., Kenny, P. J. Insular hypocretin transmission regulates nicotine reward. Proceedings of the National Academy of Sciences of the United States of America. 105, 19480-19485 (2008).
- Forget, B., Pushparaj, A., Le Foll, B. Granular insular cortex inactivation as a novel therapeutic strategy for nicotine addiction. Biological Psychiatry. 68, 265-271 (2010).
- Scott, D., Hiroi, N. Deconstructing craving: dissociable cortical control of cue reactivity in nicotine addiction. Biological Psychiatry. 69, 1052-1059 (2011).
- Buczkowski, K., Marcinowicz, L., Czachowski, S., Piszczek, E. Motivations toward smoking cessation, reasons for relapse, and modes of quitting: results from a qualitative study among former and current smokers. Patient Prefer Adherence. 8, 1353-1363 (2014).
- Hughes, J. R., Stead, L. F., Hartmann-Boyce, J., Cahill, K., Lancaster, T. Antidepressants for smoking cessation. Cochrane Database of Systematic Reviews. , CD000031(2014).
- Bedi, G., et al. Incubation of cue-induced cigarette craving during abstinence in human smokers. Biological Psychiatry. 69, 708-711 (2011).
- Bassett, J. F., Dabbs, J. M. Jr A portable version of the go/no-go association task (GNAT). Behavior Research Methods. 37, 506-512 (2005).
- Huijding, J., de Jong, P. J., Wiers, R. W., Verkooijen, K. Implicit and explicit attitudes toward smoking in a smoking and a nonsmoking setting. Addictive Behaviors. 30, 949-961 (2005).
- Sherman, S. J., Rose, J. S., Koch, K., Presson, C. C., Chassin, L. Implicit and explicit attitudes towards cigarette smoking: The effect of context and motivation. Journal of Social and Clinical Psychology. 22, 13-39 (2003).
- Swanson, J. E., Rudman, L. A., Greenwald, A. G. Using the Implicit Association Test to investigate attitude- behavior consistency for stigmatized behavior. Cognition and Emotion. 15, 207-230 (2001).
- Asgaard, G. L., Gilbert, D. G., Malpass, D., Sugai, C., Dillon, A. Nicotine primes attention to competing affective stimuli in the context of salient alternatives. Experimental and Clinical Psychopharmacology. 18, 51-60 (2010).
- Gilbert, D. G., et al. Effects of nicotine on brain responses to emotional pictures. Nicotine & Tobacco Research. 6, 985-996 (2004).
- Czyzewska, M., Graham, R. Implicit and explicit attitudes to high- and low-calorie food in females with different BMI status. Eating Behaviors. 9, 303-312 (2008).
- Gilbert, D. G., Rabinovich, N. E. International smoking images series (with neutral counterparts). , Southern Illinois University: Integrative Neuroscience Laboratory, Department of Psychology. (1999).
- Bandettini, P. A., Wong, E. C., Hinks, R. S., Tikofsky, R. S., Hyde, J. S. Time course EPI of human brain function during task activation. Magnetic Resonance Medicine. 25, 390-397 (1992).
- Goebel, R. BrainVoyager - past, present, future. NeuroImage. 62, 748-756 (2012).
- Poline, J. B., Worsley, K. J., Holmes, A. P., Frackowiak, R. S., Friston, K. J. Estimating smoothness in statistical parametric maps: variability of p values. Journal of Computer Assisted Tomography. 19, 788-796 (1995).
- Johnson, K. A., et al. Intermittent "real-time" fMRI feedback is superior to continuous presentation for a motor imagery task: a pilot study. Journal of Neuroimaging. 22, 58-66 (2012).
- Yoo, S. S., Jolesz, F. A. Functional MRI for neurofeedback: feasibility study on a hand motor task. Neuroreport. 13, 1377-1381 (2002).
- Craig, A. D. How do you feel--now? The anterior insula and human awareness. Nature reviews. Neuroscience. 10, 59-70 (2009).
- Cox, L. S., Tiffany, S. T., Christen, A. G. Evaluation of the brief questionnaire of smoking urges (QSU-brief) in laboratory and clinical settings. Nicotine & Tobacco Research. 3, 7-16 (2001).
- Wewers, M. E., Rachfal, C., Ahijevych, K. A psychometric evaluation of a visual analogue scale of craving for cigarettes. Western Journal of Nursing Research. 12, 672-681 (1990).
- Allen, D. R., Browse, N. L., Rutt, D. L., Butler, L., Fletcher, C. The effect of cigarette smoke, nicotine, and carbon monoxide on the permeability of the arterial wall. Journal of Vascular Surgery. 7, 139-152 (1988).
- Weiskopf, N., et al. Real-time functional magnetic resonance imaging: methods and applications. Magnetic Resonance Imaging. 25, 989-1003 (2007).
- Sladky, R., et al. Slice-timing effects and their correction in functional MRI. NeuroImage. 58, 588-594 (2011).
- Mazziotta, J., et al. A probabilistic atlas and reference system for the human brain: International Consortium for Brain Mapping (ICBM). Philosophical Transactions of the Royal Society of London: Series B, Biological Sciences. 356, 1293-1322 (2001).
- Heatherton, T. F., Kozlowski, L. T., Frecker, R. C., Fagerstrom, K. O. The Fagerstrom Test for Nicotine Dependence: a revision of the Fagerstrom Tolerance Questionnaire. British Journal of Addiction. 86, 1119-1127 (1991).
- Myrick, H., et al. Differential brain activity in alcoholics and social drinkers to alcohol cues: relationship to craving. Neuropsychopharmacology. 29, 393-402 (2004).
- Tapert, S. F., Brown, G. G., Baratta, M. V., Brown, S. A. fMRI BOLD response to alcohol stimuli in alcohol dependent young women. Addictive Behaviors. 29, 33-50 (2004).
- Kilts, C. D., Gross, R. E., Ely, T. D., Drexler, K. P. The neural correlates of cue-induced craving in cocaine-dependent women. American Journal of Psychiatry. 161, 233-241 (2004).
- Li, Q., et al. Assessing cue-induced brain response as a function of abstinence duration in heroin-dependent individuals: an event-related fMRI study. PloS One. 8, e62911(2013).
- Frank, S., Kullmann, S., Veit, R. Food related processes in the insular cortex. Front Hum Neurosci. 7, 499(2013).
- deCharms, R. C., et al. Control over brain activation and pain learned by using real-time functional MRI. Proceedings of the National Academy of Sciences of the United States of America. 102, 18626-18631 (2005).
- Ruiz, S., Birbaumer, N., Sitaram, R. Abnormal Neural Connectivity in Schizophrenia and fMRI-Brain-Computer Interface as a Potential Therapeutic Approach. Frontiers in Psychiatry. 4, 17(2013).
- Habes, I., et al. Pattern classification of valence in depression. NeuroImage. Clinical. 2, 675-683 (2013).
- Li, X., et al. Volitional reduction of anterior cingulate cortex activity produces decreased cue craving in smoking cessation: a preliminary real-time fMRI study. Addiction Biology. 18, 739-748 (2013).
- Lubar, J. F., Swartwood, M. O., Swartwood, J. N., O'Donnell, P. H. Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Biofeedback and Self-Regulation. 20, 83-99 (1995).
- Janssen, T. W., et al. A randomized controlled trial into the effects of neurofeedback, methylphenidate, and physical activity on EEG power spectra in children with ADHD. Journal of Child Psychology and Psychiatry. 57, 633-644 (2016).
- Mayer, K., Wyckoff, S. N., Fallgatter, A. J., Ehlis, A. C., Strehl, U. Neurofeedback as a nonpharmacological treatment for adults with attention-deficit/hyperactivity disorder (ADHD): study protocol for a randomized controlled trial. Trials. 16, 174(2015).
- Gevensleben, H., et al. Distinct EEG effects related to neurofeedback training in children with ADHD: a randomized controlled trial. International Journal of Psychophysiology. 74, 149-157 (2009).
- Ramos-Murguialday, A., et al. Brain-machine interface in chronic stroke rehabilitation: a controlled study. Annals of Neurology. 74, 100-108 (2013).
- Biasiucci, A., et al. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nature Communication. 9, 2421(2018).
- Du, J., et al. Effects of repetitive transcranial magnetic stimulation on motor recovery and motor cortex excitability in patients with stroke: a randomized controlled trial. European Journal of Neurology. 23, 1666-1672 (2016).
- Ang, K. K., et al. Facilitating effects of transcranial direct current stimulation on motor imagery brain-computer interface with robotic feedback for stroke rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, S79-S87 (2015).
- Wolbrecht, E. T., Chan, V., Reinkensmeyer, D. J., Bobrow, J. E. Optimizing compliant, model-based robotic assistance to promote neurorehabilitation. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 16, 286-297 (2008).
- Sitaram, R., et al. Closed-loop brain training: the science of neurofeedback. Nature Reviews Neuroscience. 18, 86-100 (2017).
- Simkin, D. R., Thatcher, R. W., Lubar, J. Quantitative EEG and neurofeedback in children and adolescents: anxiety disorders, depressive disorders, comorbid addiction and attention-deficit/hyperactivity disorder, and brain injury. Child and Adolescent Psychiatric Clinics of North America. 23, 427-464 (2014).
- Pascual-Marqui, R. D., et al. Assessing interactions in the brain with exact low-resolution electromagnetic tomography. Philosophical transactions: Series A, Mathematical, physical, and engineering sciences. , 3768-3784 (2011).
- Meir-Hasson, Y., Kinreich, S., Podlipsky, I., Hendler, T., Intrator, N. An EEG Finger-Print of fMRI deep regional activation. NeuroImage. 102, 128-141 (2014).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。