Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Einsatz von funktionellem Echtzeit-Magnetresonanztomographie-basiertem Neurofeedback zur Herunterregulierung der Inselrinde bei nikotinabhängigen Rauchern
In diesem Artikel
Zusammenfassung
In der funktionellen Echtzeit-Magnetresonanztomographie (rtfMRT) wird die Gehirnaktivität experimentell als unabhängige Variable manipuliert und das Verhalten als abhängige Variable gemessen. Das hier vorgestellte Protokoll konzentriert sich auf die praktische Anwendung der rtfMRT als therapeutisches Instrument bei psychiatrischen Störungen wie Nikotinabhängigkeit.
Zusammenfassung
Es ist mehr als ein Jahrzehnt her, dass der erste auf funktioneller Magnetresonanztomographie (fMRT) basierende Neurofeedback-Ansatz erfolgreich implementiert wurde. Seitdem haben verschiedene Studien gezeigt, dass Teilnehmer lernen können, eine umschriebene Gehirnregion willentlich zu steuern. Folglich bot die Echtzeit-fMRT (rtfMRT) eine neue Möglichkeit, Verhaltensänderungen aufgrund von Manipulationen der Gehirnaktivität zu untersuchen. Daher haben die Berichte über rtfMRT-Anwendungen zum Training der Selbstregulation der Gehirnaktivität und die damit einhergehenden Veränderungen bei Verhaltens- und klinischen Erkrankungen wie neurologischen und psychiatrischen Störungen [z. B. Schizophrenie, Zwangsstörung (OCD), Schlaganfall] rapide zugenommen.
Neuroimaging-Studien in der Suchtforschung haben gezeigt, dass der anteriore cinguläre Kortex, der orbitofrontale Kortex und der Inselkortex während der Präsentation von drogenassoziierten Hinweisen aktiviert werden. Es wurde auch gezeigt, dass die Aktivität sowohl in der linken als auch in der rechten Inselrinde stark mit dem Drogendrang korreliert, wenn die Teilnehmer Heißhungerreizen ausgesetzt sind. Daher ist die bilaterale Insula aufgrund ihrer Rolle bei der Repräsentation körperlicher (interozeptiver) Zustände von besonderer Bedeutung für die Erforschung von Drogentrieben und Sucht. Diese Studie untersucht den Einsatz von rtfMRT-Neurofeedback zur Verringerung der blutsauerstoffabhängigen (BOLD) Aktivität in bilateralen Inselkortiken von nikotinabhängigen Teilnehmern. Die Studie testet auch, ob es durch Neurofeedback-Training verbundene Veränderungen in den impliziten Einstellungen der Teilnehmer gegenüber Nikotin-Verlangen-Reizen und explizitem Verlangen-Verhalten gibt.
Einleitung
Neurofeedback ist ein operantes Konditionierungsverfahren, durch das Menschen oder Tiere lernen können, die neuronale Aktivität in einer oder mehreren Gehirnregionen zu modulieren. Training führt in der Regel zu Verhaltensänderungen1. Prinzipiell werden Gehirnsignale von einer oder mehreren umschriebenen Hirnregionen in sensorisches Feedback (z. B. visuelles, auditives oder taktiles Feedback) umgewandelt, das dem Teilnehmer zur Steuerung der Gehirnaktivität durch operante Konditionierung oder andere Formen des Lernens zur Verfügung gestellt wird. In der Umkehrung des traditionellen Neuroimaging-Paradigmas modulieren Neurofeedback-Studien die Gehirnaktivität als unabhängige Variable und messen das Verhalten als abhängige Variable. Somit bietet Neurofeedback einen neuen Ansatz, um die Beteiligung von Hirnregionen an verschiedenen kognitiven Funktionen zu untersuchen und zu untersuchen, wie eine Hyper- oder Hypoaktivierung dieser Hirnregionen zu abnormalem Verhalten führen kann.
Neurofeedback wurde mit verschiedenen Neuroimaging-Verfahren wie der funktionellen Magnetresonanztomographie (fMRT), der Elektroenzephalographie (EEG) und der funktionellen Nahinfrarotspektroskopie (fNIRS) eingesetzt. EEG- und fNIRS-basierte Neurofeedback-Paradigmen haben die Vorteile einer höheren zeitlichen Auflösung, Erschwinglichkeit und Portabilität 2,3. Sie zeichnen sich jedoch durch eine geringe räumliche Auflösung und die Unfähigkeit aus, tiefere Hirnregionen zu erreichen. Darüber hinaus weist das EEG die rechnerische Komplexität des inversen Problems zur Bestimmung einer Quelle neuronaler Aktivierungen aus Oberflächen-EEG-Signalenauf 4. Mit den jüngsten Entwicklungen in der Echtzeit-fMRT (rtfMRT) ist es jedoch möglich, hämodynamische Signale aus allen Teilen des Gehirns mit guter räumlicher Auflösung (z. B. 2 mm3) und einer zeitlichen Auflösung von 720 ms5 abzurufen. Damit überwindet die fMRT die oben genannten Einschränkungen von fNIRS- und EEG-Techniken.
Die Abhängigkeit von Nikotin ist eine der Haupttodesursachen auf der ganzen Welt, die auf eine Reihe von Krankheiten zurückzuführen ist, die mit dem Rauchen in Verbindung gebracht werden6. Anerkannte Faktoren, die zur Nikotinsucht führen, sind soziale, umweltbedingte, psychologische7 und genetische Anfälligkeit8. Auf neurobiologischer Ebene haben Studien eine Aktivierung im anterioren cingulären Kortex (ACC), im orbitofrontalen Kortex (OFC), im ventralen tegmentalen Bereich (VTA), im ventralen Striatum, in der Amygdala, im Hippocampus, im präfrontalen Kortex (PFC) und im insularen Kortex während der Präsentation von medikamentenassoziierten Signalen im Gegensatz zu neutralen Kontrollreizengezeigt 9,10,11,12,13,14 . Die Aktivität sowohl der linken als auch der rechten Insula korreliert stark mit dem Rauchtrieb, wenn Raucher drogenassoziierte Signale sahen15,16. Die Insula spielt eine wichtige Rolle bei der Auslösung von Verlangensverhalten 17,18,19,20,21, da sie für die Wahrnehmung des Körperzustands verantwortlich ist. Es wurde berichtet, dass Raucher mit Läsionen in der Inselrinde mit größerer Wahrscheinlichkeit mit dem Rauchen aufhörten als Raucher mit Hirnschäden, die nicht an der Insulabeteiligt waren 18.
Eine der größten Herausforderungen bei bestehenden Methoden zur Raucherentwöhnung ist die hohe Rückfallrate22. Mehr als 80 % der Raucher erleiden innerhalb der ersten Monate nach der Raucherentwöhnung einen Rückfall23. Die Exposition gegenüber Reizen, die zuvor mit Drogenkonsum in Verbindung gebracht wurden, ist ein Hauptgrund für die hohe Rückfallrate bei Nikotinabhängigkeit24. Dieser Mechanismus wird als Inkubationseffekt bezeichnet. Das aktuelle Protokoll wurde entwickelt, um den Inkubationseffekt zu untersuchen, der durch eine affektive Priming-Aufgabe bewertet wird. Frühere Studien haben gezeigt, dass Raucher, die abstinent rauchen, eine negative implizite Einstellung zu rauchbezogenen Hinweisen haben 25,26,27,28. Bei der typischen affektiven Priming-Aufgabe modifizieren emotionale Priming-Reize die Verarbeitung eines affektiven Ziels, so dass sich die Reaktionszeit und die Genauigkeit der Reaktionen verändern29. Mit anderen Worten, wenn der Prime- und der Zielreiz die gleiche Wertigkeit haben, ist die Reaktionszeit als Reaktion auf die Zielreize schneller und umgekehrt.
In der aktuellen Studie wird die Hypothese aufgestellt, dass die Herunterregulierung des bilateralen vorderen Inselkortex das Verlangen reduziert, und daher ändert sich die Wertigkeit der Verlangen auslösenden Signale von negativ zu neutral, da sich die Aufmerksamkeits- und assoziative Verzerrung von den rauchbezogenen Hinweisen entfernt30. Die implizite Verhaltensaufgabe ist eine affektive Priming-Aufgabe, die ursprünglich von Czyzewska und Graham31 übernommen wurde. Basierend auf der oben genannten Hypothese wird erwartet, dass eine Abnahme der Reaktionszeit als Reaktion auf eine Kombination aus Primzahl (Verlangen auslösendes Bild oder sein neutrales Gegenstück) und Zielwörtern mit positiver Valenz nach dem Herunterregulationsblock im Vergleich zum Ausgangsblock beobachtet wird. Die Priming-Aufgabe (Abbildung 2B) besteht aus einer Primzahl (d.h. einem Verlangen auslösenden Bild oder seinem neutralen Gegenstück Bild32) und einem Zielwort mit positiver oder negativer Valenz. Das Primbild wird 200 ms lang präsentiert, gefolgt von einem Zielwort, das 1 Sekunde lang präsentiert wird. Die Asynchronie des Stimulusbeginns (SOA) beträgt 250 ms. Die Teilnehmer werden dann angewiesen, die Wertigkeit des Zielwortes (positiv oder negativ) zu beurteilen und per Knopfdruck so schnell und genau wie möglich zu antworten.
Das rtfMRT-System (Abbildung 1) besteht aus den folgenden Subsystemen: (1) Teilnehmer, (2) Signalerfassung, (3) Online-Signalanalyse und (4) Signalrückmeldung. Die Signalerfassung erfolgt mit einem 3,0 t Siemens Trio Ganzkörperscanner unter Verwendung einer echoplanaren Bildgebung (EPI) Sequenz33. Verfahren wie Bildrekonstruktion, Verzerrungskorrektur und Mittelwertbildung des Signals werden auf dem Scannercomputer durchgeführt. Sobald die Bilder rekonstruiert und vorverarbeitet sind, werden sie in das Signalanalyse-Subsystem exportiert. Das Subsystem für die Signalanalyse wird mit dem Turbo Brain Voyager (TBV)34 implementiert. TBV ruft die rekonstruierten Bilder ab und führt eine Datenverarbeitung durch, die eine 3D-Bewegungskorrektur und eine statistische Echtzeitanalyse unter Verwendung des allgemeinen linearen Modells35 umfasst. TBV ermöglicht es dem Benutzer, Regionen von Interesse (ROIs) über mehrere Voxel auf den Funktionsbildern zu zeichnen und durchschnittliche BOLD-Werte des ROI nach jeder Wiederholungszeit (TR) zu extrahieren. Die Zeitreihen der ausgewählten ROIs werden dann in das MATLAB-Skript exportiert, das das Feedback berechnet und dem Teilnehmer präsentiert.
Visuelles Feedback der Gehirnaktivität wird den Teilnehmern in Form eines grafisch animierten Thermometers gegeben, dessen Balken sich proportional zu den prozentualen BBOLD-Änderungen der ROIs ändern. Mehrere Studien haben intermittierendes Feedback (Feedback, das einem Teilnehmer nach einer Reihe von TRs der EPI-Sequenz gegeben wird) für Trainingsteilnehmer verwendet36,37. In der aktuellen Studie wurde jedoch erwartet, dass die Teilnehmer größere Schwierigkeiten haben würden, das BOLD-Signal in der vorderen Insula mit kontinuierlichem Feedback herunterzuregulieren, da die Insula eine Rolle bei der sensorischen Integration und der Beteiligung an der Verarbeitung visueller Feedback-Informationen spielt38. Daher wurde angenommen, dass kontinuierliches Feedback zu einem Konflikt zwischen zwei Prozessen in der Inselrinde führen würde, einem Prozess, der das Signal aufgrund von externem Feedback erhöht, und einem anderen, der das Signal aufgrund des Neurofeedback-Trainings verringert. Daher geben wir in dieser Studie nur am Ende jedes Herunterregulierungsblocks Rückmeldung (verzögertes Feedback). Den Teilnehmern wird ein Text (z.B. 0,87 Euro) als visuelles Feedback gezeigt (Abbildung 2A,C), der den Geldbetrag angibt, den sie verdient haben (monetäre Belohnung). Diese Belohnung ist proportional zu der prozentualen Herunterregulierung, die im Regulierungsblock erreicht wurde.
RtfMRT ist eine neuartige Neurotechnologie, die in der Lage sein könnte, Probleme bei therapeutischen Ansätzen in der Suchtbehandlung zu überwinden und zuverlässigere und effektivere Interventionen zur Reduzierung von Rückfällen zu ermöglichen. Die langfristigen Ziele der aktuellen Studie sind dreierlei: 1) zu testen, ob Nikotinabhängige lernen können, BOLD-Signale in der vorderen Insula herunterzuregulieren, wenn Reize vorhanden sind, die Verlangensverhalten auslösen; 2) zu untersuchen, ob Neurofeedback-Training zu Veränderungen im Verlangensverhalten führt; und 3) zu untersuchen, ob Veränderungen des Verlangens während des Neurofeedback-Trainings oder der Herunterregulierung der Insula nach sechs Monaten Training ohne weitere Intervention bestehen bleiben. Dieser Artikel enthält eine detaillierte Beschreibung des experimentellen rtfMRT-Protokolls und seiner verschiedenen Komponenten. Ebenfalls vorgestellt werden Beispieldaten aus der Studie und eine Diskussion über die zukünftigen Herausforderungen und Potenziale dieser Methode sowie über die Forschung. Mit dem vorgestellten Protokoll soll untersucht werden, ob fMRT-basiertes Neurofeedback-Training verwendet werden kann, um eine Verringerung der Gehirnaktivität in der Inselrinde von Zigarettenrauchern zu untersuchen. Darüber hinaus soll das Protokoll Zusammenhänge zwischen der Aktivierung der Inselrinde und dem Verlangensverhalten von Zigarettenrauchern untersuchen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Die Ethikkommission der Medizinischen Fakultät der Universität Tübingen und der Pontificia Universidad Católica de Chile hat das folgende rtfMRT-Protokoll genehmigt.
1. Hardware-Einrichtung
- Die in Abbildung 1 dargestellte Hardware wird nur einmal vorbereitet, um den Echtzeitexport der MRT-Daten einzurichten.
- Die Vorbereitung des MRT-Raumes ist die gleiche wie bei der herkömmlichen fMRT-Messung. Bereiten Sie den MRT-Raum vor der Ankunft des Teilnehmers vor.
- Befestigen Sie die Kopfspule mit 32 oder 20 Kanälen an den Scanner.
- Schließen Sie das VGA/HDMI-Kabel des Projektors und das MR-kompatible Response-Gerät (Button-Box) an den Stimulus-Computer an.
HINWEIS: In den meisten MR-Setups liefert das Reaktionsgerät den TR-Trigger an den Stimuluscomputer. Dieser Trigger hilft bei der Synchronisierung von Stimuluspräsentation und Datenerfassung.
2. Vorbereitung der Teilnehmer außerhalb des Scanners
- Bereiten Sie die Einverständniserklärung und die Fragebögen vor, die die Teilnehmer vor ihrer Ankunft ausfüllen müssen.
- Sobald der Teilnehmer angekommen ist, erklären Sie das Experiment und die fMRT-Technik. Weisen Sie den Teilnehmer auch an, wie er die Aufgabe ausführen soll (z. B. müssen die Teilnehmer während des Experiments die Augen offen halten und immer auf die Bilder auf dem Bildschirm schauen, und sie sollten versuchen, ihren Kopf nicht im Scanner zu bewegen).
- Bitten Sie den Teilnehmer, die Einverständniserklärung zu unterschreiben und die Fragebögen auszufüllen, die zur Beurteilung des Verlangens erforderlich sind.
- Bitten Sie die Teilnehmer, die folgenden Fragebögen auszufüllen: 1) VAS-C: Visuelle Analogskala, Verlangen39, 2) QSU-b: Fragebogen zu Rauchtrieben – Kurze Version40 und 3) Zigaretten pro Tag.
- Bitten Sie den Teilnehmer, durch das Kohlenmonoxid (CO)-Messgerät auszuatmen.
HINWEIS: Die CO-Messung41 gibt an, ob der Teilnehmer mindestens 3 Stunden vor Ankunft für die Neurofeedback-Sitzung auf das Rauchen verzichtet oder nicht. CO wird in ppm (parts per million) gemessen. Niedrige CO-Werte deuten darauf hin, dass der Teilnehmer mindestens ein paar Stunden vor der Ankunft nicht geraucht hat. Die Teilnehmer sollten gebeten werden, nicht zu rauchen, damit die Heißhungersignale während des Experiments ein hohes Verlangen hervorrufen. Teilnehmer mit hohen CO-Werten werden vor der zukünftigen Neurofeedback-Sitzung gewarnt, um sicherzustellen, dass sie vor der rtfMRT-Sitzung auf das Rauchen verzichten. Teilnehmer, die nicht zweimal auf das Rauchen verzichten, sollten von der Studie ausgeschlossen werden.
3. Positionierung der Teilnehmer
HINWEIS: Das Verfahren zur Positionierung der Teilnehmer auf dem Scannertisch ähnelt dem herkömmlichen fMRT-Experiment.
- Bitten Sie den Teilnehmer, vor dem Betreten des MRT-Raumes alle metallischen Gegenstände aus seinen Taschen zu nehmen.
- Bitten Sie den Teilnehmer, Ohrstöpsel einzusetzen, bevor er sich in Rückenlage auf den Scannertisch legt.
- Verwenden Sie Pads, um die Kopfposition des Teilnehmers in der Kopfspule zu fixieren. Dieser Schritt trägt dazu bei, die Kopfbewegung während der Messung zu reduzieren.
- Verriegeln Sie den oberen Teil der Kopfspule und befestigen Sie den Spiegel an der Kopfspule.
- Geben Sie dem Teilnehmer das Reaktionsgerät und platzieren Sie das Reaktionsgerät entsprechend dem Komfort des Teilnehmers.
- Bitten Sie den Teilnehmer, die Augen zu schließen und die Referenzkopfposition des Teilnehmers zwischen den Augenbrauen mit Laserlicht zu markieren.
- Bewegen Sie den Scannertisch, um die markierte Position in der Mitte der MRT-Bohrung zu platzieren.
- Bestätigen Sie mit dem Teilnehmer, dass er sich in einer bequemen Position befindet und dass er die visuellen Reize, die mit dem Spiegel auf den Bildschirm hinter dem Scanner projiziert werden, sehen kann. Stellen Sie bei Bedarf den Spiegel ein.
4. Datenerfassung
- Bitten Sie den Teilnehmer bei den ersten Scans, die Augen zu schließen und zu versuchen, den Kopf nicht zu bewegen.
- Starten Sie die Messung mit einer Localizer-Impulssequenz. Diese Sequenz wird in der Regel verwendet, um die Schichtposition der anschließend durchgeführten anatomischen und funktionellen Scans (EPI-Sequenz) zu bestimmen.
- Wählen Sie das Sichtfeld (FOV) für den anatomischen Scan mit den folgenden Parametern: TR = 11,5 ms, TE = 5 ms, 176 Schichten ohne Schichtabstand, FOV = 240 x 240 mm2, Matrix = 256 x 256, Flip-Winkel = 18°, mit 1 mm3 isotropen Voxeln. Das Sichtfeld der Sequenz deckt den gesamten Kopf des Teilnehmers ab.
- Das Sichtfeld für den funktionellen Scan (EPI-Sequenz) ist auf die vordere Kommissurlinie/hintere Kommissurlinie (AC-PC-Linie) ausgerichtet. Passen Sie die Position der Slices an, um den Zielbereich von Interesse abzudecken. Die Parameter der Sequenz sind die folgenden: TR = 1,5, FOV = 192 mm, 25 Scheiben, Voxel = 3 mm x 3 mm x 3 mm, Flip-Winkel = 70°.
5. FMRI-Neurofeedback
- Weisen Sie den Teilnehmer darauf hin, dass der Neurofeedback-Lauf beginnt, und wiederholen Sie die zuvor gegebenen Anweisungen (z. B. dass während der Grundlinie ein Block durch ein "+"-Zeichen dargestellt wird).
HINWEIS: Der Teilnehmer muss das Bild auf dem Bildschirm beobachten. Auf der anderen Seite sollten die Teilnehmer während des Regulationsblocks, der durch einen Pfeil nach unten dargestellt wird, versuchen, sich mit einigen kognitiven Strategien von den Begierden zu lösen. Der Geldbetrag, der am Ende jedes Regulierungsblocks angezeigt wird, stellt ihre Leistung dar. Ein höherer Geldbetrag steht für eine bessere Leistung. - Führen Sie den Neurofeedback-Lauf durch, bei dem sich die Basis- und Regulationsblöcke abwechseln (jeweils 30 s; Abbildung 2).
- Führen Sie auf dem Stimulus-Computer die vom Stimulus-Code geschriebene Präsentationssoftware aus, und drücken Sie die Eingabetaste , nachdem Bereit auf dem Bildschirm angezeigt wird. Der Präsentationscode wartet nun auf den Auslöser, um den Neurofeedback-Lauf zu starten.
HINWEIS: Der Code ist synchron mit den TR-Triggern, die vom Scanner kommen. Daher ist es der erste Schritt zur Vorbereitung auf die Durchführung des Neurofeedback-Laufs. - Führen Sie auf dem Analysecomputer die hauseigene MATLAB-Toolbox und den Turbo Brain Voyager (TBV) aus.
- Geben Sie in der MATLAB-Toolbox die für den Teilnehmer spezifischen Informationen ein, z. B. Patienten-ID und Neurofeedback-Laufnummer.
- Klicken Sie auf Protokolldateien generieren , um die Protokolldatei mit den in Schritt 5.5 eingegebenen Informationen vorzubereiten.
HINWEIS: Die Protokolldatei enthält Informationen zum Bedingungstiming (z. B. den Zeitpunkt, zu dem TR eine bestimmte Bedingung beginnen sollte und welcher Stimulus präsentiert werden soll). Es wird sowohl von der MATLAB-Toolbox als auch von TBV verwendet. - Drücken Sie die Schaltfläche execute auf der GUI der MATLAB-Toolbox. Der Code wartet nun darauf, Daten vom TBV zu empfangen.
- Wählen Sie in der TBV die Protokolldatei aus, die in Schritt 5.6 generiert wurde. Wählen Sie außerdem die .roi-Datei aus, die aus den vorherigen Neurofeedback-Sitzungen generiert wurde.
HINWEIS: Die Auswahl einer ROI-Datei ist wichtig, da dadurch ein Absturz der TBV-Software während der Anfangsphase (10 TRs) des Neurofeedback-Laufs vermieden wird. - Bereiten Sie die EPI-Sequenz vor, die auf dem MR-Hostcomputer implementiert werden soll. Drücken Sie die Starttaste im TBV.
- Zeichnen Sie die Ziel-ROIs in der TBV-Software entsprechend den anatomischen Orientierungspunkten neu. Die Form und Größe der Ventrikel im Gehirn werden als Orientierungspunkte für die Auswahl der vorderen Insula verwendet. Darüber hinaus wird die wellenförmige Form der Inselrinde verwendet, um die Voxel genau auszuwählen, die mit der bilateralen vorderen Insula in Verbindung stehen.
- Zeichnen Sie einen ROI auf dem primären motorischen Bereich (M1), wobei der zentrale Sulcus als anatomischer Orientierungspunkt verwendet wird. Der primäre motorische Bereich fungiert als Referenz-ROI, um den Effekt von globalen BOLD-Erhöhungen und BOLD-Fluktuationen aufgrund von Kopfbewegungen zu eliminieren.
- Fragen Sie den Teilnehmer am Ende jeder Neurofeedback-Sitzung: "Welche kognitive Strategie haben Sie während des Regulationsblocks angewendet?". Fragen Sie den Teilnehmer außerdem, wie wohl er sich fühlt und ob er das Experiment fortsetzen möchte oder nicht.
- Wählen Sie nach vier Neurofeedback-Durchläufen den Radiobutton Ja für den Transferlauf.
HINWEIS: Ein Transferlauf ähnelt dem Neurofeedback-Lauf. Die Teilnehmer führen jedoch eine Selbstregulierung ohne Feedback durch. Dies hilft festzustellen, ob die erlernte Selbstregulation auf die Situation übertragen wird, in der der Teilnehmer kein Neurofeedback erhält (z.B. außerhalb des Scanners).
6. Kontrollgruppe
- Die Teilnehmer in der Kontrollgruppe sind auf die gleiche Weise zu instruieren wie die Teilnehmer in der Versuchsgruppe. Geben Sie den Teilnehmern jedoch Yolked-Feedback.
HINWEIS: Bei der Joch-Rückkopplung bleibt die durchschnittliche Menge an Verstärkung (Geld) sowohl in der Versuchs- als auch in der Kontrollgruppe gleich. Der einzige Unterschied zwischen den beiden Gruppen besteht in der Kontingenz des Feedbacks, das den Teilnehmern gegeben wird. Für die Teilnehmer der Kontrollgruppe wird die Gesamtmenge der Verstärkung (Geld) auf die zufällig zugewiesenen 40% der Herunterregulierungsversuche verteilt. In den anderen 60% der Studien erhalten die Teilnehmer jedoch negatives Feedback (null Euro). Die Teilnehmer in der Kontrollgruppe erhalten also kein kontingentes Feedback.
7. Offline-Analyse
- Vorverarbeitung von fMRT-Daten
- Verwenden Sie eine SPM-Toolbox (Statistical Parametric Mapping), um die fMRT-Daten (https://www.fil.ion.ucl.ac.uk/spm/ext/) vorzuverarbeiten.
- Konvertieren Sie die fMRT-Daten im DICOM-Format in das NIFTI-Format mit dem Formatkonvertierungsprogramm der SPM-Batch-Funktion.
- Entfernen Sie die ersten 10 Scans aus den Daten jedes Neurofeedback-Laufs, um Gradientengleichgewichtseffekte zu vermeiden42.
- Führen Sie den Neuausrichtungsprozess durch, um Bewegungsartefakte zu entfernen und alle Volumes am ersten Volume der Sitzung auszurichten. Zusätzlich ist eine Zeitscheibenkorrektur durchzuführen, um die Verzögerung bei der Schichterfassung43 zu kompensieren.
- Durchführung der Segmentierung des anatomischen Scans, der Co-Registrierung der EPI-Sequenzdaten und der anatomischen Daten und der Normalisierung, um die Daten des Probandenraums auf die Standard-Gehirnvorlage44 des Montreal Neurological Institute (MNI) abzubilden.
- Extrahieren Sie mit unserem hauseigenen MATLAB-Code die BOLD-Signale aus würfelförmigen ROIs, die um die MNI-Koordinaten herum erstellt wurden, die der bilateralen anterioren Insula und dem primären motorischen Kortex entsprechen.
- Berechnung der prozentualen Änderung des BOLD-Signals
- Berechnen Sie die prozentuale Änderung des BOLD-Signals basierend auf der durchschnittlichen Änderung des BOLD-Signals für jeden ROI während des Regulierungsblocks im Vergleich zum vorherigen Basisblock. Die Gleichung für die prozentuale Änderung des BOLD-Signals lautet wie folgt:
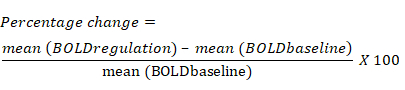
- Berechnen Sie die prozentuale Änderung des BOLD-Signals basierend auf der durchschnittlichen Änderung des BOLD-Signals für jeden ROI während des Regulierungsblocks im Vergleich zum vorherigen Basisblock. Die Gleichung für die prozentuale Änderung des BOLD-Signals lautet wie folgt:
- Analyse des expliziten Rauchverhaltens der Teilnehmer
- Importieren Sie die Antworten der Teilnehmer auf Fragebögen (d. h. QSU-b, VAS-C, CO-Messung und Zigaretten pro Tag) in MATLAB.
- Testen Sie die Normalität der Daten mit einem Kolmogorov-Smirnov-Test aus MATLAB bei einer Stichprobe.
- Ein t-Test mit einer Stichprobe sollte verwendet werden, um die Antworten verschiedener Fragebögen für jeden Teilnehmer zu vergleichen, und ein t-Test mit einer gepaarten Stichprobe, um die Ergebnisse zwischen der Versuchs- und der Kontrollgruppe zu vergleichen.
- Analyse der impliziten Einstellung zu Begierde-auslösenden Hinweisen
- Extrahieren Sie die Reaktionszeit (RT) von affektiven Priming-Versuchen für jeden Teilnehmer aus den von der Präsentationssoftware generierten Protokolldateien.
- Entfernen Sie die Ausreißer basierend auf der RT (d. h. schließen Sie keine Versuche mit einer RT ein, die länger als das 2-fache der Standardabweichung der mittleren RT des Teilnehmers ist).
- Testen Sie die Normalität der Daten mit einem Kolmogorov-Smirnov-Test aus MATLAB bei einer Stichprobe.
- Vergleichen Sie die Herunterregulationseffekte auf die medianen Reaktionszeiten einzigartiger Kombinationen von Primzahlen (Verlangen auslösende und neutrale Bilder) und Zielen (positive und negative Wörter) für jeden Teilnehmer und vergleichen Sie zwischen der Experimental- und der Kontrollgruppe mit einem paarweisen t-Test.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Vier Patienten wurden auf der Grundlage ihrer Ergebnisse im Fragebogen des Fagerström-Tests für Nikotinabhängigkeit (FTND)45 für mittlere Nikotinabhängigkeit (FTND-Score >4) und der Anzahl der täglich gerauchten Zigaretten (>15) rekrutiert. Darüber hinaus wurde sichergestellt, dass die Teilnehmer gemäß den MRT-Sicherheitsmaßnahmen der Einrichtung keine Tätowierungen oder metallischen Implantate trugen. Für jeden Teilnehmer wurden fünf rtfMRT-Sitzungen durchgeführ...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Ergebnisse von vier Teilnehmern zeigen die Möglichkeit für Zigarettenraucher, zu lernen, die Aktivierung in der bilateralen vorderen Insula in Gegenwart eines Verlangens auslösenden Hinweises herunterzuregulieren. Veränderungen im impliziten und expliziten Rauchverhalten nach Neurofeedback-Training bei den Stichprobenteilnehmern könnten mit einer erlernten Herunterregulierung zusammenhängen, da der Teilnehmer im Verlauf des Experiments keine weiteren klinischen oder experimente...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Studie wurde unterstützt von der Comisión Nacional de Investigación Científica y Tecnológica de Chile (Conicyt) durch den Fondo Nacional de Desarrollo Científico y Tecnológico, das Fondecyt Postdoctoral Grant (Nr. 3100648), Fondecyt Regular (Projekte Nr. 1171313 und Nr. 1171320) und CONICYT PIA/Anillo de Investigación en Ciencia y Tecnología ACT172121.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| MATHSWORK | MATLAB version 2014a | ||
| Presentation - Neurobehavioral Systems | Presentation version 18.0 | ||
| Brain Innovation B.V. | Turbo Brain Voyager Version 2.6 or 3.0 |
Referenzen
- Fernandez, T., et al. EEG and behavioral changes following neurofeedback treatment in learning disabled children. Clinical Electroencephalography. 34, 145-152 (2003).
- Scarapicchia, V., Brown, C., Mayo, C., Gawryluk, J. R. Functional Magnetic Resonance Imaging and Functional Near-Infrared Spectroscopy: Insights from Combined Recording Studies. Frontiers in Human Neuroscience. 11, 419(2017).
- Hinault, T., Larcher, K., Zazubovits, N., Gotman, J., Dagher, A. Spatio-temporal patterns of cognitive control revealed with simultaneous electroencephalography and functional magnetic resonance imaging. Human Brain Mapping. , (2018).
- Grech, R., et al. Review on solving the inverse problem in EEG source analysis. Journal of NeuroEngineering and Rehabilitation. 5, 25(2008).
- Van Essen, D. C., et al. The Human Connectome Project: a data acquisition perspective. NeuroImage. 62, 2222-2231 (2012).
- World Health Organization. WHO Report on the Global Tobacco Epidemic, 2017. , Geneva: World Health Organization. (2017).
- Ringlever, L., Otten, R., de Leeuw, R. N., Engels, R. C. Effects of parents' education and occupation on adolescent smoking and the mediating role of smoking-specific parenting and parent smoking. European Addiction Research. 17, 55-63 (2011).
- Malaiyandi, V., Sellers, E. M., Tyndale, R. F. Implications of CYP2A6 genetic variation for smoking behaviors and nicotine dependence. Clinical Pharmacology and Therapeutics. 77, 145-158 (2005).
- Brody, A. L., et al. Neural substrates of resisting craving during cigarette cue exposure. Biological Psychiatry. 62, 642-651 (2007).
- Childress, A. R., et al. Cue reactivity and cue reactivity interventions in drug dependence. NIDA Research Monography. 137, 73-95 (1993).
- Claus, E. D., Kiehl, K. A., Hutchison, K. E. Neural and behavioral mechanisms of impulsive choice in alcohol use disorder. Alcoholism, Clinical and Experimental Research. 35, 1209-1219 (2011).
- Franklin, T. R., et al. Limbic activation to cigarette smoking cues independent of nicotine withdrawal: a perfusion fMRI study. Neuropsychopharmacology. 32, 2301-2309 (2007).
- Grusser, S. M., et al. Cue-induced activation of the striatum and medial prefrontal cortex is associated with subsequent relapse in abstinent alcoholics. Psychopharmacology. 175, 296-302 (2004).
- Buhler, M., et al. Nicotine dependence is characterized by disordered reward processing in a network driving motivation. Biological Psychiatry. 67, 745-752 (2010).
- Bonson, K. R., et al. Neural systems and cue-induced cocaine craving. Neuropsychopharmacology. 26, 376-386 (2002).
- Brody, A. L., et al. Brain metabolic changes during cigarette craving. Archives of General Psychiatry. 59, 1162-1172 (2002).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318, 655-658 (2007).
- Naqvi, N. H., Rudrauf, D., Damasio, H., Bechara, A. Damage to the insula disrupts addiction to cigarette smoking. Science. 315, 531-534 (2007).
- Hollander, J. A., Lu, Q., Cameron, M. D., Kamenecka, T. M., Kenny, P. J. Insular hypocretin transmission regulates nicotine reward. Proceedings of the National Academy of Sciences of the United States of America. 105, 19480-19485 (2008).
- Forget, B., Pushparaj, A., Le Foll, B. Granular insular cortex inactivation as a novel therapeutic strategy for nicotine addiction. Biological Psychiatry. 68, 265-271 (2010).
- Scott, D., Hiroi, N. Deconstructing craving: dissociable cortical control of cue reactivity in nicotine addiction. Biological Psychiatry. 69, 1052-1059 (2011).
- Buczkowski, K., Marcinowicz, L., Czachowski, S., Piszczek, E. Motivations toward smoking cessation, reasons for relapse, and modes of quitting: results from a qualitative study among former and current smokers. Patient Prefer Adherence. 8, 1353-1363 (2014).
- Hughes, J. R., Stead, L. F., Hartmann-Boyce, J., Cahill, K., Lancaster, T. Antidepressants for smoking cessation. Cochrane Database of Systematic Reviews. , CD000031(2014).
- Bedi, G., et al. Incubation of cue-induced cigarette craving during abstinence in human smokers. Biological Psychiatry. 69, 708-711 (2011).
- Bassett, J. F., Dabbs, J. M. Jr A portable version of the go/no-go association task (GNAT). Behavior Research Methods. 37, 506-512 (2005).
- Huijding, J., de Jong, P. J., Wiers, R. W., Verkooijen, K. Implicit and explicit attitudes toward smoking in a smoking and a nonsmoking setting. Addictive Behaviors. 30, 949-961 (2005).
- Sherman, S. J., Rose, J. S., Koch, K., Presson, C. C., Chassin, L. Implicit and explicit attitudes towards cigarette smoking: The effect of context and motivation. Journal of Social and Clinical Psychology. 22, 13-39 (2003).
- Swanson, J. E., Rudman, L. A., Greenwald, A. G. Using the Implicit Association Test to investigate attitude- behavior consistency for stigmatized behavior. Cognition and Emotion. 15, 207-230 (2001).
- Asgaard, G. L., Gilbert, D. G., Malpass, D., Sugai, C., Dillon, A. Nicotine primes attention to competing affective stimuli in the context of salient alternatives. Experimental and Clinical Psychopharmacology. 18, 51-60 (2010).
- Gilbert, D. G., et al. Effects of nicotine on brain responses to emotional pictures. Nicotine & Tobacco Research. 6, 985-996 (2004).
- Czyzewska, M., Graham, R. Implicit and explicit attitudes to high- and low-calorie food in females with different BMI status. Eating Behaviors. 9, 303-312 (2008).
- Gilbert, D. G., Rabinovich, N. E. International smoking images series (with neutral counterparts). , Southern Illinois University: Integrative Neuroscience Laboratory, Department of Psychology. (1999).
- Bandettini, P. A., Wong, E. C., Hinks, R. S., Tikofsky, R. S., Hyde, J. S. Time course EPI of human brain function during task activation. Magnetic Resonance Medicine. 25, 390-397 (1992).
- Goebel, R. BrainVoyager - past, present, future. NeuroImage. 62, 748-756 (2012).
- Poline, J. B., Worsley, K. J., Holmes, A. P., Frackowiak, R. S., Friston, K. J. Estimating smoothness in statistical parametric maps: variability of p values. Journal of Computer Assisted Tomography. 19, 788-796 (1995).
- Johnson, K. A., et al. Intermittent "real-time" fMRI feedback is superior to continuous presentation for a motor imagery task: a pilot study. Journal of Neuroimaging. 22, 58-66 (2012).
- Yoo, S. S., Jolesz, F. A. Functional MRI for neurofeedback: feasibility study on a hand motor task. Neuroreport. 13, 1377-1381 (2002).
- Craig, A. D. How do you feel--now? The anterior insula and human awareness. Nature reviews. Neuroscience. 10, 59-70 (2009).
- Cox, L. S., Tiffany, S. T., Christen, A. G. Evaluation of the brief questionnaire of smoking urges (QSU-brief) in laboratory and clinical settings. Nicotine & Tobacco Research. 3, 7-16 (2001).
- Wewers, M. E., Rachfal, C., Ahijevych, K. A psychometric evaluation of a visual analogue scale of craving for cigarettes. Western Journal of Nursing Research. 12, 672-681 (1990).
- Allen, D. R., Browse, N. L., Rutt, D. L., Butler, L., Fletcher, C. The effect of cigarette smoke, nicotine, and carbon monoxide on the permeability of the arterial wall. Journal of Vascular Surgery. 7, 139-152 (1988).
- Weiskopf, N., et al. Real-time functional magnetic resonance imaging: methods and applications. Magnetic Resonance Imaging. 25, 989-1003 (2007).
- Sladky, R., et al. Slice-timing effects and their correction in functional MRI. NeuroImage. 58, 588-594 (2011).
- Mazziotta, J., et al. A probabilistic atlas and reference system for the human brain: International Consortium for Brain Mapping (ICBM). Philosophical Transactions of the Royal Society of London: Series B, Biological Sciences. 356, 1293-1322 (2001).
- Heatherton, T. F., Kozlowski, L. T., Frecker, R. C., Fagerstrom, K. O. The Fagerstrom Test for Nicotine Dependence: a revision of the Fagerstrom Tolerance Questionnaire. British Journal of Addiction. 86, 1119-1127 (1991).
- Myrick, H., et al. Differential brain activity in alcoholics and social drinkers to alcohol cues: relationship to craving. Neuropsychopharmacology. 29, 393-402 (2004).
- Tapert, S. F., Brown, G. G., Baratta, M. V., Brown, S. A. fMRI BOLD response to alcohol stimuli in alcohol dependent young women. Addictive Behaviors. 29, 33-50 (2004).
- Kilts, C. D., Gross, R. E., Ely, T. D., Drexler, K. P. The neural correlates of cue-induced craving in cocaine-dependent women. American Journal of Psychiatry. 161, 233-241 (2004).
- Li, Q., et al. Assessing cue-induced brain response as a function of abstinence duration in heroin-dependent individuals: an event-related fMRI study. PloS One. 8, e62911(2013).
- Frank, S., Kullmann, S., Veit, R. Food related processes in the insular cortex. Front Hum Neurosci. 7, 499(2013).
- deCharms, R. C., et al. Control over brain activation and pain learned by using real-time functional MRI. Proceedings of the National Academy of Sciences of the United States of America. 102, 18626-18631 (2005).
- Ruiz, S., Birbaumer, N., Sitaram, R. Abnormal Neural Connectivity in Schizophrenia and fMRI-Brain-Computer Interface as a Potential Therapeutic Approach. Frontiers in Psychiatry. 4, 17(2013).
- Habes, I., et al. Pattern classification of valence in depression. NeuroImage. Clinical. 2, 675-683 (2013).
- Li, X., et al. Volitional reduction of anterior cingulate cortex activity produces decreased cue craving in smoking cessation: a preliminary real-time fMRI study. Addiction Biology. 18, 739-748 (2013).
- Lubar, J. F., Swartwood, M. O., Swartwood, J. N., O'Donnell, P. H. Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Biofeedback and Self-Regulation. 20, 83-99 (1995).
- Janssen, T. W., et al. A randomized controlled trial into the effects of neurofeedback, methylphenidate, and physical activity on EEG power spectra in children with ADHD. Journal of Child Psychology and Psychiatry. 57, 633-644 (2016).
- Mayer, K., Wyckoff, S. N., Fallgatter, A. J., Ehlis, A. C., Strehl, U. Neurofeedback as a nonpharmacological treatment for adults with attention-deficit/hyperactivity disorder (ADHD): study protocol for a randomized controlled trial. Trials. 16, 174(2015).
- Gevensleben, H., et al. Distinct EEG effects related to neurofeedback training in children with ADHD: a randomized controlled trial. International Journal of Psychophysiology. 74, 149-157 (2009).
- Ramos-Murguialday, A., et al. Brain-machine interface in chronic stroke rehabilitation: a controlled study. Annals of Neurology. 74, 100-108 (2013).
- Biasiucci, A., et al. Brain-actuated functional electrical stimulation elicits lasting arm motor recovery after stroke. Nature Communication. 9, 2421(2018).
- Du, J., et al. Effects of repetitive transcranial magnetic stimulation on motor recovery and motor cortex excitability in patients with stroke: a randomized controlled trial. European Journal of Neurology. 23, 1666-1672 (2016).
- Ang, K. K., et al. Facilitating effects of transcranial direct current stimulation on motor imagery brain-computer interface with robotic feedback for stroke rehabilitation. Archives of Physical Medicine and Rehabilitation. 96, S79-S87 (2015).
- Wolbrecht, E. T., Chan, V., Reinkensmeyer, D. J., Bobrow, J. E. Optimizing compliant, model-based robotic assistance to promote neurorehabilitation. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 16, 286-297 (2008).
- Sitaram, R., et al. Closed-loop brain training: the science of neurofeedback. Nature Reviews Neuroscience. 18, 86-100 (2017).
- Simkin, D. R., Thatcher, R. W., Lubar, J. Quantitative EEG and neurofeedback in children and adolescents: anxiety disorders, depressive disorders, comorbid addiction and attention-deficit/hyperactivity disorder, and brain injury. Child and Adolescent Psychiatric Clinics of North America. 23, 427-464 (2014).
- Pascual-Marqui, R. D., et al. Assessing interactions in the brain with exact low-resolution electromagnetic tomography. Philosophical transactions: Series A, Mathematical, physical, and engineering sciences. , 3768-3784 (2011).
- Meir-Hasson, Y., Kinreich, S., Podlipsky, I., Hendler, T., Intrator, N. An EEG Finger-Print of fMRI deep regional activation. NeuroImage. 102, 128-141 (2014).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten