A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
فحص الهجرة الصفر وغرفة الجلد السمرة لتحليل في المختبر وفي الجسم الحي للشفاء الجروح
In This Article
Summary
هنا، نقدم بروتوكول احتساء الصفر في المختبر باستخدام الخلايا الليفية الأولية ولإجراء اختبار التئام الجروح في الجلد في الجسم الحي في الفئران. كلا الاختبارين هما طريقتان مباشرتان لتقييم الجروح في المختبر وفي الجسم الحي.
Abstract
يعد ضعف التئام الجروح الجلدية مصدر قلق كبير للمرضى الذين يعانون من مرض السكري والمسنين، وهناك حاجة إلى علاج فعال. الملائمة في المختبر وفي الجسم الحي هي ضرورية لتحديد جزيئات الهدف الجديد لعلاج المخدرات لتحسين عملية التئام الجروح الجلدية. حددنا الوحدة الفرعية β3 من قنوات الكالسيوم المسورة بالجهد (Cavβ3) كجزيء هدف محتمل للتأثير على التئام الجروح في اختبارين مستقلين، أي فحص الهجرة الصفر في المختبر ونموذج غرفة الجلد في الجسم الحي الظهري. الخلايا الليفية الجنينية الأولية (MEFs) معزولة بشكل حاد عن الفئران البرية من النوع (WT) وCavβ3 نقص الفئران (Cavβ3 KO) أو الخلايا الليفية المعزولة بشكل حاد من الفئران WT المعالجة مع siRNA إلى أسفل تنظيم التعبير عن الجين Cacnb3 ، ترميز Cavβ3، تم استخدامها. تم تطبيق خدش على خلية أحادية اللون confluent وأعقب إغلاق الفجوة من قبل التقاط الصور المجهرية في نقاط زمنية محددة حتى إعادة السكان كاملة من الفجوة من قبل الخلايا المهاجرة. تم تحليل هذه الصور، وتم تحديد معدل ترحيل الخلايا لكل حالة. في فحص في الجسم الحي، زرعنا غرفة الجلد الظهرية على الفئران WT وCavβ3 KO، وتطبيق جرح دائري محدد من قطر 2 ملم، وغطت الجرح مع غطاء زجاجي لحمايته من العدوى والجفاف، ورصد إغلاق الجرح العيانية مع مرور الوقت. وكان إغلاق الجرح أسرع بكثير في Cacnb3-الفئران نقص الجينات. لأن نتائج الاختبارات في الجسم الحي والمختبر ترتبط بشكل جيد، قد يكون الفحص في المختبر مفيدة للفحص عالي الإنتاجية قبل التحقق من صحة الضربات في المختبر من قبل نموذج التئام الجروح في الجسم الحي. ما أظهرناه هنا للفئران أو الخلايا التي تعاني من نقص في البراري وCavβ3 قد ينطبق أيضًا على جزيئات محددة غير Cavβ3.
Introduction
يبدأ التئام الجروح الجلدية مباشرة بعد إصابة الجلد من أجل استعادة سلامة الجلد وحماية الكائن الحي من العدوى. عملية التئام الجروح تمر بأربع مراحل متداخلة. التخثر، التهاب، تشكيل الأنسجة الجديدة، وإعادة عرض الأنسجة1. وهجرة الخلايا أمر بالغ الأهمية خلال هذه المراحل. يتم تنشيط الخلايا الالتهابية والخلايا المناعية والخلايا الكيراتينية والخلايا البطانية والخلايا الليفية في نقاط زمنية مختلفة وغزو منطقة الجرح2. طرق التحقيق في التئام الجروح في المختبر وفي الجسم الحي هي ذات أهمية كبيرة ليس فقط لفهم الآليات الكامنة ولكن أيضا لاختبار أدوية جديدة ووضع استراتيجيات جديدة تهدف إلى تحسين وتسريع التئام الجروح الجلد.
لمراقبة وتحليل ترحيل الخلايا، يمكن استخدام فحص ترحيل الخدش. وغالبا ما يشار إليها باسم في المختبر التئام الجروح الاختبار. يتطلب هذا الأسلوب مرفق ثقافة الخلية3. وهو إجراء بسيط، ليست هناك حاجة للمعدات الراقية ويمكن إجراء الفحص في معظم مختبرات بيولوجيا الخلايا. في هذا الفحص، يتم إنشاء منطقة خالية من الخلايا عن طريق التعطيل الميكانيكي لخلية أحادية اللمعة، ويفضل أن تكون خلايا أو ليفية تشبه الظهارية أو البطانية. سيتم ترحيل الخلايا الموجودة على حافة الخدش من أجل إعادة ملء الفجوة التي تم إنشاؤها. والقياس الكمي للمنطقة الخالية من الخلايا المتناقصة مع مرور الوقت يشبه معدل الهجرة ويشير إلى الوقت الذي تحتاج إليه الخلايا لسد الفجوة. لهذا الغرض، يمكن للمحققين استخدام إما خلايا معزولة بشكل حاد من الفئران WT أو الفئران تفتقر إلى جين من الفائدة4، أو الخلايا الخالدة المتاحة من مستودعات الخلايا موثوق بها. يسمح تحليل الصفر بدراسة تأثير المركبات النشطة الدوائية أو تأثير cDNAs أو siRNAs على هجرة الخلايا.
في الجسم الحي، التئام الجروح هو عملية فسيولوجية معقدة، تتطلب أنواع مختلفة من الخلايا بما في ذلك الخلايا الكيراتينية، الخلايا الالتهابية، الخلايا الليفية، الخلايا المناعية والخلايا البطانية من أجل استعادة السلامة البدنية للبشرة في أسرع وقت ممكن1 . وقد وضعت طرق مختلفة للدراسة في التئام الجروح في الجسم الحي واستخدامها في الماضي5و6و7و8. غرفة الجلد الظهرية الموصوفة في هذه المقالة كانت تستخدم سابقا لالتئام الجروح الاختبارات9. يتم استخدامه كإعداد غرفة الجلد الظهرية المعدلة للفئران. نموذج غرفة skinfold المعدلة لديها العديد من المزايا. 1) أنه يقلل من تقلص الجلد، مما يمنع مراقبة عملية التئام الجروح، ويمكن أن تؤثر على إصلاح الجروح في الفئران. 2) هذه الغرفة يجعل من استخدام تغطية الجرح مع غطاء زجاجي، والحد من التهابات الأنسجة والجفاف، والتي يمكن أن تؤخر عملية الشفاء. 3) يمكن رصد تدفق الدم والأوعية الدموية مباشرة. 4) فإنه يسمح التطبيق الموضعي المتكرر للمركبات النشطة الدوائية والكواشف من أجل علاج الجرح وتسريع الشفاء9،10.
حددنا الوحدة الفرعية β3 من قنوات الكالسيوم عالية الجهد المسورة (Cavβ3) كجزيء الهدف المحتمل للتأثير على التئام الجروح الجلد باستخدام بروتوكولين مستقلين، أي، في المختبر فحص الهجرة الصفر ونموذج غرفة الجلد في الجسم الحي الظهري. للاختبار في المختبر، استخدمنا الخلايا الليفية الأولية، وهذه الخلايا لا تعبر عن الجين Cacnb3 ترميز البروتين Cavβ3 ولكن تفتقر إلى إلغاء الاستقطاب الناجمعن Ca2+ تدفق أو التيارات Ca2 + تعتمد على الجهد. وصفنا وظيفة جديدة من Cavβ3 في هذه الخلايا الليفية: Cavβ3 يربط إلى مستقبلات الإينوزيتول 1,4,5-تريسفوسفات (IP3R) والقيود الإفراج عن الكالسيوم من الشبكية endoplasmic. حذف الجين Cacnb3 في الفئران يؤدي إلى زيادة حساسية IP3R لIP3، وتعزيز هجرة الخلايا وزيادة إصلاح الجرح الجلد4.
Protocol
وتمت الموافقة على جميع الإجراءات التجريبية وتنفيذها وفقا للوائح الأخلاقيات ولجان رعاية الحيوان في جامعة سارلاند وسارلاند.
1 [سلّ] أوّليّة ثقافة و [سرنا] [ترنسّكأيشن]
ملاحظة: في الأسلوب الموضح، يتم استخدام الخلايا الليفية الأساسية. هذه الخلايا تلعب دورا حاسما في التئام الجروح وإعادة عرض الأنسجة11. في هذه التجربة، والجينات Cacnb3، ترميز Subunit Cavβ3 من قنوات الكالسيوم عالية الجهد المسور12 كان أسفل التنظيم، وبالتالي تبين دورها في هجرة الخلايا في المختبر وإصلاح الجرح الجلد في الجسم الحي4.
- إعداد siRNA: قبل إعادة تشكيل siRNAs، طرد مركزي لفترة وجيزة الأنابيب لضمان أن المحتوى هو في الجزء السفلي. إعادة تشكيل siRNAs في 100 ميكرولتر RNase خالية العازلة (100 Mخلات البوتاسيوم، 30 MM HEPES، درجة الحموضة 7.5) المقدمة من قبل الشركة المصنعة بتركيز 20 ميكرومتر. هذا هو حل الأسهم من siRNAs.
- Aliquot هذا الحل الأسهم في 10 درجة مئوية لكل أنبوب (تركيز 20 درجة مئوية) وتخزينها في -20 درجة مئوية حتى الاستخدام.
- باستخدام علامة دائمة فائقة الدقة، ضع علامة على لوحة ذات 6 آبار مع خط أفقي في أسفل كل بئر من أجل أن تكون قادرة على تحديد نفس منطقة الصفر من الاهتمام ومتابعة إغلاقها.
ملاحظة: تم استخدام لوحات الثقافة 6-well في هذا التحليل لأنها كبيرة بما فيه الكفاية، لتوفير مساحة كافية والمرونة لتطبيق ثابتة، استنساخ وخدش عمودي باستخدام طرف ماصة 200 ميكرولتر عبر الخلية أحادية الطبقة. إذا كان هناك عدد محدود من الخلايا المتاحة، بديل وربما طريقة فعالة من حيث التكلفة هو استخدام لوحات الثقافة 12-أو 24 جيدا. - لوحة الخلايا الليفية الأولية، معزولة عن الفئران البرية وβ3 نقص4، في لوحة 6 جيدا في كثافة 5 × 105 خلايا / جيدا في وجود 2 مل Dulbecco تعديل النسر المتوسطة (DMEM) تستكمل مع 10٪ مصل البقر الجنيني (FCS).
ملاحظة: تم تأسيس 5 × 105 خلايا لكل بئر للوحة الثقافة 6-جيدا والخلايا الليفية الماوس الأولية. قد تكون هناك حاجة إلى إجراء اختبارات في حالة استخدام لوحات زراعة الخلايا 12 أو 24 بئرًا أو أنواع خلايا أخرى، والتي قد تكون مختلفة في الحجم. وينبغي التعامل مع الخلايا في بيئة معقمة مثل خزائن السلامة البيولوجية من الدرجة الثانية. - قم بتسمية لوحة 6-well مع نوع الخلية والنمط الجيني والتاريخ.
- نقل لوحة 6-جيدا في حاضنة ثقافة الخلية والحفاظ على الخلايا في 37 درجة مئوية و 5٪ CO2 لمدة 24 ساعة.
- في اليوم التالي، تأخذ لوحة للخروج من الحاضنة، يستنشق وسط ثقافة الخلية للخروج من البئر، وتجاهل ذلك واستبداله او استبداله بـ 2.25 مل وسط الثقافة الطازجة بإضافته بعناية ضد جدار البئر.
- من أجل نقل الخلايا الليفية مع siRNAs، استخدم كاشف الانف اللامفيد القائم على الدهون على النحو الموصى به من قبل الشركة المصنعة.
- لكل التغوط، تسمية اثنين من أنابيب الطرد المركزي الجزئي. في أول واحد، إضافة 9 ميكرولتر من كاشف التغوط وتخفيف مع 150 درجة مئوية خفض المصل المتوسطة. في الأنبوب الثاني، إضافة 1.5 ميكرول سيرنا(Cacnb3 siRNA-1، Cacnb3 siRNA-2 أو siRNA سارعت كسيطرة سلبية) وتخفيف مع 150 درجة مئوية خفض المصل المتوسطة.
- يُضاف السيرنا المخفف إلى الأنبوب الذي يحتوي على كاشف مُخفّف للانفال ودوامة لمدة 2 ثوان.
- تسمية الآبار مع إما Cacnb3 siRNA-1، Cacnb3 siRNA-2 أو siRNA سارعت. إضافة 250 درجة مئوية من خليط الكاشف siRNA-transfection إسقاط إلى الخلايا.
- ضع لوحة الثقافة 6-well مرة أخرى في الحاضنة والحفاظ على الخلايا في 37 درجة مئوية و 5٪ CO2 لمدة 72 ساعة.
- من أجل التحقق من كفاءة الإسكات الجينات Cacnb3، وجمع الخلايا المنقولة وإجراء تحليل المناعية كما هو موضح سابقا4.
- إخراج لوحة ثقافة الخلية من الحاضنة وفحص الخلايا تحت المجهر باستخدام الهدف 10X. ابدأ بـ "الخدش" فقط عندما يصل إلى 100% من الملاءمة.
ملاحظة: للتأكد من الدقة والتكرار، 100% الملاءمة عامل إلزامي لبدء اختبار ترحيل الصفر. لذلك، من المهم أن بذر نفس العدد من الخلايا في الآبار الثقافة، لفحص كل بئر للتزامن وتطبيق الصفر في نفس الوقت نقطة (اليوم 0 الملاءمة). الانتظار لفترة أطول بعد الخلايا تصل إلى 100٪ من الملاءمة يمكن أن تثير استجابات مختلفة. - بمجرد أن تصل الخلية إلى الملاءمة 100٪، يستنشق وسط الثقافة من البئر ويتجاهله.
- استخدم طرف ماصة (200 درجة مئوية) لإنشاء عمودي للخدش يدويًا إلى الخط الأفقي الذي تم وضع علامة عليه في أسفل البئر، عبر الطبقة الأحادية للخلايا المتجانسة في منتصف البئر.
- شطف كل جيدا مرتين مع 2 مل الفوسفات المخزنة المالحة (PBS) (137 مل خط البحر، 2.7 مل كيلو كل، 1.5 م/ KH2PO4،8.1 مليون متر Na2HPO4،درجة الحموضة 7.4) لإزالة العوامل المفرج عنها من الخلايا التالفة، والخلايا السائبة، والحطام من المنطقة خدش. إضافة 2 مل من PBS بعناية ضد جدار البئر لتجنب فصل الخلايا من ثقافة الخلية بشكل جيد.
- إضافة 2 مل من خلية ثقافة المتوسطة التي تحتوي إما 10٪ المصل أو 1٪ المصل بعناية إلى كل بئر.
ملاحظة: من المستحسن إجراء تحليل الصفر تحت المصل 10٪ وتحت المصل 1٪ للتأكد من أن التأثير الملاحظ هو سبب انتشار الخلايا والهجرة أو عن طريق هجرة الخلايا فقط. - نقل لوحة إلى مرحلة المجهر والتقاط الصور الميدانية مشرق من منطقة خالية من الخلايا (منطقتين لكل بئر) مباشرة بعد الخدش (t = 0h) في التكبير 10X باستخدام المجهر الخفيف. لتصوير نفس المنطقة من الصفر دائما، استخدم الخط الأفقي، الذي تم إعداده في الخطوة (1.3)، وخذ صورة واحدة فوق هذا الخط وصورة واحدة أسفل هذا الخط. حفظ الصور كـ TIFF أو JPEG.
- لأن مرحلة المجهر لا تحافظ على حالة نمو الخلية، نقل لوحة مرة أخرى إلى حاضنة ثقافة الخلية والحفاظ على الخلايا في 37 درجة مئوية و 5٪ CO2.
- بعد 6 و 10 و 30 ساعة، حرك اللوحة إلى مرحلة المجهر مرة أخرى والتقط الصور بنفس الطريقة الموضحة في الخطوة 2.6.
ملاحظة: تم إنشاء هذه النقاط الزمنية للإجراء الموضح وللالخلايا الليفية الأولية. خلال التجربة التجريبية الأولى، تم اختبار المزيد من النقاط الزمنية لمعرفة مدى سرعة الخلايا الليفية في إعادة ملء الفجوة. على الرغم من أن 0 و 6 و 10 و 30 ساعة هي نقاط وقت بدء معقولة، يجب على المحققين تحسين وتحديد النقاط الزمنية المناسبة لكل تطبيق ولكل نوع من أنواع الخلايا. والبديل الأكثر دقة، إذا كان متاحا، هو استخدام الفحص المجهري بفاصل زمني. - باستخدام ImageJ13،قم بتحديد المنطقة الأولية الخالية من الخلايا (100%). والمنطقة المتبقية بعد 6 و 10 و 30 ح(الشكل 1). ثم يتم حساب النسبة المئوية لمنطقة الخدش التي أعيد تعبئتها بواسطة الخلايا المهاجرة بالنسبة لمنطقة الخدش الأولية.
3. تحليل منطقة الصفر
- فتح ImageJ البرمجيات13.
- قم بتحميل الصورة الأولى كـ JPEG (على سبيل المثال، صور RGB 24 بت 1360x1024) عن طريق إسقاط الصورة في شريط القوائم ImageJ.
- حدد زر التحديدات الحرة ووضع علامة على المنطقة الخالية من الخلايا
- انقر على تحليل وحدد قياس. ستظهر نافذة تحتوي على النتائج تحتوي على قيمة المنطقة.
- نقل هذه القيمة إلى جدول بيانات تحليل.
- كرر الخطوات 3.2-3.5 لكل صورة من نقطة زمنية 0 ساعة ثم ابدأ مرة أخرى للمرة القادمة نقاط 6 و 10 و 30 ساعة.
- حساب النسبة المئوية لمنطقة الخدش المعاد تعبئتها بواسطة الخلايا المهاجرة بعد 6 و10 و30 ساعة لكل خدش باستخدام المعادلة التالية:
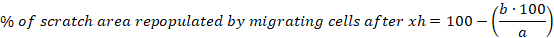
أ = منطقة خالية من الخلايا من الصفر الأولي، ب = منطقة خالية من الخلايا بعد 6 ساعة - حساب متوسط والخطأ القياسي للمتوسط (S.E.M.) للنسبة المئوية لمنطقة الخدش التي تمت إعادة تعبئتها بواسطة الخلايا المهاجرة بعد 6 ح. إظهار البيانات كرسم بياني لشريط الأعمدة أو رسم مبعثر.
4. في الجسم الحي الجلد التئام الجروح التئماف الدراسة
ملاحظة: C57BL/6 الذكور من النوع البري (8-12 أسابيع من العمر مع 22-26 غرام من وزن الجسم) وتستخدم الفئران Cavβ3 ناقص كعنصر تحكم لهذه الدراسة.
- قبل يوم واحد من بدء التجربة، الأوتوكلاف جميع الأدوات الجراحية، ومسامير، والمكسرات وإطارات التيتانيوم لاستخدامها في إعداد غرفة skinfold.
ملاحظة: يتكون إطار التيتانيوم من نصفين متكاملين متماثلين ويحتوي على نافذة مراقبة دائرية حيث سيتم تطبيق الجرح ويتبعه الفحص المجهري (انظر الشكل 2أ). - التخدير الفأر البري أو β3 ناقص (22-26 غرام من وزن الجسم) عن طريق حقن داخل الصفاق (i.p.) من 0.1 مل ملحي /10 غرام من وزن الجسم يحتوي على خليط من الكيتامين (75 ملغ / كغ من وزن الجسم) وxylazine (25 ملغ / كغ من وزن الجسم). تحقق من عمق التخدير بسبب عدم الاستجابة لقرصة اصبع القدم.
ملاحظة: هذه الحقنة يعطي حوالي 30 دقيقة التخدير الجراحي ويجب التحكم في عمق التخدير من خلال العملية الجراحية، عن طريق التحقق من ردود الفعل من الماوس. - لتجنب جفاف أو تلف العينين ، ضع مرهم العيون على كلتا العينين وكرر التطبيق إذا لزم الأمر.
- حلاقة بعناية dorsum الماوس، وذلك باستخدام حلاقة كهربائية تليها تطبيق كريم إزالة الشعر إلى منطقة حلق لإزالة أي الشعر المتبقية. الحرص على عدم إصابة الجلد الماوس. اترك كريم إزالة الشعر لمدة 10 دقائق لإزالة جميع الشعر بالكامل.
- إعداد غرفة التيتانيوم عن طريق اتخاذ جزء واحد من إطار غرفة التيتانيوم متناظرة وإصلاح مسامير ربط مع المكسرات على جانب واحد. هذه المكسرات ستكون بمثابة فاصل للحفاظ على 400-500 ميكرومتر بين الجزأين متناظرة من الغرفة لتجنب ضغط الأوعية الدموية في الجلد.
- إزالة كريم من الجزء الخلفي من الماوس وتنظيف المنطقة خالية من الشعر مع المياه الدافئة (35-37 درجة مئوية).
- تأكد من أن مكان إجراء الجراحة نظيف ودافئ (37 درجة مئوية) ورطب.
- تطهير منطقة خالية من الشعر من الماوس مع مطهر الجلد. تأخذ أضعاف الجلد الخلفي للماوس أمام مصدر الضوء ووضع الخط الأوسط للطبقة المزدوجة من الجلد حيث سيتم زرع غرفة التيتانيوم. بعد ذلك، إصلاح الجلد مع خياطة البولي بروبلين القحفي وcaudally وتشديد الجانب الآخر من خياطة على رف معدني لرفع الجلد مطوية الماوس. ضبط ارتفاع الرف للسماح للماوس للجلوس بشكل مريح.
- زرع غرفة التيتانيوم في أضعاف الجلد الخلفي للماوس بطريقة لساندويتش طبقة الجلد الظهرية مطوية بين النصفين متناظرة من إطار التيتانيوم. قم بإرفاق النصف الأول من إطار التيتانيوم بواسطة غرز البولي بروبلين على أطرافه الفائقة إلى الجزء الخلفي من الجلد الظهري.
ملاحظة: على إطار التيتانيوم، هناك 8 ثقوب على حافة متفوقة(الشكل 2أ)والجلد مطوية ينبغي أن تكون ثابتة بشكل جيد من قبل الغرز البولي بروبلين على كل من الثقوب الثمانية. - قبل الانتقال إلى الخطوة التالية، تحقق من ردود فعل الماوس للتأكد من الحفاظ على عمق التخدير.
- في قاعدة الجلد، وتمرير اثنين من مسامير ربط، تعلق على النصف الأول من غرفة التيتانيوم، لاختراق الجلد من الخلف إلى الجانب الأمامي. جعل شقوق صغيرة على الجلد (باستخدام مقص غرامة) للمساعدة في اختراق سلس من مسامير الاتصال.
- فصل الماوس من الرف ووضعه على موقف جانبي. وضع النصف التكميلي الثاني من غرفة التيتانيوم على رأس مسامير ربط 3 (انظر الشكل 2أ)وتطبيق ضغط طفيف مع الأصابع من أجل تمرير هذه مسامير من خلال النصف الثاني من إطار التيتانيوم. ثم، إصلاح كل من أجزاء متناظرة مع المكسرات الفولاذ المقاوم للصدأ.
- إيلاء اهتمام دقيق لضيق مسامير في هذه الخطوة، لأنه قد فصل، إذا كان فضفاضا جدا. على النقيض من ذلك، إذا كان ضيقا جدا، فإنه سيتم الضغط على الجلد، والحد من تدفق الدم ويمكن أن يؤدي إلى ضعف الأنسجة ونخر.
ملاحظة: المكسرات المعدة في الخطوة 4.5 بمثابة فاصل للحفاظ على مسافة 400-500 ميكرومتر بين النصفين متناظرة من غرفة التيتانيوم. يجب تشديد المكسرات حتى يشعر مقاومة طفيفة. - قطع الجزء المتبقي من مسامير باستخدام كماشة.
ملاحظة: من الضروري في هذه الخطوة لاستخدام نظارات السلامة المختبرية لحماية العين في حالة المسمار يأتي قبالة الطريق الخطأ. - وضع علامة على منطقة الجرح بواسطة لكمة خزعة موحدة (2 مم في القطر)، في وسط الجلد داخل نافذة المراقبة (انظر الشكل 2أ)من غرفة الجلد من أجل ضمان أحجام الجرح القابلة للاستنساخ.
- باستخدام ملقط غرامة ومقص، وخلق جرح دائري داخل المنطقة ملحوظ عن طريق إزالة الجلد الكامل مع البشرة والأدمة. وستكون منطقة الجرح النهائي حوالي 3.5-4.5 مم2،انظر الشكل 2ب. تنظيف الجرح مع 0.5 مل محلول ملحي معقم (0.9٪ حمض الهيدروكلوريك، 37 درجة مئوية).
- قم بتغطية الجرح بغطاء زجاجي وأصلح غطاء زجاجي هذا مع حلقة سريعة باستخدام الزمة الحلقية المفاجئة على غرفة التيتانيوم.
- مباشرة بعد الانتهاء من العملية الجراحية، وضع الماوس على مرحلة التصوير من مجهر مجسم مجهزة بكاميرا واتخاذ الصور (اليوم 0) تحت الإضاءة. استخدم التكبير 40X وحفظ الصور لتحليل هافير خارج الخط في المستقبل.
ملاحظة: ينبغي للمحقق أن يفحص الصور فور التقاطها للتأكد من أن الجودة كافية لإجراء تحليلات غير مباشرة في المستقبل. إعداد غرفة الجلد وأداء جرح الجلد يستغرق حوالي 30 دقيقة. - إبقاء الماوس في مكان دافئ أثناء الانتعاش من التخدير لمدة 2 ساعة على الأقل. بعد ذلك، نقل الفئران في أقفاص فردية مرة أخرى إلى مرفق الحيوان (12 ساعة ضوء / دورة مظلمة) والتأكد من أن الفئران لديها إمكانية الحصول على الغذاء والماء.
- ثلاثة أيام بعد الجرح وضع الماوس في تقييد الماوس وإصلاح restrainer على رأس مرحلة التصوير.
- ضع المسرح تحت مجهر مجسم مجهز بكاميرا. التقاط الصور تحت الإضاءة مع التكبير 40X، وتسجيل جميع الصور وحفظها للتحليلات خارج الخط في المستقبل
- كرر الخطوتين 4.20 و 4.21 مرة أخرى في اليوم 6 و 10 و اليوم 14 بعد الإصابة.
- استخدام صور الجرح، لتحليل خارج الخط في ImageJ13. تعتبر منطقة الجرح في اليوم 0 100٪ ويتم رسم إغلاق الجرح مع مرور الوقت بالنسبة لمنطقة الجرح الأولي. وترد النتائج التمثيلية في الشكل 2ج(د).
- حساب النسبة المئوية (%)( منطقة الجرح في كل نقطة زمنية باستخدام المعادلة التالية:
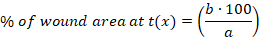
x: نقطة زمنية (اليوم 0 أو 3 أو 10 أو 14): منطقة الجرح في اليوم 0 ب:منطقة الجرح في نقطة زمنية x
النتائج
وقد أجري هذا التخدش على طبقة أحادية من الخلايا المتجانسة من نوع البرية وناقصة β3(الشكل 1ج). بعد إجراء "الصفر" باستخدام طرف ماصة 200 μL، تنتقل الخلايا من كلا النمطين الجيني إلى منطقة الصفر وتسد الفجوة. وقد التقطت الصور بعد 6 و 10 و 30 ح(الشكل 1أ). تم ...
Discussion
في هذه المخطوطة، نصف دراسة في المختبر وفي الجسم الحي للشفاء من الجروح وربط النتائج التي تم الحصول عليها. للفحص في المختبر، استخدمنا الخلايا الليفية الماوس الأولية4،14،15 التي تلعب دورا هاما في التئام الجروح وإعادة عرض الأنسجة11.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
نشكر الدكتورة بيترا فايسجربر ووحدة ترانسجين التابعة للمنشأة الحيوانية لمنتدى جنوب المحيط الهادئ (المشروع P2 من SFB 894) التابعة لكلية الطب والمنشأة الحيوانية في معهد الجراحة السريرية والتجريبية في كلية الطب في جامعة سارلاند، هومبورغ. نشكر الدكتور أندرياس بيك على قراءته النقدية للمخطوطة. تم تمويل هذه الدراسة من قبل وزارة المالية الألمانية Sonderforschungsbereich (SFB) 894، المشروع A3 إلى A.B. و V.F.).
Materials
| Name | Company | Catalog Number | Comments |
| 0.9 % NaCl | |||
| 1 ml syringes | BD Plastipak | 303172 | |
| 6 well plate | Corning | 3516 | |
| Biopsy punch | Kai Industries | 48201 | 2 mm |
| Cacnb3 Mouse siRNA Oligo Duplex (Locus ID 12297) | Origene | SR415626 | |
| Depilation cream | any depilation cream | ||
| Dexpanthenol 5% (BEPANTHEN) | Bayer | 3400935940179.00 | (BEPANTHEN) |
| Dihydroxylidinothiazine hydrochloride (Xylazine) | Bayer Health Care | Rompun 2% | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco by life technologies | 41966-029 | |
| Fetal bovine serum | Gibco by life technologies | 10270-106 | |
| Hexagon full nut | |||
| Ketamine hydrochloride | Zoetis | KETASET | |
| Light microscope | Keyence, Osaka, Japan | BZ-8000 | Similar microscopes might be used |
| Lipofectamine RNAiMAX Transfection Reagent | Thermo Fisher Scientific | 13778075 | |
| Micro-forceps | |||
| Micro-Scissors | |||
| Mouse restrainer | Home-made | ||
| Normal scissors | |||
| Objective | Nikon | plan apo 10x/0.45 | |
| Opti-MEM | Gibco by life technologies | 51985-026 | |
| Polypropylene sutures | |||
| Screwdriver | |||
| Skin disinfectant (octeniderm) | Schülke & Mayr GmbH | 118212 | |
| Slotted cheese head screw | |||
| Snap ring | |||
| Snap ring plier | |||
| Surgical microscope with camera | Leica | Leica M651 | |
| Titanium frames for the skinfold chamber | IROLA | 160001 | Halteblech M |
| Wire piler |
References
- Gurtner, G. C., Werner, S., Barrandon, Y., Longaker, M. T. Wound repair and regeneration. Nature. 453, 314-321 (2008).
- Martin, P. Wound healing--aiming for perfect skin regeneration. Science. 276, 75-81 (1997).
- Gabbiani, G., Gabbiani, F., Heimark, R. L., Schwartz, S. M. Organization of actin cytoskeleton during early endothelial regeneration in vitro. Journal of Cell Science. 66, 39-50 (1984).
- Belkacemi, A., et al. IP3 Receptor-Dependent Cytoplasmic Ca(2+) Signals Are Tightly Controlled by Cavbeta3. Cell Reports. 22, 1339-1349 (2018).
- Breuing, K., Eriksson, E., Liu, P., Miller, D. R. Healing of partial thickness porcine skin wounds in a liquid environment. Journal of Surgical Research. 52, 50-58 (1992).
- Colwell, A. S., Krummel, T. M., Kong, W., Longaker, M. T., Lorenz, H. P. Skin wounds in the MRL/MPJ mouse heal with scar. Wound Repair and Regeneration. 14, 81-90 (2006).
- Vagesjo, E., et al. Accelerated wound healing in mice by on-site production and delivery of CXCL12 by transformed lactic acid bacteria. Proceedings National Academy of Science. 115, 1895-1900 (2018).
- Eming, S. A., et al. Accelerated wound closure in mice deficient for interleukin-10. American Journal of Pathology. 170, 188-202 (2007).
- Sorg, H., Krueger, C., Vollmar, B. Intravital insights in skin wound healing using the mouse dorsal skin fold chamber. Journal of Anatomy. 211, 810-818 (2007).
- Laschke, M. W., Vollmar, B., Menger, M. D. The dorsal skinfold chamber: window into the dynamic interaction of biomaterials with their surrounding host tissue. European Cell and Materials. 22, 147-164 (2011).
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2, 2369-2392 (2012).
- Hofmann, F., Belkacemi, A., Flockerzi, V. Emerging Alternative Functions for the Auxiliary Subunits of the Voltage-Gated Calcium Channels. Current Molecular Pharmacology. 8, 162-168 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Chen, L., et al. Protein 4.1G Regulates Cell Adhesion, Spreading, and Migration of Mouse Embryonic Fibroblasts through the beta1 Integrin Pathway. Journal of Biological Chemistry. 291, 2170-2180 (2016).
- Dewor, M., et al. Macrophage migration inhibitory factor (MIF) promotes fibroblast migration in scratch-wounded monolayers in vitro. FEBS Letters. 581, 4734-4742 (2007).
- Handly, L. N., Wollman, R. Wound-induced Ca(2+) wave propagates through a simple release and diffusion mechanism. Molecular Biology of the Cell. 28, 1457-1466 (2017).
- Cappiello, F., Casciaro, B., Mangoni, M. L. A Novel In Vitro Wound Healing Assay to Evaluate Cell Migration. Journal of Visualized Experiments. (133), 56825 (2018).
- Hernandez Vera, R., Schwan, E., Fatsis-Kavalopoulos, N., Kreuger, J. A Modular and Affordable Time-Lapse Imaging and Incubation System Based on 3D-Printed Parts, a Smartphone, and Off-The-Shelf Electronics. PLoS One. 11, 0167583 (2016).
- Reinhart-King, C. A. Endothelial cell adhesion and migration. Methods in Enzymology. 443, 45-64 (2008).
- Treloar, K. K., Simpson, M. J. Sensitivity of edge detection methods for quantifying cell migration assays. PLoS One. 8, 67389 (2013).
- Pirkmajer, S., Chibalin, A. V. Serum starvation: caveat emptor. American Journal of Physiology-Cell Physioliology. 301, 272-279 (2011).
- Papenfuss, H. D., Gross, J. F., Intaglietta, M., Treese, F. A. A transparent access chamber for the rat dorsal skin fold. Microvascular Research. 18, 311-318 (1979).
- Deoliveira, D., et al. An ear punch model for studying the effect of radiation on wound healing. International Journal of Radiation Biology. 87, 869-877 (2011).
- Chen, L., Mirza, R., Kwon, Y., DiPietro, L. A., Koh, T. J. The murine excisional wound model: Contraction revisited. Wound Repair and Regeneration. 23, 874-877 (2015).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiment. (75), e50265 (2013).
- Wahedi, H. M., Park, Y. U., Moon, E. Y., Kim, S. Y. Juglone ameliorates skin wound healing by promoting skin cell migration through Rac1/Cdc42/PAK pathway. Wound Repair and Regeneration. 24, 786-794 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved