Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Царапина Миграция Анализ и Dorsal Skinfold камеры для in Vitro и In Vivo Анализ раны исцеления
В этой статье
Резюме
Здесь мы представляем протокол для анализа в пробирке нуля с использованием первичных фибробластов и для in vivo кожи раны заживления анализа у мышей. Оба анализа являются простыми методами для оценки in vitro и in vivo заживления ран.
Аннотация
Нарушение кожного заживления ран является серьезной проблемой для пациентов, страдающих диабетом и для пожилых людей, и есть необходимость в эффективном лечении. Соответствующие подходы in vitro и in vivo необходимы для идентификации новых молекул-мишеней для лечения лекарственными препаратами для улучшения процесса заживления ран. Мы определили субъединицу кальциевых каналов с напряжением,загнанные в напряжение (Каве3) в качестве потенциальной целевой молекулы, способной влиять на заживление ран в двух независимых анализах, т.е. в анализе миграции в пробирке и модели камеры in vivo dorsal skinfold. Первичные мыши эмбриональных фибробластов (MEFs) остро изолированы от дикого типа (WT) и Cav3-дефицитныхмышей (CavNo3 KO) или фибробластов остро изолированы от WT мышей, обработанных siRNA для снижения регулирования экспрессии гена Cacnb3 , кодирование CavNo3, были использованы. Царапина была применена на монослой соединительных клеток, и за закрытием разрыва последовало получение микроскопических изображений в определенных временных точках до полного перераспределения разрыва мигрирующими клетками. Эти изображения были проанализированы, и скорость миграции клеток была определена для каждого состояния. В in vivo анализ, мы имплантировали царской кожи камеры на WT и Cav'3 KO мышей, применяется определенная круговая рана 2 мм диаметром, покрыл рану стеклянным крышкой, чтобы защитить его от инфекций и высыхания, и мониторинг макроскопической замыкания раны с течением времени. Закрытие ран было значительно быстрее у мышей Cacnb3-генно-дефицитных. Потому что результаты in vivo и in vitro assays коррелируют хорошо, анализ in vitro может быть полезен для скрининга высокой пропускной способностью перед проверкой in vitro хитов по модели заживления ран In vivo. То, что мы показали здесьдля диких типа и Cav 3-дефицитных мышей или клеток также может быть применимо к конкретным молекулам, кроме Cav'3.
Введение
Заживление ран ы кожи начинается сразу после повреждения кожи, чтобы восстановить целостность кожи и защитить организм от инфекций. Процесс заживления ран проходит через четыре перекрывающиеся фазы; коагуляция, воспаление, формирование новых тканей и ремоделированиетканей 1. Миграция ячеек имеет решающее значение на этих этапах. Воспалительные клетки, иммунные клетки, кератиноциты, эндотелиальные клетки и фибробласты активируются в разное время и вторгаются в рануобласти 2. Методы исследования заживления ран in vitro и in vivo представляют большой интерес не только для понимания основных механизмов, но и для тестирования новых препаратов и разработки новых стратегий, направленных на улучшение и ускорение заживления ран ы.
Для мониторинга и анализа миграции клеток можно использовать анализ миграции царапин. Это часто называют in vitro раны заживления анализа. Этот метод требует объекта культуры клеток3. Это простая процедура, нет необходимости в высококачественном оборудовании и анализ может быть выполнен в большинстве лабораторий клеточной биологии. В этом ассоциировании область, свободная от клеток, создается механическим нарушением монослойной клеток, предпочтительно эпителиальных или эндотелиальных клеток или фибробластов. Клетки на краю нуля будут мигрировать для того, чтобы заселить созданный пробел. Количественная оценка уменьшающейся области, свободной от клеток, со временем напоминает скорость миграции и указывает время, которое ячейки должны закрыть разрыв. Для этой цели, исследователи могут использовать либо остро изолированных клеток из WT мышей или мышей, не имеющих гена интереса4, или увековеченные клетки, доступные из надежных хранилищ клеток. Анализ царапин позволяет изучать влияние фармакологически активных соединений или влияние трансинфицированных cDNA или siRNAs на миграцию клеток.
In vivo, заживление ран является сложным физиологическим процессом, требующим различных типов клеток, включая кератиноциты, воспалительные клетки, фибробласты, иммунные клетки и эндотелиальные клетки для того, чтобы восстановить физическую целостность кожи как можно быстрее1 . Различные методы для изучения in vivo заживление ран были разработаны и используются в прошлом5,6,7,8. Дорсальная камера скожа, описанная в этой статье, ранее использовалась для анализов заживления ран9. Он используется в качестве модифицированного складной шкуры подготовки к коже для мышей. Модифицированная модель камеры для стежков имеет ряд преимуществ. 1) Это сводит к минимуму сокращение кожи, что предотвращает наблюдение за процессом заживления ран и может повлиять на восстановление рану у мышей. 2) Эта камера использует покрытие раны со стеклянным покрыванием, снижение инфекций тканей и высыхания, которые могут задержать процесс заживления. 3) Поток крови и васкуляризация могут непосредственно контролироваться. 4) Это позволяет повторяющиеся актуальные применения фармакологически активных соединений и реагентов для того, чтобы лечить рану и ускорить заживление9,10.
Мы определили субъединики высокого напряжения-gated кальциевых каналов (Cav'3) в качестве потенциальной целевой молекулы, чтобы влиять на заживление раны кожи с помощью двух независимых протоколов, т.е. в пробирке нуля миграции анализа и in vivo дорсальный кожной камеры модели. Для анализа in vitro, мы использовали первичные фибробласты, эти клетки выражают ген Cacnb3, кодирующий белок Cav'3, но не имеют деполяризации индуцированной Ca2 "приток или напряжение-зависимых Токов Ca2 ". Мы описали новую функцию Cav'3 в этих фибробластах: Каве3 связывается с инозитол1,4,5-трисфосфатный рецептор (IP3R) и ограничения кальция релиз из эндоплазмической ретикулума. Удаление гена Cacnb3 у мышей приводит к повышенной чувствительности IP3R для IP3, усиленной миграции клеток и увеличению ремонта раны кожи4.
протокол
Все экспериментальные процедуры были утверждены и проведены в соответствии с правилами этики и комитетами по защите животных Саарландского и Саарского университетов.
1 Первичная культура клеток и трансфекция siRNA
ПРИМЕЧАНИЕ: В описанном методе используются первичные фибробласты. Эти клетки играют решающую роль в заживлении ран и ремоделирования тканей11. В этом эксперименте, ген Cacnb3, кодируя подразделение Cav'3 высоковольтных закрытых кальциевых каналов12 было вниз-регулируется, тем самым показывая свою роль в миграции клеток в пробирке и ремонте раны кожи в vivo4.
- Подготовка siRNA: Перед восстановлением siRNAs, кратко центрифуги труб, чтобы убедиться, что содержание находится на дне. Восстановите siRNAs в 100 l RNase-свободнобуфер (100 mM ацетат калия, 30 mM HEPES, pH 7.5) обеспеченный изготовлением на концентрации 20 мкм. Это акционерное решение siRNAs.
- Aliquot этот запас раствор на 10 qL на трубку (20 мКм концентрации) и хранить при -20 градусов до использования.
- Используя ультратонкий перманентный маркер, отметьте 6-ну колодую пластину с горизонтальной линией в нижней части каждой скважины, чтобы иметь возможность всегда определить одну и ту же область царапин, представляющих интерес, и следить за ее закрытием.
ПРИМЕЧАНИЕ: 6-хорошо культуры пластин были использованы в этом ассее, потому что они достаточно велики, чтобы обеспечить достаточно места и гибкости, чтобы применить последовательный, воспроизводимый и вертикальный нуля с помощью 200 л пипетки отзыв через монослой ячейки. Если доступно ограниченное число ячеек, то альтернативным и, вероятно, экономичным способом было бы использование 12- или 24-колодцев культуры. - Плита первичных фибробластов, изолированных от дикого типа и No 3-дефицитных мышей4, в 6-колодцов пластины при плотности 5 х 105 клеток / хорошо в присутствии 2 мл Dulbecco в модифицированных Eagle в среде (DMEM) дополнены 10% сыворотки крупного рогатого скота (FCS).
ПРИМЕЧАНИЕ: 5 х 105 5 клеток на хорошо была создана для 6-хорошо культуры пластины и для первичных фибробластов мыши. Тесты могут быть необходимы, если с помощью 12- или 24-хорошо клеточной культуры пластин или других типов клеток, которые могут быть различными по размеру. Клетки должны обрабатываться в стерильной среде, такой как биологическая безопасность шкафов класса II. - Пометьте 6-колодецную пластину клеточного типа, генотипа и даты.
- Переместите 6-хорошую пластину в инкубатор клеточной культуры и поддерживайте клетки при 37 градусах по Цельсию и 5% CO2 на 24 ч.
- На следующий день, возьмите пластину из инкубатора, аспирировать среды клеточной культуры из колодца, отбросить его и заменить его 2,25 мл свежей среде культуры, добавив его тщательно к стене колодца.
- Для того, чтобы трансфектировать фибробласты с siRNAs, используйте липидный трансфекционный реагент, как это рекомендовано производителем.
- Для каждого трансфекции, этикетка две микроцентрифуги труб. В первом, добавить 9 л трансфекционного реагента и разбавить его 150 л уменьшенной среде сыворотки. Во второй трубке добавьте 1,5 зЛ siRNA(Cacnb3 siRNA-1, Cacnb3 siRNA-2 или scrambled siRNA в качестве отрицательного контроля) и разбавьте ее с пониженной сывороткой 150 л.
- Добавьте разбавленную siRNA в трубку, содержащую разбавленный трансфекционный реагент и вихрь в течение 2 с. Инкубировать смесь в течение 5 мин при 21 градусов по Цельсию.
- Этикетка скважин либо Cacnb3 siRNA-1, Cacnb3 siRNA-2 или скремблированный siRNA. Добавьте в клетки 250 кЛ смеси реагента siRNA-transfection.
- Поместите 6-колодую культурную пластину обратно в инкубатор и держите клетки при 37 градусах по Цельсию и 5% CO2 на 72 ч.
- Для того, чтобы проверить эффективность заглушения гена Cacnb3, собирать трансинфицированные клетки и выполнять иммуноблотный анализ, как описано ранее4.
2. In vitro раны заживления анализ (царапина миграции анализ)
- Возьмите пластины культуры клеток из инкубатора и изучить клетки под микроскопом с помощью 10x цели. Начните с нуля асссеможно только тогда, когда они достигли 100% выпуклости.
ПРИМЕЧАНИЕ: Для точности и воспроизводимости, 100% сложение является обязательным фактором для начала скретч-миграционных исследований. Поэтому важно сеять одинаковое количество клеток в культурные колодцы, исследовать каждую скважину на случай стыковки и применять царапину в одно и то же время (день 0. Ожидание дольше после того, как клетки достигнут 100% стопроцентности может вызвать различные ответы. - Как только клетка достигает 100% вспухить, аспирируйте среду культуры из наилучшим образом и отбрасываете ее.
- Используйте наконечник пипетки (200 л), чтобы вручную создать повертичную царапину к горизонтальной линии, отмеченной в нижней части скважины, поперек монослойа сольственных ячеек в середине скважины.
- Промыть каждую скважину дважды с 2 мл фосфат-буферного сосудистого (PBS) (137 мМ NaCl, 2,7 мМ KCl, 1,5 мМ KH2PO4, 8,1 мМ Na2HPO4, рН 7,4) для удаления высвобожденных факторов из поврежденных клеток, свободных клеток и мусора из поцарапанной области. Добавить 2 мл PBS тщательно против стены колодца, чтобы избежать отсоединения клеток от клеточной культуры хорошо.
- Добавьте 2 мл среды клеточной культуры, содержащей либо 10% сыворотки или 1% сыворотки тщательно каждый колодец.
ПРИМЕЧАНИЕ: Рекомендуется выполнять царапины под 10% сыворотки и менее 1% сыворотки, чтобы подтвердить, что наблюдаемый эффект вызван пролиферации клеток и миграции или только клеточной миграции. - Переместите пластину на стадию микроскопа и захватите яркие полевые изображения области, свободной от клеток (две области на скважину) сразу после царапин (t'0h) при 10-кратным увеличением с помощью светового микроскопа. Чтобы отобразить всегда одну и ту же область нуля, используйте горизонтальную линию, которая была подготовлена в шаге (1.3), и возьмите одно изображение над этой линией и одно изображение ниже этой линии. Сохранение изображений как TIFF или JPEG.
- Поскольку стадия микроскопа не поддерживает состояние роста клеток, переместите пластину обратно в инкубатор клеточной культуры и держите клетки на уровне 37 градусов по Цельсию и 5% CO2.
- После 6, 10 и 30 ч, переместить пластину на стадии микроскопа снова и захватить изображения так же, как описано в шаге 2.6.
ПРИМЕЧАНИЕ: Эти временные точки были установлены для описанной процедуры и для первичных фибробластов. В ходе первого экспериментального эксперимента было проверено больше временных точек, чтобы увидеть, как быстро фибробласты заселяют этот пробел. Хотя 0, 6, 10 и 30 ч являются разумными точками начала, исследователи должны оптимизировать и установить соответствующие временные точки для каждого приложения и для каждого типа ячейки. Более точной альтернативой, если она имеется, было бы использование замедленной микроскопии. - Использование ImageJ13,количественно первоначальной области, свободной от клеток (100%) а остальная площадь после 6, 10 и 30 ч(рисунок 1). Процент области царапин, заселенной мигрирующими ячейками, затем рассчитывается по отношению к исходной области нуля.
3. Анализ области царапин
- Открытое программное обеспечение ImageJ13.
- Загрузите первое изображение как JPEG (например, 24-разрядные изображения RGB 1360x1024), сбросив изображение в панель меню ImageJ.
- Выберите кнопку freehand и пометьте область без ячейки
- Нажмите на анализ и выберите меру. Появится окно с результатами, содержащее значение области.
- Перенесите это значение в таблицу анализа.
- Повторите шаги 3.2-3.5 для каждого изображения из точки времени 0 ч, а затем начните снова в следующий раз точки 6, 10 и 30 ч.
- Рассчитайте процент области нуля, заселенной мигрирующими ячейками после 6, 10 и 30 ч для каждой царапины, используя следующее уравнение:
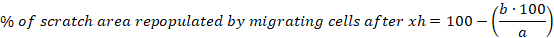
a - свободная область ячейки первоначальной царапины, b и свободная область ячейки после 6 ч - Рассчитайте среднее и стандартную ошибку среднего (S.E.M.) для процента области нуля, заселенной мигрирующими ячейками после 6 ч. Отображение данных в виде графика столбца или участка рассеяния.
4. In vivo кожи раны заживления асссек
ПРИМЕЧАНИЕ: C57BL/6 диких типа мужчин (8-12 недель с 22-26 г массы тела) и Cav'3-дефицитных мышей в качестве контроля используются для этого исследования.
- За день до начала эксперимента, автоклавировать все хирургические инструменты, винты, гайки и титановые рамы, которые будут использоваться для подготовки скин-фолк камеры.
ПРИМЕЧАНИЕ: Титановая рама состоит из двух симметричных дополнительных половинок и имеет круглое окно наблюдения, где рана будет применяться с последующей микроскопией (см. рисунок 2a). - Анестезия дикого типа или 3-дефицитной мыши (22-26 г массы тела) путем интраперитонеальной (т.р.) инъекции 0,1 мл солевых/10 г массы тела, содержащей смесь кетамина (75 мг/кг массы тела) и ксилазина (25 мг/кг массы тела). Проверьте глубину анестезии на отсутствие реакции на щепотку ног.
ПРИМЕЧАНИЕ: Эта инъекция дает около 30 мин хирургической анестезии и глубина анестезии должны контролироваться с помощью хирургической процедуры, путем проверки рефлексов мыши. - Чтобы избежать сухости или повреждения глаз, нанесите офтальмологическую мазь на оба глаза и при необходимости повторите применение.
- Тщательно побрить на курьесную цуп, используя электрическую бритву с последующим применением крема для депиляции в бритую область, чтобы удалить оставшиеся волосы. Позаботьтесь, чтобы не травмировать кожу мыши. Оставьте крем для депиляции около 10 минут, чтобы полностью удалить все волосы.
- Подготовьте титановую камеру, взяв одну часть симметричной титановой камеры и зафиксируя соединительные винты с гайками с одной стороны. Эти орехи будут служить в качестве прокладки держать 400-500 мкм между двумя симметричными частями камеры, чтобы избежать сжатия кровеносных сосудов в коже.
- Снимите крем с задней части мыши и очистите область без волос теплой (35-37 градусов по Цельсию) водопроводной водой.
- Убедитесь, что место для проведения операции чистое, теплое (37 градусов по Цельсию) и увлажнено.
- Дезинфекция без волос области мыши с дезинфицирующей кожи. Возьмите складку задней кожи мыши перед источником света и положение средней линии двойного слоя кожи, где титановая камера будет имплантирована. После этого, исправить скин с полипропиленовым швом черепно и caudally и затяните другую сторону шва на металлической стойке, чтобы поднять мышь сложенной кожи. Отрегулируйте высоту стойки, чтобы мышь удобно сидела.
- Имплантировать титановую камеру в складку задней кожи мыши таким образом, чтобы сэндвич сложенный слой спинной кожи между двумя симметричными половинками титановой рамы. Прикрепите первую половину титановой рамы полипропиленовыми швами на ее верхнем краю к задней части спинной кожи.
ПРИМЕЧАНИЕ: На титановой раме, Есть 8 отверстий на верхнем краю(Рисунок 2)и сложенная кожа должна быть хорошо зафиксирована полипропиленовые швы на каждом из восьми отверстий. - Перед переходом к следующему шагу, проверьте рефлексы мыши, чтобы убедиться, что глубина анестезии сохраняется.
- У основания скин-складки пройдите два соединительных винта, прикрепленных к первой половине титановой камеры, чтобы проникнуть в скин-фолд со спины к передней стороне. Сделайте небольшие разрезы на коже (с помощью тонких ножниц), чтобы помочь плавному проникновению соединительных винтов.
- Отсоедините мышь от стойки и поместите ее на боковое положение. Положите вторую дополнительную половину титановой камеры поверх 3 соединительных винтов (см. Рисунок 2а)и нанесите небольшое давление пальцами, чтобы пройти эти винты через вторую половину титановой рамы. Затем, исправить обе симметричные части с орехами из нержавеющей стали.
- Обратите пристальное внимание на герметичность винтов на этом этапе, так как он может отделить, если он слишком свободен. В отличие от этого, если он слишком туго, он будет сжимать кожу, уменьшить приток крови и может привести к ухудшению тканей и некроза.
ПРИМЕЧАНИЕ: Орехи, приготовленные в шаге 4.5, служат в качестве прокладки для того, чтобы держать расстояние 400-500 мкм между двумя симметричными половинками титановой камеры. Орехи следует затянуть до тех пор, пока не будет ощущаться небольшое сопротивление. - Вырежьте оставшуюся часть винтов с помощью плоскогубцев.
ПРИМЕЧАНИЕ: Необходимо на этом шаге использовать лабораторные защитные очки для защиты глаз в случае, если винт сходит не в ту сторону. - Отметьте область раны стандартизированным бивней биопсии (2 мм в диаметре), в центре кожи в окне наблюдения (см. Рисунок 2a)камеры скобами для того, чтобы обеспечить воспроизводимые размеры ран.
- Используя тонкие щипцы и ножницы, создайте круговую рану в отмеченной области, удалив полную кожу с эпидермисом и дермой. Окончательная площадь раны составит около 3,5-4,5 мм2,см. Рисунок 2b. Очистите рану стерильным сольником 0,5 мл (0,9% NaCl, 37 градусов по Цельсию).
- Обложка раны со стеклянным крышкой и исправить это стекло coverslip с оснастки кольцо с помощью плоскогубца оснастки кольцо на титановой камере.
- Сразу после окончания хирургической процедуры поместите мышь на этап визуализации стереомикроскопа, оснащенного камерой, и снимайте снимки (день 0) под освещением. Используйте увеличение 40X и сохраните изображения для будущего автономного анализа.
ПРИМЕЧАНИЕ: Следователь должен изучить изображения сразу после захвата, чтобы убедиться, что качество достаточно для будущего автономного анализа. Подготовка камеры для стежков и производительность раны кожи занимает около 30 минут. - Держите мышь в теплом месте во время восстановления после анестезии, по крайней мере 2 ч. После этого, передача мышей в отдельных клетках обратно на объект животных (12 ч свет / темный цикл) и убедитесь, что мыши имеют доступ к пище и воде.
- Три дня после ранения место мыши в мышь-ограничитель и исправить удерживающий на верхней части стадии изображения.
- Поместите сцену под стереомикроскоп, оснащенный камерой. Возьмите изображения под освещением с 40-кратным увеличением, запишите все фотографии и сохраните их для будущих автономных анализов
- Повторите шаги 4.20 и 4.21 снова в день 6, 10 и день 14 после ранения.
- Используйте изображения ран, для автономного анализа в ImageJ13. Область раны в день 0 считается 100% и замыкания раны с течением времени накладываются относительно первоначальной области раны. Результаты представительи показаны на рисунке 2c,d.
- Рассчитать процент (%) раневой области в каждый момент времени с использованием следующего уравнения:
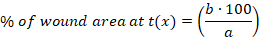
x: время (день 0, 3, 10 или 14), :область раны в день 0, b: область раны в точке времени x
Результаты
Царапина была проведена на слияние клеток монослой дикого типа и No 3-дефицитных MEFs(Рисунок 1c). После выполнения "царапины" с помощью наконечника пипетки 200 л, клетки из обоих генотипов мигрируют в область нуля и закрывают зазор. Изображения были сделаны после 6, 10 ?...
Обсуждение
В этой рукописи мы описываем in vitro и in vivo анализ заживления ран и соотносим полученные результаты. Для анализа in vitro мы использовали первичныефибробласты мыши4,14,15, которые играют важную роль в заживлении ран и ремоделирования тканей...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим д-ра Петру Вайсгербер и подразделение Transgene животного комплекса SPF (проект P2 SFB 894) медицинского факультета и животное в Институте клинической и экспериментальной хирургии на медицинском факультете Саарлендского университета в Хомбурге. Мы благодарим доктора Андреаса Бека за критическое чтение рукописи. Это исследование было профинансировано Deutsche Forschungsgemeinschaft (DFG) Sonderforschungsbereich (SFB) 894, проектом A3 для A.B. и V.F.).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9 % NaCl | |||
| 1 ml syringes | BD Plastipak | 303172 | |
| 6 well plate | Corning | 3516 | |
| Biopsy punch | Kai Industries | 48201 | 2 mm |
| Cacnb3 Mouse siRNA Oligo Duplex (Locus ID 12297) | Origene | SR415626 | |
| Depilation cream | any depilation cream | ||
| Dexpanthenol 5% (BEPANTHEN) | Bayer | 3400935940179.00 | (BEPANTHEN) |
| Dihydroxylidinothiazine hydrochloride (Xylazine) | Bayer Health Care | Rompun 2% | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco by life technologies | 41966-029 | |
| Fetal bovine serum | Gibco by life technologies | 10270-106 | |
| Hexagon full nut | |||
| Ketamine hydrochloride | Zoetis | KETASET | |
| Light microscope | Keyence, Osaka, Japan | BZ-8000 | Similar microscopes might be used |
| Lipofectamine RNAiMAX Transfection Reagent | Thermo Fisher Scientific | 13778075 | |
| Micro-forceps | |||
| Micro-Scissors | |||
| Mouse restrainer | Home-made | ||
| Normal scissors | |||
| Objective | Nikon | plan apo 10x/0.45 | |
| Opti-MEM | Gibco by life technologies | 51985-026 | |
| Polypropylene sutures | |||
| Screwdriver | |||
| Skin disinfectant (octeniderm) | Schülke & Mayr GmbH | 118212 | |
| Slotted cheese head screw | |||
| Snap ring | |||
| Snap ring plier | |||
| Surgical microscope with camera | Leica | Leica M651 | |
| Titanium frames for the skinfold chamber | IROLA | 160001 | Halteblech M |
| Wire piler |
Ссылки
- Gurtner, G. C., Werner, S., Barrandon, Y., Longaker, M. T. Wound repair and regeneration. Nature. 453, 314-321 (2008).
- Martin, P. Wound healing--aiming for perfect skin regeneration. Science. 276, 75-81 (1997).
- Gabbiani, G., Gabbiani, F., Heimark, R. L., Schwartz, S. M. Organization of actin cytoskeleton during early endothelial regeneration in vitro. Journal of Cell Science. 66, 39-50 (1984).
- Belkacemi, A., et al. IP3 Receptor-Dependent Cytoplasmic Ca(2+) Signals Are Tightly Controlled by Cavbeta3. Cell Reports. 22, 1339-1349 (2018).
- Breuing, K., Eriksson, E., Liu, P., Miller, D. R. Healing of partial thickness porcine skin wounds in a liquid environment. Journal of Surgical Research. 52, 50-58 (1992).
- Colwell, A. S., Krummel, T. M., Kong, W., Longaker, M. T., Lorenz, H. P. Skin wounds in the MRL/MPJ mouse heal with scar. Wound Repair and Regeneration. 14, 81-90 (2006).
- Vagesjo, E., et al. Accelerated wound healing in mice by on-site production and delivery of CXCL12 by transformed lactic acid bacteria. Proceedings National Academy of Science. 115, 1895-1900 (2018).
- Eming, S. A., et al. Accelerated wound closure in mice deficient for interleukin-10. American Journal of Pathology. 170, 188-202 (2007).
- Sorg, H., Krueger, C., Vollmar, B. Intravital insights in skin wound healing using the mouse dorsal skin fold chamber. Journal of Anatomy. 211, 810-818 (2007).
- Laschke, M. W., Vollmar, B., Menger, M. D. The dorsal skinfold chamber: window into the dynamic interaction of biomaterials with their surrounding host tissue. European Cell and Materials. 22, 147-164 (2011).
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2, 2369-2392 (2012).
- Hofmann, F., Belkacemi, A., Flockerzi, V. Emerging Alternative Functions for the Auxiliary Subunits of the Voltage-Gated Calcium Channels. Current Molecular Pharmacology. 8, 162-168 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Chen, L., et al. Protein 4.1G Regulates Cell Adhesion, Spreading, and Migration of Mouse Embryonic Fibroblasts through the beta1 Integrin Pathway. Journal of Biological Chemistry. 291, 2170-2180 (2016).
- Dewor, M., et al. Macrophage migration inhibitory factor (MIF) promotes fibroblast migration in scratch-wounded monolayers in vitro. FEBS Letters. 581, 4734-4742 (2007).
- Handly, L. N., Wollman, R. Wound-induced Ca(2+) wave propagates through a simple release and diffusion mechanism. Molecular Biology of the Cell. 28, 1457-1466 (2017).
- Cappiello, F., Casciaro, B., Mangoni, M. L. A Novel In Vitro Wound Healing Assay to Evaluate Cell Migration. Journal of Visualized Experiments. (133), 56825 (2018).
- Hernandez Vera, R., Schwan, E., Fatsis-Kavalopoulos, N., Kreuger, J. A Modular and Affordable Time-Lapse Imaging and Incubation System Based on 3D-Printed Parts, a Smartphone, and Off-The-Shelf Electronics. PLoS One. 11, 0167583 (2016).
- Reinhart-King, C. A. Endothelial cell adhesion and migration. Methods in Enzymology. 443, 45-64 (2008).
- Treloar, K. K., Simpson, M. J. Sensitivity of edge detection methods for quantifying cell migration assays. PLoS One. 8, 67389 (2013).
- Pirkmajer, S., Chibalin, A. V. Serum starvation: caveat emptor. American Journal of Physiology-Cell Physioliology. 301, 272-279 (2011).
- Papenfuss, H. D., Gross, J. F., Intaglietta, M., Treese, F. A. A transparent access chamber for the rat dorsal skin fold. Microvascular Research. 18, 311-318 (1979).
- Deoliveira, D., et al. An ear punch model for studying the effect of radiation on wound healing. International Journal of Radiation Biology. 87, 869-877 (2011).
- Chen, L., Mirza, R., Kwon, Y., DiPietro, L. A., Koh, T. J. The murine excisional wound model: Contraction revisited. Wound Repair and Regeneration. 23, 874-877 (2015).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiment. (75), e50265 (2013).
- Wahedi, H. M., Park, Y. U., Moon, E. Y., Kim, S. Y. Juglone ameliorates skin wound healing by promoting skin cell migration through Rac1/Cdc42/PAK pathway. Wound Repair and Regeneration. 24, 786-794 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены