È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Scratch Migration Ssay and Dorsal Skinfold Chamber for In Vitro e In Vivo Analisi della Guarigione delle Ferite
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per un saggio in vitro graffio utilizzando fibroblasti primari e per un saggio di guarigione della ferita della pelle in vivo nei topi. Entrambi i test sono metodi semplici per valutare la guarigione delle ferite in vitro e in vivo.
Abstract
La guarigione delle ferite cutanee alterate è una delle principali preoccupazioni per i pazienti affetti da diabete e per le persone anziane, e c'è bisogno di un trattamento efficace. Approcci appropriati in vitro e in vivo sono essenziali per l'identificazione di nuove molecole bersaglio per i trattamenti farmacologici per migliorare il processo di guarigione della ferita cutanea. Abbiamo identificato la sottounità n. 3 di canali di calcio legati alla tensione (Cav-3) come una potenziale molecola bersaglio per influenzare la guarigione della ferita in due saggi indipendenti, vale a dire il saggio di migrazione del graffio in vitro e il modello di camera in vivo dorsale skinfold. Fibroblasti embrionali murici primari (MEF) acutamente isolati da topi selvatici (WT) e cav-3-decisi (Cav-3 KO) o fibroblasti acutamente isolati dai topi WT trattati con siRNA per down-regolare l'espressione del gene Cacnb3 , codificacazione Cavn.3, sono stati utilizzati. Un graffio è stato applicato su un monostrato cellulare confluente e la chiusura del gap è stata seguita prendendo immagini microscopiche in punti temporali definiti fino al ripopolamento completo del divario da parte delle cellule che migrano. Queste immagini sono state analizzate e il tasso di migrazione delle cellule è stato determinato per ogni condizione. In un test in vivo, abbiamo impiantato una camera dorsale a pelli su topi WT e Cav-3 KO, abbiamo applicato una ferita circolare definita di 2 mm di diametro, coperto la ferita con un coperchio di vetro per proteggerla da infezioni e disidratazione, e monitorato la chiusura della ferita macroscopica nel corso del tempo. La chiusura delle ferite è stata significativamente più veloce nei topi carenti di Cacnb3. Poiché i risultati degli esami in vivo e in vitro sono correlati bene, il saggio in vitro può essere utile per lo screening ad alto rendimento prima di convalidare i colpi in vitro del modello di guarigione della ferita in vivo. Ciò che abbiamo mostrato qui per i topi o le cellule di tipo selvatico e Cav-3-deciziali potrebbe essere applicabile anche a molecole specifiche diverse da Cav.
Introduzione
La guarigione della ferita cutanea inizia immediatamente dopo la lesione cutanea al fine di ripristinare l'integrità della pelle e per proteggere l'organismo dalle infezioni. Il processo di guarigione della ferita passa attraverso quattro fasi sovrapposte; coagulazione, infiammazione, formazione di nuovi tessuti e rimodellamento dei tessuti1. La migrazione cellulare è fondamentale in queste fasi. Cellule infiammatorie, cellule immunitarie, cheratinociti, cellule endoteliali e fibroblasti vengono attivati in diversi punti temporali e invadono l'area della ferita2. I metodi per studiare la guarigione delle ferite in vitro e in vivo sono di grande interesse non solo per comprendere i meccanismi sottostanti, ma anche per testare nuovi farmaci e per sviluppare nuove strategie che mirano a migliorare e accelerare la guarigione delle ferite della pelle.
Per monitorare e analizzare la migrazione delle celle, è possibile utilizzare il saggio di migrazione scratch. È spesso indicato come analisi di guarigione della ferita in vitro. Questo metodo richiede una struttura di coltura cellulare3. Si tratta di una procedura semplice, non c'è bisogno di attrezzature di fascia alta e il saggio può essere eseguito nella maggior parte dei laboratori di biologia cellulare. In questo saggio, un'area priva di cellule viene creata dall'interruzione meccanica di un monostrato cellulare confluente, preferibilmente cellule epiteliali o fibroblaste endoteliali o fibroblaste. Le celle sul bordo del graffio verranno migrate per ripopolare lo spazio creato. La quantificazione dell'area libera dalle cellule decrescenti nel tempo assomiglia al tasso di migrazione e indica il tempo di cui le cellule hanno bisogno per colmare il divario. A tale scopo, i ricercatori possono utilizzare cellule acutamente isolate da topi O topi WT privi di un gene di interesse4o cellule immortalate disponibili da archivi cellulari affidabili. Il saggio di graffio permette di studiare l'influenza dei composti farmacologicamente attivi o l'effetto dei cDNA trafetti o dei siRNA sulla migrazione cellulare.
In vivo, la guarigione delle ferite è un processo fisiologico complesso, che richiede diversi tipi di cellule tra cui cheratinociti, cellule infiammatorie, fibroblasti, cellule immunitarie e cellule endoteliali al fine di ripristinare l'integrità fisica della pelle il più velocemente possibile1 . Diversi metodi per studiare la guarigione delle ferite in vivo sono stati sviluppati e utilizzati negli ultimi5,6,7,8. La camera dorsale a forma di pelle descritta in questo articolo è stata precedentemente utilizzata per i saggi di guarigione delle ferite9. Viene utilizzato come preparazione a camera dorsale modificata per i topi. Il modello di camera skinfold modificato ha diversi vantaggi. 1) Riduce al minimo la contrazione della pelle, che impedisce l'osservazione del processo di guarigione della ferita e potrebbe influenzare la riparazione della ferita nei topi. 2) Questa camera fa uso di coprire la ferita con un vetrine di vetro, riducendo le infezioni dei tessuti e la disidratazione, che potrebbe ritardare il processo di guarigione. 3) Il flusso sanguigno e la vascolarizzazione possono essere monitorati direttamente. 4) Permette ripetutamente l'applicazione topica di composti e reagenti farmacologicamente attivi al fine di trattare la ferita e accelerare la guarigione9,10.
Abbiamo identificato la sottounità n. 3 di canali di calcio ad alta tensione (Cav-3) come una potenziale molecola bersaglio per influenzare la guarigione della pelle della pelle utilizzando due protocolli indipendenti, vale a dire il saggio di migrazione del graffio in vitro e il modello della camera dorsale in vivo. Per il saggio in vitro, abbiamo usato fibroblasti primari, queste cellule esprimono il gene Cacnb3 che codifica la proteina Cav3, ma mancano di afflusso di Ca2 o di afflusso di tensione. Abbiamo descritto una nuova funzione di Cav-3 in questi fibroblasti: Cav-3 si lega al recettore dell'inositolo 1,4,5-trisfosfato (IP3R) e vincoli di rilascio di calcio dal reticolo endoplasmico. L'eliminazione del gene Cacnb3 nei topi porta ad una maggiore sensibilità dell'IP3R per IP3, a una maggiore migrazione cellulare e ad una maggiore riparazione della pelle4.
Protocollo
Tutte le procedure sperimentali sono state approvate ed eseguite in conformità con i regolamenti etici e i comitati per il benessere degli animali della Saarland e dell'Università di Saarland.
1 Coltura cellulare primaria e trasfezione del siRNA
NOTA: nel metodo descritto, vengono utilizzati fibroblasti primari. Queste cellule svolgono un ruolo cruciale nella guarigione delle ferite e nel rimodellamento dei tessuti11. In questo esperimento, il gene Cacnb3, che codifica la sottounità Cav3 dei canali di calcio ad alta tensione12 è stato abbassato, mostrando così il suo ruolo nella migrazione cellulare in vitro e riparazione della pelle in vivo4.
- Preparazione del siRNA: Prima di riconciliare i siRNA, centrifugare brevemente i tubi per assicurarsi che il contenuto sia nella parte inferiore. Ricostituire i siRNA in un buffer privo di 100 L RNase (100 mM di acetato di potassio, 30 m HEPES, pH 7,5) fornito dal produttore con una concentrazione di 20 M. Questa è una soluzione stock di siRNA.
- Questa soluzione di riserva a 10 gradi l per tubo (concentrazione di 20M) e conservarla a -20 gradi centigradi fino all'uso.
- Utilizzando un marcatore permanente ultrafine, segnare una piastra a 6 pozze con una linea orizzontale nella parte inferiore di ogni pozzo per essere in grado di identificare sempre la stessa regione scratch di interesse e di seguirne la chiusura.
NOTA: in questo saggio sono state utilizzate 6 piastre di coltura con 6 pozze di coltura perché sono abbastanza grandi, per fornire spazio e flessibilità sufficienti per applicare un graffio coerente, riproducibile e verticale utilizzando una punta di pipetta da 200 l un'altra sul monostrato cellulare. Se un numero limitato di celle è disponibile, un modo alternativo e probabilmente conveniente sarebbe quello di utilizzare piastre di coltura 12 o 24-bene. - Fibroblasti primari di piastra, isolati dai topi di tipo selvaggio e 4-decisivo di 3, in una piastra 6-po ad una densità di 5 x 105 cellule/pozzo in presenza di 2 mL di Dulbecco modificato mezzo di Eagle (DMEM) integrato con 10% siero bovino fetale (FCS).
NOTA: 5 x 105 cellule per pozzo è stato istituito per piastra di coltura 6-well e per i fibroblasti primari del mouse. I test possono essere necessari se si utilizzano piastre di coltura cellulare 12 o 24-bene o altri tipi di cellule, che potrebbero essere di dimensioni diverse. Le cellule devono essere trattate in un ambiente sterile come gli armadi di sicurezza biologica di classe II. - Etichettare la piastra a 6 piani con il tipo di cella, il genotipo e la data.
- Spostare la piastra a 6 pozze nell'incubatrice di coltura cellulare e mantenere le cellule a 37 e 5% DI CO2 per 24 h.
- Il giorno successivo, estrarre la piastra dall'incubatrice, aspirare il mezzo di coltura cellulare dal pozzo, scartarlo e sostituirlo con 2,25 mL di coltura fresca medio aggiungendolo con attenzione contro la parete del pozzo.
- Al fine di trasfecare i fibroblasti con siRNA, utilizzare un reagente di trasfezione a base di lipidi come raccomandato dal produttore.
- Per ogni trafezione, etichettare due tubi di microcentrifuga. Nel primo, aggiungere 9 L del reagente di trasfezione e diluirlo con 150 litri ridotto siero medio. Nel secondo tubo, aggiungere 1,5 l'l siRNA (Cacnb3 siRNA-1, Cacnb3 siRNA-2 o siRNA strapazzato come controllo negativo) e diluirlo con un mezzo di siero ridotto di 150 gradi.
- Aggiungere il siRNA diluito nel tubo contenente reagente di trasfusione diluito e vortice per 2 s. Incubare la miscela per 5 min a 21 gradi centigradi.
- Etichettare i pozze con siRNA Cacnb3- 1, Cacnb3 o siRNA strapazzato. Aggiungere alle cellule 250 -L della miscela reagente siRNA-trasfezione.
- Rimettere la piastra di coltura a 6 pozzetto nell'incubatrice e mantenere le cellule a 37 e 5% di CO2 per 72 h.
- Al fine di verificare l'efficienza del silenziamento genico cacnb3, raccogliere le cellule trafette ed eseguire l'analisi immunoblot come descritto in precedenza4.
2. Analisi di guarigione delle ferite in vitro (analisi della migrazione dei graffi)
- Estrarre la piastra di coltura cellulare dall'incubatrice ed esaminare le cellule al microscopio utilizzando l'obiettivo 10x. Iniziare con il saggio di graffio solo quando hanno raggiunto il 100% di confluenza.
NOTA: per l'accuratezza e la riproducibilità, la confluenza al 100% è un fattore obbligatorio per avviare il test di migrazione dei graffi. Pertanto, è importante inizializzare lo stesso numero di cellule nei pozzi di coltura, esaminare ogni pozzo per la confluenza e applicare il graffio allo stesso punto temporale (giorno 0 confluenza). Aspettare più a lungo dopo che le cellule raggiungono il 100% di confluenza può evocare risposte diverse. - Una volta che la cellula raggiunge il 100% di confluenza, aspirare il mezzo di coltura fuori dal pozzo e scartarlo.
- Utilizzare una punta di pipetta (200 ) per creare manualmente un graffio verticale alla linea orizzontale contrassegnata nella parte inferiore del pozzo, attraverso il monostrato di cellule confluenti al centro del pozzo.
- Risciacquare ogni pozzo due volte con 2 mL di salina tampina tampone (PBS) (137 mM NaCl, 2,7 mM KCl, 1,5 mM KH2PO4, 8,1 mM Na2HPO4, pH 7.4) per rimuovere i fattori rilasciati da cellule danneggiate, cellule sciolte e detriti dall'area graffiata. Aggiungere 2 mL di PBS con attenzione contro la parete del pozzo per evitare di staccare bene le cellule dalla coltura cellulare.
- Aggiungere 2 mL di coltura cellulare media contenente 10% siero o 1% siero con attenzione ad ogni bene.
NOTA: Si raccomanda di eseguire il saggio di graffio sotto il 10% del siero e sotto il siero dell'1% per confermare che l'effetto osservato è causato dalla proliferazione e dalla migrazione delle cellule o solo dalla migrazione cellulare. - Spostare la piastra sullo stadio del microscopio e catturare le immagini di campo luminoso dell'area senza cellule (due aree per pozzo) immediatamente dopo graffiare (t-0h) ad un ingrandimento 10x utilizzando un microscopio luminoso. Per visualizzare sempre la stessa regione del graffio, utilizzare la linea orizzontale, preparata nel passaggio (1.3) e scattare un'immagine sopra questa linea e un'immagine sotto questa linea. Salvare le immagini come TIFF o JPEG.
- Poiché lo stadio del microscopio non mantiene la condizione di crescita cellulare, spostare la piastra di nuovo all'incubatrice di coltura cellulare e mantenere le cellule a 37 e 5% CO2.
- Dopo 6, 10 e 30 h, spostare nuovamente la piastra sullo stadio del microscopio e acquisire le immagini nello stesso modo descritto al punto 2.6.
NOTA: Questi punti temporali sono stati stabiliti per la procedura descritta e per i fibroblasti primari. Durante il primo esperimento pilota, sono stati testati più punti temporali per vedere quanto velocemente i fibroblasti ripopolano il divario. Anche se 0, 6, 10 e 30 h sono punti di tempo di partenza ragionevoli, gli investigatori dovrebbero ottimizzare e stabilire i punti temporali appropriati per ogni applicazione e per ogni tipo di cella. L'alternativa più accurata, se disponibile, sarebbe quella di utilizzare la microscopia time-lapse. - Utilizzando ImageJ13, quantificare l'area iniziale priva di cellule (100%) e l'area rimanente dopo 6, 10 e 30 h (Figura 1). La percentuale di area scratch ripopolata dalla migrazione delle celle viene quindi calcolata in relazione all'area scratch iniziale.
3. Analisi dell'area scratch
- Aprire il software ImageJ13.
- Caricate la prima immagine come JPEG (ad esempio, immagini RGB a 24 bit 1360x1024) rilasciando l'immagine nella barra dei menu di ImageJ.
- Selezionare il pulsante Selezioni a mano libera e contrassegnare l'area senza celle
- Fare clic su Analizza e selezionare Misura. Apparirà una finestra con i risultati che contengono il valore dell'area.
- Trasferire questo valore in un foglio di calcolo di analisi.
- Ripetere i passaggi 3.2-3.5 per ogni immagine dal punto temporale 0 h e quindi ricominciare per la prossima ora punti 6, 10 e 30 h.
- Calcola la percentuale di area scratch ripopolata migrando le celle dopo 6, 10 e 30 h per ogni graffio utilizzando la seguente equazione:
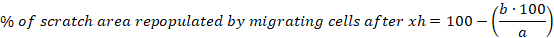
a area libera da celle del graffio iniziale, b : area libera dalla cella dopo 6 h - Calcolare la media e l'errore standard della media (S.E.M.) per la percentuale di area scratch ripopolata dalle celle di migrazione dopo 6 h. Mostra i dati come grafico a barre di colonna o a dispersione.
4. Test di guarigione della ferita della pelle in vivo
NOTA: per questo studio vengono utilizzati i topi con deficit di Stato maggiore di C57BL/6 (8-12 settimane con peso corporeo 22-26 g) e i topi con deficit di Cav-3 come controllo.
- Un giorno prima di iniziare l'esperimento, autoclave tutti gli strumenti chirurgici, viti, dadi e telai in titanio da utilizzare per la preparazione della camera di skinfold.
NOTA: Il telaio in titanio è composto da due metà complementari simmetriche e ha una finestra di osservazione circolare in cui la ferita verrà applicata e seguita da microscopia (vedi Figura 2a). - Anestetizzare un topo di tipo selvatico o 3-decisivo (22-26 g peso corporeo) da iniezione intraperitoneale (i.p.) di 0,1 mL di peso corporeo contenente una miscela di ketamina (75 mg/kg peso corporeo) e xylazina (25 mg/kg di peso corporeo). Controllare la profondità dell'anestesia dalla mancanza di risposta a un pizzico di punta.
NOTA: Questa iniezione dà circa 30 min di anestesia chirurgica e la profondità dell'anestesia deve essere controllata attraverso la procedura chirurgica, controllando i riflessi del mouse. - Per evitare secchezza o danni agli occhi, applicare unguento oftalmico a entrambi gli occhi e ripetere l'applicazione se necessario.
- Radeconate con attenzione il dorsum del topo, utilizzando un rasoio elettrico seguito dall'applicazione di una crema di depilazione nell'area rasata per rimuovere i capelli rimanenti. Fare attenzione a non ferire la pelle del mouse. Lasciare la crema depilazione per circa 10 min per rimuovere completamente tutti i capelli.
- Preparare la camera in titanio prendendo una parte del telaio simmetrico della camera in titanio e fissando le viti di collegamento con dadi su un lato. Questi dadi serviranno come distanziale per mantenere 400-500 m tra le due parti simmetriche della camera per evitare la compressione dei vasi sanguigni nella pelle.
- Togliere la crema dalla parte posteriore del mouse e pulire la regione senza capelli con acqua calda (35-37 gradi centigradi).
- Assicurarsi che il luogo per eseguire un intervento chirurgico sia pulito, caldo (37 gradi centigradi) e umidificato.
- Disinfettare l'area senza peli del topo con il disinfettante della pelle. Prendere una piega della pelle posteriore del mouse di fronte a una fonte di luce e posizionare la linea mediana del doppio strato della pelle dove verrà impiantata la camera in titanio. Dopo di che, fissare la piega con una sutura polipropilene cranicamente e caudalmente e stringere l'altro lato della sutura su un rack metallico per sollevare la pelle piegata del mouse. Regolare l'altezza del rack per consentire al mouse di sedersi comodamente.
- Impiantare la camera in titanio nella piega della pelle posteriore del mouse in modo da inserire lo strato di pelle dorsale piegata tra le due metà simmetriche del telaio in titanio. Fissare la prima metà del telaio in titanio con suture in polipropilene sul suo bordo superiore sul retro della pelle dorsale.
NOTA: Sul telaio in titanio, ci sono 8 fori sul bordo superiore (Figura 2a) e la pelle piegata deve essere ben fissata da suture in polipropilene su ciascuno degli otto fori. - Prima di passare alla fase successiva, controllare i riflessi del mouse per assicurarsi che la profondità dell'anestesia sia mantenuta.
- Alla base della penatura della pelle, passare le due viti di collegamento, attaccate alla prima metà della camera di titanio, per penetrare la penetraente dalla schiena al lato anteriore. Fare piccole incisioni sulla pelle (utilizzando forbici sottili) per aiutare la penetrazione liscia delle viti di collegamento.
- Scollegare il mouse dal rack e posizionarlo in posizione laterale. Mettere la seconda metà complementare della camera in titanio sopra le 3 viti di collegamento (vedi Figura 2a) e applicare una leggera pressione con le dita per passare queste viti attraverso la seconda metà del telaio in titanio. Quindi, fissare entrambe le parti simmetriche con dadi in acciaio inox.
- Prestare attenzione alla tenuta delle viti in questo passaggio, dal momento che potrebbe staccarsi, se è troppo sciolto. Al contrario, se è troppo stretto, stringerà la piega della pelle, ridurrà il flusso sanguigno e può portare a compromissione dei tessuti e necrosi.
NOTA: I dadi preparati al punto 4.5 fungono da distanziale per mantenere una distanza di 400-500 m tra le due metà simmetriche della camera in titanio. I dadi devono essere serrati fino a quando non si avverte una leggera resistenza. - Tagliare la parte rimanente delle viti utilizzando pinze.
NOTA: In questa fase è necessario utilizzare occhiali di sicurezza di laboratorio per la protezione degli occhi nel caso in cui la vite si stacca nel modo sbagliato. - Contrassegnare l'area della ferita con un punzone biopsia standardizzato (2 mm di diametro), al centro della pelle all'interno della finestra di osservazione (vedere la figura 2a) della camera pieghevole dello skinperla al fine di garantire dimensioni riproducibili della ferita.
- Utilizzando pinze sottili e forbici, creare una ferita circolare all'interno dell'area contrassegnata rimuovendo la pelle completa con epidermide e derma. L'area finale della ferita sarà di circa 3,5-4,5 mm2, vedere la figura 2b. Pulire la ferita con una salina sterile di 0,5 mL (0,9 % NaCl, 37 gradi centigradi).
- Coprire la ferita con una vetrina di vetro e fissare questo coperchio di vetro con un anello a scatto utilizzando la pinza ad anello snap sulla camera di titanio.
- Subito dopo aver terminato la procedura chirurgica, posizionare il mouse sullo stadio di imaging di uno stereomicroscopio dotato di una fotocamera e scattare immagini (giorno 0) sotto illuminazione. Utilizzate l'ingrandimento 40X e salvate le immagini per future analisi off-line.
NOTA: l'investigatore deve esaminare le immagini immediatamente dopo l'acquisizione per assicurarsi che la qualità sia sufficiente per future analisi off-line. La preparazione della camera pieghevole della pelle e le prestazioni della ferita cutanea durano circa 30 minuti. - Tenere il mouse in un luogo caldo durante il recupero dall'anestesia per almeno 2 h. Successivamente, trasferire i topi in singole gabbie all'impianto animale (12 h ciclo chiaro/scuro) e assicurarsi che i topi abbiano accesso al cibo e all'acqua.
- Tre giorni dopo la ferita posizionare il mouse in un restrainer del mouse e fissare il restrainer sulla parte superiore della fase di imaging.
- Posizionare il palco sotto uno stereomicroscopio dotato di una telecamera. Scatta immagini sotto illuminazione con ingrandimento 40x, registra tutte le immagini e salvale per future analisi off-line
- Ripetere i passaggi 4.20 e 4.21 al giorno 6, 10 e giorno 14 post-ferita.
- Utilizzare le immagini della ferita, per l'analisi off-line in ImageJ13. L'area della ferita al giorno 0 è considerata come 100 % e la chiusura della ferita nel tempo viene tracciata rispetto all'area iniziale della ferita. I risultati rappresentativi sono riportati nella figura 2c,d.
- Calcolare la percentuale (%) dell'area della ferita ad ogni punto temporale utilizzando la seguente equazione:
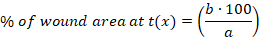
x: punto temporale (giorno 0, 3, 10 o 14), a: area ferita al giorno 0, b: area ferita al punto temporale x
Risultati
Il saggio di graffio è stato eseguito su un monostrato di cellule confluenti di MEF di tipo selvaggio e a 3 persone (Figura 1c). Dopo aver eseguito il "scratch" utilizzando una punta di pipetta da 200, le cellule di entrambi i genotipi migrano nell'area del graffio e chiudono il divario. Le immagini sono state scattate dopo 6, 10 e 30 h (Figura 1a). La migrazione cellulare è stata quantificata come percentuale (%) dell'area sc...
Discussione
In questo manoscritto, descriviamo un test di guarigione delle ferite in vitro e in vivo e correliamo i risultati ottenuti. Per il saggio in vitro, abbiamo usato fibroblasti di topo primari4,14,15 che svolgono un ruolo importante nella guarigione delle ferite e nella ristrutturazione dei tessuti11. Possono essere utilizzati anche altri tipi di cellule aderenti che crescono come monostrati (ad esempio, cel...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo la Dott.ssa Petra Weissgerber e l'Unità Transgene dell'impianto animale SPF (progetto P2 di SFB 894) della Facoltà di Medicina e la struttura animale presso l'Istituto di Chirurgia Clinica e Sperimentale presso la Facoltà di Medicina dell'Università di Saarland, Homburg. Ringraziamo il dottor Andreas Beck per la lettura critica del manoscritto. Questo studio è stato finanziato dalla Deutsche Forschungsgemeinschaft (DFG) Sonderforschungsbereich (SFB) 894, dal progetto A3 per A.B. e V.F.).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9 % NaCl | |||
| 1 ml syringes | BD Plastipak | 303172 | |
| 6 well plate | Corning | 3516 | |
| Biopsy punch | Kai Industries | 48201 | 2 mm |
| Cacnb3 Mouse siRNA Oligo Duplex (Locus ID 12297) | Origene | SR415626 | |
| Depilation cream | any depilation cream | ||
| Dexpanthenol 5% (BEPANTHEN) | Bayer | 3400935940179.00 | (BEPANTHEN) |
| Dihydroxylidinothiazine hydrochloride (Xylazine) | Bayer Health Care | Rompun 2% | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco by life technologies | 41966-029 | |
| Fetal bovine serum | Gibco by life technologies | 10270-106 | |
| Hexagon full nut | |||
| Ketamine hydrochloride | Zoetis | KETASET | |
| Light microscope | Keyence, Osaka, Japan | BZ-8000 | Similar microscopes might be used |
| Lipofectamine RNAiMAX Transfection Reagent | Thermo Fisher Scientific | 13778075 | |
| Micro-forceps | |||
| Micro-Scissors | |||
| Mouse restrainer | Home-made | ||
| Normal scissors | |||
| Objective | Nikon | plan apo 10x/0.45 | |
| Opti-MEM | Gibco by life technologies | 51985-026 | |
| Polypropylene sutures | |||
| Screwdriver | |||
| Skin disinfectant (octeniderm) | Schülke & Mayr GmbH | 118212 | |
| Slotted cheese head screw | |||
| Snap ring | |||
| Snap ring plier | |||
| Surgical microscope with camera | Leica | Leica M651 | |
| Titanium frames for the skinfold chamber | IROLA | 160001 | Halteblech M |
| Wire piler |
Riferimenti
- Gurtner, G. C., Werner, S., Barrandon, Y., Longaker, M. T. Wound repair and regeneration. Nature. 453, 314-321 (2008).
- Martin, P. Wound healing--aiming for perfect skin regeneration. Science. 276, 75-81 (1997).
- Gabbiani, G., Gabbiani, F., Heimark, R. L., Schwartz, S. M. Organization of actin cytoskeleton during early endothelial regeneration in vitro. Journal of Cell Science. 66, 39-50 (1984).
- Belkacemi, A., et al. IP3 Receptor-Dependent Cytoplasmic Ca(2+) Signals Are Tightly Controlled by Cavbeta3. Cell Reports. 22, 1339-1349 (2018).
- Breuing, K., Eriksson, E., Liu, P., Miller, D. R. Healing of partial thickness porcine skin wounds in a liquid environment. Journal of Surgical Research. 52, 50-58 (1992).
- Colwell, A. S., Krummel, T. M., Kong, W., Longaker, M. T., Lorenz, H. P. Skin wounds in the MRL/MPJ mouse heal with scar. Wound Repair and Regeneration. 14, 81-90 (2006).
- Vagesjo, E., et al. Accelerated wound healing in mice by on-site production and delivery of CXCL12 by transformed lactic acid bacteria. Proceedings National Academy of Science. 115, 1895-1900 (2018).
- Eming, S. A., et al. Accelerated wound closure in mice deficient for interleukin-10. American Journal of Pathology. 170, 188-202 (2007).
- Sorg, H., Krueger, C., Vollmar, B. Intravital insights in skin wound healing using the mouse dorsal skin fold chamber. Journal of Anatomy. 211, 810-818 (2007).
- Laschke, M. W., Vollmar, B., Menger, M. D. The dorsal skinfold chamber: window into the dynamic interaction of biomaterials with their surrounding host tissue. European Cell and Materials. 22, 147-164 (2011).
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2, 2369-2392 (2012).
- Hofmann, F., Belkacemi, A., Flockerzi, V. Emerging Alternative Functions for the Auxiliary Subunits of the Voltage-Gated Calcium Channels. Current Molecular Pharmacology. 8, 162-168 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Chen, L., et al. Protein 4.1G Regulates Cell Adhesion, Spreading, and Migration of Mouse Embryonic Fibroblasts through the beta1 Integrin Pathway. Journal of Biological Chemistry. 291, 2170-2180 (2016).
- Dewor, M., et al. Macrophage migration inhibitory factor (MIF) promotes fibroblast migration in scratch-wounded monolayers in vitro. FEBS Letters. 581, 4734-4742 (2007).
- Handly, L. N., Wollman, R. Wound-induced Ca(2+) wave propagates through a simple release and diffusion mechanism. Molecular Biology of the Cell. 28, 1457-1466 (2017).
- Cappiello, F., Casciaro, B., Mangoni, M. L. A Novel In Vitro Wound Healing Assay to Evaluate Cell Migration. Journal of Visualized Experiments. (133), 56825 (2018).
- Hernandez Vera, R., Schwan, E., Fatsis-Kavalopoulos, N., Kreuger, J. A Modular and Affordable Time-Lapse Imaging and Incubation System Based on 3D-Printed Parts, a Smartphone, and Off-The-Shelf Electronics. PLoS One. 11, 0167583 (2016).
- Reinhart-King, C. A. Endothelial cell adhesion and migration. Methods in Enzymology. 443, 45-64 (2008).
- Treloar, K. K., Simpson, M. J. Sensitivity of edge detection methods for quantifying cell migration assays. PLoS One. 8, 67389 (2013).
- Pirkmajer, S., Chibalin, A. V. Serum starvation: caveat emptor. American Journal of Physiology-Cell Physioliology. 301, 272-279 (2011).
- Papenfuss, H. D., Gross, J. F., Intaglietta, M., Treese, F. A. A transparent access chamber for the rat dorsal skin fold. Microvascular Research. 18, 311-318 (1979).
- Deoliveira, D., et al. An ear punch model for studying the effect of radiation on wound healing. International Journal of Radiation Biology. 87, 869-877 (2011).
- Chen, L., Mirza, R., Kwon, Y., DiPietro, L. A., Koh, T. J. The murine excisional wound model: Contraction revisited. Wound Repair and Regeneration. 23, 874-877 (2015).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiment. (75), e50265 (2013).
- Wahedi, H. M., Park, Y. U., Moon, E. Y., Kim, S. Y. Juglone ameliorates skin wound healing by promoting skin cell migration through Rac1/Cdc42/PAK pathway. Wound Repair and Regeneration. 24, 786-794 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon