Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ensayo de migración de arañazos y cámara dorsal Skinfold para análisis In Vitro e In Vivo de sanación de heridas
En este artículo
Resumen
Aquí, presentamos un protocolo para un ensayo de arañazos in vitro utilizando fibroblastos primarios y para un ensayo de cicatrización de heridas de piel in vivo en ratones. Ambos ensayos son métodos sencillos para evaluar la cicatrización in vitro e in vivo de heridas.
Resumen
La cicatrización de heridas cutáneas deterioradas es una preocupación importante para los pacientes que sufren de diabetes y para las personas mayores, y es necesario un tratamiento eficaz. Los enfoques in vitro e in vivo adecuados son esenciales para la identificación de nuevas moléculas diana para tratamientos farmacológicos para mejorar el proceso de cicatrización de heridas en la piel. Identificamos la subunidad 3 de canales de calcio cerrados por voltaje (Cav-3) como una molécula objetivo potencial para influir en la cicatrización de heridas en dos ensayos independientes, es decir, el ensayo de migración de arañazos in vitro y el modelo de cámara de plegado de piel dorsal in vivo. Fibroblastos embrionarios de ratón primario (MEF) agudamente aislados de ratones de tipo salvaje (WT) y de cav3-deficienciat(Cav3KO) o fibroblastos agudamente aislados de ratones WT tratados con siRNA para regular la reducción de la expresión del gen Cacnb3 , se utilizaron la codificación Cav3. Se aplicó un rasguño en una monocapa de células confluentes y el cierre de brecha fue seguido por la toma de imágenes microscópicas en puntos de tiempo definidos hasta la repoblación completa de la brecha por las células migratorias. Estas imágenes se analizaron y se determinó la tasa de migración de celdas para cada condición. En un ensayo in vivo, implantamos una cámara dorsal en ratones WT y Cav-3 KO, aplicamos una herida circular definida de 2 mm de diámetro, cubrimos la herida con un cubrecristalo para protegerla de infecciones y desecación, y monitoreamos el cierre de la herida macroscópica con el tiempo. El cierre de heridas fue significativamente más rápido en cacnb3-ratones con deficiencia de genes. Debido a que los resultados de los ensayos in vivo y in vitro se correlacionan bien, el ensayo in vitro puede ser útil para el cribado de alto rendimiento antes de validar los golpes in vitro por el modelo de cicatrización de heridas in vivo. Lo que hemos mostrado aquí para ratones o células de tipo salvaje y de deficiencia deCav3 también podría ser aplicable para moléculas específicas distintas de Cav-3.
Introducción
La cicatrización de heridas en la piel comienza inmediatamente después de la lesión de la piel con el fin de restaurar la integridad de la piel y proteger al organismo de las infecciones. El proceso de cicatrización de heridas pasa por cuatro fases superpuestas; coagulación, inflamación, formación de tejido nuevo y remodelación tisular1. La migración celular es crucial durante estas fases. Las células inflamatorias, las células inmunitarias, los queratinocitos, las células endoteliales y los fibroblastos se activan en diferentes momentos e invaden el área de la herida2. Los métodos para investigar la cicatrización de heridas in vitro e in vivo son de gran interés no sólo para entender los mecanismos subyacentes, sino también para probar nuevos fármacos y desarrollar nuevas estrategias con el objetivo de mejorar y acelerar la cicatrización de heridas en la piel.
Para supervisar y analizar la migración de celdas, se puede utilizar el ensayo de migración de cero. A menudo se conoce como ensayo de cicatrización de heridas in vitro. Este método requiere una instalación de cultivo celular3. Es un procedimiento simple, no hay necesidad de equipos de alta gama y el ensayo se puede realizar en la mayoría de los laboratorios de biología celular. En este ensayo, una zona libre de células es creada por la interrupción mecánica de una monocapa celular confluente, preferiblemente células epiteliales o endoteliales o fibroblastos. Las celdas en el borde del rasguño se migrarán para volver a rellenar la brecha creada. La cuantificación del área libre de celdas decreciente con el tiempo se asemeja a la tasa de migración e indica el tiempo, que las celdas necesitan para cerrar la brecha. Para este propósito, los investigadores pueden utilizar células agudamente aisladas de ratones WT o ratones que carecen de un gen de interés4,o células inmortalizadas disponibles en repositorios celulares confiables. El ensayo de arañazos permite estudiar la influencia de los compuestos farmacológicamente activos o el efecto de los CDNA transinfectados o siRNAs en la migración celular.
In vivo, la cicatrización de heridas es un proceso fisiológico complejo, que requiere diferentes tipos de células, incluyendo queratinocitos, células inflamatorias, fibroblastos, células inmunitarias y células endoteliales con el fin de restaurar la integridad física de la piel lo más rápido posible1 . Diferentes métodos para estudiar la cicatrización de heridas in vivo se han desarrollado y utilizado en los últimos5,6,7,8. La cámara dorsal de pliegue de la piel descrita en este artículo se utilizó anteriormente para los ensayos de cicatrización de heridas9. Se utiliza como una preparación de la cámara dorsal de la piel modificada para ratones. El modelo de cámara skinfold modificado tiene varias ventajas. 1) Minimiza la contracción de la piel, lo que evita observar el proceso de cicatrización de heridas y podría influir en la reparación de heridas en ratones. 2) Esta cámara hace uso de cubrir la herida con un cubreobjetos de vidrio, reducir las infecciones de tejido y la desecación, que podría retrasar el proceso de curación. 3) El flujo sanguíneo y la vascularización se pueden controlar directamente. 4) Permite la aplicación tópica repetitiva de compuestos y reactivos farmacológicamente activos con el fin de tratar la herida y acelerar la curación9,10.
Identificamos la subunidad 3 de canales de calcio cerrados de alta tensión (Cav-3) como una molécula objetivo potencial para influir en la cicatrización de heridas de la piel utilizando dos protocolos independientes, es decir, el ensayo de migración de arañazos in vitro y el modelo de cámara de plegado de piel dorsal in vivo. Para el ensayo in vitro, utilizamos fibroblastos primarios, estas células expresan el gen Cacnb3 que codifica la proteína Cav-3, pero carecen de influjo Ca2+ inducido por despolarización o corrientes Ca2+ dependientes del voltaje. Hemos descrito una función novedosa de Cav-3 en estos fibroblastos: Cav-3 se une al receptor de inositol 1,4,5-trisfosfato (IP3R) y restricciones liberación de calcio del retículo endoplasmático. La eliminación del gen Cacnb3 en ratones conduce a una mayor sensibilidad del IP3R para IP3, una mayor migración celular y una mayor reparación de heridas cutáneas4.
Protocolo
Todos los procedimientos experimentales fueron aprobados y realizados de acuerdo con las regulaciones éticas y los comités de bienestar animal de La Universidad del Sarre y el Sarre.
1 Cultivo celular primario y transfección de siRNA
NOTA: En el método descrito, se utilizan fibroblastos primarios. Estas células juegan un papel crucial en la cicatrización de heridas y la remodelación detejidos 11. En este experimento, el gen Cacnb3, que codifica la subunidad Cav-3 de los canales de calcio12 cerrados de alta tensión, fue regulado por la baja, mostrando así su papel en la migración celular in vitro y la reparación de heridas de piel in vivo4.
- Preparación de siRNA: Antes de reconstituir los siRNAs, centrifugar brevemente los tubos para asegurarse de que el contenido está en la parte inferior. Reconstituir los siRNAs en tampón libre de RNase de 100 ml (100 mM de acetato de potasio, 30 mM HEPES, pH 7.5) suministrados por el fabricante a una concentración de 20 m. Esta es una solución de stock de siRNAs.
- Alícuota esta solución en stock a 10 ml por tubo (concentración de 20 m) y almacenar a -20 oC hasta su uso.
- Usando un marcador permanente ultrafino, marque una placa de 6 pocillos con una línea horizontal en la parte inferior de cada pozo para poder identificar siempre la misma región de arañazo sin interés y seguir su cierre.
NOTA: En este ensayo se utilizaron placas de cultivo de 6 pocillos porque son lo suficientemente grandes, para proporcionar suficiente espacio y flexibilidad para aplicar un rasguño consistente, reproducible y vertical utilizando una punta de pipeta de 200 ml a través de la monocapa de la célula. Si hay un número limitado de celdas disponibles, una forma alternativa y probablemente la forma rentable sería utilizar placas de cultivo de 12 o 24 pocillos. - Placa de fibroblastos primarios, aislados de los ratones de tipo salvaje y deficientes4, en una placa de 6 pocillos a una densidad de 5 x 105 células/bien en presencia del medio de águila modificado de 2 ml de Dulbecco (DMEM) complementado con 10% de suero bovino fetal (FCS).
NOTA: 5 x 105 células por pozo se ha establecido para placa de cultivo de 6 pocillos y para fibroblastos primarios de ratón. Pueden ser necesarios exámenes si se usan placas de cultivo celular de 12 o 24 pocillos u otros tipos de células, que podrían ser diferentes en tamaño. Las células deben manipularse en un entorno estéril, como los gabinetes de seguridad biológicos de clase II. - Etiquete la placa de 6 pocillos con el tipo de célula, el genotipo y la fecha.
- Mueva la placa de 6 pocillos a la incubadora de cultivo celular y mantenga las células a 37 oC y 5% deCO2 durante 24 h.
- Al día siguiente, saque la placa de la incubadora, saque el medio de cultivo celular del pozo, deséchelo y sustitúyalo por un medio de cultivo fresco de 2,25 ml agregándolo cuidadosamente contra la pared del pozo.
- Para transfectar fibroblastos con siRNAs, utilice un reactivo de transfección a base de lípidos según lo recomendado por el fabricante.
- Para cada transfección, etiquete dos tubos de microcentrífuga. En la primera, añadir 9 l del reactivo de transfección y diluirlo con un medio sérico reducido de 150 l. En el segundo tubo, añadir un siRNA de 1,5 l(Cacnb3 siRNA-1, Cacnb3 siRNA-2 o siRNA revuelto como un control negativo) y diluirlo con un medio sérico reducido de 150 l.
- Añadir el siRNA diluido en el tubo que contenga reactivo de transfección diluido y vórtice durante 2 s. Incubar la mezcla durante 5 min a 21oC.
- Etiquete los pozos con Cacnb3 siRNA-1, Cacnb3 siRNA-2 o siRNA revuelto. Añadir 250 l de la mezcla de reactivo de siRNA-transfección en forma de gota a las células.
- Vuelva a colocar la placa de cultivo de 6 pocillos en la incubadora y mantenga las células a 37 oC y 5% deCO2 durante 72 h.
- Con el fin de comprobar la eficiencia del silenciamiento del gen Cacnb3, recoger células transinfectadas y realizar análisis de inmunoblot como se describió anteriormente4.
2. Ensayo de cicatrización de heridas in vitro (ensayo de migración de arañazos)
- Saque la placa de cultivo celular de la incubadora y examine las células bajo el microscopio utilizando el objetivo 10x. Comience con el ensayo de arañazos sólo cuando hayan alcanzado el 100% de confluencia.
NOTA: Para la precisión y reproducibilidad, la confluencia del 100% es un factor obligatorio para iniciar el ensayo de migración de arañazos. Por lo tanto, es importante sembrar el mismo número de células en los pozos de cultivo, examinar cada pozo para la confluencia y aplicar el rasguño en el mismo punto de tiempo (día 0 confluencia). Esperar más tiempo después de que las células alcancen el 100% de confluencia puede evocar diferentes respuestas. - Una vez que la célula alcanza el 100% de confluencia, aspirar el medio de cultivo fuera del pozo y descartarlo.
- Utilice una punta de pipeta (200 l) para crear manualmente un rasguño vertical a la línea horizontal marcada en la parte inferior del pozo, a través de la monocapa de celda confluente en el centro del pozo.
- Enjuague cada pozo dos veces con 2 ml de solución salina con fosfato (PBS) (137 mM NaCl, 2,7 mM KCl, 1,5 mM KH2PO4, 8,1 mM Na2HPO4, pH 7.4) para eliminar los factores liberados de las células dañadas, las células sueltas y los desechos de la zona rayada. Agregue 2 ml de PBS cuidadosamente contra la pared del pozo para evitar separar bien las células del cultivo celular.
- Agregue 2 ml de medio de cultivo celular que contenga 10% de suero o 1% de suero cuidadosamente a cada poca.
NOTA: Se recomienda realizar el ensayo de arañazos con menos de 10% de suero y menos del 1% de suero para confirmar que el efecto observado es causado por la proliferación y migración celular o solo por la migración celular. - Mueva la placa a la etapa del microscopio y capture imágenes de campo brillante del área libre de células (dos áreas por pozo) inmediatamente después de rayar (t-0h) con un aumento de 10x utilizando un microscopio de luz. Para crear una imagen siempre la misma región del rasguño, utilice la línea horizontal, que se preparó en el paso (1.3), y tome una imagen por encima de esta línea y una imagen debajo de esta línea. Guardar imágenes como TIFF o JPEG.
- Debido a que la etapa del microscopio no mantiene la condición de crecimiento celular, mueva la placa de nuevo a la incubadora de cultivo celular y mantenga las células a 37 oC y 5% deCO2.
- Después de 6, 10 y 30 h, mueva la placa a la etapa del microscopio de nuevo y capture las imágenes de la misma manera que se describe en el paso 2.6.
NOTA: Estos puntos de tiempo se han establecido para el procedimiento descrito y para los fibroblastos primarios. Durante el primer experimento piloto, se probaron más puntos de tiempo para ver qué tan rápido los fibroblastos repoblan la brecha. Aunque 0, 6, 10 y 30 h son puntos de tiempo de inicio razonables, los investigadores deben optimizar y establecer los puntos de tiempo adecuados para cada aplicación y para cada tipo de celda. La alternativa más precisa, si está disponible, sería utilizar la microscopía de lapso de tiempo. - Utilizando ImageJ13, cuantifique el área inicial libre de células (100%) y el área restante después de 6, 10 y 30 h(Figura 1). El porcentaje de área de rascar repoblada mediante la migración de celdas se calcula en relación con el área de rascado inicial.
3. Análisis de la zona de rascar
- Abra el software ImageJ13.
- Cargue la primera imagen como JPEG (por ejemplo, imágenes RGB de 24 bits 1360x1024) colocando la imagen en la barra de menús de ImageJ.
- Seleccione el botón Selecciones a mano alzada y marque el área libre de celdas
- Haga clic en Analizar y seleccione Medir. Aparecerá una ventana con los resultados que contiene el valor del área.
- Transfiera este valor a una hoja de cálculo de análisis.
- Repita los pasos 3.2-3.5 para cada imagen desde el punto de tiempo 0 h y luego comience de nuevo para los próximos puntos de tiempo 6, 10 y 30 h.
- Calcule el porcentaje de área de rascado repoblada migrando celdas después de 6, 10 y 30 h para cada rasguño utilizando la siguiente ecuación:
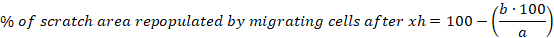
a - área libre de celdas del rasguño inicial, b - área libre de celdas después de 6 h - Calcule la media y el error estándar de la media (S.E.M.) para el porcentaje de área de rascar repoblada mediante la migración de celdas después de 6 h. Mostrar datos como un gráfico de barra de columna o un gráfico de dispersión.
4. Ensayo de cicatrización de heridas en la piel in vivo
NOTA: Para este estudio se utilizan machos de tipo salvaje C57BL/6 (8-12 semanas de edad con 22-26 g de peso corporal) y ratones con deficiencia de Cav-3 como control.
- Un día antes de iniciar el experimento, autoclave todos los instrumentos quirúrgicos, tornillos, tuercas y marcos de titanio que se utilizarán para la preparación de la cámara de pliegue de la piel.
NOTA: El marco de titanio se compone de dos mitades complementarias simétricas y tiene una ventana de observación circular donde se aplicará la herida y seguida de microscopía (ver Figura 2a). - Anestetizar un ratón de tipo salvaje o deficiente de 3 o 3 (22-26 g de peso corporal) por inyección intraperitoneal (es decir) de 0,1 ml de salina/10 g de peso corporal que contenga una mezcla de ketamina (75 mg/kg de peso corporal) y xilazina (25 mg/kg de peso corporal). Compruebe la profundidad de la anestesia por la falta de respuesta a un pellizco del dedo del dedo del dedo del dedo del tiempo.
NOTA: Esta inyección proporciona alrededor de 30 minutos de anestesia quirúrgica y la profundidad de la anestesia debe controlarse a través del procedimiento quirúrgico, comprobando los reflejos del ratón. - Para evitar la sequedad o daño de los ojos, aplicar pomada oftálmica en ambos ojos y repetir la aplicación si es necesario.
- Afeitar cuidadosamente el dorso del ratón, utilizando una afeitadora eléctrica seguida de la aplicación de una crema de depilación en la zona afáctula para eliminar el pelo restante. Tenga cuidado de no dañar la piel del ratón. Dejar la crema de depilación durante unos 10 min para eliminar por completo todo el cabello.
- Prepare la cámara de titanio tomando una parte del marco de la cámara de titanio simétrico y fije los tornillos de conexión con tuercas en un lado. Estas tuercas servirán como un espaciador para mantener 400-500 m entre las dos partes simétricas de la cámara para evitar la compresión de los vasos sanguíneos en la piel.
- Retire la crema de la parte posterior del ratón y limpie la región sin pelo con agua tibia del grifo (35-37 oC).
- Asegúrese de que el lugar para realizar la cirugía esté limpio, caliente (37 oC) y humecitado.
- Desinfectar la zona libre de pelo del ratón con desinfectante de la piel. Tome un pliegue de la piel posterior del ratón delante de una fuente de luz y coloque la línea media de la doble capa de la piel donde se implantará la cámara de titanio. Después de eso, fijar el pliegue de la piel con una sutura de polipropileno craneal y caudal y apretar el otro lado de la sutura en un estante de metal para levantar la piel doblada del ratón. Ajuste la altura del bastidor para permitir que el ratón se sente cómodamente.
- Implante la cámara de titanio en el pliegue de la piel posterior del ratón de una manera que empareja la capa de piel dorsal doblada entre las dos mitades simétricas del marco de titanio. Coloque la primera mitad del marco de titanio en su sturas de polipropileno en su borde superior en la parte posterior del pliegue dorsal.
NOTA: En el marco de titanio, hay 8 agujeros en el borde superior(Figura 2a)y la piel plegada debe estar bien fijada por suturas de polipropileno en cada uno de los ocho agujeros. - Antes de pasar al siguiente paso, compruebe los reflejos del ratón para asegurarse de que se mantiene la profundidad de la anestesia.
- En la base del pliegue de la piel, pasar los dos tornillos de conexión, unidos a la primera mitad de la cámara de titanio, para penetrar el pliegue de la piel de la espalda hacia el lado frontal. Hacer pequeñas incisiones en la piel (usando tijeras finas) para ayudar a suavizar la penetración de los tornillos de conexión.
- Separe el ratón del bastidor y colóquelo en una posición lateral. Coloque la segunda mitad complementaria de la cámara de titanio enla parte superior de los 3 tornillos de conexión (consulte la figura 2a ) y aplique una ligera presión con los dedos para pasar estos tornillos a través de la segunda mitad del marco de titanio. A continuación, fije ambas piezas simétricas con tuercas de acero inoxidable.
- Preste atención a la estanqueidad de los tornillos en este paso, ya que podría desprenderse, si está demasiado suelto. Por el contrario, si está demasiado apretado, apretará el pliegue de la piel, reducirá el flujo sanguíneo y puede conducir a deterioro tisular y necrosis.
NOTA: Las nueces preparadas en el paso 4.5 sirven como espaciador para mantener una distancia de 400-500 m entre las dos mitades simétricas de la cámara de titanio. Las tuercas deben apretarse hasta que se sienta una ligera resistencia. - Corte la parte restante de los tornillos con alicates.
NOTA: En este paso es necesario utilizar gafas de seguridad de laboratorio para la protección de los ojos en caso de que el tornillo salga de la manera incorrecta. - Marque el área de la herida mediante un punzón de biopsia estandarizado (2 mm de diámetro), en el centro de la piel dentro de la ventana de observación (ver Figura 2a) de la cámara del pliegue de la piel para garantizar el tamaño de la herida reproducible.
- Mediante el uso de fórceps finos y tijeras, crear una herida circular dentro del área marcada mediante la eliminación de la piel completa con epidermis y dermis. El área final de la herida será alrededor de 3.5-4.5 mm2, ver Figura 2b. Limpie la herida con 0,5 ml de solución salina estéril (0,9 % NaCl, 37 oC).
- Cubra la herida con una cubierta de vidrio y fije este cubreobjetos de vidrio con un anillo de presión usando el alicate de anillo de presión en la cámara de titanio.
- Inmediatamente después de finalizar el procedimiento quirúrgico, coloque el ratón en la etapa de imagen de un estereomicroscopio equipado con una cámara y tome imágenes (día 0) bajo iluminación. Utilice la ampliación 40X y guarde las imágenes para futuros análisis fuera de línea.
NOTA: El investigador debe examinar las imágenes inmediatamente después de la captura para asegurarse de que la calidad es suficiente para futuros análisis fuera de línea. La preparación de la cámara del pliegue de la piel y el rendimiento de la herida de la piel toma alrededor de 30 minutos. - Mantenga el ratón en un lugar cálido durante la recuperación de la anestesia durante al menos 2 h. A partir de entonces, transfiera ratones en jaulas individuales de vuelta a las instalaciones de animales (12 h ciclo claro/oscuro) y asegúrese de que los ratones tengan acceso a alimentos y agua.
- Tres días después de la herida coloque el ratón en un mouse-restrainer y fije el restrainer en la parte superior de la etapa de imagen.
- Coloque el escenario bajo un estereomicroscopio equipado con una cámara. Tome imágenes bajo iluminación con aumento de 40x, grabe todas las imágenes y guárdelas para futuros análisis fuera de línea
- Repita los pasos 4.20 y 4.21 de nuevo en los días 6, 10 y 14 después de la herida.
- Utilice las imágenes de heridas para el análisis fuera de línea en ImageJ13. El área de la herida en el día 0 se considera como 100 % y el cierre de la herida con el tiempo se traza en relación con el área inicial de la herida. Los resultados representativos se muestran en la Figura 2c,d.
- Calcular el porcentaje (%) del área de la herida en cada punto de tiempo utilizando la siguiente ecuación:
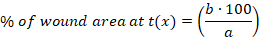
x: punto de tiempo (día 0, 3, 10 o 14), a : área de la herida en el día 0, b: área de la herida en el punto de tiempo x
Resultados
El ensayo de arañazos se realizó en una monocapa de células confluentes de MEF de tipo salvaje y deficientes en 3(Figura 1c). Después de realizar el "rasguño" usando una punta de pipeta de 200 l, las células de ambos genotipos migran a la zona de arañazos y cierran la brecha. Las imágenes se tomaron después de 6, 10 y 30 h(Figura 1a). La migración celular se cuantificó como porcentaje (%) área de arañazos repoblada ...
Discusión
En este manuscrito, describimos un ensayo de cicatrización de heridas in vitro e in vivo y correlacionamos los resultados obtenidos. Para el ensayo in vitro, utilizamos fibroblastos primarios de ratón4,14,15 que juegan un papel importante en la cicatrización de heridas y la remodelación detejidos 11. También se pueden utilizar otros tipos de células adherentes que crecen como monocapas (por ejemplo,...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a la Dra. Petra Weissgerber y a la Unidad Transgénica de la instalación animal SPF (proyecto P2 de la SFB 894) de la Facultad de Medicina y a la instalación animal del Instituto de Cirugía Clínica y Experimental de la Facultad de Medicina de la Universidad del Sarre, Homburg. Agradecemos al Dr. Andreas Beck por la lectura crítica del manuscrito. Este estudio fue financiado por la Deutsche Forschungsgemeinschaft (DFG) Sonderforschungsbereich (SFB) 894, proyecto A3 a A.B. y V.F.).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9 % NaCl | |||
| 1 ml syringes | BD Plastipak | 303172 | |
| 6 well plate | Corning | 3516 | |
| Biopsy punch | Kai Industries | 48201 | 2 mm |
| Cacnb3 Mouse siRNA Oligo Duplex (Locus ID 12297) | Origene | SR415626 | |
| Depilation cream | any depilation cream | ||
| Dexpanthenol 5% (BEPANTHEN) | Bayer | 3400935940179.00 | (BEPANTHEN) |
| Dihydroxylidinothiazine hydrochloride (Xylazine) | Bayer Health Care | Rompun 2% | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco by life technologies | 41966-029 | |
| Fetal bovine serum | Gibco by life technologies | 10270-106 | |
| Hexagon full nut | |||
| Ketamine hydrochloride | Zoetis | KETASET | |
| Light microscope | Keyence, Osaka, Japan | BZ-8000 | Similar microscopes might be used |
| Lipofectamine RNAiMAX Transfection Reagent | Thermo Fisher Scientific | 13778075 | |
| Micro-forceps | |||
| Micro-Scissors | |||
| Mouse restrainer | Home-made | ||
| Normal scissors | |||
| Objective | Nikon | plan apo 10x/0.45 | |
| Opti-MEM | Gibco by life technologies | 51985-026 | |
| Polypropylene sutures | |||
| Screwdriver | |||
| Skin disinfectant (octeniderm) | Schülke & Mayr GmbH | 118212 | |
| Slotted cheese head screw | |||
| Snap ring | |||
| Snap ring plier | |||
| Surgical microscope with camera | Leica | Leica M651 | |
| Titanium frames for the skinfold chamber | IROLA | 160001 | Halteblech M |
| Wire piler |
Referencias
- Gurtner, G. C., Werner, S., Barrandon, Y., Longaker, M. T. Wound repair and regeneration. Nature. 453, 314-321 (2008).
- Martin, P. Wound healing--aiming for perfect skin regeneration. Science. 276, 75-81 (1997).
- Gabbiani, G., Gabbiani, F., Heimark, R. L., Schwartz, S. M. Organization of actin cytoskeleton during early endothelial regeneration in vitro. Journal of Cell Science. 66, 39-50 (1984).
- Belkacemi, A., et al. IP3 Receptor-Dependent Cytoplasmic Ca(2+) Signals Are Tightly Controlled by Cavbeta3. Cell Reports. 22, 1339-1349 (2018).
- Breuing, K., Eriksson, E., Liu, P., Miller, D. R. Healing of partial thickness porcine skin wounds in a liquid environment. Journal of Surgical Research. 52, 50-58 (1992).
- Colwell, A. S., Krummel, T. M., Kong, W., Longaker, M. T., Lorenz, H. P. Skin wounds in the MRL/MPJ mouse heal with scar. Wound Repair and Regeneration. 14, 81-90 (2006).
- Vagesjo, E., et al. Accelerated wound healing in mice by on-site production and delivery of CXCL12 by transformed lactic acid bacteria. Proceedings National Academy of Science. 115, 1895-1900 (2018).
- Eming, S. A., et al. Accelerated wound closure in mice deficient for interleukin-10. American Journal of Pathology. 170, 188-202 (2007).
- Sorg, H., Krueger, C., Vollmar, B. Intravital insights in skin wound healing using the mouse dorsal skin fold chamber. Journal of Anatomy. 211, 810-818 (2007).
- Laschke, M. W., Vollmar, B., Menger, M. D. The dorsal skinfold chamber: window into the dynamic interaction of biomaterials with their surrounding host tissue. European Cell and Materials. 22, 147-164 (2011).
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2, 2369-2392 (2012).
- Hofmann, F., Belkacemi, A., Flockerzi, V. Emerging Alternative Functions for the Auxiliary Subunits of the Voltage-Gated Calcium Channels. Current Molecular Pharmacology. 8, 162-168 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Chen, L., et al. Protein 4.1G Regulates Cell Adhesion, Spreading, and Migration of Mouse Embryonic Fibroblasts through the beta1 Integrin Pathway. Journal of Biological Chemistry. 291, 2170-2180 (2016).
- Dewor, M., et al. Macrophage migration inhibitory factor (MIF) promotes fibroblast migration in scratch-wounded monolayers in vitro. FEBS Letters. 581, 4734-4742 (2007).
- Handly, L. N., Wollman, R. Wound-induced Ca(2+) wave propagates through a simple release and diffusion mechanism. Molecular Biology of the Cell. 28, 1457-1466 (2017).
- Cappiello, F., Casciaro, B., Mangoni, M. L. A Novel In Vitro Wound Healing Assay to Evaluate Cell Migration. Journal of Visualized Experiments. (133), 56825 (2018).
- Hernandez Vera, R., Schwan, E., Fatsis-Kavalopoulos, N., Kreuger, J. A Modular and Affordable Time-Lapse Imaging and Incubation System Based on 3D-Printed Parts, a Smartphone, and Off-The-Shelf Electronics. PLoS One. 11, 0167583 (2016).
- Reinhart-King, C. A. Endothelial cell adhesion and migration. Methods in Enzymology. 443, 45-64 (2008).
- Treloar, K. K., Simpson, M. J. Sensitivity of edge detection methods for quantifying cell migration assays. PLoS One. 8, 67389 (2013).
- Pirkmajer, S., Chibalin, A. V. Serum starvation: caveat emptor. American Journal of Physiology-Cell Physioliology. 301, 272-279 (2011).
- Papenfuss, H. D., Gross, J. F., Intaglietta, M., Treese, F. A. A transparent access chamber for the rat dorsal skin fold. Microvascular Research. 18, 311-318 (1979).
- Deoliveira, D., et al. An ear punch model for studying the effect of radiation on wound healing. International Journal of Radiation Biology. 87, 869-877 (2011).
- Chen, L., Mirza, R., Kwon, Y., DiPietro, L. A., Koh, T. J. The murine excisional wound model: Contraction revisited. Wound Repair and Regeneration. 23, 874-877 (2015).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiment. (75), e50265 (2013).
- Wahedi, H. M., Park, Y. U., Moon, E. Y., Kim, S. Y. Juglone ameliorates skin wound healing by promoting skin cell migration through Rac1/Cdc42/PAK pathway. Wound Repair and Regeneration. 24, 786-794 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados