Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
In Vitro ve In Vivo In Vivo Analizi Yara İyileşmesi için Scratch Migration Tahlil ve Dorsal Skinfold Odası
Bu Makalede
Özet
Burada, primer fibroblastlar kullanarak in vitro çizik testve farelerde in vivo deri yara iyileşmesi test için bir protokol salıyoruz. Her iki tahliller in vitro ve in vivo yara iyileşmesini değerlendirmek için basit yöntemlerdir.
Özet
Bozulmuş kutanöz yara iyileşmesi diyabet hastaları ve yaşlılar için önemli bir endişe kaynağıdır ve etkili bir tedaviye ihtiyaç vardır. Uygun in vitro ve in vivo yaklaşımlar cilt yara iyileşme sürecini iyileştirmek için ilaç tedavileri için yeni hedef moleküllerin belirlenmesi için gereklidir. Voltaj kapılı kalsiyum kanallarının β3 alt birimini (Cavβ3) iki bağımsız tahlilde yara iyileşmesini etkileyebilecek potansiyel bir hedef molekül olarak belirledik, yani in vitro çizik göçü tahlilleri ve in vivo dorsal skinfold oda modeli. Birincil fare embriyonik fibroblastlar (MEFs) akut yabani tip (WT) ve Cavβ3-eksik fareler (Cavβ3 KO) veya fibroblastlar akut WT fareler siRNA ile tedavi izole aşağı-Cacnb3 genin ekspresyonunu düzenlemek için izole , Cavβ3 kodlama, kullanılmıştır. Bir çizik bir confluent hücre monolayer üzerine uygulandı ve boşluk kapatma göç eden hücreler tarafından boşluğun tam yeniden popülasyonkadar tanımlanan zaman noktalarında mikroskobik görüntüler alarak izledi. Bu görüntüler analiz edildi ve her durum için hücre geçiş hızı belirlendi. İn vivo bir testte, WT ve Cavβ3 KO farelere bir sırt derisi kalıbı yerleştirdik, 2 mm çapında tanımlanmış dairesel bir yara uyguladık, yarayı enfeksiyonlardan ve kurutunmaya karşı korumak için cam bir kapak kaymasıyla kapladık ve makroskopik yara nın kapanmasını izledik. zaman içinde. Cacnb3-gen eksikliği olan farelerde yara kapanması önemli ölçüde daha hızlıydı. In vivo ve in vitro tahlilsonuçları iyi korelasyon nedeniyle, in vitro tahlil in vivo yara iyileşme modeli ile in vitro isabet doğrulamadan önce yüksek iş itme taraması için yararlı olabilir. Burada yabani tip ve Cavβ3-eksik fareler veya hücreler için gösterdikleri Cavβ3 dışındaki belirli moleküller için de uygulanabilir.
Giriş
Cildin bütünlüğünü geri getirmek ve organizmayı enfeksiyonlardan korumak için cilt yaralanmasından hemen sonra cilt yaraiyileşmesi başlar. Yara iyileşme süreci dört örtüşen aşamadan geçer; koagülasyon, inflamasyon, yeni doku oluşumu ve doku remodeling1. Hücre göçü bu evrelerde çok önemlidir. İnflamatuar hücreler, bağışıklık hücreleri, keratinositler, endotel hücreleri ve fibroblastlar farklı zaman noktalarında aktive edilir ve yara bölgesini istila eder2. İn vitro ve in vivo yara iyileşmesini araştırma yöntemleri sadece altta yatan mekanizmaları anlamak için değil, aynı zamanda yeni ilaçları test etmek ve cilt yara iyileşmesini iyileştirmeyi ve hızlandırmayı amaçlayan yeni stratejiler geliştirmek için de büyük ilgi görmektedir.
Hücre geçişini izlemek ve analiz etmek için, sıfırdan geçiş titremi kullanılabilir. Genellikle in vitro yara iyileşmesi tsay olarak adlandırılır. Bu yöntem bir hücre kültür tesisi3gerektirir. Bu basit bir işlemdir, high-end ekipman gerek yoktur ve test çoğu hücre biyolojisi laboratuvarlarında yapılabilir. Bu teşpte, hücresiz bir alan, tercihen epitel veya endotel benzeri hücreler veya fibroblastlar, konfluent hücre monolayer mekanik bozulma tarafından oluşturulur. Çiziğin kenarındaki hücreler, oluşturulan boşluğu yeniden doldurmak için göç eder. Zaman içinde azalan hücresiz alanın niceliği geçiş hızına benzer ve hücrelerin boşluğu kapatmak için ihtiyaç duydukları zamanı gösterir. Bu amaçla, araştırmacılar ya WT fareler veya fareler ilgi4bir gen yoksun akut izole hücreleri kullanabilirsiniz , ya da güvenilir hücre depolarından kullanılabilir ölümsüzleştirilmiş hücreler. Çizik tsay farmakolojik olarak aktif bileşiklerin etkisi veya hücre göçü üzerinde transfected cDNA veya siRNA etkisi incelenmesi sağlar.
In vivo, yara iyileşmesi keratinositler, inflamatuar hücreler, fibroblastlar, bağışıklık hücreleri ve endotel hücreleri de dahil olmak üzere farklı hücre tipleri gerektiren karmaşık bir fizyolojik süreçtir mümkün olduğunca hızlı cildin fiziksel bütünlüğünü geri yüklemek için1 . In vivo yara iyileşmesi nde farklı yöntemler geliştirilmiş ve son5,6,7,8. Bu makalede açıklanan dorsal deri odası daha önce yara iyileşmesi tahlilleri için kullanılmıştır9. Bu fareler için modifiye dorsal skinfold oda hazırlığı olarak kullanılır. Modifiye skinfold oda modeli çeşitli avantajları vardır. 1) Yaranın iyileşme sürecini engelleyen ve farelerde yara onarımını etkileyebilecek cilt daralmasını en aza indirir. 2) Bu oda, yaranın cam bir kapak fişi ile kaplanması, doku enfeksiyonlarının azaltılması ve kurutunma, iyileşme sürecini geciktirebilir kullanır. 3) Kan akışı ve vaskülarizasyon doğrudan izlenebilir. 4) Bu yara tedavi etmek ve iyileşme yi hızlandırmak için farmakolojik olarak aktif bileşikler ve reaktifler tekrarlayan topikal uygulama sağlar9,10.
Yüksek gerilim kapılı kalsiyum kanallarının (Cavβ3) β3 alt ünitesini, iki bağımsız protokol, yani in vitro çizik göçü tetkik ve in vivo dorsal skinfold oda modeli ile cilt yara iyileşmesini etkileyebilecek potansiyel bir hedef molekül olarak tanımladık. İn vitro tetkik için, birincil fibroblastlar kullandık, bu hücreler Cavβ3 proteinini kodlayan Cacnb3 genini ifade eder, ancak depolarizasyona bağlı Ca2+ akını veya voltaj bağımlı Ca2+ akımları yoktur. Bu fibroblastlarda Cavβ3'ün yeni bir işlevini tanımladık: Cavβ3 inositol 1,4,5-trisfosfat reseptörüne (IP3R) bağlanır ve endoplazmik retikulumdan kalsiyum salınımını kısıtlar. Farelerde Cacnb3 geninin silinmesi IP3R IP3R artan duyarlılık yol açar, gelişmiş hücre göçü ve artan deri yara onarımı 4.
Protokol
Tüm deneysel prosedürler etik düzenlemelere ve Saarland ve Saarland Üniversitesi hayvan refahı komitelerine uygun olarak onaylandı ve gerçekleştirildi.
1 Birincil hücre kültürü ve siRNA transfeksiyonu
NOT: Açıklanan yöntemde primer fibroblastlar kullanılır. Bu hücreler yara iyileşmesi ve doku remodeling önemli bir rol oynamaktadır11. Bu deneyde, yüksek gerilim kapılı kalsiyum kanalları12 Cavβ3 alt birimi kodlama Cacnb3 geni aşağı düzenlenmiş, böylece in vitro hücre göçü ve in vivo cilt yara onarım rolünü gösteren4.
- SiRNA'nın hazırlanması: SiRNA'ları yeniden oluşturmadan önce, içeriğin en altta olduğundan emin olmak için tüpleri kısaca santrifüj edin. Üretici tarafından 20 μM konsantrasyonda sağlanan 100 μL RNase içermeyen tampon (100 mM potasyum asetat, 30 mM HEPES, pH 7.5) siRNA'ları yeniden oluşturun. Bu siRNA bir stok çözümdür.
- Aliquot bu stok çözeltisi tüp başına 10 μL (20 μM konsantrasyon) ve kullanıma kadar -20 °C'de saklayın.
- Ultra ince kalıcı bir işaretleyici kullanarak, her zaman aynı kazı kazan bölgesini belirleyebilmek ve kapanmasını takip edebilmek için her kuyunun alt kısmında yatay bir çizgi bulunan 6 kuyulu bir plaka işaretleyin.
NOT: Hücre tek katmanında 200 μL pipet ucu kullanılarak tutarlı, tekrarlanabilir ve dikey bir çizik uygulamak için yeterli alan ve esneklik sağlamak için yeterince büyük oldukları ndan bu titrede 6 kuyulu kültür plakaları kullanılmıştır. Sınırlı sayıda hücre varsa, alternatif ve muhtemelen uygun maliyetli bir yol 12 veya 24-iyi kültür plakaları kullanmak olacaktır. - Plaka primer fibroblastlar, yabani tip ve β3-eksik fareler izole4, 5 x 105 hücre / iyi yoğunluğunda 6-iyi bir plaka içinde 2 mL Dulbecco modifiye Eagle's orta varlığında (DMEM) 10% fetal sığır serumu ile desteklenmektedir (FCS).
NOT: 6 kuyulu kültür plakası ve birincil fare fibroblastları için kuyu başına 5 x 105 hücre oluşturulmuştur. 12 veya 24 kuyulu hücre kültür plakaları veya boyutu farklı olabilecek diğer hücre tipleri kullanılarak testler gerekebilir. Hücreler biyolojik güvenlik dolapları sınıf II gibi steril bir ortamda ele alınmalıdır. - 6 kuyulu plakayı hücre tipi, genotip ve tarihle etiketlayın.
- 6 kuyulu plakayı hücre kültürü kuluçka makinesine taşıyın ve hücreleri 37 °C ve %5 CO2'de 24 saat boyunca koruyun.
- Ertesi gün, kuvözden tabağı çıkarın, hücre kültürünü kuyudan çıkarın, atın ve kuyunun duvarına dikkatlice ekleyerek 2,25 mL taze kültür ortamı ile değiştirin.
- SiRNA'larla fibroblastları transfect olarak, üretici nin önerdiği gibi lipid bazlı transfeksiyon reaktifi kullanın.
- Her transfeksiyon için iki mikrosantrifüj tüp etiket. İlkinde transfeksiyon reaktifinin 9 μL'sini ekleyin ve 150°L azaltılmış serum ortamı ile seyreltin. İkinci tüpe 1,5 μL siRNA(Cacnb3 siRNA-1, Cacnb3 siRNA-2 veya negatif kontrol olarak çırpılmış siRNA) ekleyin ve 150°L azaltılmış serum ortamı ile seyreltin.
- Seyreltilmiş siRNA'yı seyreltilmiş transfeksiyon reaktifi ve girdap içeren tüpe 2 s. 21 °C'de 5 dakika kuluçkaya yatırın.
- Etiket kuyuları veya Cacnb3 siRNA-1, Cacnb3 siRNA-2 veya şifreli siRNA ile. Hücrelere siRNA-transfeksiyon reaktif karışımının 250 μL'sini damla ile ekleyin.
- 6 kuyulu kültür plakasını kuvöze geri yerleştirin ve hücreleri 37 °C ve %5 CO2'de 72 saat tutun.
- Cacnb3 gen susturma etkinliğini kontrol etmek için, transfected hücreleri toplamak ve daha önce açıklandığı gibi immünoblot analizi yapmak4.
2. In vitro yara iyileşmesi tsay (çizik göç tsay)
- Hücre kültür plakasını kuvözden alın ve 10x hedefini kullanarak mikroskop altındaki hücreleri inceleyin. Sadece %100 biraraya geldiklerinde çizik tetkikiyle başlayın.
NOT: Doğruluk ve tekrarlanabilirlik için , %100 birleşim, sıfırdan geçiş tetkikini başlatmak için zorunlu bir faktördür. Bu nedenle, kültür kuyularına aynı sayıda hücre tohumlamak, her kuyuyu biraraya gelmek için incelemek ve çiziyi aynı zaman noktasında (0. gün birleşimi) uygulamak önemlidir. Hücreler %100 birleştiğinde daha uzun süre beklemek farklı tepkileri çağrıştırabilir. - Hücre %100 birleştiğinde, kültür ortamını kuyudan çıkarın ve atın.
- Kuyunun ortasındaki enakıcı hücre monokatmanı boyunca, kuyunun alt kısmında işaretlenmiş yatay çizgiye el ile dikey bir çizik oluşturmak için bir pipet ucu (200°L) kullanın.
- Hasarlı hücrelerden, gevşek hücrelerden ve kazınmış alandan çıkan faktörleri gidermek için her kuyuyu 2 mL fosfat tamponlu salin (PBS) (137 mM NaCl, 2,7 mM KCl, 1,5 mM KH2PO4,8,1 mM Na2HPO4, pH 7,4) ile iki kez durun. Hücre kültüründen hücreleri ayırmaktan kaçınmak için kuyunun duvarına dikkatlice 2 mL PBS ekleyin.
- Her kuyuya %10 serum veya %1 serum içeren 2 mL hücre kültürü ortamı ekleyin.
NOT: Gözlenen etkinin hücre çoğalması ve göçü nden veya sadece hücre göçünden kaynaklandığını doğrulamak için %10 serum ve %1 serumun altında çizik tahtının kullanılması önerilir. - Plakayı mikroskop aşamasına taşıyın ve ışık mikroskobu kullanarak 10 x büyütmede (t=0h) çizildikten hemen sonra hücresiz alanın (kuyu başına iki alan) parlak alan görüntülerini yakalayın. Her zaman çizilmeye ait aynı bölgeyi görüntülemek için, adım (1.3) olarak hazırlanan yatay çizgiyi kullanın ve bu çizginin üzerinde bir görüntü ve bu çizginin altında bir görüntü alın. Görüntüleri TIFF veya JPEG olarak kaydedin.
- Mikroskop evresi hücre büyüme durumunu korumadığından, plakayı hücre kültürü kuluçka makinesine geri taşıyın ve hücreleri 37 °C ve %5 CO2'detutun.
- 6, 10 ve 30 saat sonra plakayı tekrar mikroskop aşamasına taşıyın ve 2.6 adımda açıklandığı gibi görüntüleri yakalayın.
NOT: Bu zaman noktaları tanımlanan prosedür ve primer fibroblastlar için oluşturulmuştur. İlk pilot deney sırasında, daha fazla zaman noktaları ne kadar hızlı fibroblastlar boşluğu yeniden görmek için test edildi. 0, 6, 10 ve 30 saat makul başlangıç noktaları olmasına rağmen, araştırmacılar optimize etmeli ve her uygulama ve her hücre türü için uygun zaman noktaları kurmak. Daha doğru bir alternatif, eğer varsa, zaman atlamalı mikroskopi kullanmak olacaktır. - ImageJ13kullanarak, ilk hücreserbest alanı (%100) ölçmek ve 6, 10 ve 30 saat sonra kalan alan (Şekil 1). Geçiş hücreleri tarafından yeniden doldurulan çizilme alanı yüzdesi, ilk çizilme alanına göre hesaplanır.
3. Çizilme alanının analizi
- Açık ImageJ yazılımı13.
- Görüntüyü ImageJ menü çubuğuna bırakarak ilk resmi JPEG (örn. 24 bit RGB görüntüleri 1360x1024) olarak yükleyin.
- Serbest seçim düğmesini seçin ve hücresiz alanı işaretleyin
- Analiz et'e tıklayın ve Ölçü'nüseçin. Sonuçların bulunduğu bir pencere, alan değerini içeren görünür.
- Bu değeri bir analiz elektronik tablosuna aktarın.
- Her görüntü için 0 saat arası 3,2-3,5 adımlarını tekrarlayın ve bir sonraki zaman için 6, 10 ve 30 saat için yeniden başlayın.
- Aşağıdaki denklemi kullanarak her çizik için 6, 10 ve 30 saat sonra geçirilen hücreler tarafından yeniden doldurulan çizilme alanıyüzdesini hesaplayın:
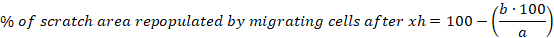
a = ilk çizik hücre serbest alanı, b = hücre serbest alan sonra 6 saat - 6 saat sonra geçiş hücreleri tarafından yeniden doldurulan çizilme alanı yüzdesi için ortalamanın (S.E.M.) ortalamasını ve standart hatasını hesaplayın.
4. In vivo cilt yara iyileşme tsay
NOT: Bu çalışmada C57BL/6 yabani tip erkekler (22-26 g vücut ağırlığına sahip 8-12 haftalık) ve Cavβ3-eksik fareler kontrol olarak kullanılmaktadır.
- Deneye başlamadan bir gün önce, skinfold odası nın hazırlanmasında kullanılacak tüm cerrahi aletler, vidalar, somunlar ve titanyum çerçeveler otoklav.
NOT: Titanyum çerçeve iki simetrik tamamlayıcı yarımdan oluşur ve yaranın uygulanacağı ve ardından mikroskopinin yapılacağı dairesel bir gözlem penceresi vardır (bkz. Şekil 2a). - Ketamin (75 mg/kg vücut ağırlığı) ve ksilazin (25 mg/kg vücut ağırlığı) karışımını içeren 0,1 mL salin/10 g vücut ağırlığı enjeksiyonu ile yabani tip veya β3-eksik fare (22-26 g vücut ağırlığı) anestezi. Bir parmak sıkışmayanıt eksikliği ile anestezi derinliğini kontrol edin.
NOT: Bu enjeksiyon yaklaşık 30 dk cerrahi anestezi verir ve anestezi derinliği fare refleksleri kontrol edilerek, cerrahi işlem ile kontrol edilmelidir. - Gözlerde kuruluk veya hasar görmesini önlemek için her iki göze de oftalmik merhem uygulayın ve gerekirse uygulamayı tekrarlayın.
- Fare dorsumunu dikkatlice tıraş edin, elektrikli tıraş makinesi ni kullanarak kalan tüyleri çıkarmak için traş edilen alana bir depilasyon kremi uygulamayı takip edin. Fare derisine zarar vermemeye dikkat edin. Tamamen tüm saç kaldırmak için yaklaşık 10 dakika için depilation krem bırakın.
- Simetrik titanyum oda çerçevesinin bir parçasını alarak titanyum haznesini hazırlayın ve bir tarafta ki somunlarla bağlantı vidalarını düzeltin. Bu fındık ciltte kan damarlarının sıkıştırma önlemek için odanın iki simetrik parçaları arasında 400-500 μm tutmak için bir spacer olarak hizmet verecek.
- Kremi farenin arkasından çıkarın ve tüysüz bölgeyi ılık (35-37 °C) musluk suyuyla temizleyin.
- Ameliyat yapılacak yerin temiz, sıcak (37 °C) ve nemli olduğundan emin olun.
- Farenin tüysüz bölgesini deri dezenfektanı ile dezenfekte edin. Bir ışık kaynağının önünde farenin arka derisinin bir kat ını alın ve titanyum odasının yerleştirileceği derinin çift tabakasının orta çizgisini yerleştirin. Bundan sonra, bir polipropilen sütür kranially ve caudally ile skinfold düzeltmek ve fare katlanmış cilt kaldırmak için metal bir raf üzerinde dikiş diğer tarafını sıkın. Farenin rahatça oturmasını sağlamak için rafın yüksekliğini ayarlayın.
- Titanyum çerçevenin iki simetrik yarısı arasında katlanmış sırt derisi tabakası sandviç bir şekilde farenin arka deri kıvrım içine titanyum oda implant. Titanyum çerçevenin ilk yarısını, üstün kenarına, dorsal deri kıvrımının arkasına polipropilen dikişlerle takın.
NOT: Titanyum çerçeveüzerinde, üstün kenarda 8 delik vardır(Şekil 2a) ve katlanmış deri sekiz deliğin her birinde polipropilen dikişlerle iyi sabitlenmelidir. - Bir sonraki adıma geçmeden önce, anestezi derinliğikorunur emin olmak için farenin refleksleri kontrol edin.
- Skinfold tabanında, titanyum odasının ilk yarısına bağlı iki bağlantı vidaları geçmek, arkadan ön tarafa skinfold nüfuz etmek için. Bağlantı vidalarının düzgün penetrasyonuna yardımcı olmak için ciltte küçük kesiler (ince makas kullanarak) yapın.
- Fareyi raftan ayırın ve yanal bir konuma yerleştirin. Titanyum haznesinin ikinci tamamlayıcı yarısını 3 bağlantı vidasının üzerine koyun (Şekil 2a'yabakınız) ve bu vidaları titanyum çerçevenin ikinci yarısından geçirmek için parmaklarla hafif basınç uygulayın. Sonra, paslanmaz çelik fındık ile her iki simetrik parçaları düzeltmek.
- Çok gevşek sayılsa bile, bu adımda vidaların sıkılığına dikkat edin. Buna karşılık, çok sıkı ise, cilt sıkmak, kan akışını azaltmak ve doku bozukluğu ve nekroz yol açabilir.
NOT: 4.5 adımda hazırlanan somunlar, titanyum haznesinin iki simetrik yarısı arasında 400-500 m mesafeyi korumak için bir boşluk görevi göremez. Hafif bir direnç hissedilene kadar somunlar sıkılmalıdır. - Vidaların kalan kısmını pliers kullanarak kesin.
NOT: Bu adımda vidanın yanlış şekilde çıkması durumunda göz koruması için laboratuvar güvenlik gözlüklerinin kullanılması gerekmektedir. - Tekrarlanabilir yara boyutlarını sağlamak için yara alanını gözlem penceresi içindeki derinin ortasına standart biyopsi yumruğu (2 mm çapında) işaretleyin (Bkz. Şekil 2a)cilt kıvrımı odasının.
- Ince forceps ve makas kullanarak, epidermis ve dermis ile tam deri kaldırarak işaretli alan içinde dairesel bir yara oluşturmak. Son yara alanı 3.5-4.5 mm2civarında olacaktır, bkz. Şekil 2b. Yarayı 0,5 mL steril salin (%0,9 NaCl, 37 °C) ile temizleyin.
- Yarayı cam bir kapak kaydırıcısıyla kapatın ve titanyum haznedeki çıtçıt halkasını kullanarak bu cam kapak kayslipini bir çıtçıt halkası ile düzeltin.
- Cerrahi işlemi tamamladıktan hemen sonra fareyi kamera yla donatılmış bir stereomikroskobun görüntüleme aşamasına yerleştirin ve ışıkaltında (0. gün) fotoğraf çekin. 40X büyütmeyi kullanın ve görüntüleri gelecekteki çevrimdışı analizler için kaydedin.
NOT: Araştırmacı, kalitenin gelecekteki çevrimdışı analizler için yeterli olduğundan emin olmak için görüntüleri yakalandıktan hemen sonra incelemelidir. Deri kıvrım odasının hazırlanması ve deri yarasının performansı yaklaşık 30 dakika sürer. - En az 2 saat anestezi kurtarma sırasında sıcak bir yerde fare tutun. Bundan sonra, tek tek kafeslerde farelergeri hayvan tesisine transfer (12 saat ışık / karanlık döngüsü) ve fareler gıda ve su erişimi olduğundan emin olun.
- Üç gün sonra yaralayıcı fareyi fareyi dizginlemeye yerleştirin ve izleme aşamasının üstüne dizginleyiciyi düzeltin.
- Sahneyi kamerayla donatılmış stereomikroskop un altına yerleştirin. 40x büyütme ile görüntüleri aydınlatma altında alın, tüm resimleri kaydedin ve gelecekteki çevrimdışı analizler için kaydedin
- Tekrar adımlar 4.20 ve 4.21 tekrar gün 6, 10 ve gün 14 sonrası yaralama.
- ImageJ13'tekioff-line analiz için yara görüntülerini kullanın. 0. gün deki yara alanı % 100 olarak kabul edilir ve zaman içinde yara kapanması ilk yara bölgesine göre çizilir. Temsil sonuçları Şekil 2c,d'degösterilmiştir.
- Yüzdeyi hesaplama (%) aşağıdaki denklemi kullanarak her zaman noktasında yara alanının:
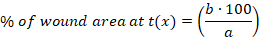
x: zaman noktası (gün 0, 3, 10 veya 14), a: 0, b: zaman noktasında ki yara alanı x
Sonuçlar
Çizik telbette, yabani tip ve β3-eksik MEF'lerin(Şekil 1c)etkili bir hücre monotabakasıüzerinde yapıldı. 200 μL'lik pipet ucu kullanılarak "çizik" yaptıktan sonra, her iki genotipten hücreler çizilme alanına göç eder ve boşluğu kapatır. Görüntüler 6, 10 ve 30 saat sonraalınmıştır(Şekil 1a ). Hücre geçişi yüzde (%) olarak ölçüldü çizik yaptıktan 6 saat sonra göç eden hücreler tarafından y...
Tartışmalar
Bu yazıda in vitro ve in vivo yara iyileşmesi tahsinini açıklar ve elde edilen sonuçları ilişkilendiriz. In vitro tsay için, biz yara iyileşmesi ve doku remodeling önemli bir rol oynayan birincil fare fibroblastlar4,14,15 kullanılır11. Monolayers olarak büyüyen diğer yapışık hücre tipleri (örn. epitel hücreleri, endotel hücreleri, keratinositler) de kullanılabilir. Uygun ve sağlık...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Dr. Petra Weissgerber'e ve Tıp Fakültesi'nin SPF hayvan tesisinin Transgen Birimi'ne (SFB 894'ün P2 projesi) ve Homburg'daki Saarland Üniversitesi Tıp Fakültesi Klinik ve Deneysel Cerrahi Enstitüsü'ndeki hayvan tesisine teşekkür ederiz. Dr. Andreas Beck'e el yazmasının eleştirel okuması için teşekkür ederiz. Bu çalışma Deutsche Forschungsgemeinschaft (DFG) Sonderforschungsbereich (SFB) 894, Proje A3 a.B. ve V.F. tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.9 % NaCl | |||
| 1 ml syringes | BD Plastipak | 303172 | |
| 6 well plate | Corning | 3516 | |
| Biopsy punch | Kai Industries | 48201 | 2 mm |
| Cacnb3 Mouse siRNA Oligo Duplex (Locus ID 12297) | Origene | SR415626 | |
| Depilation cream | any depilation cream | ||
| Dexpanthenol 5% (BEPANTHEN) | Bayer | 3400935940179.00 | (BEPANTHEN) |
| Dihydroxylidinothiazine hydrochloride (Xylazine) | Bayer Health Care | Rompun 2% | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco by life technologies | 41966-029 | |
| Fetal bovine serum | Gibco by life technologies | 10270-106 | |
| Hexagon full nut | |||
| Ketamine hydrochloride | Zoetis | KETASET | |
| Light microscope | Keyence, Osaka, Japan | BZ-8000 | Similar microscopes might be used |
| Lipofectamine RNAiMAX Transfection Reagent | Thermo Fisher Scientific | 13778075 | |
| Micro-forceps | |||
| Micro-Scissors | |||
| Mouse restrainer | Home-made | ||
| Normal scissors | |||
| Objective | Nikon | plan apo 10x/0.45 | |
| Opti-MEM | Gibco by life technologies | 51985-026 | |
| Polypropylene sutures | |||
| Screwdriver | |||
| Skin disinfectant (octeniderm) | Schülke & Mayr GmbH | 118212 | |
| Slotted cheese head screw | |||
| Snap ring | |||
| Snap ring plier | |||
| Surgical microscope with camera | Leica | Leica M651 | |
| Titanium frames for the skinfold chamber | IROLA | 160001 | Halteblech M |
| Wire piler |
Referanslar
- Gurtner, G. C., Werner, S., Barrandon, Y., Longaker, M. T. Wound repair and regeneration. Nature. 453, 314-321 (2008).
- Martin, P. Wound healing--aiming for perfect skin regeneration. Science. 276, 75-81 (1997).
- Gabbiani, G., Gabbiani, F., Heimark, R. L., Schwartz, S. M. Organization of actin cytoskeleton during early endothelial regeneration in vitro. Journal of Cell Science. 66, 39-50 (1984).
- Belkacemi, A., et al. IP3 Receptor-Dependent Cytoplasmic Ca(2+) Signals Are Tightly Controlled by Cavbeta3. Cell Reports. 22, 1339-1349 (2018).
- Breuing, K., Eriksson, E., Liu, P., Miller, D. R. Healing of partial thickness porcine skin wounds in a liquid environment. Journal of Surgical Research. 52, 50-58 (1992).
- Colwell, A. S., Krummel, T. M., Kong, W., Longaker, M. T., Lorenz, H. P. Skin wounds in the MRL/MPJ mouse heal with scar. Wound Repair and Regeneration. 14, 81-90 (2006).
- Vagesjo, E., et al. Accelerated wound healing in mice by on-site production and delivery of CXCL12 by transformed lactic acid bacteria. Proceedings National Academy of Science. 115, 1895-1900 (2018).
- Eming, S. A., et al. Accelerated wound closure in mice deficient for interleukin-10. American Journal of Pathology. 170, 188-202 (2007).
- Sorg, H., Krueger, C., Vollmar, B. Intravital insights in skin wound healing using the mouse dorsal skin fold chamber. Journal of Anatomy. 211, 810-818 (2007).
- Laschke, M. W., Vollmar, B., Menger, M. D. The dorsal skinfold chamber: window into the dynamic interaction of biomaterials with their surrounding host tissue. European Cell and Materials. 22, 147-164 (2011).
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2, 2369-2392 (2012).
- Hofmann, F., Belkacemi, A., Flockerzi, V. Emerging Alternative Functions for the Auxiliary Subunits of the Voltage-Gated Calcium Channels. Current Molecular Pharmacology. 8, 162-168 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Chen, L., et al. Protein 4.1G Regulates Cell Adhesion, Spreading, and Migration of Mouse Embryonic Fibroblasts through the beta1 Integrin Pathway. Journal of Biological Chemistry. 291, 2170-2180 (2016).
- Dewor, M., et al. Macrophage migration inhibitory factor (MIF) promotes fibroblast migration in scratch-wounded monolayers in vitro. FEBS Letters. 581, 4734-4742 (2007).
- Handly, L. N., Wollman, R. Wound-induced Ca(2+) wave propagates through a simple release and diffusion mechanism. Molecular Biology of the Cell. 28, 1457-1466 (2017).
- Cappiello, F., Casciaro, B., Mangoni, M. L. A Novel In Vitro Wound Healing Assay to Evaluate Cell Migration. Journal of Visualized Experiments. (133), 56825 (2018).
- Hernandez Vera, R., Schwan, E., Fatsis-Kavalopoulos, N., Kreuger, J. A Modular and Affordable Time-Lapse Imaging and Incubation System Based on 3D-Printed Parts, a Smartphone, and Off-The-Shelf Electronics. PLoS One. 11, 0167583 (2016).
- Reinhart-King, C. A. Endothelial cell adhesion and migration. Methods in Enzymology. 443, 45-64 (2008).
- Treloar, K. K., Simpson, M. J. Sensitivity of edge detection methods for quantifying cell migration assays. PLoS One. 8, 67389 (2013).
- Pirkmajer, S., Chibalin, A. V. Serum starvation: caveat emptor. American Journal of Physiology-Cell Physioliology. 301, 272-279 (2011).
- Papenfuss, H. D., Gross, J. F., Intaglietta, M., Treese, F. A. A transparent access chamber for the rat dorsal skin fold. Microvascular Research. 18, 311-318 (1979).
- Deoliveira, D., et al. An ear punch model for studying the effect of radiation on wound healing. International Journal of Radiation Biology. 87, 869-877 (2011).
- Chen, L., Mirza, R., Kwon, Y., DiPietro, L. A., Koh, T. J. The murine excisional wound model: Contraction revisited. Wound Repair and Regeneration. 23, 874-877 (2015).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiment. (75), e50265 (2013).
- Wahedi, H. M., Park, Y. U., Moon, E. Y., Kim, S. Y. Juglone ameliorates skin wound healing by promoting skin cell migration through Rac1/Cdc42/PAK pathway. Wound Repair and Regeneration. 24, 786-794 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır