Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Scratch Migration Assay und Dorsal Skinfold Kammer für In Vitro und In Vivo Analyse der Wundheilung
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll für einen In-vitro-Scratch-Assay mit primären Fibroblasten und für einen in vivo Hautwundheilungstest bei Mäusen vor. Beide Assays sind einfache Methoden zur Beurteilung der In-vitro- und In-vivo-Wundheilung.
Zusammenfassung
Die zahngeschädigte Wundheilung ist ein großes Anliegen für Patienten mit Diabetes und für ältere Menschen, und es besteht bedarf einer wirksamen Behandlung. Geeignete In-vitro- und In-vivo-Ansätze sind für die Identifizierung neuer Zielmoleküle für medikamentöse Behandlungen unerlässlich, um den Wundheilungsprozess der Haut zu verbessern. Wir identifizierten die Untereinheit 3 von spannungsgebundenen Kalziumkanälen (Cav3) als potenzielles Zielmolekül, um die Wundheilung in zwei unabhängigen Assays zu beeinflussen, d.h. dem In-vitro-Scratch-Migration-Assay und dem in vivo dorsalen Hautfaltenkammermodell. Primäre mausembryonale Fibroblasten (MEFs) akut isoliert aus Wildtyp (WT) undCav3-defizienten Mäusen(Cav3 KO) oder Fibroblasten, die akut von mit siRNA behandelten WT-Mäusen isoliert wurden, um die Expression des Cacnb3-Gens zu regulieren , kodierte Cav3,wurden verwendet. Auf eine konfluente Zellmonoschicht wurde ein Kratzer aufgebracht, und auf den Lückenschluss folgten mikroskopische Bilder zu definierten Zeitpunkten bis zur vollständigen Wiederbesiedlung der Lücke durch die wandernden Zellen. Diese Bilder wurden analysiert, und die Zellmigrationsrate wurde für jede Bedingung bestimmt. In einem In-vivo-Test implantierten wir eine dorsale Hautfaltenkammer auf WT- und Cav3 KO-Mäuse, legten eine definierte kreisförmige Wunde von 2 mm Durchmesser auf, bedeckten die Wunde mit einem Glasdeckel, um sie vor Infektionen und Austrocknung zu schützen, und überwachten den makroskopischen Wundverschluss. im Laufe der Zeit. Bei Cacnb3-Gen-mangelhaftenMäusen war der Wundverschluss deutlich schneller. Da die Ergebnisse der in vivo und der In-vitro-Assays gut korrelieren, kann der In-vitro-Assay für das Hochdurchsatz-Screening nützlich sein, bevor die In-vitro-Treffer des in vivo Wundheilungsmodells validiert werden. Was wir hier für Wildtyp-und Cav-3-defizienten Mäusen oder Zellen gezeigt haben, könnte auch für andere Moleküle als Cav3 gelten.
Einleitung
Die Wundheilung der Haut beginnt unmittelbar nach der Hautverletzung, um die Integrität der Haut wiederherzustellen und den Organismus vor Infektionen zu schützen. Der Wundheilungsprozess durchläuft vier überlappende Phasen; Gerinnung, Entzündung, neue Gewebebildung und Gewebeumbau1. Die Zellmigration ist in diesen Phasen von entscheidender Bedeutung. Entzündliche Zellen, Immunzellen, Keratinozyten, Endothelzellen und Fibroblasten werden zu verschiedenen Zeitpunkten aktiviert und dringen in den Wundbereichein 2. Methoden zur Untersuchung der Wundheilung in vitro und in vivo sind von großem Interesse, nicht nur um die zugrunde liegenden Mechanismen zu verstehen, sondern auch um neue Medikamente zu testen und neue Strategien zu entwickeln, die darauf abzielen, die Wundheilung der Haut zu verbessern und zu beschleunigen.
Zum Überwachen und Analysieren der Zellmigration kann der Scratch-Migrationstest verwendet werden. Es wird oft als in vitro Wundheilung assay bezeichnet. Diese Methode erfordert eine Zellenkultureinrichtung3. Es ist ein einfaches Verfahren, es gibt keine Notwendigkeit für High-End-Ausrüstung und der Assay kann in den meisten zellbiologischen Laboratorien durchgeführt werden. Bei diesem Test entsteht ein zellfreier Bereich durch die mechanische Störung einer Konfluentzellmonoschicht, vorzugsweise epitheliale oder endotheliale Zellen oder Fibroblasten. Zellen am Rand des Kratzers werden migriert, um die erstellte Lücke wieder aufzufüllen. Die Quantifizierung des abnehmenden zellfreien Bereichs im Zeitverlauf ähnelt der Migrationsrate und gibt die Zeit an, die die Zellen benötigen, um die Lücke zu schließen. Zu diesem Zweck können die Forscher entweder akut isolierte Zellen von WT-Mäusen oder Mäusen ohne ein Gen von Interesse4oder verewigte Zellen aus zuverlässigen Zellrepositorien verwenden. Der Kratztest ermöglicht die Untersuchung des Einflusses pharmakologisch aktiver Verbindungen oder der Wirkung transfizierter cDNAs oder siRNAs auf die Zellmigration.
In vivo ist die Wundheilung ein komplexer physiologischer Prozess, der verschiedene Zelltypen wie Keratinozyten, Entzündungszellen, Fibroblasten, Immunzellen und Endothelzellen erfordert, um die körperliche Unversehrtheit der Haut so schnell wie möglich wiederherzustellen1 . Verschiedene Methoden zur Erforschung der In-vivo-Wundheilung wurden in denletzten5,6,7,8entwickelt und angewendet. Die in diesem Artikel beschriebene dorsale Hautfaltenkammer wurde zuvor für Die Wundheilungstests9verwendet. Es wird als modifiziertes dorsales Hautfaltenkammerpräparat für Mäuse verwendet. Das modifizierte Skinfold-Kammermodell hat mehrere Vorteile. 1) Es minimiert die Hautkontraktion, was die Beobachtung des Wundheilungsprozesses verhindert und die Wundreparatur bei Mäusen beeinflussen kann. 2) Diese Kammer nutzt die Abdeckung der Wunde mit einem Glasdeckel, Verringerung von Gewebeinfektionen und Austrocknung, die den Heilungsprozess verzögern könnte. 3) Blutfluss und Vaskularisation können direkt überwacht werden. 4) Es ermöglicht die repetitive topische Anwendung von pharmakologisch aktiven Verbindungen und Reagenzien, um die Wunde zu behandeln und die Heilung zu beschleunigen9,10.
Wir identifizierten die Untereinheit 3 von hochspannungsgeschlossenen Kalziumkanälen (Cav3) als potenzielles Zielmolekül, um die Wundheilung der Haut mit zwei unabhängigen Protokollen zu beeinflussen, d.h. dem In-vitro-Scratch-Migration-Assay und dem in vivo dorsalen Hautfaltenkammermodell. Für den In-vitro-Test verwendeten wir primäre Fibroblasten, diese Zellen exprimieren zwar das Cacnb3-Gen, das für das Cav3-Protein kodiert, aber es fehlt an Depolarisations-induzierten Ca2+-Zufluss- oder spannungsabhängigen Ca2+-Strömen. Wir beschrieben eine neuartige Funktion von Cav3 in diesen Fibroblasten: Cav3 bindet an den Inositol 1,4,5-Trisphosphat-Rezeptor (IP3R) und schränkt die Calciumfreisetzung aus dem endoplasmatischen Retikulum ein. Die Deletion des Cacnb3-Gens bei Mäusen führt zu einer erhöhten Empfindlichkeit des IP3R für IP3, einer verbesserten Zellmigration und einer erhöhten Hautwundreparatur4.
Protokoll
Alle Versuchsverfahren wurden in Übereinstimmung mit den Ethik-Regeln und den Tierschutzausschüssen des Saarlandes und der Universität des Saarlandes genehmigt und durchgeführt.
1 Primäre Zellkultur und siRNA-Transfektion
HINWEIS: Bei der beschriebenen Methode werden primäre Fibroblasten verwendet. Diese Zellen spielen eine entscheidende Rolle bei der Wundheilung und Der Umgestaltung des Gewebes11. In diesem Experiment wurde das Cacnb3-Gen, das die Untereinheit Cav3 aus hochspannungsgebundenen Kalziumkanälen12 kodiert, down-reguliert, wodurch seine Rolle bei der Zellmigration in vitro und der Hautwundreparatur in vivo4gezeigt wurde.
- Vorbereitung von siRNA: Vor der Rekonstituierung der siRNAs zentrieren Sie die Rohre kurz, um sicherzustellen, dass sich der Inhalt am Boden befindet. Rekonstituieren Sie die siRNAs in einem 100-L-RNase-freien Puffer (100 mM Kaliumacetat, 30 mM HEPES, pH 7,5), der vom Hersteller in einer Konzentration von 20 m bereitgestellt wird. Dies ist eine Aktienlösung von siRNAs.
- Aliquot diese Lagerlösung bei 10 l pro Tube (20 M Konzentration) und lagern Sie bei -20 °C bis zur Verwendung.
- Markieren Sie mit einem ultrafeinen permanenten Marker eine 6-Well-Platte mit einer horizontalen Linie an der Unterseite jedes Brunnens, um immer den gleichen Kratzbereich von Interesse identifizieren zu können und seinem Verschluss zu folgen.
HINWEIS: 6-Well-Kulturplatten wurden in diesem Test verwendet, weil sie groß genug sind, um genügend Platz und Flexibilität zu bieten, um einen konsistenten, reproduzierbaren und vertikalen Kratzer mit einer 200-L-Pipettenspitze über die Zellmonoschicht aufzutragen. Wenn eine begrenzte Anzahl von Zellen zur Verfügung steht, wäre eine Alternative und wahrscheinlich der kosteneffiziente Weg, 12- oder 24-Well-Kulturplatten zu verwenden. - Plattenprimär-Fibroblasten, isoliert von den Wildtyp- und 3-defizienten Mäusen4, in einer 6-Well-Platte mit einer Dichte von 5 x 105 Zellen/Well in Gegenwart von 2 ml Dulbeccos modifiziertem Eagle-Medium (DMEM), ergänzt durch 10% fetales Rinderserum (FCS).
HINWEIS: 5 x 105 Zellen pro Brunnen wurden für 6-Well-Kulturplatte und für primäre Maus-Fibroblasten etabliert. Tests können erforderlich sein, wenn 12- oder 24-Well-Zellkulturplatten oder andere Zelltypen verwendet werden, die unterschiedlich groß sein können. Zellen sollten in einer sterilen Umgebung wie biologischen Sicherheitsschränken der Klasse II behandelt werden. - Beschriften Sie die 6-Well-Platte mit dem Zelltyp, dem Genotyp und dem Datum.
- Bewegen Sie die 6-Well-Platte in den Zellkultur-Inkubator und halten Sie die Zellen bei 37 °C und 5%CO2 für 24 h.
- Am nächsten Tag die Platte aus dem Brutkasten nehmen, das Zellkulturmedium aus dem Brunnen saugen, entsorgen und durch 2,25 ml frisches Kulturmedium ersetzen, indem man es vorsichtig an die Wand des Brunnens anfügt.
- Um Fibroblasten mit siRNAs zu transfekieren, verwenden Sie ein lipidbasiertes Transfektionsreagenz, wie vom Hersteller empfohlen.
- Etikettieren Sie für jede Transfektion zwei Mikrozentrifugenrohre. Fügen Sie im ersten das Transfektionsreagenz hinzu und verdünnen Sie es mit einem reduzierten Serummedium von 150 l. In der zweiten Röhre 1,5 l siRNA (Cacnb3 siRNA-1, Cacnb3 siRNA-2 oder scrambled siRNA als Negativkontrolle) hinzufügen und mit 150 l reduziertem Serummedium verdünnen.
- Die verdünnte siRNA in die Röhre geben, die ein verdünntes Transfektionsreagenz enthält, und Wirbel für 2 s. Inkubieren Sie das Gemisch 5 min bei 21 °C.
- Beschriften mit Cacnb3 siRNA-1, Cacnb3 siRNA-2 oder Rührbrunnen. Fügen Sie den Zellen 250 l des siRNA-transfection Reagenzgemisches tropfenweise hinzu.
- Legen Sie die 6-Well-Kulturplatte wieder in den Inkubator und halten Sie die Zellen bei 37 °C und 5%CO2 für 72 h.
- Um die Effizienz des Cacnb3-Gen-Silencings zu überprüfen, sammeln Sie transfizierte Zellen und führen Sie eine Immunoblot-Analyse durch, wie zuvorbeschrieben 4.
2. In-vitro-Wundheilungstest (Scratch-Migration-Assay)
- Nehmen Sie die Zellkulturplatte aus dem Inkubator und untersuchen Sie die Zellen unter dem Mikroskop mit dem 10-fachen Objektiv. Beginnen Sie mit dem Scratch-Assay nur, wenn sie 100% Konfluenz erreicht haben.
HINWEIS: Für die Genauigkeit und Reproduzierbarkeit ist 100% Konfluenz ein obligatorischer Faktor für den Start des Scratch-Migration-Assays. Daher ist es wichtig, die gleiche Anzahl von Zellen in die Kulturbrunnen zu saaten, jeden Brunnen auf Diekonfluenz zu untersuchen und den Kratzer gleichzeitig anzuwenden (Tag 0 Konfluency). Das längere Warten, nachdem die Zellen 100% Konfluenz erreicht haben, kann unterschiedliche Reaktionen hervorrufen. - Sobald die Zelle 100% Konfluenz erreicht hat, saugen Sie das Kulturmedium aus dem Brunnen und entsorgen Sie es.
- Verwenden Sie eine Pipettenspitze (200 l), um manuell einen Kratzer vertikal zur horizontalen Linie zu erstellen, die am unteren Rand des Brunnens markiert ist, über die konfluente Zellmonolayer in der Mitte des Brunnens.
- Spülen Sie jeweils gut zweimal mit 2 ml Phosphat-gepufferter Saline (PBS) (137 mM NaCl, 2,7 mM KCl, 1,5 mM KH2PO4, 8,1 mM Na2HPO4, pH 7,4), um die freigesetzten Faktoren aus beschädigten Zellen, losen Zellen und Schmutz aus dem zerkratzten Bereich zu entfernen. Fügen Sie 2 ml PBS vorsichtig gegen die Wand des Brunnens hinzu, um zu vermeiden, dass zellengut von der Zellkultur gelöst werden.
- Fügen Sie 2 ml Zellkulturmedium, das entweder 10% Serum oder 1% Serum enthält, sorgfältig zu jedem Brunnen hinzu.
HINWEIS: Es wird empfohlen, den Kratztest unter 10% Serum und unter 1% Serum durchzuführen, um zu bestätigen, dass der beobachtete Effekt nur durch die Zellproliferation und -migration oder nur durch Zellmigration verursacht wird. - Bewegen Sie die Platte auf die Mikroskopstufe und erfassen Sie helle Feldbilder des zellfreien Bereichs (zwei Bereiche pro Brunnen) unmittelbar nach dem Kratzen (t=0h) bei einer 10-fachen Vergrößerung mit einem Lichtmikroskop. Um immer den gleichen Bereich des Kratzers abzubilden, verwenden Sie die horizontale Linie, die in Schritt (1.3) vorbereitet wurde, und nehmen Sie ein Bild über dieser Linie und ein Bild unterhalb dieser Linie. Speichern Sie Bilder als TIFF oder JPEG.
- Da das Mikroskopstadium den Zellwachstumszustand nicht aufrechterhält, bewegen Sie die Platte zurück in den Zellkultur-Inkubator und halten Sie die Zellen bei 37 °C und 5%CO2.
- Nach 6, 10 und 30 h die Platte wieder auf die Mikroskopstufe bewegen und Bilder auf die gleiche Weise aufnehmen, wie in Schritt 2.6 beschrieben.
HINWEIS: Diese Zeitpunkte wurden für das beschriebene Verfahren und für primäre Fibroblasten festgelegt. Während des ersten Pilotversuchs wurden weitere Zeitpunkte getestet, um zu sehen, wie schnell Fibroblasten die Lücke wieder bevölkern. Obwohl 0, 6, 10 und 30 h vernünftige Startzeitpunkte sind, sollten die Prüfer die geeigneten Zeitpunkte für jede Anwendung und für jeden Zelltyp optimieren und festlegen. Die genauere Alternative, falls verfügbar, wäre die Zeitraffermikroskopie. - Mit ImageJ13, quantifizieren Sie den anfänglichen zellfreien Bereich (100%) und die verbleibende Fläche nach 6, 10 und 30 h (Abbildung 1). Der Prozentsatz der Scratch-Fläche, die durch migrierende Zellen neu aufgefüllt wird, wird dann relativ zum ursprünglichen Scratch-Bereich berechnet.
3. Analyse der Kratzfläche
- Öffnen Sie ImageJ Software13.
- Laden Sie das erste Bild als JPEG hoch (z. B. 24-Bit-RGB-Bilder 1360x1024), indem Sie das Bild in die ImageJ-Menüleiste ablegen.
- Wählen Sie die Schaltfläche Freihandauswahl und markieren Sie den zellfreien Bereich
- Klicken Sie auf Analysieren und wählen Sie Measureaus. Es wird ein Fenster mit den Ergebnissen angezeigt, das den Flächenwert enthält.
- Übertragen Sie diesen Wert in eine Analysetabelle.
- Wiederholen Sie die Schritte 3.2-3.5 für jedes Bild vom Zeitpunkt 0 h und starten Sie dann erneut für die nächsten Zeitpunkte 6, 10 und 30 h.
- Berechnen Sie den Prozentsatz der Scratch-Fläche, die durch Migrieren von Zellen nach 6, 10 und 30 h für jeden Scratch neu aufgefüllt wird, indem Sie die folgende Gleichung verwenden:
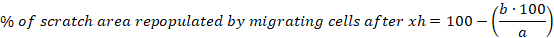
a = zellfreier Bereich des anfänglichen Kratzers, b = zellfreier Bereich nach 6 h - Berechnen Sie den Mittelwert und den Standardfehler des Mittelwerts (S.E.M.) für den Prozentsatz der Scratch-Fläche, der durch migrierende Zellen nach 6 h neu aufgefüllt wird. Zeigen Sie Daten als Spaltenbalkendiagramm oder Streudiagramm an.
4. In vivo HautWundheilungstest
HINWEIS: Für diese Studie werden C57BL/6 Wildmännchen (8-12 Wochen alt mit 22-26 g Körpergewicht) und Cav-3-mäuse als Kontrollmittel verwendet.
- Einen Tag vor Beginn des Experiments, Autoklaven alle chirurgischen Instrumente, Schrauben, Muttern und Titanrahmen für die Hautfaltkammervorbereitung verwendet werden.
HINWEIS: Der Titanrahmen besteht aus zwei symmetrischen komplementären Hälften und verfügt über ein kreisförmiges Beobachtungsfenster, in dem die Wunde aufgetragen und anschließend mikroskopisch dargestellt wird (siehe Abbildung 2a). - Anästhetisieren Sie eine Wild-Typ- oder 3-mangelhafte Maus (22-26 g Körpergewicht) durch intraperitoneale (i.p.) Injektion von 0,1 ml Saline/10 g Körpergewicht, das eine Mischung aus Ketamin (75 mg/kg Körpergewicht) und Xylazin (25 mg/kg Körpergewicht) enthält. Überprüfen Sie die Tiefe der Anästhesie durch die fehlende Reaktion auf eine Zehenklemme.
HINWEIS: Diese Injektion gibt etwa 30 min chirurgische Anästhesie und die Tiefe der Anästhesie muss durch den chirurgischen Eingriff durch die Überprüfung der Reflexe der Maus kontrolliert werden. - Um Trockenheit oder Schädigung der Augen zu vermeiden, tragen Sie die ophthalmologische Salbe auf beide Augen auf und wiederholen Sie die Anwendung bei Bedarf.
- Vorsichtig rasieren Sie die Maus dorsum, mit einem elektrischen Rasierer gefolgt von der Anwendung einer Enthaarungscreme auf den rasierten Bereich, um alle verbleibenden Haare zu entfernen. Achten Sie darauf, die Maushaut nicht zu verletzen. Lassen Sie die Enthaarungscreme für ca. 10 min vollständig alle Haare zu entfernen.
- Bereiten Sie die Titankammer vor, indem Sie einen Teil des symmetrischen Titankammerrahmens nehmen und die Verbindungsschrauben mit Muttern auf einer Seite befestigen. Diese Nüsse dienen als Abstandsgeber, um 400-500 m zwischen den beiden symmetrischen Teilen der Kammer zu halten, um eine Kompression der Blutgefäße in der Haut zu vermeiden.
- Entfernen Sie die Creme von der Rückseite der Maus und reinigen Sie den haarfreien Bereich mit warmem (35-37 °C) Leitungswasser.
- Stellen Sie sicher, dass der Ort, an dem eine Operation durchgeführt werden kann, sauber, warm (37 °C) und befeuchtet ist.
- Desinfizieren Sie den haarfreien Bereich der Maus mit dem Hautdesinfektionsmittel. Nehmen Sie eine Falte der hinteren Haut der Maus vor einer Lichtquelle und positionieren Sie die mittlere Linie der Doppelschicht der Haut, wo die Titankammer implantiert wird. Danach fixieren Sie die Hautfalte mit einer Polypropylen-Nähte kranially und kauarisch und straffen Sie die andere Seite der Naht auf einem Metallgestell, um die Maus gefaltete Haut zu heben. Stellen Sie die Höhe des Racks ein, damit die Maus bequem sitzen kann.
- Implantieren Sie die Titankammer in die Falte der hinteren Haut der Maus, um die gefaltete dorsale Hautschicht zwischen den beiden symmetrischen Hälften des Titanrahmens einzusperren. Befestigen Sie die erste Hälfte des Titanrahmens durch Polypropylen-Nähte an ihrer oberen Kante an der Rückseite der dorsalen Hautfalte.
HINWEIS: Auf dem Titanrahmen befinden sich 8 Löcher an der oberen Kante (Abbildung 2a) und die gefaltete Haut sollte gut durch Polypropylen-Nähte auf jedem der acht Löcher fixiert werden. - Bevor Sie zum nächsten Schritt übergehen, überprüfen Sie die Reflexe der Maus, um sicherzustellen, dass die Tiefe der Anästhesie erhalten bleibt.
- An der Basis der Hautfalte, passieren Sie die beiden Verbindungsschrauben, an der ersten Hälfte der Titankammer befestigt, um die Hautfalte von hinten nach vorne zu durchdringen. Machen Sie kleine Schnitte auf der Haut (mit feiner Schere), um das reibungslose Eindringen der Verbindungsschrauben zu erleichtern.
- Lösen Sie die Maus vom Rack und legen Sie sie seitlich an. Legen Sie die zweite komplementäre Hälfte der Titankammer auf die 3 Verbindungsschrauben (siehe Abbildung 2a) und setzen Sie leichten Druck mit den Fingern, um diese Schrauben durch die zweite Hälfte des Titanrahmens zu passieren. Fixieren Sie dann beide symmetrischen Teile mit Edelstahlmuttern.
- Achten Sie bei diesem Schritt sorgfältig auf die Dichtheit der Schrauben, da sie sich lösen könnte, wenn sie zu locker ist. Im Gegensatz dazu, wenn es zu eng ist, wird es die Hautfalte drücken, den Blutfluss reduzieren und kann zu Gewebebeeinträchtigung und Nekrose führen.
HINWEIS: In Schritt 4.5 hergestellte Muttern dienen als Abstandser, um einen Abstand von 400-500 m zwischen den beiden symmetrischen Hälften der Titankammer zu halten. Die Muttern sollten so lange angezogen werden, bis ein leichter Widerstand zu spüren ist. - Schneiden Sie den restlichen Teil der Schrauben mit einer Zange.
HINWEIS: Bei diesem Schritt ist es notwendig, Laborschutzbrillen für den Augenschutz zu verwenden, falls die Schraube falsch abkommt. - Markieren Sie den Wundbereich durch einen standardisierten Biopsie-Punch (2 mm Durchmesser) in der Mitte der Haut innerhalb des Beobachtungsfensters (siehe Abbildung 2a) der Hautfaltkammer, um reproduzierbare Wundgrößen zu gewährleisten.
- Durch die Verwendung von feinen Zangen und Scheren, erstellen Sie eine kreisförmige Wunde innerhalb des markierten Bereichs, indem Sie die gesamte Haut mit Epidermis und Dermis entfernen. Die letzte Wundfläche wird etwa 3,5-4,5 mm2betragen, siehe Abbildung 2b. Reinigen Sie die Wunde mit 0,5 ml steriler Saline (0,9 % NaCl, 37 °C).
- Bedecken Sie die Wunde mit einem Glasdeckel und fixieren Sie diesen Glasdeckel mit einem Schnappring mit der Schnappringzange auf der Titankammer.
- Unmittelbar nach Abschluss des chirurgischen Eingriffs stellen Sie die Maus auf die Bildstufe eines Stereomikroskops, das mit einer Kamera ausgestattet ist, und nehmen Sie Bilder (Tag 0) unter Beleuchtung auf. Verwenden Sie die 40X Vergrößerung und speichern Sie die Bilder für zukünftige Off-Line-Analysen.
HINWEIS: Der Prüfer sollte die Bilder unmittelbar nach der Aufnahme untersuchen, um sicherzustellen, dass die Qualität für zukünftige Online-Analysen ausreicht. Die Herstellung der Hautfaltkammer und die Leistung der Hautwunde dauert etwa 30 Minuten. - Halten Sie die Maus an einem warmen Ort während der Erholung von der Anästhesie für mindestens 2 h. Danach bringen Sie Mäuse in einzelnen Käfigen zurück in die Tieranlage (12 h Hell-/Dunkelzyklus) und stellen Sie sicher, dass Mäuse Zugang zu Nahrung und Wasser haben.
- Drei Tage nach der Wundung legen Sie die Maus in einen Maus-Restrainer und fixieren Sie den Restrainer auf der Bildstufe.
- Platzieren Sie die Bühne unter einem Stereomikroskop, das mit einer Kamera ausgestattet ist. Nehmen Sie Bilder unter Beleuchtung mit 40-facher Vergrößerung auf, zeichnen Sie alle Bilder auf und speichern Sie sie für zukünftige Off-Line-Analysen
- Wiederholen Sie die Schritte 4.20 und 4.21 erneut an Tag 6, 10 und Tag 14 nach der Verwundung.
- Verwenden Sie die Wundbilder für die Off-Line-Analyse in ImageJ13. Der Wundbereich an Tag 0 wird als 100 % betrachtet und der Wundverschluss im Laufe der Zeit wird relativ zum ursprünglichen Wundbereich gezeichnet. Repräsentative Ergebnisse sind in Abbildung 2c,ddargestellt.
- Berechnen des Prozentsatzes (%) der Wundfläche zu jedem Zeitpunkt mit der folgenden Gleichung:
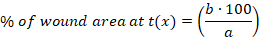
x: Zeitpunkt (Tag 0, 3, 10 oder 14), a: Wundbereich am Tag 0, b: Wundbereich zum Zeitpunkt x
Ergebnisse
Der Kratzer-Assay wurde an einer Konfluentzellmonoschicht von Wildtyp- und 3-mangelhaften MEFs durchgeführt (Abbildung 1c). Nach dem Ausführen des "Kratzers" mit einer 200-L-Pipettenspitze wandern Zellen beider Genotypen in den Kratzbereich und schließen die Lücke. Die Bilder wurden nach 6, 10 und 30 h aufgenommen (Abbildung 1a). Die Zellmigration wurde als Prozentsatz quantifiziert (%) der Kratzerfläche neu bevölkert durc...
Diskussion
In diesem Manuskript beschreiben wir einen in vitro und in vivo Wundheilungstest und korrelieren die erzielten Ergebnisse. Für den In-vitro-Test verwendeten wir primäre Maus-Fibroblasten4,14,15, die eine wichtige Rolle bei der Wundheilung und Gewebeumgestaltung11spielen. Andere anhängliche Zelltypen, die als Monolayer wachsen (z. B. Epithelzellen, Endothelzellen, Keratinozyten), können ebenfalls verwe...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Dr. Petra Weissgerber und der Transgene Unit der SPF Tieranlage (Projekt P2 des SFB 894) der Medizinischen Fakultät und der Tiereinrichtung am Institut für Klinische und Experimentelle Chirurgie der Medizinischen Fakultät der Universität des Saarlandes, Homburg. Wir danken Dr. Andreas Beck für die kritische Lektüre des Manuskripts. Gefördert wurde die Studie von der Deutschen Forschungsgemeinschaft (DFG) Sonderforschungsbereich (SFB) 894, Projekt A3 bis A.B. und V.F.).
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9 % NaCl | |||
| 1 ml syringes | BD Plastipak | 303172 | |
| 6 well plate | Corning | 3516 | |
| Biopsy punch | Kai Industries | 48201 | 2 mm |
| Cacnb3 Mouse siRNA Oligo Duplex (Locus ID 12297) | Origene | SR415626 | |
| Depilation cream | any depilation cream | ||
| Dexpanthenol 5% (BEPANTHEN) | Bayer | 3400935940179.00 | (BEPANTHEN) |
| Dihydroxylidinothiazine hydrochloride (Xylazine) | Bayer Health Care | Rompun 2% | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco by life technologies | 41966-029 | |
| Fetal bovine serum | Gibco by life technologies | 10270-106 | |
| Hexagon full nut | |||
| Ketamine hydrochloride | Zoetis | KETASET | |
| Light microscope | Keyence, Osaka, Japan | BZ-8000 | Similar microscopes might be used |
| Lipofectamine RNAiMAX Transfection Reagent | Thermo Fisher Scientific | 13778075 | |
| Micro-forceps | |||
| Micro-Scissors | |||
| Mouse restrainer | Home-made | ||
| Normal scissors | |||
| Objective | Nikon | plan apo 10x/0.45 | |
| Opti-MEM | Gibco by life technologies | 51985-026 | |
| Polypropylene sutures | |||
| Screwdriver | |||
| Skin disinfectant (octeniderm) | Schülke & Mayr GmbH | 118212 | |
| Slotted cheese head screw | |||
| Snap ring | |||
| Snap ring plier | |||
| Surgical microscope with camera | Leica | Leica M651 | |
| Titanium frames for the skinfold chamber | IROLA | 160001 | Halteblech M |
| Wire piler |
Referenzen
- Gurtner, G. C., Werner, S., Barrandon, Y., Longaker, M. T. Wound repair and regeneration. Nature. 453, 314-321 (2008).
- Martin, P. Wound healing--aiming for perfect skin regeneration. Science. 276, 75-81 (1997).
- Gabbiani, G., Gabbiani, F., Heimark, R. L., Schwartz, S. M. Organization of actin cytoskeleton during early endothelial regeneration in vitro. Journal of Cell Science. 66, 39-50 (1984).
- Belkacemi, A., et al. IP3 Receptor-Dependent Cytoplasmic Ca(2+) Signals Are Tightly Controlled by Cavbeta3. Cell Reports. 22, 1339-1349 (2018).
- Breuing, K., Eriksson, E., Liu, P., Miller, D. R. Healing of partial thickness porcine skin wounds in a liquid environment. Journal of Surgical Research. 52, 50-58 (1992).
- Colwell, A. S., Krummel, T. M., Kong, W., Longaker, M. T., Lorenz, H. P. Skin wounds in the MRL/MPJ mouse heal with scar. Wound Repair and Regeneration. 14, 81-90 (2006).
- Vagesjo, E., et al. Accelerated wound healing in mice by on-site production and delivery of CXCL12 by transformed lactic acid bacteria. Proceedings National Academy of Science. 115, 1895-1900 (2018).
- Eming, S. A., et al. Accelerated wound closure in mice deficient for interleukin-10. American Journal of Pathology. 170, 188-202 (2007).
- Sorg, H., Krueger, C., Vollmar, B. Intravital insights in skin wound healing using the mouse dorsal skin fold chamber. Journal of Anatomy. 211, 810-818 (2007).
- Laschke, M. W., Vollmar, B., Menger, M. D. The dorsal skinfold chamber: window into the dynamic interaction of biomaterials with their surrounding host tissue. European Cell and Materials. 22, 147-164 (2011).
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2, 2369-2392 (2012).
- Hofmann, F., Belkacemi, A., Flockerzi, V. Emerging Alternative Functions for the Auxiliary Subunits of the Voltage-Gated Calcium Channels. Current Molecular Pharmacology. 8, 162-168 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Chen, L., et al. Protein 4.1G Regulates Cell Adhesion, Spreading, and Migration of Mouse Embryonic Fibroblasts through the beta1 Integrin Pathway. Journal of Biological Chemistry. 291, 2170-2180 (2016).
- Dewor, M., et al. Macrophage migration inhibitory factor (MIF) promotes fibroblast migration in scratch-wounded monolayers in vitro. FEBS Letters. 581, 4734-4742 (2007).
- Handly, L. N., Wollman, R. Wound-induced Ca(2+) wave propagates through a simple release and diffusion mechanism. Molecular Biology of the Cell. 28, 1457-1466 (2017).
- Cappiello, F., Casciaro, B., Mangoni, M. L. A Novel In Vitro Wound Healing Assay to Evaluate Cell Migration. Journal of Visualized Experiments. (133), 56825 (2018).
- Hernandez Vera, R., Schwan, E., Fatsis-Kavalopoulos, N., Kreuger, J. A Modular and Affordable Time-Lapse Imaging and Incubation System Based on 3D-Printed Parts, a Smartphone, and Off-The-Shelf Electronics. PLoS One. 11, 0167583 (2016).
- Reinhart-King, C. A. Endothelial cell adhesion and migration. Methods in Enzymology. 443, 45-64 (2008).
- Treloar, K. K., Simpson, M. J. Sensitivity of edge detection methods for quantifying cell migration assays. PLoS One. 8, 67389 (2013).
- Pirkmajer, S., Chibalin, A. V. Serum starvation: caveat emptor. American Journal of Physiology-Cell Physioliology. 301, 272-279 (2011).
- Papenfuss, H. D., Gross, J. F., Intaglietta, M., Treese, F. A. A transparent access chamber for the rat dorsal skin fold. Microvascular Research. 18, 311-318 (1979).
- Deoliveira, D., et al. An ear punch model for studying the effect of radiation on wound healing. International Journal of Radiation Biology. 87, 869-877 (2011).
- Chen, L., Mirza, R., Kwon, Y., DiPietro, L. A., Koh, T. J. The murine excisional wound model: Contraction revisited. Wound Repair and Regeneration. 23, 874-877 (2015).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiment. (75), e50265 (2013).
- Wahedi, H. M., Park, Y. U., Moon, E. Y., Kim, S. Y. Juglone ameliorates skin wound healing by promoting skin cell migration through Rac1/Cdc42/PAK pathway. Wound Repair and Regeneration. 24, 786-794 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten