A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نمذجة طيف الحجم للفقاريات والأسماك في النظم الإيكولوجية للتيار
In This Article
Summary
وهذا بروتوكول لنمذجة طيف الحجم (توسيع العلاقة بين الكتلة الفردية والكثافة السكانية) للبيانات المجمعة عن الأسماك واللافقاريات من الجداول والأنهار القابلة للخوض. وتشمل الأساليب ما يلي: التقنيات الميدانية لجمع الأسماك الكمية والعينات اللافقارية؛ والتقنيات الميدانية لجمع الأسماك الكمية والعينات اللافقارية؛ والتقنيات الميدانية لجمع الأسماك الكمية و أساليب المختبر لتوحيد البيانات الميدانية؛ وتحليل البيانات الإحصائية.
Abstract
حجم الطيف هو معكوس، العلاقة التحجيم الكلومتري بين متوسط كتلة الجسم (M) وكثافة (D) من الأفراد داخل المجتمع الإيكولوجي أو شبكة الغذاء. والأهم من ذلك، يفترض طيف الحجم أن الحجم الفردي، بدلاً من خصائص الأنواع السلوكية أو خصائص تاريخ الحياة، هو المحدد الرئيسي للوفرة داخل النظام الإيكولوجي. وهكذا، على عكس العلاقات اللامترية التقليدية التي تركز على البيانات على مستوى الأنواع (على سبيل المثال، متوسط حجم جسم الأنواع مقابل الكثافة السكانية)، فإن تحليلات الأطياف الحجم هي "ترنح" - يتم تحديد العينات الفردية فقط من حيث حجمها، دون النظر في الهوية التصنيفية. نماذج الأطياف الحجم هي تمثيل اتّصال فعّال للشبكات الغذائية التقليدية والمعقدة ويمكن استخدامها في سياقات وصفية وتنبؤية (مثل التنبؤ باستجابات المستهلكين الكبار للتغيرات في الموارد القاعدية). كما أفادت الدراسات التجريبية المستمدة من النظم الإيكولوجية المائية المتنوعة بمستويات معتدلة إلى عالية من التشابه في منحدرات الأطياف الحجمية، مما يشير إلى أن العمليات المشتركة قد تنظم وفرة الكائنات الحية الصغيرة والكبيرة في بيئات مختلفة جداً. هذا هو بروتوكول لنموذج الطيف حجم على مستوى المجتمع في تيارات قابلة للخوض. ويتألف البروتوكول من ثلاث خطوات رئيسية. أولاً، جمع الأسماك القاعية الكمية والعينات اللافقارية التي يمكن استخدامها لتقدير الكثافات المحلية. ثانياً، توحيد البيانات السمكية واللافقارية عن طريق تحويل جميع الأفراد إلى وحدات ترنحية (أي الأفراد المحددين حسب الحجم، بغض النظر عن الهوية التصنيفية)، وتلخيص الأفراد داخل صناديق قياس السجل2. ثالثاً، استخدم الانحدار الخطي لنمذجة العلاقة بين تقديرات M وD. وترد هنا تعليمات مفصلة لإكمال كل من هذه الخطوات، بما في ذلك البرمجيات المخصصة لتسهيل تقدير D وحجم الأطياف النمذجة.
Introduction
حجم الجسم علاقات التحجيم، مثل الارتباط الإيجابي بين كتلة الجسم ومعدل التمثيل الغذائي، معروفة على مستوى الكائنالحي الفردية ويجري الآن دراستها على مستويات أعلى من المنظمة 1،2،3 . هذه العلاقات المترية هي في معظم الأحيان وظائف قانون السلطة من النموذج Y = aMب، حيث Y هو متغير الفائدة (على سبيل المثال، التمثيل الغذائي، وفرة، أو حجم النطاق المنزلي)، M هو كتلة الجسم من واحد أو متوسط الفردية، b هو معامل التحجيم، وa هو ثابت. للراحة الإحصائية، غالباً ما يتم تحويل البيانات Y و M قبل التحليل ثم على غرار المعادلات الخطية لسجل النموذج (Y) = السجل (a) + b log (M)، حيث b و log ( أ) تصبح ميل النموذج الخطي واعتراض، على التوالي.
حجم الطيف هو نوع من العلاقة اللامترية التي تتنبأ الكثافة (D، عدد الأفراد لكل منطقة وحدة) أو الكتلة الحيوية (B، الكتلة الإجمالية للأفراد لكل منطقة وحدة) كدالة M (انظر القسم 4 للحصول على إضافية معلومات عن استخدام تقديرات "عادية" D أو B.) مثل غيرها من علاقات التحجيم بين M و D أو بين M و B، والطيف حجم يلعب دورا مركزيا في الإيكولوجيا الأساسية والتطبيقية. وعلى مستوى السكان، كثيراً ما يفسر علماء الأحياء العلاقات السلبية D 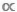 M كدليل على البقاء على قيد الحياة المعتمد على الكثافة أو كنماذج لقدرة حمل النظم الإيكولوجية (أي "قاعدة الترقق الذاتي")4، 5. وعلى مستوى المجتمع المحلي، يمكن استخدام العلاقات بين
M كدليل على البقاء على قيد الحياة المعتمد على الكثافة أو كنماذج لقدرة حمل النظم الإيكولوجية (أي "قاعدة الترقق الذاتي")4، 5. وعلى مستوى المجتمع المحلي، يمكن استخدام العلاقات بين 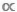 B M لدراسة آثار الاضطرابات البشرية المنشأ على مستوى المنظومة، مثل الصيد الانتقائي الحجم6و7. كما أن التحجيم المتري للD وB مع M أساسي للجهود الأخيرة لتوحيد السكان والمجتمع والبيئة2و8 و9.
B M لدراسة آثار الاضطرابات البشرية المنشأ على مستوى المنظومة، مثل الصيد الانتقائي الحجم6و7. كما أن التحجيم المتري للD وB مع M أساسي للجهود الأخيرة لتوحيد السكان والمجتمع والبيئة2و8 و9.
واحدة سمة هامة بشكل خاص من الطيف حجم هو حقيقة أنه هو تماما ترنح9،10. هذه النقطة من السهل أن تفوت عند مقارنة scatterplots من البيانات D 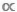 M أو B
M أو B 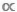 M ولكن التمييز بين نماذج taxic وtaxic هو واحد حاسم. في نماذج سيارات الأجرة، يتم استخدام قيمة M واحدة لتمثيل كتلة الجسم المتوسط لكل فرد من الأنواع معينة أو taxa11. في نماذج ترنح، يتم تقسيم جميع الأفراد داخل مجموعة بيانات بين سلسلة من الفواصل الزمنية حجم الجسم أو صناديق M، بغض النظر عن هويتهم التصنيفية12. وهذا النهج الأخير، نهج الترنح مفيد في النظم الإيكولوجية المائية حيث يظهر العديد من تاكسا نموا غير محدد ويختبر تحولات وراثية أو أكثر في سلوك التغذية؛ في هذه الحالات، فإن متوسط M واحد على مستوى الأنواع يحجب حقيقة أن الأنواع يمكن أن تملأ أدواروظيفية مختلفة طوال تاريخ حياتها9،13،14.
M ولكن التمييز بين نماذج taxic وtaxic هو واحد حاسم. في نماذج سيارات الأجرة، يتم استخدام قيمة M واحدة لتمثيل كتلة الجسم المتوسط لكل فرد من الأنواع معينة أو taxa11. في نماذج ترنح، يتم تقسيم جميع الأفراد داخل مجموعة بيانات بين سلسلة من الفواصل الزمنية حجم الجسم أو صناديق M، بغض النظر عن هويتهم التصنيفية12. وهذا النهج الأخير، نهج الترنح مفيد في النظم الإيكولوجية المائية حيث يظهر العديد من تاكسا نموا غير محدد ويختبر تحولات وراثية أو أكثر في سلوك التغذية؛ في هذه الحالات، فإن متوسط M واحد على مستوى الأنواع يحجب حقيقة أن الأنواع يمكن أن تملأ أدواروظيفية مختلفة طوال تاريخ حياتها9،13،14.
هنا، نقدم بروتوكول كامل لتحديد حجم الطيف داخل الجداول والأنهار القابلة للخوض. ويبدأ البروتوكول بأساليب أخذ العينات الميدانية لجمع البيانات اللازمة للأسماك واللافقاريات الكبيرة القاعية. وسيتم جمع الأسماك من خلال عملية أخذ العينات "استنفاد ثلاثة تمريرات". ثم سيتم تقدير وفرة من البيانات استنفاد مع طريقة زيبين15. وفي أخذ عينات الاستنفاد، تُنقل الأسماك الفردية التي تدخل في نطاق دراسة مغلقة (أي لا يمكن للأفراد الدخول أو مغادرة النطاق المغلق) من متناول اليد من خلال ثلاث عينات متعاقبة. وبالتالي، فإن عدد الأسماك المتبقية سيُستنفد تدريجيا. من هذا الاستنزاف اتّجاه, وفرة إجماليّة ضمن الدراسة مدىيستطيع كنت قدّمت بعد ذلك يحوّل إلى [د] (في سمكة لكلّ [م 2]), يستعمل ال يعرف [سورفس را] من الدراسة مدى. وسيتم جمع اللافقاريات الكلية القاعية مع عينات قياسية من المناطق الثابتة، ثم يتم تحديدها وقياسها في المختبر.
وبعد ذلك، سيتم تقسيم البيانات المجمعة عن الأسماك واللافقاريات الكبيرة بين صناديق الحجم. تقليدياً، تم استخدام مقياس اوكتاف أو السجل2 (أي مضاعفة الفواصل الزمنية) لتعيين حدود سلة الحجم16. وبمجرد وضع قائمة بصناديق الحجم، يكون تقسيم اللافقاريات الكبيرة القاعية بين صناديق الحجم الخاصة بها أمراً مباشراً لأن اللافقاريات تُعدد مباشرة كأرقام للأفراد لكل منطقة وحدة. غير أن تقدير وفرة الأسماك داخل صناديق الحجم هو أكثر تجريدا لأن هذه التقديرات مستمدة من بيانات الاستنفاد. ولذلك، تقدم تعليمات مفصلة لتقدير وفرة الأسماك داخل صناديق الحجم، بغض النظر عن الهوية التصنيفية، من بيانات عينات استنفادها.
وأخيراً، سيتم استخدام الانحدار الخطي لنمذجة طيف الحجم. هذا البروتوكول متوافق تماما مع الطريقة الأصلية والعامة من كير وديكي16 ومطابق ة للأساليب المستخدمة من قبل McGarvey وكيرك، 201817 في دراسة للأسماك والأطياف حجم اللافقاريات في تيارات فرجينيا الغربية. باستخدام هذا البروتوكول، يمكن للمحققين التأكد من أن نتائجها قابلة للمقارنة مباشرة مع الدراسات الأخرى التي تعتمد على كير وديكي16،وبالتالي تسريع فهم واسع وقوي للعلاقات حجم الجسم في المياه العذبة النظم الإيكولوجية والآليات التي تدفعها.
Protocol
تمت الموافقة على جميع الطرق الموضحة هنا من قبل اللجنة المؤسسية لرعاية الحيوانات واستخدامها (IACUC) من جامعة فرجينيا كومنولث.
1 - جمع وتجهيز عينات الأسماك
- عزل الأسماك ضمن الدراسة تصل إلى إنشاء تجميع الأسماك المغلقة
- تحديد المنبع والمصب (الاتجاه هو نسبة إلى مساح تواجه 'المنبع' وضد تيار المياه) ينتهي من الدراسة الوصول ثم وضع علامة على نهايات مع الشريط وضع علامة القابلة للإزالة.
ملاحظة: الطول الإجمالي للوصول إلى الدراسة تعسفي ولكن ينبغي أن تكون طويلة بما فيه الكفاية لتشمل مجموعة تمثيلية من أنواع الموائل المختلفة (مثل ريفلز، ويدير، وحمامات السباحة، والبنوك تقويض) الموجودة داخل تيار كامل. وفي معظم الحالات، يكون الوصول إلى الدراسة بين 100 و200 متر كافياً. - قياس عرض قناة تيار مبللة في 5-10 المقاطع، موزعة بالتساوي على طول الوصول إلى الدراسة. تقدير المساحة الإجمالية للدراسة تصل إلى متوسط عرض القناة الرطبة مضروباً في الطول الإجمالي للوصول.
- شبكات كتلة آمنة (أي السين غير العقدية مع العوامات على الخط العلوي والأوزان على الخط السفلي) عبر قناة تيار في المنبع والمصب طرفي الدراسة تصل. استخدم شبكات متوسطة إلى خشنة (6.3-9.5 مم أو شبكة 1/4-3/8 بوصة) لتقليل تراكم الحطام والانسداد. لا تستخدم الشباك الشبكية الكبيرة (> 12.7 مم) حيث ستمر الأسماك الصغيرة.
ملاحظة: قبل أخذ العينات، وإعداد مجموعة تزوير التي تشمل: '1' 8 طويلة (≥ 15 م طول) قطعة من حبل البولي بروبلين (9.5 ملم أو 3/8 بوصة قطر)؛ و '2' 8 أشرطة ربط بكاميرا. لا تستخدم الأشرطة اسئلة العمل كما يمكن أن المفاجئة ويسبب إصابة خطيرة عند تحرير حمولتها.- في نهاية المنبع من الوصول إلى الدراسة، حدد موقع شجرة أو جذر أو صخرة كبيرة أو كائن صلب آخر يمكن استخدامه لإرساء شبكة على كل جانب من الدفق. ومن المرجح أن يؤثر توافر نقاط الإرساء المناسبة على كل جانب من جانبي الدفق على موقع حدود المنبع.
- حدد قطعة واحدة من حبل البولي بروبلين وخلق حلقة في كل نهاية باستخدام عقدة bowline. استخدام عقدة القوس فقط، كما قد تصبح عقدة أخرى مختومة بشكل دائم عندما تتعرض للرطوبة والتوتر العالي. للحصول على إرشادات حول ربط عقدة bowline، انظر الشكل 1.
- التفاف الحبل حول شجرة / الجذر / الصخور وتغذية حلقة في نهاية واحدة من خلالحلقة في الطرف الآخر لإنشاء نقطة الإرساء (الشكل 2). تقصير أو إطالة مرساة الحبل عن طريق إضافة أو إزالة يلتف حول الشجرة / الجذر / الصخور.
- كرر الخطوات 1.1.3.1-1.1.3.3 لإنشاء نقطة تثبيت ثانية على الجانب الآخر من الدفق.
- إنشاء حلقة في الخطوط في كل من الزوايا الأربعة للشبكة كتلة باستخدام عقدة bowline. استخدام عقدة القوسفقط (الشكل 1).
- قم بتوصيل كلا الجانبين من الخط العلوي للشبكة كتلة (الخط مع العوامات) إلى نقاط المرساة باستخدام كام العمل التعادل إلى أسفل الأشرطة. إدراج السنانير في أي من طرفي حزام التعادل إلى أسفل في الحلقات فيزوايا الشبكة كتلة ونقاط مرساة (الشكل 2). سحب الحبل الحر من حزام التعادل إلى أسفل من خلال مشبك كام لتشديد كل نقطة اتصال.
ملاحظة: للافراج عن التوتر على المراسي (لضبط كتلة صافي الإعداد أو لإزالة شبكة كتلة عند اكتمال أخذ العينات)، الاكتئاب زر كام على كل من الأشرطة التعادل لأسفل. - تأمين الخط السفلي من شبكة كتلة (الخط مع الأوزان) عن طريق تثبيتها على البنك تيار مع حصص خيمة.
- إنشاء ختم مع الجزء السفلي من تيار باستخدام الصخور الكبيرة لدبوس صافي كتلة أسفل. وضع الصخور على جانب الشبكة التي تواجه المنبع. تأكد من أن الجزء العلوي من الشبكةلا يزال فوق مستوى المياه (الشكل 2). اضبط الارتفاع (الارتفاعات) لنقطة (نقاط) الارتساء حسب الحاجة.
- تعيين شبكة كتلة ثانية عن طريق تكرار الخطوات 1.1.3.1-1.1.3.8 في نهاية المصب من الوصول إلى الدراسة.
- تحديد المنبع والمصب (الاتجاه هو نسبة إلى مساح تواجه 'المنبع' وضد تيار المياه) ينتهي من الدراسة الوصول ثم وضع علامة على نهايات مع الشريط وضع علامة القابلة للإزالة.
- تنفيذ أول من 3 الأسماك أخذ العينات الاستنزاف يمر ضمن الوصول إلى الدراسة المغلقة. ويفترض هذا البروتوكول أن الصيادين الكهربائيين على ظهره متاحون وأن جميع أفراد طاقم المسح مدربون تدريبا ً مناسباً على استخدامه. ويمكن استخدام أساليب أخرى ولكنها قد لا تكون فعالة في جمع عينات الأسماك التمثيلية.
ملاحظة: في الجداول الصغيرة، 4-5 أشخاص هو حجم الطاقم المثالي: واحد لتشغيل الصيادين الكهربائيين، واثنين إلى صافي الأسماك الذهول، واحد أو اثنين لحمل الدلاء عقد والأسماك المكوك القبض عليها. أيضا، يمكن أن يسبب الصيد الكهربائي على ظهره إصابة كبيرة، على حد سواء لتيار الأسماك والبشر18. ولذلك، من الأهمية بمكان توخي الحذر وتلقي التدريب المناسب.- بدءا من نهاية المصب من الوصول إلى الدراسة المغلقة، وتحويل electrofisher على ظهره على والتحرك في اتجاه المنبع. التقدم ببطء، والانتقال جنبا إلى جنب في جميع أنحاء الدراسة الوصول إلى ضمان أخذ عينات من جميع الموائل في مجرى. يتم إكمال أول تمرير استنفاد عند الوصول إلى شبكة المنبع.
- دعونا أفراد الطاقم الداعمين يتبعون الزعيم (الذي يقوم بتشغيل الصيادين الكهربائيين)، وجمع الأسماك المذهولة مع شبكات تراجع كما يتم رصدها ونقلها إلى دلاء مؤقتة، ثم إلى أحواض عقد مهواة. استخدم مضخات "دلو الطعم" التي تعمل بالبطارية الصغيرة مع أحجار التبذير لضمان بقاء الأسماك التي يتم التقاطها في صحة جيدة.
- إيلاء اهتمام خاص للأسماك الصغيرة جدا، والشباب من السنة لأنها من الصعب اكتشاف والتقاط. وعندما يكون صيد أصغر الأسماك غير فعال إلى حد كبير، قد تكون النتائج متحيزة. في هذه الحالة، قد يكون من الضروري إزالة أصغر فئات حجم السجل2 من بيانات الأسماك، قبل تقدير الكثافات داخل صناديق حجم السجل2 (راجع الخطوة 3.2.2).
ملاحظة: سيختلف النجاح في صيد الأسماك المذهولة باختلاف عدد من الظروف البيولوجية والبيئية. فعلى سبيل المثال، فإن المياه العكرة التي تكون فيها الرؤية منخفضة سوف تحد من القدرة على تحديد أماكن الأسماك واحتجازها بفعالية؛ إذا كان العكر مرتفعًا جدًا، يجب إعادة جدولة أخذ العينات، أو تحديد موقع أخذ عينات بديل.
- إيلاء اهتمام خاص للأسماك الصغيرة جدا، والشباب من السنة لأنها من الصعب اكتشاف والتقاط. وعندما يكون صيد أصغر الأسماك غير فعال إلى حد كبير، قد تكون النتائج متحيزة. في هذه الحالة، قد يكون من الضروري إزالة أصغر فئات حجم السجل2 من بيانات الأسماك، قبل تقدير الكثافات داخل صناديق حجم السجل2 (راجع الخطوة 3.2.2).
- تجهيز الأسماك التي تم جمعها في أول تمريراستنفاد
- تحديد ما إذا كان التخدير سيكون مطلوباً أم لا. وغالبا ما يكون من الصعب التعامل مع الأسماك الحية، وقد يكون التخدير ضروريا لتقليل الإجهاد والإصابة بعينات الأسماك. إذا تم استخدام التخدير، هناك خياران متاحان على نطاق واسع (اعتباراً من أبريل 2019): Tricaine-S (tricaine methanesulfonate، MS-222) وثاني أكسيد الكربون (صودا الخبز).
ملاحظة: ينطوي ثلاثي الكوكايين-S على فترة احتجاز مدتها 21 يومًا قبل أن يمكن استهلاك الأسماك المكشوفة بأمان19و20 ، ولكنها حالياً (اعتباراً من أبريل 2019) هي المهدئة السمكية الوحيدة التي وافقت عليها إدارة الغذاء والدواء الأمريكية. - عند استخدام المهدئات، اتبع بعناية جميع التعليمات المقدمة مع المنتج مخدر. في جميع الحالات، مزيج مركب التخدير في حمام مائي مهواة. غمر الأسماك التي تم جمعها في الحمام حتى يتم مراقبة التخدير. بمجرد تخديره، قم بمعالجة الأسماك في أسرع وقت ممكن، حيث أن التعرض لفترات طويلة للمهدئات قد يسبب الوفاة.
- استخدام شباك الغمس الصغيرة لاسترداد الأسماك التي تم أخذ عينات منها من خزان الاحتجاز (مع أو بدون التخدير)، بشكل فردي أو على دفعات صغيرة، لتحديد الهوية. ضع العينات في صواني بلاستيكية بيضاء أو مطلية بالمينا واستخدم الملقط والنظارات المكبرة للفحص. استخدام مفاتيح تحديد الهوية المحلية أو الإقليمية (على سبيل المثال، "أسماك أوهايو")21 للمساعدة في تحديد الهوية.
- قياس الطول الكلي (من طرف من المعمة إلى نهاية الزفية الصدوفية الكاوية) لكل عينة ثم تزن على توازن الحقل. في حالة استخدام رصيد إلكتروني، حدد واحد ًا بدقة 0.1 أو 0.01 جم. الحفاظ على مربع من البلاستيك شفافة في متناول اليد لاستخدامها، حسب الضرورة، كما حيرة الرياح والمطر (يجب أن تكون كبيرة بما يكفي لتغطية التوازن والعينات التي يجري وزنها).
- تسجيل جميع المعلومات (هوية الأنواع، الطول الإجمالي، والوزن) على أوراق البيانات للماء. ويرد مثال للطباعة لورقة بيانات الأسماك في الملف التكميلي 1.
- بمجرد معالجتها، إعادة الأسماك إلى سلة عقد منفصلة مهواة / استرداد. عندما تتم معالجة جميع الأسماك، الإفراج عنها المصب من صافي كتلة المصب.
ملاحظة: إذا قمت عن طريق الخطأ الإفراج عنهم في الوصول إلى الدراسة المغلقة الخاصة بك، سوف تدمر العينة الخاصة بك! إذا تم استخدام التخدير، انتظر للإفراج حتى تتعافى جميع الأسماك وتستعيد التوازن.
- تحديد ما إذا كان التخدير سيكون مطلوباً أم لا. وغالبا ما يكون من الصعب التعامل مع الأسماك الحية، وقد يكون التخدير ضروريا لتقليل الإجهاد والإصابة بعينات الأسماك. إذا تم استخدام التخدير، هناك خياران متاحان على نطاق واسع (اعتباراً من أبريل 2019): Tricaine-S (tricaine methanesulfonate، MS-222) وثاني أكسيد الكربون (صودا الخبز).
- تنفيذ تمريرات الاستنفاد الثانية والثالثة
ملاحظة: إذا لم يكن هناك اتجاه قوي للاستنفاد في التمريرات الثلاث الأولى (أي إذا لم ينخفض عدد الأسماك التي أخذت عينات منها بشكل ملحوظ بحلول الممر الثالث)، فقد تكون هناك حاجة إلى تصاريح إضافية لتقدير وفرة الأسماك بدقة22. وإذا سمح الوقت بذلك، كثيرا ما يكون من الجيد القيام بنحو أربع أو خمس تمريرات متتالية للاستنفاد.- تحقق من أن شبكات كتلة المنبع والمصب لا تزال آمنة. إذا تم جمع حطام كبير في أي من شبكة كتلة، إزالته عن طريق الانتقاء اليدوي.
- جمع عينات تمرير استنفاد المتبقية عن طريق تكرار الخطوات 1.2-1.3. ضمان أن تظل جهود أخذ العينات متسقة بين جميع التمريرات الثلاثة. استخدام نفس وتيرة الحركة (توقيت العملية الموصى بها) ونفس أفراد الطاقم لإعادة مسح وصول أخذ العينات.
- عند الانتهاء، تفكيك شبكات كتلة وإزالة جميع المواد مرساة.
2- جمع ومعالجة عينات اللافقاريات المجهرية القاعية
- اختيار مواقع عينات اللافقاريات الكبيرة القاعية داخل حدود وصول أخذ عينات الأسماك التي تمثل الأنواع الرئيسية من الموائل الفيزيائية (على سبيل المثال، ريفلز أو أشواط) لوحظ في الوصول إلى الدراسة.
- باستخدام عينات منطقة ثابتة، جمع أول عينة اللافقاريات الكبيرة القاعية. في الجداول الضحلة مع واسعة من الحصى إلى حصاة حجم المواد، والعينات Surber وHess العينات هي الأجهزة الأكثر استخداما ولكن يمكن استخدام أي العينات منطقة ثابتة. عند أخذ عينات من أنواع أخرى من الموائل حيث لا تعمل هذه الأجهزة، راجع Merritt وآخرون. 23 وهاور ورش24.
- وضع جهاز أخذ العينات بحزم ضد أسفل تيار مع صافي جمع عينة الموجهة المصب؛ نقل الحصى كبيرة حسب الضرورة لإنشاء ختم ثابت مع الركيزة.
- استخدام سلك أو فرشاة بلاستيكية لفرك بقوة الركيزة داخل منطقة أخذ العينات لمدة 2 دقيقة، مما يسمح للفقاريات المجهرية القاعية التي تم خلعها أن تنجرف إلى شبكة العينة.
- نقل محتويات العينة من الشبكة إلى جرة بلاستيكية وتغطية مع الكحول isopropyl 70٪ للحفظ. وضع علامة على الجرة وتخزينها في مكان آمن لنقلها إلى المختبر.
- جمع وحفظ عينات إضافية من اللافقاريات الكبيرة القاعية، تكرار الخطوة 2.2.
ملاحظة: عدد عينات اللافقاريات الكبيرة التي يجب جمعها متغير وتعسفي إلى حد ما. من الناحية المثالية، ينبغي جمع 5-10 عينات تكرار والحفاظ عليها بشكل فردي. على الأقل، ينبغي جمع 3 عينات تكرار. - إعادة جميع العينات التي تم جمعها إلى المختبر للمعالجة.
ملاحظة: كحول ايزوبروبيل هو سائل قابل للاشتعال، وإذا تم شحن العينات المحفوظة عن طريق الناقل الأرضي أو الجوي، سيكون من الضروري أولاً إكمال وتلبية جميع السلع الخطرة ذات الصلة/ التدريب على البضائع الخطرة، والتعبئة، ومتطلبات الشحن. - في المختبر، فرز وتحديد عينات اللافقاريات المجهرية القاعية المحفوظة.
- فصل العينات من الرواسب الدقيقة عن طريق صب محتويات العينة بعناية في غربال شبكة غرامة (على سبيل المثال، 125 أو 250 ميكرومتر) والقشر.
- نقل المحتويات المغسولة إلى علبة بلاستيكية بيضاء أو المينا، وتغطي مع كمية صغيرة من الماء، واختيار اللافقاريات الماكرونية يدويا من بقايا المتبقية مع ملقط نقطة غرامة. وضع اللافقاريات الماكرونية المستخرجة في حاوية صغيرة من الكحول isopropyl 70٪.
ملاحظة: إذا تم خلط كمية كبيرة من المخلفات النباتية أو المعدنية الخشنة مع محتويات العينة، مما يجعل من الصعب رؤية اللافقاريات الكبيرة في الدرج، قد يكون من الضروري معالجة محتويات العينة المتبقية عن طريق تقسيم المادة أولاً والعمل مع عدة كميات أصغر. - باستخدام مجهر ستيريو تشريح مع ميكرومتر العين المثبتة في واحدة من النظارات، وتحديد العينات إلى أدنى مستوى التصنيف العملي. في معظم الحالات، سيكون هذا مستوى الأسرة أو الجنس.
ملاحظة: غالباً ما تتطلب معالجة وتحديد المحتويات الكاملة لعينة لافقارية واحدة 2-5 ساعات أو أكثر. الميزانية الوقت الكافي وتأكد من أن مكتبة مناسبة من المفاتيح التصنيفية25،26،27،28 متاحة للمساعدة في تحديد الهوية. - استخدام ميكرومتر العين في العين المجهر لقياس طول الجسم الكامل لكل عينة. إذا كان قياس طول الجسم غير ممكن (على سبيل المثال، البطن التالف أو المفقود)، قد يكفي قياس عرض كبسولة الرأس.
- تقدير الكتلة الجافة الفردية (M) لكل عينة باستخدام طول الجسم أو قياسات عرض كبسولة الرأس وطول الجسم الخاص بالتصنيف مقابل M أو عرض الرأس مقابل معادلات الانحدار M من المصادر المنشورة29، 30. على سبيل المثال، معادلة طول الجسم التجريبي (مم) مقابل M (mg) التي تم الإبلاغ عنها في Benke وآخرون. 29 لـ(ألدرفلي سيليس إس بي) (ميغالوبترا، سياليدا) هو M = 0.0031 × الطول الإجمالي2.801. ولذلك، يقدر M لعينة Sialis sp. مع طول إجمالي 15 ملم هو 6.104 ملغ.
ملاحظة: إذا لم تكن معادلة الطول المنشورة مقابل M متوفرة لتصنيف معين، استبدل معادلة مناسبة على مستوى أعلى من الدقة التصنيفية (على سبيل المثال، استبدال معادلة مستوى الأسرة المناسبة عندما تكون معادلة مستوى الجنس غير متوفر) أو من تصنيف وثيق الصلة مع شكل جسم مماثل.
3 - تقدير كثافات الأسماك واللافقاريات الكبيرة القاعية داخل صناديق قياس اللولب2
تتوفر في http://bit.ly/SizeSpectraDensitiesرسوم متحركة توضح كيفية تنسيق البيانات السمكية واللافقارية لاستخدامها في تحليل الأطياف الحجمية.
- إنشاء سلسلة من صناديق قياس اللولب2 التي ستشمل جميع العينات اللافقارية والأسماك، تتراوح بين أصغر اللافقاريات الكبيرة القاعية إلى أكبر الأسماك. تأكد من أن جميع تقديرات الحجم هي في وحدات من كتلة ملغ الجافة.
ملاحظة: للتناسق، نوصي صناديق الحجم المستخدمة من قبل McGarvey وكيرك17. تتراوح هذه الصناديق حجم من 0.0001 إلى 214,748.3648 ملغ. يتم توفير جدول بيانات مع الحدين السفلي والعلوي لكل من هذه الصناديق حجم السجل2 31 في الملف التكميلي 2. - تقدير وفرة الأسماك داخل كل من صناديق الحجم المقابلة.
- أولا تحويل جميع أوزان الأسماك الفردية من كتلة الرطب ز (مسجلة على أوراق البيانات الميدانية) إلى كتلة ملغ الجافة. يمكن استخدام عامل تحويل الكتلة الرطبة إلى الجافة من المياه31 (1 غرام كتلة رطبة = 0.2 غرام كتلة جافة) بعد التحويل من غرام إلى ملغ.
- جمع العدد الإجمالي للأسماك الفردية التي تم التقاطها داخل كل صندوق من صناديق الحجم ذات الحجم (بغض النظر عن هوية الأنواع) خلال عينات الاستنفاد الأولى والثانية والثالثة. يظهر مثال في "ملف تكميلي2".
ملاحظة: إن أخذ العينات الناقصة المتحيزة من الأسماك الصغيرة جداأمر شائع في أخذ عينات الأسماك البخارية، وسيكون واضحا عندما يتم جمع الأفراد داخل صناديق حجم السجل 2؛ وسوف تكون وفرة مجموع أصغر الأسماك أقل بشكل واضح مما كانت عليه في صناديق أكبر (على سبيل المثال، 5 مقابل 100 فرد في صناديق الحجم المجاورة). إزالة صناديق حجم السجل2 التي هي منحازة بشكل واضح قبل تحليل الأطياف الحجم (انظر الخطوة 4). - استخدم معادلة زيبين للاحتمال الأقصى15و32 لتقدير إجمالي وفرة الأسماك (ن) ضمن أصغر سلة سمكة.
- تبدأ بحساب إحصائيات X وسيطة كـ

حيث يشير لي ith تمرير أخذ العينات (ط = 1، 2، 3، الخ)، k يمثل العدد الإجمالي للتمريرات (ك = 3، ما لم يتم مسح تصاريح إضافية)، وC I هو المجموع عدد من الأسماك التي تم التقاطها خلال مرور ith. - حساب تقدير الاحتمال الأقصى لـ n عن طريق استبدال قيم n المتناقصة بشكل متكرر في المعادلة 2 حتى

حيث T هو العدد الإجمالي للأفراد الذين تم القبض عليهم أثناء مرور k وجميع المتغيرات المتبقية كما هو محدد أعلاه في المعادلة 1. - وإذا لوحظت صفر من عمليات العد في عينة الاستنفاد الأولى أو الثانية أو الثالثة، فإن تقدير ن كمجموع الأفراد الذين تم الاستيلاء عليهم بين عينات الاستنفاد الثلاث. يظهر مثال يعمل من المعادلات 1 و 2 في الملف التكميلي 2.
ملاحظة: يمكن استخدام العديد من تطبيقات البرمجيات لحساب تقديرات وفرة زيبين من عينات استنفاد، مثل وظيفة 'إزالة' في R حزمة 'FSA' (تقييم أرصدة الأسماك)33. ومع ذلك، فمن المفيد أكثر لحل المعادلات 1 و 2 يدوياً في جدول بيانات. وترد تعليمات مفصلة في لوكوود وشنايدر34 وملف تكميلي 2.
- تبدأ بحساب إحصائيات X وسيطة كـ
- كرر الخطوة 3.2.3 لكل من صناديق حجم الأسماك المتبقية.
- تحويل تقدير n لكل سلة حجم تحتوي على الأسماك إلى تقدير لكل 1 متر2D عن طريق تقسيم n على تقدير المساحة الإجمالية للمدى المسحي من الخطوة 1-1-2 أعلاه. على سبيل المثال، إذا كان تقدير زيبين ن هو 70 الأسماك والمساحة السطحية للوصول المسح هو 1200 م2،ثم D = 0.058 الأسماك / م2.
- تقدير وفرة اللافقاريات الكبيرة القاعية داخل صناديق حجم السجل2 عن طريق تجميع النتائج من كل عينة من العينات الميدانية (أي الجمع بين النتائج من العينات المكررة في قائمة واحدة من العينات الفردية)، ثم جمع العدد الإجمالي للعينات الأفراد داخل كل بن حجم.
ملاحظة: إذا كانت معادلات الكتلة الطويلة المستخدمة في الخطوة 2-5-5 تنتج تقديرات فردية للوزن في وحدات الكتلة الجافة ملغم، فلا يلزم تحويل وحدة إضافية للفقاريات المجهرية القاعية. - تقدير اللافقاريات الكبيرة القاعية D داخل كل سلة حجم كما
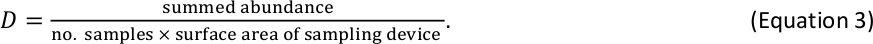
فعلى سبيل المثال، إذا تم جمع 6 عينات من اللافقاريات الكبيرة القاعيةباستخدام جهاز قياسي من طراز Hess (المساحة السطحية = 0.086 م 2) وتم حساب ما مجموعه 110 أفراد داخل سلة حجم معينة، فإن التقدير دال لسلة الأفراد الحجم هذا هو 213 فرداً/م2 . - الجمع بين نتائج D للأسماك واللافقاريات الكبيرة القاعية في جدول واحد من التقديرات D لكل سلة حجم سجل2. إذا كانت الأسماك واللافقاريات الكبيرة تحدث في نفس حجم بن (حدث نادر قد يحدث لأكبر اللافقاريات وأصغر الأسماك)، جمع تقديرات D الخاصة بهم للحصول على تقدير D الإجمالي لهذا بن الحجم.
- حذف أي "فارغة" سجل2 حجم صناديق (أي، صناديق حجم مع قيم D من الصفر)، كما صناديق فارغة سوف التحيز نماذج الانحدار الخطي التي تستخدم لتقدير حجم المعلمات spectra35،36.
4- نمذجة اللافقاريات الكبيرة القاعية وطيف حجم الأسماك
- تقدير متوسط الكتلة الجافة لكل سلة من الصناديق بحجم2 () باستخدام إحدى القيم التالية: '1' الحد الأدنى (الحد الأدنى) لكل سلة حجم؛ '2' القيمة القصوى (الحدود العليا)؛ '3' المتوسط الحسابي (الحد الأدنى والحد الأقصى)؛ أو '4' المتوسط الهندسي (الحد الأدنى والحد الأقصى)35.
ملاحظة: في الأمثلة الموضحة أدناه ، تم تقدير ( ... ) كمتوسط حسابي لكل سلة حجم سجل2 (راجع الملف التكميلي 2). - 'تطبيع' تقدير D لكل سلة حجم سجل2 عن طريق تقسيمها على عرضها (أي الفرق بين الحد العلوي والسفلي)16،35. سيؤديذلك إلى منع فواصل حجم السجل2 غير الموحدة من إنشاء تحيز في نماذج الانحدار الخطي التي يتم استخدامها لتقدير معلمات الأطياف الحجم35و37و38.
- سجل10 تحويل جميع البيانات ووة لتحويل علاقة D
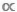 M المنحنية إلى علاقة خطية. ثم استخدام العادية أقل المربعات الانحدار مع سجل10()وسجل10()البيانات لنموذج الطيف الحجم كما
M المنحنية إلى علاقة خطية. ثم استخدام العادية أقل المربعات الانحدار مع سجل10()وسجل10()البيانات لنموذج الطيف الحجم كما 
حيث السجل10(أ) هو الاعتراض و b هو ميل نموذج الطيف الخطي الحجم.
النتائج
يتم تقديم النتائج المثالية، بما في ذلك البيانات الميدانية الأصلية، لشوكة إطلاق، فيرجينيا الغربية، تيار صغير في جنوب ولاية فرجينيا الغربية. كما يتم عرض نتائج نموذج الأطياف حجم إضافية لاثنين من تيارات أخرى في نفس المنطقة: كامب كريك وكابين كريك، ولاية فرجينيا الغربية. هذه هي مواقع الدراسة ا...
Discussion
ويمكن استخدام هذا البروتوكول الأطياف حجم الارتجاج لتحديد حجم ونموذج هيكل داخل المجتمعات المحلية من الأسماك تيار واللافقاريات. وقد تراوحت دراسات الأطياف السابقة في النظم الإيكولوجية للتيار من البحوث الوصفية الأساسية39و40 إلى المقارنات على طول لمحة عن النهر الطولي
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقدمت تمويل هذا العمل المؤسسة الوطنية للعلوم (grant DEB-1553111) ومؤسسة إيبلي للبحث العلمي. هذه المخطوطة هي مساهمة مركز أنهار الأرز VCU #89.
Materials
| Name | Company | Catalog Number | Comments |
| Chest waders | Multiple options | n/a | Personal protective equipment for use during electrofishing. Do NOT use 'breatheable' waders as electrical current will pass through them. |
| Rubber lineman's gloves | Multiple options | n/a | Personal protective equipment for use during electrofishing. |
| Dip nets with fiberglass poles | Multiple options | n/a | Used to capture stunned fishes during electrofishing. |
| Backpack electrofishing unit | Smith-Root; Halltech; Midwest Lake Management; Aqua Shock Solutions | www.smith-root.com; www.halltechaquatic.com; https://midwestlake.com; https://aquashocksolutions.com/ | Backpack electrofishers are currently manufactured and distributed by four independent companies in North America. Prices and warranty/technical support are the most important factors in choosing a vendor. |
| Block nets/seines (×2) | Duluth Nets | https://duluthfishnets.com/ | Necessary length will depend on stream width. 3/8 inch mesh is recommended. |
| Cam-action utility straps with 1 inch nylon webbing (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at auto supply, hardware, and department stores. |
| Large tent stakes (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at camping and department stores. |
| 5 gallon plastic buckets (×5) | Multiple options | n/a | Used to hold and transport fish during electrofishing. Available at hardware and paint supply stores. |
| 10-20 gallon totes (×3) | Multiple options | n/a | Used as livewells, sedation tanks, and recovery bins for captured fishes. Available at hardware and department stores. |
| Battery powered 'bait bucket' aeration pumps | Cabelas | IK-019008 | Used to aerate fish holding bins during field processing. |
| Fish anesthesia (Tricaine-S) | Syndel | www.syndel.com | Used to sedate fishes for field processing. Tricaine-S is regulated by the U.S. Food and Drug Administration. |
| Folding camp table and chairs | Cabelas | IK-518976; IK-552777 | Used to process fish samples. |
| Pop-up canopy | Multiple options | n/a | Used as necessary for sun and rain protection. |
| Fish measuring board | Wildco | 3-118-E40 | Used to measure fish lengths. |
| Battery powered field scale with weighing dish | Multiple options | n/a | Used to weigh fishes. Must weigh be accurate to 0.1 or 0.01 grams. |
| Clear plastic wind/rain baffle | Multiple options | n/a | Used to shield scale in rainy or windy conditions. Must be large enough to cover the scale and a weighing dish. |
| White plastic or enamel examination trays | Multiple options | n/a | Trays are essential for examining fishes in the field. |
| Stainless steel forceps | Multiple options | n/a | Forceps are helpful when examining small fishes and in transfering invertebrates to specimen jars. |
| Hand magnifiers | Multiple options | n/a | Magnification is often helpful when identifying fish specimens in the field. |
| Fish identification keys | n/a | n/a | Laminated keys that are custom prepared for specific locations are most effective. |
| Datasheets printed on waterproof paper | Rite in the Rain | n/a | Waterproof paper is essential when working with aquatic specimens. |
| Retractable fiberglass field tapes | Lufkin | n/a | Used to measure stream channel dimensions. |
| Surber sampler or Hess sampler | Wildco | 3-12-D56; 3-16-C52 | Either of these fixed-area benthic samplers will work well in shallow streams with gravel or pebble substrate. |
| 70% ethanol or isopropyl alcohol | Multiple options | n/a | Used as invertebrate preservative. |
| Widemouth invertebrate specimen jars (20-32 oz.) | U.S. Plastic Corp. | 67712 | Any widemouth plastic jars will work but these particular jars are durable and inexpensive. |
References
- Peters, R. H. . The ecological implications of body size. , (1983).
- Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M., West, G. B. Toward a metabolic theory of ecology. Ecology. 85 (7), 1771-1789 (2004).
- Marquet, P. A., et al. Scaling and power-laws in ecological systems. Journal of Experimental Biology. 208 (9), 1749-1769 (2005).
- Bohlin, T., Dellefors, C., Faremo, U., Johlander, A. The energetic equivalence hypothesis and the relation between population-density and body-size in stream-living salmonids. The American Naturalist. 143 (3), 478-493 (1994).
- Dunham, J. B., Vinyard, G. L. Relationships between body mass, population density, and the self-thinning rule in stream-living salmonids. Canadian Journal of Fisheries and Aquatic Sciences. 54 (5), 1025-1030 (1997).
- Jennings, S., Blanchard, J. L. Fish abundance with no fishing: predictions based on macroecological theory. Journal of Animal Ecology. 73 (4), 632-642 (2004).
- Petchey, O. L., Belgrano, A. Body-size distributions and size-spectra: universal indicators of ecological status?. Biology Letters. 6 (4), 434-437 (2010).
- Woodward, G., et al. Body size in ecological networks. Trends in Ecology and Evolution. 20 (7), 402-409 (2005).
- Trebilco, R., Baum, J. K., Salomon, A. K., Dulvy, N. K. Ecosystem ecology: size-based constraints on the pyramids of life. Trends in Ecology and Evolution. 28 (7), 423-431 (2013).
- White, E. P., Ernest, S. K. M., Kerkhoff, A. J., Enquist, B. J. Relationships between body size and abundance in ecology. Trends in Ecology and Evolution. 22 (6), 323-330 (2007).
- Schmid, P. E., Tokeshi, M., Schmid-Araya, J. M. Relation between population density and body size in stream communities. Science. 289 (5484), 1557-1560 (2000).
- Morin, A., Nadon, D. Size distribution of epilithic lotic invertebrates and implications for community metabolism. Journal of the North American Benthological Society. 10 (3), 300-308 (1991).
- Mittelbach, G. G., Persson, L. The ontogeny of piscivory and its ecological consequences. Canadian Journal of Fisheries and Aquatic Sciences. 55 (6), 1454-1465 (1998).
- Woodward, G., Hildrew, A. G. Body-size determinants of niche overlap and intraguild predation within a complex food web. Journal of Animal Ecology. 71 (6), 1063-1074 (2002).
- Zippin, C. The removal method of population estimation. Journal of Wildlife Management. 22 (1), 82-90 (1958).
- Kerr, S. R., Dickie, L. M. . The biomass spectrum: a predator-prey theory of aquatic production. , (2001).
- McGarvey, D. J., Kirk, A. J. Seasonal comparison of community-level size-spectra in southern coalfield streams of West Virginia (USA). Hydrobiologia. 809 (1), 65-77 (2018).
- Reynolds, J. B., Kolz, A. L., Zale, A. V., Parrish, D. L., Sutton, T. M. Electrofishing. Fisheries techniques. 8, 305-361 (2012).
- Bowker, J., Trushenski, J. Fish drug questions answered by the FDA. Fisheries. 38 (12), 549-552 (2013).
- Topic Popovic, N., et al. Tricaine methane-sulfonate (MS-222) application in fish anaesthesia. Journal of Applied Ichthyology. 28 (4), 553-564 (2012).
- Trautman, M. B. . The fishes of Ohio. , (1981).
- Riley, S. C., Fausch, K. D. Underestimation of trout population size by maximum-likelihood removal estimates in small streams. North American Journal of Fisheries Management. 12 (4), 768-776 (1992).
- Merritt, R. W., Cummins, K. W., Resh, V. H., Batzer, D. P., Merritt, R. W., Cummins, K. W., Berg, M. B. Sampling aquatic insects: collection devices, statistical considerations, and rearing procedures. An introduction to the aquatic insects of North America. , 15-37 (2008).
- Hauer, F. R., Resh, V. H., Hauer, F. R., Lamberti, G. A. Macroinvertebrates. Methods in stream ecology. 1, 297-319 (2017).
- Thorp, J. H., Covich, A. P. . Ecology and classification of North American freshwater invertebrates. , (2010).
- Merritt, R. W., Cummins, K. W., Berg, M. B. . An introduction to the aquatic insects of North America. , (2008).
- Stewart, K. W., Stark, B. P. . Nymphs of North American stonefly genera (Plecoptera). , (2002).
- Wiggins, G. B. . Larvae of the North American caddisfly genera (Trichoptera). , (1998).
- Benke, A. C., Huryn, A. D., Smock, L. A., Wallace, J. B. Length-mass relationships for freshwater macroinvertebrates in North America with particular reference to the Southeastern United States. Journal of the North American Benthological Society. 18 (3), 308-343 (1999).
- Smock, L. A. Relationships between body size and biomass of aquatic insects. Freshwater Biology. 10 (4), 375-383 (1980).
- Waters, T. F. Secondary production in inland waters. Adv. Ecol. Res. 10, 91-164 (1977).
- Carle, F. L., Strub, M. R. New method for estimating population-size from removal data. Biometrics. 34 (4), 621-630 (1978).
- Ogle, D. H., Wheeler, P., Dinno, A. FSA: fisheries stock analysis. R package version 0.8.22.9000. , (2018).
- Lockwood, R. N., Schneider, J. C., Schneider, J. C. Stream fish population estimates by mark-and-recapture and depletion methods. Manual of fisheries survey methods II: with periodic updates. 7, (2000).
- Blanco, J. M., Echevarría, F., García, C. M. Dealing with size-spectra: some conceptual and mathematical problems. Scientia Marina. 58 (1-2), 17-29 (1994).
- White, E. P., Enquist, B. J., Green, J. L. On estimating the exponent of power-law frequency distributions. Ecology. 89 (4), 905-912 (2008).
- Vidondo, B., Prairie, Y. T., Blanco, J. M., Duarte, C. M. Some aspects of the analysis of size spectra in aquatic ecology. Limnology and Oceanography. 42 (1), 184-192 (1997).
- Sprules, W. G., Barth, L. E. Surfing the biomass size spectrum: some remarks on history, theory, and application. Canadian Journal of Fisheries and Aquatic Sciences. 73 (4), 477-495 (2016).
- Poff, N. L., et al. Size structure of the metazoan community in a Piedmont stream. Oecologia. 95 (2), 202-209 (1993).
- Ramsay, P. M., et al. A rapid method for estimating biomass size spectra of benthic metazoan communities. Canadian Journal of Fisheries and Aquatic Sciences. 54 (8), 1716-1724 (1997).
- Solimini, A. G., Benvenuti, A., D’Olimpio, R., Cicco, M. D., Carchini, G. Size structure of benthic invertebrate assemblages in a Mediterranean river. Journal of the North American Benthological Society. 20 (3), 421-431 (2001).
- Huryn, A. D., Benke, A. C., Hildrew, A., Raffaelli, D., Edmonds-Brown, R. Relationship between biomass turnover and body size for stream communities. Body size: the structure and function of aquatic ecosystems. 4, 55-76 (2007).
- Gaedke, U. The size distribution of plankton biomass in a large lake and its seasonal variability. Limnology and Oceanography. 37 (6), 1202-1220 (1992).
- Stead, T. K., Schmid-Araya, J. M., Schmid, P. E., Hildrew, A. G. The distribution of body size in a stream community: one system, many patterns. Journal of Animal Ecology. 74 (3), 475-487 (2005).
- Brose, U., et al. Consumer-resource body-size relationships in natural food webs. Ecology. 87 (10), 2411-2417 (2006).
- Mehner, T., et al. Empirical correspondence between trophic transfer efficiency in freshwater food webs and the slope of their size spectra. Ecology. 99 (6), 1463-1472 (2018).
- Daan, N., Gislason, H. G., Pope, J. C., Rice, J. Changes in the North Sea fish community: evidence of indirect effects of fishing?. ICES Journal of Marine Science. 62 (2), 177-188 (2005).
- Murry, B. A., Farrell, J. M. Resistance of the size structure of the fish community to ecological perturbations in a large river ecosystem. Freshwater Biology. 59 (1), 155-167 (2014).
- Broadway, K. J., Pyron, M., Gammon, J. R., Murry, B. A. Shift in a large river fish assemblage: body-size and trophic structure dynamics. PLoS ONE. 10 (4), e0124954 (2015).
- Vila-Martínez, N., Caiola, N., Ibáñez, C., Benejam, L., Brucet, S. Normalized abundance spectra of fish community reflect hydro-peaking on a Mediterranean large river. Ecological Indicators. 97, 280-289 (2019).
- Brucet, S., et al. Size-based interactions across trophic levels in food webs of shallow Mediterranean lakes. Freshwater Biology. 62 (11), 1819-1830 (2017).
- Ersoy, Z., et al. Size-based interactions and trophic transfer efficiency are modified by fish predation and cyanobacteria blooms in Lake Mývatn, Iceland. Freshwater Biology. 62 (11), 1942-1952 (2017).
- Arranz, I., Hsieh, C. H., Mehner, T., Brucet, S. Systematic deviations from linear size spectra of lake fish communities are correlated with predator–prey interactions and lake-use intensity. Oikos. 128 (1), 33-44 (2019).
- Jennings, S., et al. Long-term trends in the trophic structure of the North Sea fish community: evidence from stable-isotope analysis, size-spectra and community metrics. Marine Biology. 141 (6), 1085-1097 (2002).
- Guiet, J., Poggiale, J. C., Maury, O. Modelling the community size-spectrum: recent developments and new directions. Ecological Modelling. 337, 4-14 (2016).
- Robinson, J. P. W., et al. Fishing degrades size structure of coral reef fish communities. Global Change Biology. 23 (3), 1009-1022 (2017).
- Reuman, D. C., Mulder, C., Raffaelli, D., Cohen, J. E. Three allometric relations of population density to body mass: theoretical integration and empirical tests in 149 food webs. Ecology Letters. 11 (11), 1216-1228 (2008).
- Huryn, A. D., Wallace, J. B., Anderson, N. H., Merritt, R. W., Cummins, K. W., Berg, M. B. Habitat, life history, secondary production, and behavioral adaptations of aquatic insects. An introduction to the aquatic insects of. 5, 55-103 (2008).
- Werner, E. E., Gilliam, J. F. The ontogenetic niche and species interactions in size-structured populations. Annual Review of Ecology and Systematics. 15 (1), 393-425 (1984).
- Edwards, A. M., Robinson, J. P. W., Plank, M. J., Baum, J. K., Blanchard, J. L. Testing and recommending methods for fitting size spectra to data. Methods in Ecology and Evolution. 8 (1), 57-67 (2017).
- Roell, M., Orth, D. Production of three crayfish populations in the New River of West Virginia, USA. Hydrobiologia. 228 (3), 185-194 (1992).
- Hawkins, C. P., Murphy, M. L., Anderson, N. H., Wilzbach, M. A. Density of fish and salamanders in relation to riparian canopy and physical habitat in streams of the northwestern United States. Canadian Journal of Fisheries and Aquatic Sciences. 40 (8), 1173-1185 (1983).
- Rabeni, C. F., Collier, K. J., Parkyn, S. M., Hicks, B. J. Evaluating techniques for sampling stream crayfish (Paranephrops planifrons). New Zealand Journal of Marine and Freshwater Research. 31 (5), 693-700 (1997).
- DiStefano, R. J., Gale, C. M., Wagner, B. A., Zweifel, R. D. A sampling method to assess lotic crayfish communities. Journal of Crustacean Biology. 23 (3), 678-690 (2003).
- Price, J. E., Welch, S. M. Semi-quantitative methods for crayfish sampling: sex, size, and habitat bias. Journal of Crustacean Biology. 29 (2), 208-216 (2009).
- Sheldon, R. W., Sutcliffe, W. H., Paranjape, A. M. Structure of pelagic food chain and relationship between plankton and fish production. Journal of the Fisheries Research Board of Canada. 34 (12), 2344-2353 (1977).
- Andersen, K., et al. Asymptotic size determines species abundance in the marine size spectrum. The American Naturalist. 168 (1), 54-61 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved