É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelagem do espectro de tamanho para macroinvertebrados e peixes em ecossistemas de fluxo
Neste Artigo
Resumo
Este é um protocolo para modelar o espectro de tamanho (relação de dimensionamento entre massa individual e densidade populacional) para os dados combinados de peixes e invertebrados de córregos e rios wadable. Os métodos incluem: técnicas de campo para coletar amostras quantitativas de peixes e invertebrados; métodos de laboratório para padronizar os dados de campo; e análise estatística dos dados.
Resumo
O espectro de tamanho é uma relação de escala inversa, alométrica entre a massa corporal média (M) e a densidade (D) de indivíduos dentro de uma comunidade ecológica ou Web de alimentos. É importante ressaltar que o espectro de tamanho assume que o tamanho individual, em vez das características comportamentais ou de história de vida da espécie, é o principal determinante da abundância dentro de um ecossistema. Assim, diferentemente das relações alométricas tradicionais que se concentram em dados de nível de espécie (por exemplo, tamanho do corpo da espécie média versus densidade populacional), as análises de espectros de tamanho são ' ataxic ' – espécimes individuais são identificados apenas pelo seu tamanho, sem consideração de identidade taxonômica. Os modelos de espectros de tamanho são representações eficientes de teias alimentares tradicionais e complexas e podem ser usados em contextos descritivos, bem como preditivos (por exemplo, prever respostas de grandes consumidores a mudanças nos recursos basais). Estudos empíricos de diversos ecossistemas aquáticos também relataram níveis moderados a altos de similaridade em inclinações de espectros de tamanho, sugerindo que processos comuns podem regular as abundâncias de pequenos e grandes organismos em ambientes muito diferentes. Este é um protocolo para modelar o espectro de tamanho de nível comunitário em fluxos wadable. O protocolo consiste em três etapas principais. Em primeiro lugar, coletar amostras de peixes e invertebrados bentônicos quantitativos que podem ser usados para estimar densidades locais. Em segundo lugar, padronizar os dados de peixes e invertebrados, convertendo todos os indivíduos em unidades atáxicas (i.e., indivíduos identificados por tamanho, independentemente da identidade taxonômica), e somando indivíduos dentro de silos de tamanho de log2 . Em terceiro lugar, use a regressão linear para modelar a relação entre as estimativas de M e D ataxic. Instruções detalhadas são fornecidas neste documento para concluir cada uma dessas etapas, incluindo software personalizado para facilitar a modelagem de espectros de estimativa e tamanho D .
Introdução
As relações de dimensionamento do tamanho do corpo, como a associação positiva entre a massa corporal e a taxa metabólica, são bem conhecidas no nível do organismo individual e agora estão sendo estudadas em níveis mais elevados de organização1,2,3 . Essas relações alométricas são, na maioria das vezes, funções de poder-lei da forma y = amb, onde y é a variável de interesse (por exemplo, metabolismo, abundância, ou tamanho do intervalo de casa), M é a massa corporal de uma única ou média individual, b é um coeficiente de dimensionamento e a é uma constante. Para conveniência estatística, os dados Y e M são muitas vezes transformados em log antes da análise, em seguida, modelado com equações lineares do formulário log (y) = log (a) + b log (M), onde b e log ( a) tornar-se a inclinação do modelo linear e interceptar, respectivamente.
O espectro de tamanho é um tipo de relação alométrica que prevê a densidade (D, o número de indivíduos por unidade de área) ou biomassa (B, a massa somada de indivíduos por unidade de área) em função de M (ver seção 4 para adicional informações sobre o uso de estimativas de D ou B "normalizadas".) Como outras relações de dimensionamento entre m e D ou entre m e B, o espectro de tamanho desempenha um papel central na ecologia básica e aplicada. A nível populacional, os biólogos frequentemente interpretam relações negativas de D 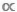 M como evidência de sobrevivência dependente de densidade ou como modelos de capacidade de transporte do ecossistema (ou seja, a "regra de autodiluição")4, a 5. A nível comunitário, as relações B
M como evidência de sobrevivência dependente de densidade ou como modelos de capacidade de transporte do ecossistema (ou seja, a "regra de autodiluição")4, a 5. A nível comunitário, as relações B 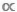 M podem ser utilizadas para estudar os efeitos de nível de sistema de perturbações antropogênicas, como a pesca de tamanho seletivo6,7. O dimensionamento alométrico de D e B com M também é fundamental para esforços recentes para unir a ecologia populacional, comunitária e ecossistêmica2,8,9.
M podem ser utilizadas para estudar os efeitos de nível de sistema de perturbações antropogênicas, como a pesca de tamanho seletivo6,7. O dimensionamento alométrico de D e B com M também é fundamental para esforços recentes para unir a ecologia populacional, comunitária e ecossistêmica2,8,9.
Uma característica particularmente importante do espectro de tamanho é o fato de que é inteiramente ataxic9,10. Este ponto é fácil de perder ao comparar gráficos de dispersão de dados de D 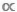 m ou B
m ou B 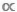 m , mas a distinção entre os modelos taxic e ataxic é uma crítica. Em modelos taxic, um único valor de M é usado para representar a massa corporal média de cada indivíduo de uma determinada espécie ou táxons11. Em modelos ataxic, todos os indivíduos dentro de um conjunto de dados são particionados entre uma série de intervalos de tamanho de corpo ou M Bins, independentemente de sua identidade taxonômica12. Este último, abordagem atáxica é vantajoso em ecossistemas aquáticos onde muitos táxons exibem um crescimento indeterminado e experimentam uma ou mais mudanças ontogenéticas no comportamento alimentar; nesses casos, uma única média de M de nível de espécie irá obscurecer o fato de que uma espécie pode preencher diferentes papéis funcionais ao longo de sua história de vida9,13,14.
m , mas a distinção entre os modelos taxic e ataxic é uma crítica. Em modelos taxic, um único valor de M é usado para representar a massa corporal média de cada indivíduo de uma determinada espécie ou táxons11. Em modelos ataxic, todos os indivíduos dentro de um conjunto de dados são particionados entre uma série de intervalos de tamanho de corpo ou M Bins, independentemente de sua identidade taxonômica12. Este último, abordagem atáxica é vantajoso em ecossistemas aquáticos onde muitos táxons exibem um crescimento indeterminado e experimentam uma ou mais mudanças ontogenéticas no comportamento alimentar; nesses casos, uma única média de M de nível de espécie irá obscurecer o fato de que uma espécie pode preencher diferentes papéis funcionais ao longo de sua história de vida9,13,14.
Aqui, nós apresentamos um protocolo completo para quantificar o espectro do tamanho dentro dos córregos e dos rios wadable. O protocolo começa com métodos de amostragem de campo para coletar os peixes necessários e os dados de macroinvertebrados bentônicos. Os peixes serão recolhidos através de um processo de amostragem de "depleção de três passagens". A abundância será então estimada a partir dos dados de depleção com o método Zippin15. Na amostragem de depleção, os peixes individuais dentro de um alcance de estudo fechado (ou seja, os indivíduos não podem entrar nem deixar o alcance fechado) são removidos do alcance através de três amostras sucessivas. Assim, o número de peixes remanescentes será progressivamente esgotado. A partir dessa tendência de depleção, a abundância total dentro do alcance do estudo pode ser estimada em seguida, convertida em D (em peixes por m2), usando a área de superfície conhecida do alcance do estudo. Os macroinvertebrados bentônicos serão coletados com amostradores de área fixa padrão, então identificados e medidos em laboratório.
Em seguida, os dados combinados de peixes e macroinvertebrados serão divididos entre as caixas de tamanho. Tradicionalmente, a escala de oitava ou log2 (ou seja, intervalos de duplicação) foi usada para definir os limites do compartimento de tamanho16. Uma vez estabelecida uma lista de compartimentos de tamanho, o particionamento de macroinvertebrados bentônicos individuais entre seus respectivos compartimentos de tamanho é simples porque os invertebrados são diretamente enumerados como números de indivíduos por unidade de área. No entanto, estimar as abundâncias de peixes dentro das caixas de tamanho é mais abstrata, pois essas estimativas são inferidas dos dados de depleção. Portanto, são fornecidas instruções detalhadas para estimar a abundância de peixes dentro de compartimentos de tamanho, independentemente da identidade taxonômica, de dados de amostra de depleção.
Finalmente, a regressão linear será usada para modelar o espectro de tamanho. Este protocolo é inteiramente compatível com o método original, geral de Kerr e Dickie16 e idêntico aos métodos usados por McGarvey e por Kirk, 201817 em um estudo de espectros do tamanho dos peixes e do invertebrados em córregos de Virgínia Ocidental. Usando este protocolo, os investigadores podem segurar que seus resultados são diretamente comparáveis com outros estudos que constroem em cima de Kerr e Dickie16, acelerando desse modo uma compreensão larga e robusta do tamanho de corpo que escala relacionamentos na água doce ecossistemas e os mecanismos que os conduzem.
Protocolo
Todos os métodos descritos aqui foram aprovados pelo Comitê institucional de cuidados e uso de animais (IACUC) da Virginia Commonwealth University.
1. recolha e processamento de amostras de peixe
- Isolando os peixes dentro do alcance do estudo para criar uma Assembléia de peixes fechados
- Identifique o ascendente e a jusante (a direção é relativa a um topógrafo que enfrenta "upstream" e contra a corrente de água) extremidades do alcance do estudo, em seguida, marcar as extremidades com fita de sinalização removível.
Nota: o comprimento total do alcance do estudo é arbitrário, mas deve ser longo o suficiente para abranger uma seleção representativa dos diferentes tipos de habitat (por exemplo, riffles, corre, piscinas, bancos undercut) presentes dentro de todo o córrego. Na maioria dos casos, um alcance de estudo de 100 — 200 m será adequado. - Meça a largura do canal de fluxo molhado em 5 — 10 transectos, distribuídos uniformemente ao longo do comprimento do alcance do estudo. Estimar a área de superfície total do alcance do estudo como a largura média do canal molhado multiplicada pelo comprimento total do alcance.
- Redes de bloqueio seguras (ou seja, retenida sem nó com flutuadores na linha superior e pesos na linha de fundo) em todo o canal de fluxo nas extremidades upstream e downstream do alcance do estudo. Use redes de malha média a grossa (6,3 — 9,5 mm ou 1/4 — 3/8 polegadas mesh) para minimizar o acúmulo de detritos e entupimento. Não use grandes (> 12.7 mm) redes de malha como pequenos peixes passarão.
Nota: antes da amostragem, prepare um kit de aparelhamento que inclua: (i) 8 peças longas (≥ 15 m de comprimento) de corda de polipropileno (9,5 mm ou 3/8 polegada de diâmetro); e (II) 8 cintas tie-down da came-ação . Não use cintas da catraca-ação porque estes podem estalar e causar ferimento sério quando sua carga é liberada.- Na extremidade ascendente do alcance do estudo, localize uma árvore, raiz, rocha grande ou outro objeto sólido que possa ser usado para ancorar uma rede em cada lado do fluxo. A disponibilidade de pontos de ancoragem adequados em cada lado do fluxo afetará provavelmente a posição do limite ascendente.
- Selecione um pedaço de corda de polipropileno e criar um loop em cada extremidade usando um nó bolina. Use somente um nó do bolina, porque outros nós podem tornar-se permanentemente selados quando expor à umidade e à tensão elevada. Para obter instruções sobre como amarrar um nó de linha de bolina, consulte a Figura 1.
- Enrole a corda em torno da árvore/raiz/rocha e alimente o laço em uma extremidade através do laço na outra extremidade para criar um ponto de ancoragem (Figura 2). Encurte ou alonha a âncora da corda adicionando ou removendo envoltórios em torno da árvore/raiz/rocha.
- Repita as etapas 1.1.3.1 — 1.1.3.3 para estabelecer um segundo ponto de ancoragem no lado oposto do fluxo.
- Crie um laço nas linhas em cada um dos quatro cantos da rede do bloco usando um nó do bolina. Use apenas um nó de linha de bolina (Figura 1).
- Conecte ambos os lados da linha superior da rede do bloco (a linha com flutuadores) aos pontos de ancoragem usando cintas tie-down da came-ação. Insira os ganchos em cada extremidade da cinta de amarração nas alças nos cantos da rede de blocos e nos pontos de ancoragem (Figura 2). Puxe a corda livre da cinta tie-down através da fivela de came para apertar cada ponto de contato.
Nota: para libertar a tensão nas âncoras (para ajustar a rede de blocos ou para remover a rede de blocos quando a amostragem estiver concluída), pressione o botão de came em cada uma das correias de amarração. - Fixe a linha inferior da rede do bloco (a linha com pesos) fixando os ao banco do córrego com estacas da barraca.
- Estabeleça um selo com a parte inferior do córrego usando grandes rochas para fixar a rede do bloco para baixo. Coloque as rochas no lado da rede virada a montante. Certifique-se de que a parte superior da rede permaneça acima do nível da água (Figura 2). Ajuste a altura (s) dos pontos de ancoragem conforme necessário.
- Defina uma rede de segundo bloco repetindo etapas 1.1.3.1 — 1.1.3.8 na extremidade downstream do alcance do estudo.
- Identifique o ascendente e a jusante (a direção é relativa a um topógrafo que enfrenta "upstream" e contra a corrente de água) extremidades do alcance do estudo, em seguida, marcar as extremidades com fita de sinalização removível.
- Realize o primeiro dos 3 passes de depleção de amostragem de peixe dentro do alcance do estudo incluído. Este protocolo supõe que um moldados da trouxa está disponível e todo o pessoal de levantamento da tripulação está treinado corretamente para usá-lo. Outros métodos podem potencialmente ser usados, mas podem não ser tão eficazes na coleta de amostras representativas de peixes.
Nota: em pequenos córregos, 4 — 5 pessoas é um tamanho de tripulação ideal: um para operar o Electrofisher, dois para peixes atordoados líquidos, e um ou dois para transportar baldes segurando e Shuttle capturados peixes. Também, a electropesca da trouxa pode causar ferimento significativo, ambos aos peixes do córrego e aos seres humanos18. Portanto, é fundamental exercer cautela e receber treinamento adequado.- Começando na extremidade a jusante do alcance do estudo incluido, gire o moldados da trouxa sobre e mova-se na direção ascendente. Progrida lentamente, movendo-se lado a lado em todo o alcance do estudo para garantir que todos os habitats de InStream são amostrados. A primeira passagem de depleção é concluída quando a rede upstream é atingida.
- Vamos apoiar os membros da tripulação seguir o líder (que está operando o Electrofisher), coletando peixes atordoados com redes de mergulho como eles são detectados e transferi-los para baldes temporários, em seguida, aerado segurando banheiras. Use a bateria pequena alimentado ' isca balde ' bombas com pedras de aeração para garantir que os peixes capturados permanecem saudáveis.
- Preste especial atenção aos peixes muito pequenos, jovens-de-ano como eles são difíceis de detectar e capturar. Quando a captação dos peixes os menores é altamente ineficiente, os resultados podem ser tendenciosos. Neste caso, pode ser necessário remover as menores classes de tamanho de log2 dos dados de peixe, antes de estimar densidades dentro de Bins de tamanho de log2 (consulte a etapa 3.2.2).
Nota: o sucesso na rede de peixes atordoados variará com uma série de condições biológicas e ambientais. Por exemplo, água turva em que a visibilidade é baixa vai restringir a capacidade de efetivamente localizar e capturar peixes; se a turbidez for muito alta, a amostragem deve ser reprogramada ou um local de amostragem alternativo deve ser selecionado.
- Preste especial atenção aos peixes muito pequenos, jovens-de-ano como eles são difíceis de detectar e capturar. Quando a captação dos peixes os menores é altamente ineficiente, os resultados podem ser tendenciosos. Neste caso, pode ser necessário remover as menores classes de tamanho de log2 dos dados de peixe, antes de estimar densidades dentro de Bins de tamanho de log2 (consulte a etapa 3.2.2).
- Processamento de peixes recolhidos no primeiro passe de depleção
- Determine se a anestesia será necessária. Os peixes vivos são frequentemente difíceis de segurar, e a sedação pode ser necessária para minimizar o stress e ferimento aos espécimes de peixes. Se a anestesia é usada, duas opções são amplamente (a partir de abril 2019) disponível: Tricaine-S (tricaína Methanesulfonate, MS-222) e dióxido de carbono (bicarbonato de sódio).
Nota: tricaine-S implica um período de 21 dias de detenção antes de peixes expostos podem ser consumidos com segurança19,20, mas é atualmente (a partir de abril 2019) o sedativo único peixe aprovado pela administração de alimentos e drogas dos EUA. - Ao usar sedativos, siga cuidadosamente todas as instruções fornecidas com o produto anestésico. Em todos os casos, misture o composto anestésico em um banho de água aerado. Submergir peixes recolhidos no banho até que a sedação é observada. Uma vez sedado, processe os peixes o mais rapidamente possível, como a exposição prolongada aos sedativos pode causar a morte.
- Use pequenas redes de imersão para recuperar peixes amostrados do tanque de retenção (com ou sem sedação), individualmente ou em pequenos lotes, para identificação. Coloque os espécimes em plástico branco ou bandejas de esmalte e use fórceps e lupa para exame. Use as chaves de identificação local ou regional (por exemplo, "os peixes de Ohio")21 para ajudar na identificação.
- Meça o comprimento total (da ponta do focê até o fim da nadadeira caudal) para cada espécime, em seguida, pesar em um equilíbrio de campo. Se estiver usando um saldo eletrônico, selecione um com 0,1 ou 0, 1 g de precisão. Mantenha uma caixa plástica transparente na mão para usar, como necessário, como um defletor do vento e da chuva (deve ser grande bastante cobrir o contrapeso e os espécimes que estão sendo pesados).
- Registre todas as informações (identidade de espécies, comprimento total e peso) em folhas de dados impermeáveis. Um exemplo imprimível de uma folha de dados de peixe é fornecido no arquivo complementar 1.
- Uma vez processado, devolva os peixes a um compartimento de retenção/recuperação aerado separado. Quando todos os peixes foram processados, liberá-los a jusante da rede de blocos a jusante.
Nota: se você acidentalmente liberá-los em seu alcance de estudo fechado, você vai arruinar a sua amostra! Se a anestesia foi usada, esperar para liberar até que todos os peixes recuperaram e recuperou o equilíbrio.
- Determine se a anestesia será necessária. Os peixes vivos são frequentemente difíceis de segurar, e a sedação pode ser necessária para minimizar o stress e ferimento aos espécimes de peixes. Se a anestesia é usada, duas opções são amplamente (a partir de abril 2019) disponível: Tricaine-S (tricaína Methanesulfonate, MS-222) e dióxido de carbono (bicarbonato de sódio).
- Realizando a segunda e terceira depleção passa
Nota: se uma tendência de depleção forte não for induzida nos três primeiros passes (ou seja, se o número de peixes amostrados não tiver diminuído visivelmente pela terceira passagem), podem ser necessárias passagens adicionais para estimar com precisão a abundância de peixes22. O tempo permite, muitas vezes é uma boa idéia para realizar proativamente quatro ou cinco passagens sucessivas de depleção.- Verifique se as redes de blocos upstream e downstream ainda estão seguras. Se os detritos significativos foram recolhidos em qualquer rede de blocos, removê-lo com a mão picking.
- Colete as amostras de passe de depleção restantes repetindo as etapas 1.2 – 1.3. Assegure-se de que o esforço amostral permaneça consistente entre os três passes. Use o mesmo ritmo de movimento (cronometrar o processo é recomendado) e os mesmos membros da tripulação para inspecionar o alcance de amostragem.
- Quando terminado, desmonte as redes do bloco e remova todos os materiais da escora.
2. coleta e processamento de amostras de macroinvertebrados bentônicos
- Selecionar locais de amostra de macroinvertebrados bentônicos dentro dos limites do alcance de amostragem de peixes representativos dos principais tipos de habitats físicos (por exemplo, corredeiras ou corridas) observados no alcance do estudo.
- Usando um amostrador de área fixa, colete a primeira amostra de macroinvertebrados bentônicos. Em córregos rasos com material extensivo do tamanho do cascalho-à-seixo, o sampler de Surber e o sampler de Hess são os dispositivos os mais geralmente usados mas todo o sampler da fixo-área podem ser usados. Ao amostrar outros tipos de habitats onde estes dispositivos não funcionam, consulte Merritt et al. 23 e Hauer e resh24.
- Coloque o dispositivo de amostragem firmemente contra a parte inferior do fluxo com a recolha de amostras líquida orientada a jusante; Mova as grandes pedras conforme necessário para estabelecer um selo firme com o substrato.
- Use uma escova de arame ou plástico para esfregar vigorosamente o substrato dentro da área de amostragem por um período de 2 min, permitindo que os macroinvertebrados bentônicos desalojados se desviem para a rede de amostras.
- Transfira o conteúdo da amostra da rede para um frasco de plástico e cubra com 70% de álcool isopropílico para preservação. Rotule o pote e armazene-o em um local seguro para transferência para o laboratório.
- Colete e preserve amostras de macroinvertebrados bentônicos adicionais, repetindo o passo 2,2.
Nota: o número de amostras de macroinvertebrados que devem ser coletadas é variável e um pouco arbitrária. Idealmente, 5 — 10 amostras replicadas devem ser coletadas e preservadas individualmente. No mínimo, 3 amostras de repetição devem ser coletadas. - Retorne todas as amostras coletadas para o laboratório para processamento.
Nota: o álcool isopropílico é um líquido inflamável e se as amostras preservadas serão expedidas através da terra ou da transportadora aérea, será necessário primeiro completar e satisfazer todos os bens perigosos pertinentes/treinamento de mercadorias perigosas, embalagem, e requisitos de envio. - No laboratório, classificar e identificar amostras de macroinvertebrados bentônicos preservados.
- Separe os thespecimens do sedimento fino, derramando cuidadosamente o conteúdo da amostra em uma peneira de malha fina (por exemplo, 125 ou 250 μm) e enxaguar.
- Transfira os conteúdos enxaguados para uma bandeja de plástico branco ou esmalte, cubra com um pequeno volume de água e escolha manualmente macroinvertebrados do resíduo remanescente com pinça de ponto fino. Coloque macroinvertebrados extraídos em um pequeno recipiente de álcool isopropílico a 70%.
Nota: se uma grande quantidade de resíduos de plantas grosseiras ou minerais for misturada com o conteúdo da amostra, dificultando a observação de macroinvertebrados na bandeja, pode ser necessário processar o conteúdo remanescente da amostra pela primeira subdividindo o material e trabalhando com várias quantidades menores. - Usando um microscópio estereofónico de dissecação com um micrômetro da ocular instalado em uma das oculares, identifique espécimes ao mais baixo nível taxonômico prático. Na maioria dos casos, este será o nível de família ou gênero.
Nota: processar e identificar o conteúdo completo de uma única amostra de invertebrados exigirá frequentemente 2 — 5 h ou mais. Orçamento tempo suficiente e certifique-se de que uma biblioteca adequada de chaves taxonômicas25,26,27,28 está disponível para ajudar na identificação. - Use o micrômetro ocular na ocular do microscópio para medir o comprimento de corpo completo de cada espécime. Se a medição do comprimento do corpo não for possível (por exemplo, abdômen danificado ou ausente), a medição da largura da cápsula da cabeça pode ser suficiente.
- Estimar a massa seca individual (M) para cada espécime usando o comprimento do corpo ou a largura da cápsula da cabeça medições e comprimento de corpo específico de taxon vs. m ou largura da cabeça vs. equações de regressão m de fontes publicadas29, a 30. Por exemplo, o comprimento do corpo empírico (mm) vs. M (mg) equação relatada em Benke et al. 29 para a Sialidae sialis SP. (Megaloptera, Sialidae) é M = 0, 31 × comprimento total2,801. Portanto, M estimado para um espécime sialis SP. com um comprimento total de 15 mm é 6,104 mg.
Observação: se uma equação de comprimento vs. M publicada não estiver disponível para um determinado taxon, substitua uma equação apropriada em um nível mais alto de resolução taxonômica (por exemplo, substituindo a equação de nível familiar apropriada quando a equação de nível de gênero é Não disponível) ou de um táxon estreitamente relacionado com uma forma semelhante do corpo.
3. estimativa dos peixes e das densidades de macroinvertebrados bentônicos dentro dos escaninhos do tamanho do registro2
Uma animação demonstrando como formatar os dados de peixes e invertebrados para uso na análise de espectros de tamanho está disponível em http://bit.ly/SizeSpectraDensities.
- Estabeleça uma série de escaninhos do tamanho do registro2 que abrangerão todos os espécimes do invertebrado e dos peixes, variando dos macroinvertebrados bentônicos os menores ao peixe o maior. Assegure-se de que todas as estimativas do tamanho estejam nas unidades da massa seca do magnésio.
Nota: para consistência, recomendamos as caixas de tamanho usadas por McGarvey e Kirk17. Estes tamanho Bins variam de 0, 1 a 214748,3648 mg. Uma planilha com os limites inferior e superior para cada um desses 31 Bins de tamanho de log2 é fornecida no arquivo complementar 2. - Estimar a abundância de peixes dentro de cada um dos compartimentos de tamanho correspondente.
- Primeiro converta todos os pesos de peixe individuais de g massa molhada (gravado nas folhas de dados de campo) para mg de massa seca. O fator de conversão de massa molhado-seco de Waters31 (1 g de massa úmida = 0,2 g de massa seca) pode ser usado após a conversão de g para mg.
- Soma o número total de peixes individuais que foram capturados dentro de cada uma das respectivas caixas de tamanho (independentemente da identidade das espécies) durante as primeiras, segundas e terceiras amostras de depleção. Um exemplo é mostrado no arquivo complementar 2.
Nota: a subamostragem tendenciosa de peixes muito pequenos é comum na amostragem dos peixes do vapor e será evidente quando os indivíduos são somados dentro dos escaninhos do tamanho do registro2 ; As abundâncias somadas dos peixes os menores serão conspicuamente mais baixas do que em escaninhos maiores (por exemplo, 5 contra 100 indivíduos em escaninhos adjacentes do tamanho). Remova as caixas de tamanho do log2 que são claramente tendenciosas antes da análise de espectros de tamanho (consulte Etapa 4). - Use a equação de verossimilhança máxima de Zippin15,32 para estimar a abundância total de peixes (n) dentro do menor tamanho de peixe bin.
- Comece calculando uma estatística X intermediária como

onde eu denota o passo de amostragem ith (i = 1, 2, 3, etc.), k representa o número total de passes (k = 3, a menos que passes adicionais foram pesquisados), e Ci é o total número de peixes capturados durante o ith Pass. - Calcule a estimativa de probabilidade máxima de n , substituindo iterativamente a diminuição dos valores de n na equação 2 até

onde T é o número total de indivíduos capturados durante os passes k e todas as variáveis restantes são definidas acima na equação 1. - Se forem observadas contagens de zero na primeira, segunda ou terceira amostra de depleção, estimar n como a soma dos indivíduos que foram captam entre as três amostras de depleção. Um exemplo trabalhado de equações 1 e 2 é mostrado no arquivo complementar 2.
Nota: vários aplicativos de software podem ser usados para calcular estimativas de abundância de Zippin de amostras de depleção, como a função de "remoção" no pacote R ' FSA ' (avaliação de estoque de pesca)33. No entanto, é mais instrutivo para resolver manualmente as equações 1 e 2 em uma planilha. Instruções detalhadas são fornecidas em Lockwood e Schneider34 e arquivo complementar 2.
- Comece calculando uma estatística X intermediária como
- Repita o passo 3.2.3 para cada um dos compartimentos de tamanho de peixe restantes.
- Converta a estimativa n para cada compartimento de tamanho contendo peixes para uma estimativa por 1 m2D dividindo n pela estimativa da área de superfície total do alcance pesquisado do passo 1.1.2 acima. Por exemplo, se a estimativa de n zippin é 70 peixes e a área de superfície do alcance pesquisado é 1.200 m2, então D = 0, 58 Fish/m2.
- Estimar a abundância de macroinvertebrados bentônicos dentro das caixas de tamanho de log2 , agrupando os resultados de cada uma das amostras de campo (ou seja, combine os resultados das amostras replicantes em uma única lista de espécimes individuais) e, em seguida, somando o número total de indivíduos dentro de cada tamanho bin.
Nota: se as equações de massa de comprimento utilizadas na etapa 2.5.5 produzem estimativas de peso individuais em unidades de massa seca de mg, nenhuma conversão de unidade adicional é necessária para macroinvertebrados bentônicos. - Estimar macroinvertebrados bentônicos D dentro de cada tamanho bin como
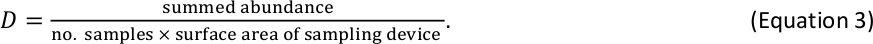
Por exemplo, se 6 amostras de macroinvertebrados bentônicos foram coletadas com um dispositivo padrão de Hess (área de superfície = 0, 86 m2) e um total de 110 indivíduos foram contados dentro de um escaninho dado do tamanho, a estimativa D para esse escaninho do tamanho é 213 indivíduos/m2 . - Combine d resultados para peixes e macroinvertebrados bentônicos em uma única tabela de estimativas d por log2 tamanho bin. Se os peixes e macroinvertebrados ocorrem no mesmo tamanho bin (um evento raro que pode ocorrer para os maiores invertebrados e peixes menores), somar suas respectivas estimativas d para obter uma estimativa d total para esse tamanho bin.
- Exclua qualquer escaninhos de tamanho de log2 ' vazios ' (ou seja, caixas de tamanho com valores D de zero), pois as caixas vazias irão distorcê-los nos modelos de regressão linear usados para estimar os parâmetros de espectros de tamanho35,36.
4. modelagem do espectro do tamanho do macroinvertebrado e dos peixes bentônicos
- Estimar a massa seca média para cada log2 tamanho bin (Ḿ) usando um dos seguintes valores: (i) o valor mínimo (limite inferior) para cada tamanho bin; (II) o valor máximo (limite superior); (III) a média aritmética (do mínimo e máximo); ou (IV) a média geométrica (do mínimo e máximo)35.
Nota: nos exemplos mostrados abaixo, Ḿ foi estimado como a média aritmética de cada bin de tamanho de log2 (ver arquivo complementar 2). - ' Normalize ' a estimativa D para cada bin de tamanho de log2 dividindo-a por sua respectiva largura (i.e., diferença entre o limite superior e inferior)16,35. Isso impedirá que os intervalos de tamanho de log não-uniforme2 de criar viés nos modelos de regressão linear que são usados para estimar os parâmetros de espectros de tamanho35,37,38.
- O log10 transforma todos os dados Ḿ e ḏ para converter a relação curvilíneo D
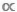 M para uma relação linear. Em seguida, use a regressão de mínimos quadrados comuns com os dados de log10(Ḿ) e log10(ḏ) para modelar o espectro de tamanho como
M para uma relação linear. Em seguida, use a regressão de mínimos quadrados comuns com os dados de log10(Ḿ) e log10(ḏ) para modelar o espectro de tamanho como 
onde o log10(a) é o intercepto e b é a inclinação do modelo de espectro de tamanho linear.
Resultados
Resultados exemplar, incluindo dados de campo originais, são apresentados para Slaunch Fork, Virgínia Ocidental, um pequeno riacho no sul da Virgínia Ocidental. Os resultados do modelo de espectros de tamanho adicional também são apresentados para outros dois córregos na mesma região: Camp Creek e Cabin Creek, Virgínia Ocidental. Estes são os três locais de estudo incluídos em McGarvey e Kirk17, mas os dados apresentados aqui são de novas amostras coletadas em maio 2015. Um exemplo tot...
Discussão
Este protocolo de espectros de tamanho atáxico pode ser usado para quantificar e modelar a estrutura de tamanho dentro das comunidades de peixes e invertebrados de fluxo. Os estudos de espectros de tamanho prévio em ecossistemas de fluxo variaram de pesquisa descritiva básica39,40 a comparações ao longo de um perfil longitudinal do Rio41 e entre distintas regiões biogeográficas42. Comparações sazonais foram...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O financiamento para este trabalho foi prestado pela National Science Foundation (Grant DEB-1553111) e pela Fundação Eppley para a investigação científica. Este manuscrito é a contribuição da VUC Rice Rivers Center #89.
Materiais
| Name | Company | Catalog Number | Comments |
| Chest waders | Multiple options | n/a | Personal protective equipment for use during electrofishing. Do NOT use 'breatheable' waders as electrical current will pass through them. |
| Rubber lineman's gloves | Multiple options | n/a | Personal protective equipment for use during electrofishing. |
| Dip nets with fiberglass poles | Multiple options | n/a | Used to capture stunned fishes during electrofishing. |
| Backpack electrofishing unit | Smith-Root; Halltech; Midwest Lake Management; Aqua Shock Solutions | www.smith-root.com; www.halltechaquatic.com; https://midwestlake.com; https://aquashocksolutions.com/ | Backpack electrofishers are currently manufactured and distributed by four independent companies in North America. Prices and warranty/technical support are the most important factors in choosing a vendor. |
| Block nets/seines (×2) | Duluth Nets | https://duluthfishnets.com/ | Necessary length will depend on stream width. 3/8 inch mesh is recommended. |
| Cam-action utility straps with 1 inch nylon webbing (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at auto supply, hardware, and department stores. |
| Large tent stakes (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at camping and department stores. |
| 5 gallon plastic buckets (×5) | Multiple options | n/a | Used to hold and transport fish during electrofishing. Available at hardware and paint supply stores. |
| 10-20 gallon totes (×3) | Multiple options | n/a | Used as livewells, sedation tanks, and recovery bins for captured fishes. Available at hardware and department stores. |
| Battery powered 'bait bucket' aeration pumps | Cabelas | IK-019008 | Used to aerate fish holding bins during field processing. |
| Fish anesthesia (Tricaine-S) | Syndel | www.syndel.com | Used to sedate fishes for field processing. Tricaine-S is regulated by the U.S. Food and Drug Administration. |
| Folding camp table and chairs | Cabelas | IK-518976; IK-552777 | Used to process fish samples. |
| Pop-up canopy | Multiple options | n/a | Used as necessary for sun and rain protection. |
| Fish measuring board | Wildco | 3-118-E40 | Used to measure fish lengths. |
| Battery powered field scale with weighing dish | Multiple options | n/a | Used to weigh fishes. Must weigh be accurate to 0.1 or 0.01 grams. |
| Clear plastic wind/rain baffle | Multiple options | n/a | Used to shield scale in rainy or windy conditions. Must be large enough to cover the scale and a weighing dish. |
| White plastic or enamel examination trays | Multiple options | n/a | Trays are essential for examining fishes in the field. |
| Stainless steel forceps | Multiple options | n/a | Forceps are helpful when examining small fishes and in transfering invertebrates to specimen jars. |
| Hand magnifiers | Multiple options | n/a | Magnification is often helpful when identifying fish specimens in the field. |
| Fish identification keys | n/a | n/a | Laminated keys that are custom prepared for specific locations are most effective. |
| Datasheets printed on waterproof paper | Rite in the Rain | n/a | Waterproof paper is essential when working with aquatic specimens. |
| Retractable fiberglass field tapes | Lufkin | n/a | Used to measure stream channel dimensions. |
| Surber sampler or Hess sampler | Wildco | 3-12-D56; 3-16-C52 | Either of these fixed-area benthic samplers will work well in shallow streams with gravel or pebble substrate. |
| 70% ethanol or isopropyl alcohol | Multiple options | n/a | Used as invertebrate preservative. |
| Widemouth invertebrate specimen jars (20-32 oz.) | U.S. Plastic Corp. | 67712 | Any widemouth plastic jars will work but these particular jars are durable and inexpensive. |
Referências
- Peters, R. H. . The ecological implications of body size. , (1983).
- Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M., West, G. B. Toward a metabolic theory of ecology. Ecology. 85 (7), 1771-1789 (2004).
- Marquet, P. A., et al. Scaling and power-laws in ecological systems. Journal of Experimental Biology. 208 (9), 1749-1769 (2005).
- Bohlin, T., Dellefors, C., Faremo, U., Johlander, A. The energetic equivalence hypothesis and the relation between population-density and body-size in stream-living salmonids. The American Naturalist. 143 (3), 478-493 (1994).
- Dunham, J. B., Vinyard, G. L. Relationships between body mass, population density, and the self-thinning rule in stream-living salmonids. Canadian Journal of Fisheries and Aquatic Sciences. 54 (5), 1025-1030 (1997).
- Jennings, S., Blanchard, J. L. Fish abundance with no fishing: predictions based on macroecological theory. Journal of Animal Ecology. 73 (4), 632-642 (2004).
- Petchey, O. L., Belgrano, A. Body-size distributions and size-spectra: universal indicators of ecological status?. Biology Letters. 6 (4), 434-437 (2010).
- Woodward, G., et al. Body size in ecological networks. Trends in Ecology and Evolution. 20 (7), 402-409 (2005).
- Trebilco, R., Baum, J. K., Salomon, A. K., Dulvy, N. K. Ecosystem ecology: size-based constraints on the pyramids of life. Trends in Ecology and Evolution. 28 (7), 423-431 (2013).
- White, E. P., Ernest, S. K. M., Kerkhoff, A. J., Enquist, B. J. Relationships between body size and abundance in ecology. Trends in Ecology and Evolution. 22 (6), 323-330 (2007).
- Schmid, P. E., Tokeshi, M., Schmid-Araya, J. M. Relation between population density and body size in stream communities. Science. 289 (5484), 1557-1560 (2000).
- Morin, A., Nadon, D. Size distribution of epilithic lotic invertebrates and implications for community metabolism. Journal of the North American Benthological Society. 10 (3), 300-308 (1991).
- Mittelbach, G. G., Persson, L. The ontogeny of piscivory and its ecological consequences. Canadian Journal of Fisheries and Aquatic Sciences. 55 (6), 1454-1465 (1998).
- Woodward, G., Hildrew, A. G. Body-size determinants of niche overlap and intraguild predation within a complex food web. Journal of Animal Ecology. 71 (6), 1063-1074 (2002).
- Zippin, C. The removal method of population estimation. Journal of Wildlife Management. 22 (1), 82-90 (1958).
- Kerr, S. R., Dickie, L. M. . The biomass spectrum: a predator-prey theory of aquatic production. , (2001).
- McGarvey, D. J., Kirk, A. J. Seasonal comparison of community-level size-spectra in southern coalfield streams of West Virginia (USA). Hydrobiologia. 809 (1), 65-77 (2018).
- Reynolds, J. B., Kolz, A. L., Zale, A. V., Parrish, D. L., Sutton, T. M. Electrofishing. Fisheries techniques. 8, 305-361 (2012).
- Bowker, J., Trushenski, J. Fish drug questions answered by the FDA. Fisheries. 38 (12), 549-552 (2013).
- Topic Popovic, N., et al. Tricaine methane-sulfonate (MS-222) application in fish anaesthesia. Journal of Applied Ichthyology. 28 (4), 553-564 (2012).
- Trautman, M. B. . The fishes of Ohio. , (1981).
- Riley, S. C., Fausch, K. D. Underestimation of trout population size by maximum-likelihood removal estimates in small streams. North American Journal of Fisheries Management. 12 (4), 768-776 (1992).
- Merritt, R. W., Cummins, K. W., Resh, V. H., Batzer, D. P., Merritt, R. W., Cummins, K. W., Berg, M. B. Sampling aquatic insects: collection devices, statistical considerations, and rearing procedures. An introduction to the aquatic insects of North America. , 15-37 (2008).
- Hauer, F. R., Resh, V. H., Hauer, F. R., Lamberti, G. A. Macroinvertebrates. Methods in stream ecology. 1, 297-319 (2017).
- Thorp, J. H., Covich, A. P. . Ecology and classification of North American freshwater invertebrates. , (2010).
- Merritt, R. W., Cummins, K. W., Berg, M. B. . An introduction to the aquatic insects of North America. , (2008).
- Stewart, K. W., Stark, B. P. . Nymphs of North American stonefly genera (Plecoptera). , (2002).
- Wiggins, G. B. . Larvae of the North American caddisfly genera (Trichoptera). , (1998).
- Benke, A. C., Huryn, A. D., Smock, L. A., Wallace, J. B. Length-mass relationships for freshwater macroinvertebrates in North America with particular reference to the Southeastern United States. Journal of the North American Benthological Society. 18 (3), 308-343 (1999).
- Smock, L. A. Relationships between body size and biomass of aquatic insects. Freshwater Biology. 10 (4), 375-383 (1980).
- Waters, T. F. Secondary production in inland waters. Adv. Ecol. Res. 10, 91-164 (1977).
- Carle, F. L., Strub, M. R. New method for estimating population-size from removal data. Biometrics. 34 (4), 621-630 (1978).
- Ogle, D. H., Wheeler, P., Dinno, A. FSA: fisheries stock analysis. R package version 0.8.22.9000. , (2018).
- Lockwood, R. N., Schneider, J. C., Schneider, J. C. Stream fish population estimates by mark-and-recapture and depletion methods. Manual of fisheries survey methods II: with periodic updates. 7, (2000).
- Blanco, J. M., Echevarría, F., García, C. M. Dealing with size-spectra: some conceptual and mathematical problems. Scientia Marina. 58 (1-2), 17-29 (1994).
- White, E. P., Enquist, B. J., Green, J. L. On estimating the exponent of power-law frequency distributions. Ecology. 89 (4), 905-912 (2008).
- Vidondo, B., Prairie, Y. T., Blanco, J. M., Duarte, C. M. Some aspects of the analysis of size spectra in aquatic ecology. Limnology and Oceanography. 42 (1), 184-192 (1997).
- Sprules, W. G., Barth, L. E. Surfing the biomass size spectrum: some remarks on history, theory, and application. Canadian Journal of Fisheries and Aquatic Sciences. 73 (4), 477-495 (2016).
- Poff, N. L., et al. Size structure of the metazoan community in a Piedmont stream. Oecologia. 95 (2), 202-209 (1993).
- Ramsay, P. M., et al. A rapid method for estimating biomass size spectra of benthic metazoan communities. Canadian Journal of Fisheries and Aquatic Sciences. 54 (8), 1716-1724 (1997).
- Solimini, A. G., Benvenuti, A., D’Olimpio, R., Cicco, M. D., Carchini, G. Size structure of benthic invertebrate assemblages in a Mediterranean river. Journal of the North American Benthological Society. 20 (3), 421-431 (2001).
- Huryn, A. D., Benke, A. C., Hildrew, A., Raffaelli, D., Edmonds-Brown, R. Relationship between biomass turnover and body size for stream communities. Body size: the structure and function of aquatic ecosystems. 4, 55-76 (2007).
- Gaedke, U. The size distribution of plankton biomass in a large lake and its seasonal variability. Limnology and Oceanography. 37 (6), 1202-1220 (1992).
- Stead, T. K., Schmid-Araya, J. M., Schmid, P. E., Hildrew, A. G. The distribution of body size in a stream community: one system, many patterns. Journal of Animal Ecology. 74 (3), 475-487 (2005).
- Brose, U., et al. Consumer-resource body-size relationships in natural food webs. Ecology. 87 (10), 2411-2417 (2006).
- Mehner, T., et al. Empirical correspondence between trophic transfer efficiency in freshwater food webs and the slope of their size spectra. Ecology. 99 (6), 1463-1472 (2018).
- Daan, N., Gislason, H. G., Pope, J. C., Rice, J. Changes in the North Sea fish community: evidence of indirect effects of fishing?. ICES Journal of Marine Science. 62 (2), 177-188 (2005).
- Murry, B. A., Farrell, J. M. Resistance of the size structure of the fish community to ecological perturbations in a large river ecosystem. Freshwater Biology. 59 (1), 155-167 (2014).
- Broadway, K. J., Pyron, M., Gammon, J. R., Murry, B. A. Shift in a large river fish assemblage: body-size and trophic structure dynamics. PLoS ONE. 10 (4), e0124954 (2015).
- Vila-Martínez, N., Caiola, N., Ibáñez, C., Benejam, L., Brucet, S. Normalized abundance spectra of fish community reflect hydro-peaking on a Mediterranean large river. Ecological Indicators. 97, 280-289 (2019).
- Brucet, S., et al. Size-based interactions across trophic levels in food webs of shallow Mediterranean lakes. Freshwater Biology. 62 (11), 1819-1830 (2017).
- Ersoy, Z., et al. Size-based interactions and trophic transfer efficiency are modified by fish predation and cyanobacteria blooms in Lake Mývatn, Iceland. Freshwater Biology. 62 (11), 1942-1952 (2017).
- Arranz, I., Hsieh, C. H., Mehner, T., Brucet, S. Systematic deviations from linear size spectra of lake fish communities are correlated with predator–prey interactions and lake-use intensity. Oikos. 128 (1), 33-44 (2019).
- Jennings, S., et al. Long-term trends in the trophic structure of the North Sea fish community: evidence from stable-isotope analysis, size-spectra and community metrics. Marine Biology. 141 (6), 1085-1097 (2002).
- Guiet, J., Poggiale, J. C., Maury, O. Modelling the community size-spectrum: recent developments and new directions. Ecological Modelling. 337, 4-14 (2016).
- Robinson, J. P. W., et al. Fishing degrades size structure of coral reef fish communities. Global Change Biology. 23 (3), 1009-1022 (2017).
- Reuman, D. C., Mulder, C., Raffaelli, D., Cohen, J. E. Three allometric relations of population density to body mass: theoretical integration and empirical tests in 149 food webs. Ecology Letters. 11 (11), 1216-1228 (2008).
- Huryn, A. D., Wallace, J. B., Anderson, N. H., Merritt, R. W., Cummins, K. W., Berg, M. B. Habitat, life history, secondary production, and behavioral adaptations of aquatic insects. An introduction to the aquatic insects of. 5, 55-103 (2008).
- Werner, E. E., Gilliam, J. F. The ontogenetic niche and species interactions in size-structured populations. Annual Review of Ecology and Systematics. 15 (1), 393-425 (1984).
- Edwards, A. M., Robinson, J. P. W., Plank, M. J., Baum, J. K., Blanchard, J. L. Testing and recommending methods for fitting size spectra to data. Methods in Ecology and Evolution. 8 (1), 57-67 (2017).
- Roell, M., Orth, D. Production of three crayfish populations in the New River of West Virginia, USA. Hydrobiologia. 228 (3), 185-194 (1992).
- Hawkins, C. P., Murphy, M. L., Anderson, N. H., Wilzbach, M. A. Density of fish and salamanders in relation to riparian canopy and physical habitat in streams of the northwestern United States. Canadian Journal of Fisheries and Aquatic Sciences. 40 (8), 1173-1185 (1983).
- Rabeni, C. F., Collier, K. J., Parkyn, S. M., Hicks, B. J. Evaluating techniques for sampling stream crayfish (Paranephrops planifrons). New Zealand Journal of Marine and Freshwater Research. 31 (5), 693-700 (1997).
- DiStefano, R. J., Gale, C. M., Wagner, B. A., Zweifel, R. D. A sampling method to assess lotic crayfish communities. Journal of Crustacean Biology. 23 (3), 678-690 (2003).
- Price, J. E., Welch, S. M. Semi-quantitative methods for crayfish sampling: sex, size, and habitat bias. Journal of Crustacean Biology. 29 (2), 208-216 (2009).
- Sheldon, R. W., Sutcliffe, W. H., Paranjape, A. M. Structure of pelagic food chain and relationship between plankton and fish production. Journal of the Fisheries Research Board of Canada. 34 (12), 2344-2353 (1977).
- Andersen, K., et al. Asymptotic size determines species abundance in the marine size spectrum. The American Naturalist. 168 (1), 54-61 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados