Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modélisation du spectre de taille pour les macroinvertébrés et les poissons dans les écosystèmes des cours d'eau
Dans cet article
Résumé
Il s'agit d'un protocole visant à modéliser le spectre de taille (rapport d'échelle entre la masse individuelle et la densité de population) pour les données combinées sur les poissons et les invertébrés provenant des cours d'eau et des rivières. Les méthodes comprennent : les techniques de terrain pour recueillir des échantillons quantitatifs de poissons et d'invertébrés; méthodes de laboratoire pour normaliser les données sur le terrain; et l'analyse des données statistiques.
Résumé
Le spectre de taille est une relation inverse et allométrique de mise à l'échelle entre la masse corporelle moyenne (M) et la densité (D) des individus au sein d'une communauté écologique ou d'un réseau alimentaire. Fait important, le spectre de la taille suppose que la taille individuelle, plutôt que les caractéristiques comportementales ou d'histoire de vie des espèces, est le principal déterminant de l'abondance au sein d'un écosystème. Ainsi, contrairement aux relations allométriques traditionnelles qui se concentrent sur les données au niveau des espèces (p. ex., la taille corporelle des espèces moyennes par rapport à la densité de population), les analyses des spectres de taille sont « ataxiques » - les spécimens individuels ne sont identifiés que par leur taille, sans tenir compte de l'identité taxonomique. Les modèles de spectres de taille sont des représentations efficaces des réseaux alimentaires traditionnels et complexes et peuvent être utilisés dans des contextes descriptifs et prédictifs (p. ex., prédire les réponses des grands consommateurs aux changements dans les ressources basales). Des études empiriques provenant de divers écosystèmes aquatiques ont également fait état de niveaux modérés à élevés de similitude dans les pentes spectrales de taille, ce qui suggère que des processus communs peuvent réguler l'abondance des petits et grands organismes dans des milieux très différents. Il s'agit d'un protocole pour modéliser le spectre de taille au niveau communautaire dans les cours d'eau pataugés. Le protocole se compose de trois étapes principales. Tout d'abord, recueillir des échantillons quantitatifs de poissons benthiques et d'invertébrés qui peuvent être utilisés pour estimer les densités locales. Deuxièmement, normaliser les données sur les poissons et les invertébrés en convertissant tous les individus en unités d'ataxique (c.-à-d. les individus identifiés par la taille, indépendamment de l'identité taxonomique), et en résumant les individus dans des bacs de taillelog 2. Troisièmement, utilisez la régression linéaire pour modéliser la relation entre les estimations ataxiques M et D. Des instructions détaillées sont fournies ici pour compléter chacune de ces étapes, y compris un logiciel personnalisé pour faciliter l'estimation D et la modélisation des spectres de taille.
Introduction
Les relations de mise à l'échelle de la taille du corps, telles que l'association positive entre la masse corporelle et le taux métabolique, sont bien connues au niveau de l'organisme individuel et sont maintenant étudiées à des niveaux plus élevés d'organisation1,2,3 . Ces relations allométriques sont le plus souvent des fonctions de droit du pouvoir de la forme Y - aMb, où Y est la variable d'intérêt (par exemple, le métabolisme, l'abondance, ou la taille de la gamme à la maison), M est la masse corporelle d'un seul ou moyen individuel, b est un coefficient de mise à l'échelle, et a est une constante. Pour plus de commodité statistique, les données Y et M sont souvent transformées en journal avant l'analyse, puis modélisées avec des équations linéaires du journal de formulaire (Y) - journal (a ) et b journal (M), où b et journal ( a) devenir la pente linéaire du modèle et intercepter, respectivement.
Le spectre de taille est un type derelation allométrique qui prédit la densité (D , le nombre d'individus par zone unitaire) ou la biomasse (B, la masse résumée des individus par zone unitaire) en fonction de M (voir la section 4 pour plus informations sur l'utilisation des estimations D ou B « normalisées »). Comme d'autres relations de mise à l'échelle entre M et D ou entre M et B, le spectre de taille joue un rôle central dans l'écologie fondamentale et appliquée. Au niveau de la population, 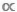 les biologistes interprètent souvent les relations négatives d'Assouplissement que M comme des preuves de survie dépendante de la densité ou comme des modèles de capacité de charge de l'écosystème (c.-à-d. la « règle de l'auto-éclaircie »)4, 5. Au niveau communautaire, les relations B
les biologistes interprètent souvent les relations négatives d'Assouplissement que M comme des preuves de survie dépendante de la densité ou comme des modèles de capacité de charge de l'écosystème (c.-à-d. la « règle de l'auto-éclaircie »)4, 5. Au niveau communautaire, les relations B 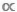 M peuvent être utilisées pour étudier les effets au niveau du système des perturbations anthropiques, telles que la pêche sélective de taille6,7. La mise à l'échelle allométrique de D et B avec M est également au cœur des efforts récents visant à unir l'écologie de la population, de la communauté et de l'écosystème2,8,9.
M peuvent être utilisées pour étudier les effets au niveau du système des perturbations anthropiques, telles que la pêche sélective de taille6,7. La mise à l'échelle allométrique de D et B avec M est également au cœur des efforts récents visant à unir l'écologie de la population, de la communauté et de l'écosystème2,8,9.
Une caractéristique particulièrement importante du spectre de taille est le fait qu'il est entièrement ataxique9,10. Ce point est facile à manquer lorsque l'on compare des scatterplots de données D 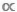 M ou B
M ou B 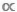 M, mais la distinction entre les modèles taxic et ataxique est critique. Dans les modèles taxic, une valeur M unique est utilisée pour représenter la masse corporelle moyenne de chaque individu d'une espèce donnée ou taxa11. Dans les modèles d'ataxique, tous les individus au sein d'un ensemble de données sont répartis entre une série d'intervalles de taille corporelle ou de bacs M, indépendamment de leur identité taxonomique12. Cette dernière approche ataxique est avantageuse dans les écosystèmes aquatiques où de nombreux taxons présentent une croissance indéterminée et subissent un ou plusieurs changements ontogénétiques dans le comportement alimentaire; dans ces cas, une seule moyenne M de niveau d'espèce masquera le fait qu'une espèce peut remplir différents rôles fonctionnels tout au long de son histoire de vie9,13,14.
M, mais la distinction entre les modèles taxic et ataxique est critique. Dans les modèles taxic, une valeur M unique est utilisée pour représenter la masse corporelle moyenne de chaque individu d'une espèce donnée ou taxa11. Dans les modèles d'ataxique, tous les individus au sein d'un ensemble de données sont répartis entre une série d'intervalles de taille corporelle ou de bacs M, indépendamment de leur identité taxonomique12. Cette dernière approche ataxique est avantageuse dans les écosystèmes aquatiques où de nombreux taxons présentent une croissance indéterminée et subissent un ou plusieurs changements ontogénétiques dans le comportement alimentaire; dans ces cas, une seule moyenne M de niveau d'espèce masquera le fait qu'une espèce peut remplir différents rôles fonctionnels tout au long de son histoire de vie9,13,14.
Ici, nous présentons un protocole complet pour quantifier le spectre de taille dans les ruisseaux et les rivières. Le protocole commence par des méthodes d'échantillonnage sur le terrain pour recueillir les données nécessaires sur les poissons et les macroinvertébrés benthiques. Les poissons seront recueillis au moyen d'un processus d'échantillonnage à trois passes. L'abondance sera alors estimée à partir des données d'épuisement avec la méthode Zippin15. Dans l'échantillonnage de l'épuisement, les poissons individuels dans une portée d'étude fermée (c.-à-d. que les individus ne peuvent ni entrer ni sortir de la portée fermée) sont retirés de la portée par trois échantillons successifs. Ainsi, le nombre de poissons restants sera progressivement épuisé. De cette tendance à l'épuisement, l'abondance totale dans la portée de l'étude peut être estimée puis convertie en D (en poissons par m2),en utilisant la surface connue de la portée de l'étude. Les macroinvertébrés benthiques seront recueillis avec des échantillonneurs de zones fixes standard, puis identifiés et mesurés en laboratoire.
Ensuite, les données combinées sur les poissons et les macroinvertébrés seront divisées entre les bacs de taille. Traditionnellement, l'échelle de l'octave ou du journal2 (c.-à-d. les intervalles de doublement) a été utilisée pour définir les limites des bacs de taille16. Une fois qu'une liste de bacs de taille a été établie, le cloisonnement des macroinvertébrés benthiques individuels entre leurs bacs de taille respective est simple parce que les invertébrés sont directement énumérés comme nombre d'individus par zone unitaire. Cependant, l'estimation de l'abondance des poissons dans les bacs de taille est plus abstraite parce que ces estimations sont déduites des données d'épuisement. Des instructions détaillées sont donc fournies pour estimer l'abondance des poissons dans les bacs de taille, indépendamment de l'identité taxonomique, à partir des données de l'échantillon d'épuisement.
Enfin, la régression linéaire sera utilisée pour modéliser le spectre de taille. Ce protocole est entièrement compatible avec la méthode originale et générale de Kerr et Dickie16 et identique aux méthodes utilisées par McGarvey et Kirk, 201817 dans une étude des spectres de taille de poissons et d'invertébrés dans les cours d'eau de Virginie-Occidentale. En utilisant ce protocole, les chercheurs peuvent s'assurer que leurs résultats sont directement comparables à d'autres études qui s'appuient sur Kerr et Dickie16, accélérant ainsi une compréhension large et robuste des relations de mise à l'échelle de la taille du corps en eau douce les écosystèmes et les mécanismes qui les animent.
Protocole
Toutes les méthodes décrites ici ont été approuvées par le Comité institutionnel de soins et d'utilisation des animaux (IACUC) de l'Université du Commonwealth de Virginie.
1. Collecte et traitement des échantillons de poisson
- Isoler les poissons dans la portée de l'étude pour créer un assemblage fermé de poissons
- Identifier l'amont et l'aval (la direction est relative à un arpenteur faisant face à « en amont » et contre le courant d'eau) les extrémités de l'étude atteignent puis marquez les extrémités avec du ruban adhésif amovible.
REMARQUE : La durée totale de l'étude est arbitraire, mais devrait être suffisamment longue pour englober une sélection représentative des différents types d'habitats (p. ex., riffles, pistes, piscines, banques sous-découpées) présents dans l'ensemble du cours d'eau. Dans la plupart des cas, une portée d'étude de 100 à 200 m sera adéquate. - Mesurer la largeur du chenal de flux mouillé à 5 à 10 transects, réparti uniformément le long de la portée de l'étude. Estimer la superficie totale de l'étude, car la largeur moyenne du chenal humide est multipliée par la longueur totale de la portée.
- Filets de blocs sécurisés (c.-à-d. sennes sans noeuds avec flotteurs sur la ligne supérieure et poids sur la ligne de fond) à travers le chenal du cours d'eau aux extrémités amont et aval de la portée de l'étude. Utilisez des filets à mailles moyennes à grossières (6,3 à 9,5 mm ou 1/4 à 3/8 po) pour minimiser l'accumulation de débris et l'engorgement. N'utilisez pas de grands filets à mailles (12,7 mm) lorsque de petits poissons passeront.
REMARQUE : Avant l'échantillonnage, préparez une trousse de gréement qui comprend : (i) 8 morceaux de corde en polypropylène de long (15 m) (9,5 mm ou 3/8 pouces de diamètre); et (ii) 8 sangles d'arrimage cam-action. N'utilisez pas de sangles à cliquet car celles-ci peuvent se casser et causer des blessures graves lorsque leur charge est relâchée.- À l'extrémité amont de la portée de l'étude, localisez un arbre, une racine, une grosse roche ou tout autre objet solide qui peut être utilisé pour ancrer un filet de chaque côté du cours d'eau. La disponibilité de points d'ancrage appropriés de chaque côté du cours d'eau aura probablement une incidence sur la position de la limite en amont.
- Sélectionnez un morceau de corde en polypropylène et créez une boucle à chaque extrémité à l'aide d'un noeud de bowline. N'utilisez qu'un noeud de bowline, car d'autres noeuds peuvent être scellés de façon permanente lorsqu'ils sont exposés à l'humidité et à une tension élevée. Pour obtenir des instructions sur l'attachement d'un noeud de noeud d'arc, voir Figure 1.
- Enroulez la corde autour de l'arbre/racine/roche et alimentez la boucle à une extrémité à travers la boucle à l'autre extrémité pour créer un point d'ancrage (Figure 2). Raccourcir ou allonger l'ancre de corde en ajoutant ou en enlevant les enveloppes autour de l'arbre/racine/roche.
- Répéter les étapes 1.1.3.1—1.1.3.3 pour établir un deuxième point d'ancrage de l'autre côté du cours d'eau.
- Créez une boucle dans les lignes à chacun des quatre coins du filet de bloc à l'aide d'un noeud de ligne d'arc. N'utilisez qu'un noeud arc (figure1).
- Connectez les deux côtés de la ligne supérieure du filet de bloc (la ligne avec des flotteurs) aux points d'ancrage à l'aide de sangles d'attache de cam-action. Insérez les crochets à chaque extrémité de la sangle d'arrimage dans les boucles aux coins du filet de bloc et aux points d'ancrage (figure 2). Tirez l'attache libre de la sangle d'attache à travers la boucle de la came pour serrer chaque point de contact.
REMARQUE : Pour relâcher la tension sur les ancres (pour ajuster la configuration du filet de bloc ou pour enlever le filet de bloc lorsque l'échantillonnage est terminé), appuyez sur le bouton de la came sur chacune des sangles d'arrimage. - Sécurisez la ligne de fond du filet de bloc (la ligne avec des poids) en les épinglant à la banque de flux avec des piquets de tente.
- Établir un joint avec le fond du ruisseau à l'aide de grosses roches pour épingler le filet de bloc vers le bas. Placez les roches sur le côté du filet en amont. Assurez-vous que le haut du filet demeure au-dessus du niveau de l'eau (figure 2). Ajustez la hauteur du point d'ancrage au besoin.
- Définir un deuxième bloc net en répétant les étapes 1.1.3.1-1.1.3.8 à l'extrémité aval de la portée de l'étude.
- Identifier l'amont et l'aval (la direction est relative à un arpenteur faisant face à « en amont » et contre le courant d'eau) les extrémités de l'étude atteignent puis marquez les extrémités avec du ruban adhésif amovible.
- Effectuer le premier des 3 laissez-passer d'échantillonnage des poissons à l'intérieur de la portée de l'étude incluse. Ce protocole suppose qu'un électropêcheur sac à dos est disponible et que tout le personnel de l'équipe d'arpentage est correctement formé pour l'utiliser. D'autres méthodes peuvent potentiellement être utilisées, mais peuvent ne pas être aussi efficaces dans la collecte d'échantillons de poissons représentatifs.
REMARQUE : Dans les petits cours d'eau, 4 à 5 personnes est une taille d'équipage idéale : une pour faire fonctionner l'électropêcheur, deux pour net les poissons étourdis, et une ou deux pour transporter des seaux de retenue et des poissons capturés par navette. En outre, l'électropêche sac à dos peut causer des blessures importantes, à la fois pour les poissons de flux et les humains18. Il est donc essentiel de faire preuve de prudence et de recevoir une formation adéquate.- À partir de l'extrémité aval de la portée de l'étude ci-jointe, allumez l'électropêcheur sac à dos et déplacez-vous dans la direction en amont. Progressez lentement et se déplacez d'un côté à l'autre tout au long de l'étude afin de s'assurer que tous les habitats en cours d'eau sont échantillonnés. Le premier passage d'épuisement est terminé lorsque le filet en amont est atteint.
- Laissez les membres de l'équipage de soutien suivre le chef (qui exploite l'électropêcheur), la collecte des poissons étourdis avec des filets de trempette comme ils sont repérés et les transférer dans des seaux temporaires, puis à des baignoires aérées. Utilisez de petites pompes à appâts alimentées par batterie avec des pierres d'aération pour s'assurer que les poissons capturés restent en bonne santé.
- Portez une attention particulière aux très petits poissons de l'année, car ils sont difficiles à repérer et à capturer. Lorsque la capture des plus petits poissons est très inefficace, les résultats peuvent être biaisés. Dans ce cas, il peut être nécessaire de supprimer les plus petites classes de taille du journal2 des données sur les poissons, avant d'estimer les densités dans les bacs de taille du journal2 (voir l'étape 3.2.2).
REMARQUE : Le succès des poissons étourdis à filet variera en fonction d'un certain nombre de conditions biologiques et environnementales. Par exemple, l'eau turbide dans laquelle la visibilité est faible limitera la capacité de localiser et de capturer efficacement les poissons; si la turbidité est trop élevée, l'échantillonnage doit être reprogrammé ou un autre site d'échantillonnage doit être choisi.
- Portez une attention particulière aux très petits poissons de l'année, car ils sont difficiles à repérer et à capturer. Lorsque la capture des plus petits poissons est très inefficace, les résultats peuvent être biaisés. Dans ce cas, il peut être nécessaire de supprimer les plus petites classes de taille du journal2 des données sur les poissons, avant d'estimer les densités dans les bacs de taille du journal2 (voir l'étape 3.2.2).
- Traitement des poissons collectés lors du premier passage d'épuisement
- Déterminer si une anesthésie sera nécessaire. Les poissons vivants sont souvent difficiles à manipuler, et la sédation peut être nécessaire pour minimiser le stress et les blessures aux spécimens de poissons. Si l'anesthésie est utilisée, deux options sont largement disponibles (à partir d'avril 2019) : Tricaine-S (tricaine methanesulfonate, MS-222) et dioxyde de carbone (bicarbonate de soude).
REMARQUE : Tricaine-S prévoit une période d'attente de 21 jours avant que les poissons exposés puissent être consommés en toute sécurité19,20, mais il est actuellement (en avril 2019) le seul sédatif de poisson approuvé par la Food and Drug Administration des États-Unis. - Lorsque vous utilisez des sédatifs, suivez attentivement toutes les instructions fournies avec le produit anesthésique. Dans tous les cas, mélanger le composé anesthésique dans un bain d'eau aéré. Immerger les poissons recueillis dans le bain jusqu'à ce que la sédation soit observée. Une fois sous sédatifs, traiter les poissons le plus rapidement possible, car une exposition prolongée aux sédatifs peut causer la mort.
- Utilisez de petites moustiquaires pour récupérer les poissons échantillonnés dans le réservoir de retenue (avec ou sans sédation), individuellement ou en petits lots, pour identification. Placez les spécimens dans des plateaux en plastique blanc ou en émail et utilisez des forceps et des loupes pour l'examen. Utilisez les clés d'identification locales ou régionales (p. ex., « Les poissons de l'Ohio »)21 pour faciliter l'identification.
- Mesurer la longueur totale (de la pointe du museau à l'extrémité de la nageoire caudale) pour chaque spécimen, puis peser sur l'équilibre du champ. Si vous utilisez un solde électronique, sélectionnez-en un avec une précision de 0,1 ou 0,01 g. Gardez une boîte en plastique transparente à portée de main pour l'utiliser, au besoin, comme une déflecteur de vent et de pluie (elle doit être assez grande pour couvrir l'équilibre et les spécimens étant pesés).
- Enregistrez toutes les informations (identité de l'espèce, longueur totale et poids) sur des fiches de données imperméables. Un exemple imprimable d'une feuille de données sur les poissons est fourni dans le fichier supplémentaire 1.
- Une fois transformés, retourner les poissons dans un bac de retenue/récupération aéré séparément. Lorsque tous les poissons ont été transformés, relâchez-les en aval du filet de bloc en aval.
REMARQUE: Si vous les relâchez accidentellement dans votre portée d'étude incluse, vous ruinerez votre échantillon! Si l'anesthésie a été utilisée, attendez de libérer jusqu'à ce que tous les poissons ont récupéré et retrouvé l'équilibre.
- Déterminer si une anesthésie sera nécessaire. Les poissons vivants sont souvent difficiles à manipuler, et la sédation peut être nécessaire pour minimiser le stress et les blessures aux spécimens de poissons. Si l'anesthésie est utilisée, deux options sont largement disponibles (à partir d'avril 2019) : Tricaine-S (tricaine methanesulfonate, MS-222) et dioxyde de carbone (bicarbonate de soude).
- Exécution des deuxième et troisième passes d'épuisement
REMARQUE : Si une forte tendance à l'épuisement n'est pas induite dans les trois premiers passages (c.-à-d. si le nombre de poissons échantillonnés n'a pas sensiblement diminué au troisième passage), des passages supplémentaires peuvent être nécessaires pour estimer avec précision l'abondance des poissons22. Si le temps le permet, il est souvent judisé d'effectuer de manière proactive quatre ou cinq passes d'épuisement successives.- Vérifiez que les filets de blocs en amont et en aval sont toujours sécurisés. Si des débris importants ont été recueillis dans l'un ou l'autre filet de bloc, retirez-les à la cueillette manuelle.
- Recueillir les échantillons de laissez-passer d'épuisement restants en répétant les étapes 1.2-1.3. Veiller à ce que l'effort d'échantillonnage demeure constant entre les trois passages. Utilisez le même rythme de mouvement (le moment du processus est recommandé) et les mêmes membres d'équipage pour reexaminer la portée de l'échantillonnage.
- Une fois terminé, démonter les filets de bloc et enlever tous les matériaux d'ancrage.
2. Collecte et traitement d'échantillons de macroinvertébrés benthiques
- Sélectionnez des sites d'échantillons de macroinvertébrés benthiques à l'intérieur des limites de la portée de l'échantillonnage des poissons qui sont représentatifs des principaux types d'habitats physiques (p. ex., riffles ou pistes) observés dans la portée de l'étude.
- À l'aide d'un échantillonneur de zone fixe, prélever le premier échantillon de macroinvertébrés benthiques. Dans les cours d'eau peu profonds avec un matériau de taille gravier-caillou étendu, l'échantillonneur Surber et l'échantillonneur Hess sont les dispositifs les plus couramment utilisés, mais n'importe quel échantillonneur de zone fixe peut être utilisé. Lorsque vous échantillonnez d'autres types d'habitats où ces dispositifs ne fonctionnent pas, consultez Merritt et coll. 23 et Hauer et Resh24.
- Placez fermement le dispositif d'échantillonnage contre le fond du cours d'eau avec le filet de collecte d'échantillons orienté en aval; déplacer de grands galets au besoin pour établir un joint ferme avec le substrat.
- Utilisez un fil ou une brosse en plastique pour frotter vigoureusement le substrat dans la zone d'échantillonnage pendant une période de 2 min, ce qui permet aux macroinvertébrés benthiques délogés de dériver dans le filet de l'échantillon.
- Transférer le contenu de l'échantillon du filet dans un bocal en plastique et recouvrir d'alcool isopropyl à 70 % pour être conservé. Étiquetez le pot et rangez-le dans un endroit sûr pour le transférer au laboratoire.
- Recueillir et conserver d'autres échantillons de macroinvertébrés benthiques, en répétant l'étape 2.2.
REMARQUE : Le nombre d'échantillons de macroinvertébrés qui doivent être prélevés est variable et quelque peu arbitraire. Idéalement, 5 à 10 échantillons de repli devraient être prélevés et conservés individuellement. Au minimum, 3 échantillons de repli doivent être prélevés. - Retournez tous les échantillons recueillis au laboratoire pour traitement.
REMARQUE : L'alcool isopropyl est un liquide inflammable et si les échantillons conservés seront expédiés par voie terrestre ou aérienne, il sera nécessaire de compléter et de satisfaire d'abord toutes les exigences pertinentes en matière de formation, d'emballage et d'expédition de marchandises dangereuses et de marchandises dangereuses. - En laboratoire, trier et identifier les échantillons de macroinvertébrés benthiques conservés.
- Séparez les spécimens des sédiments fins en versant soigneusement le contenu de l'échantillon dans un tamis à mailles fines (p. ex., 125 ou 250 m) et en les rinçant.
- Transférer le contenu rincé sur un plateau en plastique blanc ou en émail, couvrir d'un petit volume d'eau et cueillir manuellement les macroinvertébrés des résidus restants avec des pointes fines. Placer les macroinvertébrés extraits dans un petit récipient de 70% d'alcool isopropyl.
REMARQUE : Si une grande quantité de résidus de plantes ou de minéraux grossiers est mélangée au contenu de l'échantillon, ce qui rend difficile la vue des macroinvertébrés dans le plateau, il peut être nécessaire de traiter le reste du contenu de l'échantillon en subdivisant d'abord le matériau et en travaillant avec plusieurs petites quantités. - À l'aide d'un microscope stéréo disséquant avec un micromètre oculaire installé dans l'un des oculaires, identifiez les spécimens au niveau taxonomique pratique le plus bas. Dans la plupart des cas, il s'agira d'un niveau familial ou de genre.
REMARQUE : Le traitement et l'identification du contenu complet d'un seul échantillon d'invertébrés nécessiteront souvent de 2 à 5 h ou plus. Budget suffisamment de temps et assurez-vous qu'une bibliothèque appropriée de clés taxonomiques25,26,27,28 est disponible pour aider à l'identification. - Utilisez le micromètre oculaire dans l'oculaire du microscope pour mesurer la longueur complète du corps de chaque spécimen. Si la mesure de la longueur du corps n'est pas possible (p. ex., abdomen endommagé ou manquant), la mesure de la largeur de la capsule de la tête peut suffire.
- Estimer la masse sèche individuelle (M) pour chaque spécimen en utilisant la longueur du corps ou la tête des mesures de largeur de capsule et la longueur du corps taxon-spécifique par rapport à M ou largeur de la tête vs M équations de régression des sources publiées29, 30. Par exemple, l'équation empirique de longueur du corps (mm) par rapport à M (mg) signalée dans Benke et al. 29 pour l'alderfly Sialis sp. (Megaloptera, Sialidae) est M 0,0031 - longueur totale2,801. Par conséquent, estimé M pour un spécimen Sialis sp. avec une longueur totale de 15 mm est de 6,104 mg.
REMARQUE : Si une équation de longueur publiée par rapport à M n'est pas disponible pour un taxon particulier, substituez une équation appropriée à un niveau plus élevé de résolution taxonomique (p. ex., substituer l'équation appropriée du niveau de la famille lorsque l'équation du niveau du genre est pas disponible) ou à partir d'un taxon étroitement lié avec une forme de corps similaire.
3. Estimation des densités de poissons et de macroinvertébrés benthiques dans les bacs de taille2 du journal
Une animation montrant comment formater les données des poissons et des invertébrés pour une analyse des spectres de taille est disponible à http://bit.ly/SizeSpectraDensities.
- Établir une série de bacs de taille2 qui engloberont tous les spécimens d'invertébrés et de poissons, allant du plus petit macroinvertébré benthique au plus gros poisson. Assurez-vous que toutes les estimations de taille sont en unités de masse sèche mg.
REMARQUE: Pour la cohérence, nous recommandons les bacs de taille utilisés par McGarvey et Kirk17. Ces bacs de taille vont de 0,0001 à 214 748,3648 mg. Une feuille de calcul avec les limites inférieures et supérieures pour chacun de ces 31 bacs de taille2 de journal est fournie dans le fichier supplémentaire 2. - Estimer l'abondance des poissons dans chacun des bacs de taille correspondants.
- Convertir d'abord tous les poids individuels des poissons de la masse humide g (enregistré sur les feuilles de données de champ) en masse sèche mg. Le facteur de conversion de masse humide à sec des eaux31 (1 g de masse humide à 0,2 g de masse sèche) peut être utilisé après la conversion de g en mg.
- Sommez le nombre total de poissons qui ont été capturés dans chacun des bacs de taille respectifs (indépendamment de l'identité de l'espèce) au cours des premiers, deuxièmes et troisièmes échantillons d'épuisement. Un exemple est affiché dans le fichier supplémentaire 2.
REMARQUE : Le sous-échantillonnage biaisé des très petits poissons est courant dans l'échantillonnage des poissons à vapeur et sera évident lorsque les individus seront résumés dans des bacs de taille2; les abondances résumées des plus petits poissons seront nettement inférieures à celles des grands bacs (p. ex., 5 contre 100 individus dans des bacs de taille adjacente). Supprimer les bacs de taillelog 2 qui sont clairement biaisés avant l'analyse des spectres de taille (voir l'étape 4). - Utilisez l'équation de probabilité maximale De Zippin15,32 pour estimer l'abondance totale des poissons (n) dans le plus petit bac de taille de poisson.
- Commencez par calculer une statistique intermédiaire X

où je désigne le pass d'échantillonnage ith (i 1, 2, 3, etc.), k représente le nombre total de passes (k - 3, à moins que des passes supplémentaires n'aient été étudiées), et Ci est le total nombre de poissons capturés au cours de la passe i th. - Calculer l'estimation de probabilité maximale de n en substituant itérativement des valeurs n décroissantes dans l'équation 2 jusqu'à

où Le T est le nombre total d'individus capturés au cours des passages k et toutes les variables restantes sont définies ci-dessus dans l'équation 1. - Si aucun dénombrement est observé dans le premier, deuxième ou troisième échantillon d'épuisement, estimez n comme la somme des individus qui ont été capturés parmi les trois échantillons d'épuisement. Un exemple travaillé des équations 1 et 2 est affiché dans le fichier supplémentaire 2.
REMARQUE : Plusieurs applications logicielles peuvent être utilisées pour calculer les estimations de l'abondance de Zippin à partir d'échantillons d'épuisement, comme la fonction « enlèvement » dans le paquet R « FSA » (Évaluation des stocks de pêche)33. Cependant, il est plus instructif de résoudre manuellement les équations 1 et 2 dans une feuille de calcul. Des instructions détaillées sont fournies dans Lockwood et Schneider34 et le fichier supplémentaire 2.
- Commencez par calculer une statistique intermédiaire X
- Répétez l'étape 3.2.3 pour chacun des bacs de taille de poisson restants.
- Convertir l'estimation n pour chaque bac de taille contenant du poisson à une estimation de 1 m2D en divisant n par l'estimation totale de la superficie de la portée étudiée à partir de l'étape 1.1.2 ci-dessus. Par exemple, si l'estimation de Zippin n est de 70 poissons et que la superficie de la portée étudiée est de 1 200 m2,puis D de 0,058 poisson/m2.
- Estimer l'abondance des macroinvertébrés benthiques dans les bacs de taille2 du journal en mettant en commun les résultats de chacun des échantillons sur le terrain (c.-à-d. combiner les résultats des échantillons répliqués en une seule liste de spécimens individuels), puis en résumant le nombre total de personnes dans chaque bac de taille.
REMARQUE : Si les équations de longueur-masse utilisées à l'étape 2.5.5 produisent des estimations de poids individuelles dans des unités de masse sèche mg, aucune conversion d'unité supplémentaire n'est nécessaire pour les macroinvertébrés benthiques. - Estimer le macroinvertébré benthique D dans chaque bac de taille comme
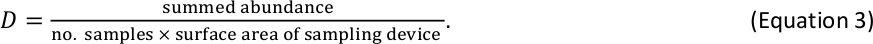
Par exemple, si 6 échantillons de macroinvertébrés benthiques ont été prélevés à l'aide d'un dispositif Hess standard (surface de 0,086 m2) et qu'un total de 110 individus ont été comptés dans un bac de taille donnée, l'estimation D pour ce bac de taille est de 213 individus/m2 . - Combiner les résultats D pour les poissons et les macroinvertébrés benthiques dans un seul tableau d'estimations D par bac de taille2. Si les poissons et les macroinvertébrés se trouvent dans le bac de même taille (un événement rare qui peut se produire pour les plus grands invertébrés et les plus petits poissons), résumez leurs estimations Respectives D pour obtenir une estimation D totale pour ce bac de taille.
- Supprimer tous les bacs de taille2 du journal « vide » (c.-à-d. les bacs de taille avec des valeurs D de zéro), car les bacs vides biaiseront les modèles de régression linéaire qui sont utilisés pour estimer les paramètres spectrals de taille35,36.
4. Modélisation du spectre des macroinvertébrés benthiques et de la taille des poissons
- Estimer la masse sèche moyenne pourchaque bac de taille2 du journal ( ) en utilisant l'une des valeurs suivantes : (i) la valeur minimale (limite inférieure) pour chaque bac de taille; (ii) la valeur maximale (limite supérieure); (iii) la moyenne arithmétique (du minimum et du maximum); ou (iv) la moyenne géométrique (du minimum et du maximum)35.
REMARQUE : Dans les exemples présentés ci-dessous, la moyenne arithmétique de chaque bac de taille2 du journal (voir Dossier supplémentaire 2). - « Normaliser » l'estimation D pour chaque bac de taille2 du journal en le divisant par sa largeur respective (c.-à-d. différence entre la limite supérieure et la limite inférieure)16,35. Cela empêchera les intervalles de taille du journal non uniforme2 de créer un biais dans les modèles de régression linéaire qui sont utilisés pour estimer les paramètres spectrals de taille35,37,38.
- Le journal10 transforme toutes les données de l'ide-m pour convertir la relation Curvilinear D
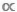 M en relation linéaire. Ensuite, utilisez la régression ordinaire desmoindres carrés avec le journal10( ) et le journal10(') données pour modéliser le spectre de taille comme
M en relation linéaire. Ensuite, utilisez la régression ordinaire desmoindres carrés avec le journal10( ) et le journal10(') données pour modéliser le spectre de taille comme 
où le journal10(a) est l'interception et b est la pente du modèle de spectre de taille linéaire.
Résultats
Les résultats exemplaires, y compris les données originales sur le terrain, sont présentés pour Slaunch Fork, en Virginie-Occidentale, un petit cours d'eau dans le sud de la Virginie-Occidentale. Des résultats de modèles spectrales de taille additionnelle sont également présentés pour deux autres cours d'eau dans la même région : Camp Creek et Cabin Creek, en Virginie-Occidentale. Ce sont les trois sites d'étude inclus dans McGarvey et Kirk17, mais les données présentées ici provien...
Discussion
Ce protocole spectral de taille ataxique peut être utilisé pour quantifier et modéliser la structure de la taille au sein des communautés de poissons des cours d'eau et d'invertébrés. Les études antérieures sur les spectres de taille dans les écosystèmes des cours d'eau ont varié de la recherche descriptive de base39,40 à des comparaisons le long d'un profil longitudinal41 et parmi les régions biogéographiques distinctes
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Le financement de ces travaux a été fourni par la National Science Foundation (subvention DEB-1553111) et la Fondation Eppley pour la recherche scientifique. Ce manuscrit est VCU Rice Rivers Center contribution #89.
matériels
| Name | Company | Catalog Number | Comments |
| Chest waders | Multiple options | n/a | Personal protective equipment for use during electrofishing. Do NOT use 'breatheable' waders as electrical current will pass through them. |
| Rubber lineman's gloves | Multiple options | n/a | Personal protective equipment for use during electrofishing. |
| Dip nets with fiberglass poles | Multiple options | n/a | Used to capture stunned fishes during electrofishing. |
| Backpack electrofishing unit | Smith-Root; Halltech; Midwest Lake Management; Aqua Shock Solutions | www.smith-root.com; www.halltechaquatic.com; https://midwestlake.com; https://aquashocksolutions.com/ | Backpack electrofishers are currently manufactured and distributed by four independent companies in North America. Prices and warranty/technical support are the most important factors in choosing a vendor. |
| Block nets/seines (×2) | Duluth Nets | https://duluthfishnets.com/ | Necessary length will depend on stream width. 3/8 inch mesh is recommended. |
| Cam-action utility straps with 1 inch nylon webbing (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at auto supply, hardware, and department stores. |
| Large tent stakes (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at camping and department stores. |
| 5 gallon plastic buckets (×5) | Multiple options | n/a | Used to hold and transport fish during electrofishing. Available at hardware and paint supply stores. |
| 10-20 gallon totes (×3) | Multiple options | n/a | Used as livewells, sedation tanks, and recovery bins for captured fishes. Available at hardware and department stores. |
| Battery powered 'bait bucket' aeration pumps | Cabelas | IK-019008 | Used to aerate fish holding bins during field processing. |
| Fish anesthesia (Tricaine-S) | Syndel | www.syndel.com | Used to sedate fishes for field processing. Tricaine-S is regulated by the U.S. Food and Drug Administration. |
| Folding camp table and chairs | Cabelas | IK-518976; IK-552777 | Used to process fish samples. |
| Pop-up canopy | Multiple options | n/a | Used as necessary for sun and rain protection. |
| Fish measuring board | Wildco | 3-118-E40 | Used to measure fish lengths. |
| Battery powered field scale with weighing dish | Multiple options | n/a | Used to weigh fishes. Must weigh be accurate to 0.1 or 0.01 grams. |
| Clear plastic wind/rain baffle | Multiple options | n/a | Used to shield scale in rainy or windy conditions. Must be large enough to cover the scale and a weighing dish. |
| White plastic or enamel examination trays | Multiple options | n/a | Trays are essential for examining fishes in the field. |
| Stainless steel forceps | Multiple options | n/a | Forceps are helpful when examining small fishes and in transfering invertebrates to specimen jars. |
| Hand magnifiers | Multiple options | n/a | Magnification is often helpful when identifying fish specimens in the field. |
| Fish identification keys | n/a | n/a | Laminated keys that are custom prepared for specific locations are most effective. |
| Datasheets printed on waterproof paper | Rite in the Rain | n/a | Waterproof paper is essential when working with aquatic specimens. |
| Retractable fiberglass field tapes | Lufkin | n/a | Used to measure stream channel dimensions. |
| Surber sampler or Hess sampler | Wildco | 3-12-D56; 3-16-C52 | Either of these fixed-area benthic samplers will work well in shallow streams with gravel or pebble substrate. |
| 70% ethanol or isopropyl alcohol | Multiple options | n/a | Used as invertebrate preservative. |
| Widemouth invertebrate specimen jars (20-32 oz.) | U.S. Plastic Corp. | 67712 | Any widemouth plastic jars will work but these particular jars are durable and inexpensive. |
Références
- Peters, R. H. . The ecological implications of body size. , (1983).
- Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M., West, G. B. Toward a metabolic theory of ecology. Ecology. 85 (7), 1771-1789 (2004).
- Marquet, P. A., et al. Scaling and power-laws in ecological systems. Journal of Experimental Biology. 208 (9), 1749-1769 (2005).
- Bohlin, T., Dellefors, C., Faremo, U., Johlander, A. The energetic equivalence hypothesis and the relation between population-density and body-size in stream-living salmonids. The American Naturalist. 143 (3), 478-493 (1994).
- Dunham, J. B., Vinyard, G. L. Relationships between body mass, population density, and the self-thinning rule in stream-living salmonids. Canadian Journal of Fisheries and Aquatic Sciences. 54 (5), 1025-1030 (1997).
- Jennings, S., Blanchard, J. L. Fish abundance with no fishing: predictions based on macroecological theory. Journal of Animal Ecology. 73 (4), 632-642 (2004).
- Petchey, O. L., Belgrano, A. Body-size distributions and size-spectra: universal indicators of ecological status?. Biology Letters. 6 (4), 434-437 (2010).
- Woodward, G., et al. Body size in ecological networks. Trends in Ecology and Evolution. 20 (7), 402-409 (2005).
- Trebilco, R., Baum, J. K., Salomon, A. K., Dulvy, N. K. Ecosystem ecology: size-based constraints on the pyramids of life. Trends in Ecology and Evolution. 28 (7), 423-431 (2013).
- White, E. P., Ernest, S. K. M., Kerkhoff, A. J., Enquist, B. J. Relationships between body size and abundance in ecology. Trends in Ecology and Evolution. 22 (6), 323-330 (2007).
- Schmid, P. E., Tokeshi, M., Schmid-Araya, J. M. Relation between population density and body size in stream communities. Science. 289 (5484), 1557-1560 (2000).
- Morin, A., Nadon, D. Size distribution of epilithic lotic invertebrates and implications for community metabolism. Journal of the North American Benthological Society. 10 (3), 300-308 (1991).
- Mittelbach, G. G., Persson, L. The ontogeny of piscivory and its ecological consequences. Canadian Journal of Fisheries and Aquatic Sciences. 55 (6), 1454-1465 (1998).
- Woodward, G., Hildrew, A. G. Body-size determinants of niche overlap and intraguild predation within a complex food web. Journal of Animal Ecology. 71 (6), 1063-1074 (2002).
- Zippin, C. The removal method of population estimation. Journal of Wildlife Management. 22 (1), 82-90 (1958).
- Kerr, S. R., Dickie, L. M. . The biomass spectrum: a predator-prey theory of aquatic production. , (2001).
- McGarvey, D. J., Kirk, A. J. Seasonal comparison of community-level size-spectra in southern coalfield streams of West Virginia (USA). Hydrobiologia. 809 (1), 65-77 (2018).
- Reynolds, J. B., Kolz, A. L., Zale, A. V., Parrish, D. L., Sutton, T. M. Electrofishing. Fisheries techniques. 8, 305-361 (2012).
- Bowker, J., Trushenski, J. Fish drug questions answered by the FDA. Fisheries. 38 (12), 549-552 (2013).
- Topic Popovic, N., et al. Tricaine methane-sulfonate (MS-222) application in fish anaesthesia. Journal of Applied Ichthyology. 28 (4), 553-564 (2012).
- Trautman, M. B. . The fishes of Ohio. , (1981).
- Riley, S. C., Fausch, K. D. Underestimation of trout population size by maximum-likelihood removal estimates in small streams. North American Journal of Fisheries Management. 12 (4), 768-776 (1992).
- Merritt, R. W., Cummins, K. W., Resh, V. H., Batzer, D. P., Merritt, R. W., Cummins, K. W., Berg, M. B. Sampling aquatic insects: collection devices, statistical considerations, and rearing procedures. An introduction to the aquatic insects of North America. , 15-37 (2008).
- Hauer, F. R., Resh, V. H., Hauer, F. R., Lamberti, G. A. Macroinvertebrates. Methods in stream ecology. 1, 297-319 (2017).
- Thorp, J. H., Covich, A. P. . Ecology and classification of North American freshwater invertebrates. , (2010).
- Merritt, R. W., Cummins, K. W., Berg, M. B. . An introduction to the aquatic insects of North America. , (2008).
- Stewart, K. W., Stark, B. P. . Nymphs of North American stonefly genera (Plecoptera). , (2002).
- Wiggins, G. B. . Larvae of the North American caddisfly genera (Trichoptera). , (1998).
- Benke, A. C., Huryn, A. D., Smock, L. A., Wallace, J. B. Length-mass relationships for freshwater macroinvertebrates in North America with particular reference to the Southeastern United States. Journal of the North American Benthological Society. 18 (3), 308-343 (1999).
- Smock, L. A. Relationships between body size and biomass of aquatic insects. Freshwater Biology. 10 (4), 375-383 (1980).
- Waters, T. F. Secondary production in inland waters. Adv. Ecol. Res. 10, 91-164 (1977).
- Carle, F. L., Strub, M. R. New method for estimating population-size from removal data. Biometrics. 34 (4), 621-630 (1978).
- Ogle, D. H., Wheeler, P., Dinno, A. FSA: fisheries stock analysis. R package version 0.8.22.9000. , (2018).
- Lockwood, R. N., Schneider, J. C., Schneider, J. C. Stream fish population estimates by mark-and-recapture and depletion methods. Manual of fisheries survey methods II: with periodic updates. 7, (2000).
- Blanco, J. M., Echevarría, F., García, C. M. Dealing with size-spectra: some conceptual and mathematical problems. Scientia Marina. 58 (1-2), 17-29 (1994).
- White, E. P., Enquist, B. J., Green, J. L. On estimating the exponent of power-law frequency distributions. Ecology. 89 (4), 905-912 (2008).
- Vidondo, B., Prairie, Y. T., Blanco, J. M., Duarte, C. M. Some aspects of the analysis of size spectra in aquatic ecology. Limnology and Oceanography. 42 (1), 184-192 (1997).
- Sprules, W. G., Barth, L. E. Surfing the biomass size spectrum: some remarks on history, theory, and application. Canadian Journal of Fisheries and Aquatic Sciences. 73 (4), 477-495 (2016).
- Poff, N. L., et al. Size structure of the metazoan community in a Piedmont stream. Oecologia. 95 (2), 202-209 (1993).
- Ramsay, P. M., et al. A rapid method for estimating biomass size spectra of benthic metazoan communities. Canadian Journal of Fisheries and Aquatic Sciences. 54 (8), 1716-1724 (1997).
- Solimini, A. G., Benvenuti, A., D’Olimpio, R., Cicco, M. D., Carchini, G. Size structure of benthic invertebrate assemblages in a Mediterranean river. Journal of the North American Benthological Society. 20 (3), 421-431 (2001).
- Huryn, A. D., Benke, A. C., Hildrew, A., Raffaelli, D., Edmonds-Brown, R. Relationship between biomass turnover and body size for stream communities. Body size: the structure and function of aquatic ecosystems. 4, 55-76 (2007).
- Gaedke, U. The size distribution of plankton biomass in a large lake and its seasonal variability. Limnology and Oceanography. 37 (6), 1202-1220 (1992).
- Stead, T. K., Schmid-Araya, J. M., Schmid, P. E., Hildrew, A. G. The distribution of body size in a stream community: one system, many patterns. Journal of Animal Ecology. 74 (3), 475-487 (2005).
- Brose, U., et al. Consumer-resource body-size relationships in natural food webs. Ecology. 87 (10), 2411-2417 (2006).
- Mehner, T., et al. Empirical correspondence between trophic transfer efficiency in freshwater food webs and the slope of their size spectra. Ecology. 99 (6), 1463-1472 (2018).
- Daan, N., Gislason, H. G., Pope, J. C., Rice, J. Changes in the North Sea fish community: evidence of indirect effects of fishing?. ICES Journal of Marine Science. 62 (2), 177-188 (2005).
- Murry, B. A., Farrell, J. M. Resistance of the size structure of the fish community to ecological perturbations in a large river ecosystem. Freshwater Biology. 59 (1), 155-167 (2014).
- Broadway, K. J., Pyron, M., Gammon, J. R., Murry, B. A. Shift in a large river fish assemblage: body-size and trophic structure dynamics. PLoS ONE. 10 (4), e0124954 (2015).
- Vila-Martínez, N., Caiola, N., Ibáñez, C., Benejam, L., Brucet, S. Normalized abundance spectra of fish community reflect hydro-peaking on a Mediterranean large river. Ecological Indicators. 97, 280-289 (2019).
- Brucet, S., et al. Size-based interactions across trophic levels in food webs of shallow Mediterranean lakes. Freshwater Biology. 62 (11), 1819-1830 (2017).
- Ersoy, Z., et al. Size-based interactions and trophic transfer efficiency are modified by fish predation and cyanobacteria blooms in Lake Mývatn, Iceland. Freshwater Biology. 62 (11), 1942-1952 (2017).
- Arranz, I., Hsieh, C. H., Mehner, T., Brucet, S. Systematic deviations from linear size spectra of lake fish communities are correlated with predator–prey interactions and lake-use intensity. Oikos. 128 (1), 33-44 (2019).
- Jennings, S., et al. Long-term trends in the trophic structure of the North Sea fish community: evidence from stable-isotope analysis, size-spectra and community metrics. Marine Biology. 141 (6), 1085-1097 (2002).
- Guiet, J., Poggiale, J. C., Maury, O. Modelling the community size-spectrum: recent developments and new directions. Ecological Modelling. 337, 4-14 (2016).
- Robinson, J. P. W., et al. Fishing degrades size structure of coral reef fish communities. Global Change Biology. 23 (3), 1009-1022 (2017).
- Reuman, D. C., Mulder, C., Raffaelli, D., Cohen, J. E. Three allometric relations of population density to body mass: theoretical integration and empirical tests in 149 food webs. Ecology Letters. 11 (11), 1216-1228 (2008).
- Huryn, A. D., Wallace, J. B., Anderson, N. H., Merritt, R. W., Cummins, K. W., Berg, M. B. Habitat, life history, secondary production, and behavioral adaptations of aquatic insects. An introduction to the aquatic insects of. 5, 55-103 (2008).
- Werner, E. E., Gilliam, J. F. The ontogenetic niche and species interactions in size-structured populations. Annual Review of Ecology and Systematics. 15 (1), 393-425 (1984).
- Edwards, A. M., Robinson, J. P. W., Plank, M. J., Baum, J. K., Blanchard, J. L. Testing and recommending methods for fitting size spectra to data. Methods in Ecology and Evolution. 8 (1), 57-67 (2017).
- Roell, M., Orth, D. Production of three crayfish populations in the New River of West Virginia, USA. Hydrobiologia. 228 (3), 185-194 (1992).
- Hawkins, C. P., Murphy, M. L., Anderson, N. H., Wilzbach, M. A. Density of fish and salamanders in relation to riparian canopy and physical habitat in streams of the northwestern United States. Canadian Journal of Fisheries and Aquatic Sciences. 40 (8), 1173-1185 (1983).
- Rabeni, C. F., Collier, K. J., Parkyn, S. M., Hicks, B. J. Evaluating techniques for sampling stream crayfish (Paranephrops planifrons). New Zealand Journal of Marine and Freshwater Research. 31 (5), 693-700 (1997).
- DiStefano, R. J., Gale, C. M., Wagner, B. A., Zweifel, R. D. A sampling method to assess lotic crayfish communities. Journal of Crustacean Biology. 23 (3), 678-690 (2003).
- Price, J. E., Welch, S. M. Semi-quantitative methods for crayfish sampling: sex, size, and habitat bias. Journal of Crustacean Biology. 29 (2), 208-216 (2009).
- Sheldon, R. W., Sutcliffe, W. H., Paranjape, A. M. Structure of pelagic food chain and relationship between plankton and fish production. Journal of the Fisheries Research Board of Canada. 34 (12), 2344-2353 (1977).
- Andersen, K., et al. Asymptotic size determines species abundance in the marine size spectrum. The American Naturalist. 168 (1), 54-61 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon