JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
스트림 생태계에서 거대 척추 동물 및 물고기의 크기 스펙트럼 모델링
요약
이 프로토콜은 물놀이가 가능한 하천과 하천의 결합된 어류 및 무척추 동물 데이터에 대한 크기 스펙트럼(개별 질량과 인구 밀도 간의 크기 조정 관계)을 모델링하는 프로토콜입니다. 방법은 다음을 포함한다: 정량적 물고기와 무척추 동물 샘플을 수집하는 필드 기술; 현장 데이터를 표준화하는 실험실 방법; 및 통계 데이터 분석.
초록
크기 스펙트럼은 생태 학적 커뮤니티 또는 식품 웹 내에서개인의 평균 체질량 (M)과 밀도 (D) 사이의 역, 대칭 스케일링 관계입니다. 중요한 것은, 크기 스펙트럼은 종의 행동 이나 생명 역사 특성보다는 개별 크기가 생태계 내에서 풍요로움의 주요 결정요인이라고 가정합니다. 따라서 종 수준 데이터(예: 평균 종의 신체 크기 대 인구 밀도)에 초점을 맞춘 기존의 동종 측정 관계와 달리 크기 스펙트럼 분석은 'ataxic'이며 개별 표본은 크기별로만 식별됩니다. 분류학적 정체성. 크기 스펙트럼 모델은 기존의 복잡한 식품 웹을 효율적으로 표현하며 설명및 예측 컨텍스트(예: 기초 자원의 변화에 대한 대규모 소비자의 응답 예측)에 사용할 수 있습니다. 다양한 수생 생태계의 경험적 연구는 또한 크기 스펙트럼 경사면에서 중간 수준에서 높은 수준의 유사성을 보고했으며, 이는 일반적인 프로세스가 매우 다른 환경에서 크고 작은 유기체의 풍부함을 조절할 수 있음을 시사합니다. 이 프로토콜은 방수 스트림에서 커뮤니티 수준 크기 스펙트럼을 모델링하는 프로토콜입니다. 프로토콜은 세 가지 주요 단계로 구성됩니다. 첫째, 현지 밀도를 추정하는 데 사용할 수있는 양적 벤틱 물고기와 무척추 동물 샘플을 수집합니다. 둘째, 모든 개인을 무과단위(즉, 분류학적 정체성에 관계없이 크기로 식별된 개인)로 변환하고 로그2 크기 저장소 내에서 개인을 합산하여 물고기와 무척추 동물 데이터를 표준화합니다. 셋째, 선형 회귀를 사용하여 ataxic M과 D 추정사이의 관계를 모델링합니다. D 추정 및 크기 스펙트럼 모델링을 용이하게 하기 위한 사용자 지정 소프트웨어를 포함하여 이러한 각 단계를 완료하기 위한 자세한 지침이 여기에 제공됩니다.
서문
체질량과 신진 대사 속도 사이의 긍정적 인 연관성과 같은 신체 크기 스케일링 관계는 개별 유기체 수준에서잘 알려져 있으며 현재 조직 1,2,3의 높은 수준에서 연구되고 있습니다. . 이러한 동종 측정 관계는 가장 자주 Y = aMb형태의 전력 법칙 기능이며, 여기서 Y는 관심의 변수 (예를 들어, 대사, 풍부함 또는 홈 범위 크기),M은 단일 또는 평균의 체질량이다. 개별, b는 배율 계수이고 a는 상수입니다. 통계적 편의를 위해 Y 및 M 데이터는 분석 전에 로그 변환된 다음 양식 로그 (Y) = log (a) + b 로그(M) 및 b 로그(M)로 모델링한 다음 b 및 로그 ( a)각각 선형 모델 경사 및 절편이 됩니다.
크기 스펙트럼은 M의 함수로서 밀도(D,단위 면적당 개인 수) 또는 바이오매스(B, 단위 면적당 개인의 합산 질량)를 예측하는 동종측정 관계의 일종이다(추가요금 제4항 참조) '정규화' D 또는 B 추정의 사용에 대한 정보입니다.) M과 D 사이의 다른 스케일링 관계와 마찬가지로 또는 M과 B사이의 크기 스펙트럼은 기본 및 적용 생태학에서 중심적인 역할을 합니다. 인구 수준에서 생물학자들은 종종 부정적인 D 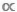 M 관계를 밀도 의존적 생존의 증거 또는 용량을 운반하는 생태계의 모델로 해석합니다 (즉, '자가 희석 규칙')4, 5. 커뮤니티 수준에서 B
M 관계를 밀도 의존적 생존의 증거 또는 용량을 운반하는 생태계의 모델로 해석합니다 (즉, '자가 희석 규칙')4, 5. 커뮤니티 수준에서 B 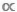 M 관계는 크기 선택적 낚시6,7과같은 인위적 섭동에 대한 시스템 수준의 효과를 연구하는 데 사용할 수 있습니다. M을 가진 D와 B의 동형 스케일링은 또한 인구, 지역 사회 및 생태계 생태계를 통합하기 위한 최근의 노력의 중심입니다2,8,9.
M 관계는 크기 선택적 낚시6,7과같은 인위적 섭동에 대한 시스템 수준의 효과를 연구하는 데 사용할 수 있습니다. M을 가진 D와 B의 동형 스케일링은 또한 인구, 지역 사회 및 생태계 생태계를 통합하기 위한 최근의 노력의 중심입니다2,8,9.
크기 스펙트럼의 특히 중요한 특징 중 하나는 완전히 무택시9,10이라는사실이다. 이 점은 D 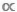 M 또는 B
M 또는 B 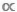 M 데이터의 산도도를 비교할 때 놓치기 쉽지만 택시 모델과 무택시 모델 간의 구분은 매우 중요합니다. taxic 모델에서, 단일 M 값은 주어진 종 또는 taxa11의모든 개인의 평균 체질량을 나타내는 데 사용된다. ataxic 모델에서 데이터 집합 내의 모든 개인은 분류학적 ID12에관계없이 일련의 신체 크기 간격 또는 M 저장소 간에 분할됩니다. 후자, 무과소 접근은 많은 taxa가 불확실한 성장을 전시하고 먹이 행동에 있는 하나 이상의 온유전적 변화를 경험하는 수생 생태계에서 유리합니다; 이러한 경우에, 단일 종 수준 M 평균종은 종의 생애 역사를 통해 다른 기능적 역할을 채울 수 있다는 사실을 모호하게 할 것이다9,13,14.
M 데이터의 산도도를 비교할 때 놓치기 쉽지만 택시 모델과 무택시 모델 간의 구분은 매우 중요합니다. taxic 모델에서, 단일 M 값은 주어진 종 또는 taxa11의모든 개인의 평균 체질량을 나타내는 데 사용된다. ataxic 모델에서 데이터 집합 내의 모든 개인은 분류학적 ID12에관계없이 일련의 신체 크기 간격 또는 M 저장소 간에 분할됩니다. 후자, 무과소 접근은 많은 taxa가 불확실한 성장을 전시하고 먹이 행동에 있는 하나 이상의 온유전적 변화를 경험하는 수생 생태계에서 유리합니다; 이러한 경우에, 단일 종 수준 M 평균종은 종의 생애 역사를 통해 다른 기능적 역할을 채울 수 있다는 사실을 모호하게 할 것이다9,13,14.
여기서는 물놀이가 가능한 하천과 하천 내의 크기 스펙트럼을 정량화하는 완전한 프로토콜을 제시합니다. 프로토콜은 필요한 물고기와 벤틱 거대 척추 동물 데이터를 수집하는 필드 샘플링 방법으로 시작합니다. 물고기는 '3 패스 고갈'샘플링 과정을 통해 수집됩니다. 그런 다음 Zippin 메서드15를사용하여 고갈 데이터에서 풍요로움을 추정합니다. 고갈 샘플링에서, 폐쇄 된 연구 범위 내의 개별 물고기 (즉, 개인은 동봉 된 도달 범위를 입력하거나 떠날 수 없습니다) 세 개의 연속 샘플을 통해 도달 범위에서 제거됩니다. 따라서, 남아있는 물고기의 수는 점진적으로 고갈될 것입니다. 이러한 고갈 추세로부터, 연구 범위 내의 총 풍부도는 연구 범위의공지된 표면적을 사용하여 D(m2당 어류)로 변환된 후 추정될 수 있다. 벤틱 거대 척추 동물은 표준 고정 영역 샘플러로 수집 된 다음 실험실에서 식별및 측정됩니다.
다음으로, 결합된 물고기와 거대 척추 동물 데이터는 크기 저장소 간에 분할됩니다. 전통적으로 옥타브 또는 로그2 스케일(즉, 두 배 간격)은 크기 빈경계(16)를설정하는 데 사용되어 왔다. 크기 저장소 목록이 설정되면 무척추 동물이 단위 면적당 개인의 수로 직접 나열되기 때문에 개별 벤틱 거대 척추 동물의 분할은 각 크기의 빈 중에서 간단합니다. 그러나 이러한 추정치는 고갈 데이터에서 유추되기 때문에 크기 저장소 내에서 물고기의 풍부도를 추정하는 것이 더 추상적입니다. 따라서 분류학적 ID에 관계없이 고갈 샘플 데이터에서 크기 저장소 내에서 물고기의 풍부도를 추정하기 위한 자세한 지침이 제공됩니다.
마지막으로 선형 회귀는 크기 스펙트럼을 모델링하는 데 사용됩니다. 이 프로토콜은 커와 디키(16)의 원래, 일반적인 방법과 완벽하게 호환되며, 웨스트 버지니아 스트림에서 물고기와 무척추 동물 크기 스펙트럼의 연구에서 맥가비와 커크, 201817에 의해 사용되는 방법과 동일합니다. 이 프로토콜을 사용하여, 조사관은 그들의 결과가 Kerr와 Dickie16에근거를 두는 그밖 연구 결과와 직접 비교된다는 것을 보장할 수 있습니다, 따라서 담수에 있는 바디 크기 스케일링 관계의 광범위하고 강력한 이해를 가속화하 생태계와 그들을 구동하는 메커니즘.
프로토콜
여기에 설명된 모든 방법은 버지니아 커먼웰스 대학의 기관 동물 관리 및 사용 위원회(IACUC)에 의해 승인되었습니다.
1. 생선 샘플 의 수집 및 가공
- 연구 범위 내에서 물고기를 분리하여 닫힌 물고기 조립을 만듭니다.
- 업스트림 및 다운스트림(방향은 '상류'를 향한 측량사및 물 전류에 대해 상대적)을 식별한 다음 이동식 플래그 테이프로 끝을 표시합니다.
참고: 스터디 도달 범위의 총 길이는 임의적이지만 전체 스트림 내에 존재하는 다양한 서식지 유형(예: 리플, 런, 풀, 언더컷 뱅크)의 대표적인 선택을 포괄할 수 있을 만큼 길어야 합니다. 대부분의 경우, 100-200 m 연구 도달이 적절할 것입니다. - 연구 도달 길이에 따라 균등하게 분포된 5-10개의 트랜스크에서 젖은 스트림 채널의 폭을 측정합니다. 평균 습윤 채널 폭에 도달 범위의 총 길이를 곱하여 스터디 도달범위의 총 표면적을 추정합니다.
- 스터디 도달 범위의 업스트림 및 다운스트림 끝에 있는 스트림 채널을 가로질러 블록 그물(즉, 상단 선에 수레가 있는 매듭없는 세느러미)을 고정합니다. 중간 에서 거친 메쉬 그물(6.3-9.5mm 또는 1/4-3/8인치 메쉬)을 사용하여 이물질과 막힘의 축적을 최소화합니다. 작은 물고기가 통과할 때 큰(>12.7mm) 메쉬 그물을 사용하지 마십시오.
참고: 샘플링 전에 다음과 같은 리깅 키트를 준비하십시오: (i) 8개의 길이(≥15 m 길이) 폴리프로필렌 로프 조각(9.5mm 또는 3/8인치 직경); (ii) 8 개의 캠 액션 타이 다운 스트랩. 래칫 액션 스트랩은 스냅되어 부하가 풀릴 때 심각한 부상을 입을 수 있으므로 사용하지 마십시오.- 스터디 도달 의 업스트림 끝에서 스트림의 각 측면에 그물을 고정하는 데 사용할 수 있는 나무, 루트, 큰 바위 또는 기타 솔리드 오브젝트를 찾습니다. 스트림의 각 측면에 적합한 앵커 포인트의 가용성은 업스트림 경계의 위치에 영향을 줄 수 있습니다.
- 폴리 프로필렌 로프의 한 조각을 선택하고 보우 라인 매듭을 사용하여 각 끝에 루프를 만들 수 있습니다. 다른 매듭은 습기와 높은 장력에 노출 될 때 영구적으로 밀봉 될 수 있기 때문에, 보우 라인 매듭을 사용합니다. 보우라인 매듭을 묶는 방법에 대한 지침은 그림1을 참조하십시오.
- 로프를 나무/루트/바위 주위에 감싸고 다른 쪽 끝의 루프를 통해 한쪽 끝에루프를 공급하여 앵커 포인트를 만듭니다(그림 2). 나무/루트/바위 주위에 랩을 추가하거나 제거하여 로프 앵커를 줄이거나 길게 합니다.
- 1.1.3.1-1.1.3 단계를 반복하여 스트림의 반대쪽에 두 번째 기준점을 설정합니다.
- 보우라인 매듭을 사용하여 블록 넷의 네 모서리 각각에 있는 선에 루프를 만듭니다. 보우라인 매듭지만사용합니다(그림 1).
- 캠 액션 타이다운 스트랩을 사용하여 블록 네트의 상단 선(수레가 있는 선)의 양면을 앵커 포인트에 연결합니다. 타이다운 스트랩의 양쪽 끝에 있는 후크를 블록 네트와 앵커 포인트의 루프에 삽입합니다(그림 2). 캠 버클을 통해 타이다운 스트랩의 자유 밧줄을 당겨 각 접촉 지점을 조입니다.
참고: 앵커에 장력을 해제하려면(블록 네트 설정을 조정하거나 샘플링이 완료되면 블록 그물을 제거하기 위해) 각 타이다운 스트랩의 캠 버튼을 누른다. - 텐트 말뚝이있는 스트림 뱅크에 고정하여 블록 그물 (가중치가있는 라인)의 하단 라인을 고정하십시오.
- 큰 바위를 사용하여 스트림의 바닥에 씰을 설정하여 블록 그물을 아래로 고정합니다. 그물 의 측면에 바위를 상류를 향하여 놓습니다. 그물의 상단이 수위 위에 남아 있는지확인하십시오 (그림 2). 필요에 따라 기준점의 높이를 조정합니다.
- 스터디 도달 범위의 다운스트림 끝에서 1.1.3.1-1.1.3.8 단계를 반복하여 두 번째 블록 그물을 설정합니다.
- 업스트림 및 다운스트림(방향은 '상류'를 향한 측량사및 물 전류에 대해 상대적)을 식별한 다음 이동식 플래그 테이프로 끝을 표시합니다.
- 밀폐된 스터디 리치 내에서 3개의 물고기 샘플링 고갈 패스 중 첫 번째를 수행합니다. 이 프로토콜은 배낭 전기 피셔를 사용할 수 있으며 모든 측량 승무원이 제대로 사용할 수 있도록 교육을 받은 것으로 가정합니다. 다른 방법은 잠재적으로 사용될 수 있지만 대표적인 생선 샘플을 수집하는 데 효과적이지 않을 수 있습니다.
참고: 작은 개울에서는 4~5명이 이상적인 승무원 크기입니다: 하나는 전기 피셔를 운영하고, 두 마리는 그물에 기절한 물고기, 그리고 한두 마리는 양동이를 들고 가지고 다니며 잡은 물고기를 운반합니다. 또한, 배낭 전기 낚시는 물고기와 인간(18)을스트리밍 모두, 상당한 부상을 일으킬 수 있습니다. 따라서 주의를 기울이고 적절한 훈련을 받는 것이 중요합니다.- 밀폐된 스터디 리치의 하류 끝에서 시작하여 배낭 전기 피셔를 켜고 상류 방향으로 이동합니다. 천천히 진행, 모든 인스트림 서식지샘플링을 보장하기 위해 연구 범위 전반에 걸쳐 좌우로 이동. 업스트림 그물에 도달하면 첫 번째 고갈 패스가 완료됩니다.
- 지원 승무원이 리더 (전기 피셔를 운영하는 사람)를 따라 가서 발견 된 대로 기절 한 물고기를 수집하고 임시 양동이로 옮긴 다음 통을 들고 있는 욕조로 옮길 수 있습니다. 포획된 물고기가 건강을 유지할 수 있도록 폭기 돌이 있는 작은 배터리 구동식 '미끼 버킷' 펌프를 사용하십시오.
- 그들은 발견하고 캡처하기 어렵기 때문에 매우 작은, 젊은 년 물고기에 특히주의를 기울이. 가장 작은 물고기를 포획하는 것이 매우 비효율적일 때, 결과는 편향될 수 있습니다. 이 경우 로그 2 크기 저장소 내의 밀도를 추정하기 전에 물고기 데이터에서 가장 작은 로그2 크기 클래스를 제거해야 할 수 있습니다(단계 3.2.2 참조).
참고: 기절한 물고기를 그물로 그물에 성공시키는 것은 생물학적 및 환경적 조건에 따라 달라집니다. 예를 들어, 가시성이 낮은 탁수물은 물고기를 효과적으로 찾고 포획하는 능력을 제한합니다. 탁도가 너무 높으면 샘플링을 다시 예약하거나 대체 샘플링 사이트를 선택해야 합니다.
- 그들은 발견하고 캡처하기 어렵기 때문에 매우 작은, 젊은 년 물고기에 특히주의를 기울이. 가장 작은 물고기를 포획하는 것이 매우 비효율적일 때, 결과는 편향될 수 있습니다. 이 경우 로그 2 크기 저장소 내의 밀도를 추정하기 전에 물고기 데이터에서 가장 작은 로그2 크기 클래스를 제거해야 할 수 있습니다(단계 3.2.2 참조).
- 첫 번째 고갈 패스에서 수집된 생선 가공
- 마취가 필요한지 여부를 결정합니다. 살아있는 물고기는 종종 처리하기 어렵고, 물고기 표본에 스트레스와 부상을 최소화하기 위해 신분이 필요할 수 있습니다. 마취를 사용하는 경우, 두 가지 옵션이 널리 사용할 수 있습니다 (4 월 2019) 사용할 수 있습니다: 트리카인-S (트리카인 메탄설포네이트, MS-222) 및 이산화탄소 (베이킹 소다).
참고: Tricaine-S는 노출된 생선을 안전하게 19,20을섭취하기 전에 21일의 보유 기간을 수반하지만 현재는 (2019년 4월 현재) 미국 식품의약국(FDA)이 승인한 유일한 생선 진정제입니다. - 진정제를 사용할 때는 마취제와 함께 제공되는 모든 지침을 주의 깊게 따르십시오. 모든 경우에, 식수 욕조에 마취 화합물을 섞는다. 수분이 관찰 될 때까지 목욕에서 수집 된 물고기를 잠수. 진정되면 진정제에 장기간 노출되면 죽을 수 있으므로 가능한 한 빨리 물고기를 처리하십시오.
- 작은 딥 그물을 사용하여 식별을 위해 개별적으로 또는 작은 배치로 보관 탱크에서 샘플링 된 물고기를 검색하십시오 (침전 유무에 관계없이). 표본을 흰색 플라스틱 또는 에나멜 트레이에 놓고 검지와 돋보기를 사용하여 검사하십시오. 현지 또는 지역 식별 키(예: "오하이오의 물고기")를 사용하여 식별을 돕습니다.
- 각 시편에 대한 총 길이(주총 끝에서 꼬리 지느러미 끝까지)를 측정한 다음 필드 저울에 무게를 두는다. 전자 저울을 사용하는 경우 0.1 또는 0.01g의 정밀도를 가진 저울을 선택합니다. 바람과 비 배플 (그것은 균형과 무게를 받고 있는 표본을 커버하기에 충분히 커야한다) 필요에 따라 사용하기 위해 손에 투명 플라스틱 상자를 유지합니다.
- 방수 데이터 시트에 모든 정보(종 ID, 총 길이 및 무게)를 기록합니다. 생선 데이터 시트의 인쇄 가능한 예는 보충 파일1에 제공됩니다.
- 처리가 완료되면 물고기를 별도의 포지트 보류/회수 통으로 되돌려 보입니다. 모든 물고기가 처리되면 다운스트림 블록 그물의 하류를 놓습니다.
참고 : 실수로 동봉 된 연구 범위로 놓으면 샘플을 망칠 것입니다! 마취를 사용 하는 경우, 모든 물고기 가 회복 되 고 평형을 회복 될 때까지 해제 기다립니다.
- 마취가 필요한지 여부를 결정합니다. 살아있는 물고기는 종종 처리하기 어렵고, 물고기 표본에 스트레스와 부상을 최소화하기 위해 신분이 필요할 수 있습니다. 마취를 사용하는 경우, 두 가지 옵션이 널리 사용할 수 있습니다 (4 월 2019) 사용할 수 있습니다: 트리카인-S (트리카인 메탄설포네이트, MS-222) 및 이산화탄소 (베이킹 소다).
- 두 번째 및 세 번째 고갈 패스 수행
참고: 처음 세 번의 패스에서 강한 고갈 추세가 유발되지 않는 경우(즉, 샘플링된 물고기의 수가 세 번째 패스에 의해 눈에 띄게 감소하지 않은 경우), 물고기 풍부도22를정확하게 추정하기 위해 추가 패스가 필요할 수 있습니다. 시간이 허락한다면, 4~5회 연속 고갈 패스를 사전에 실시하는 것이 좋은 생각입니다.- 업스트림 및 다운스트림 블록 그물이 여전히 안전한지 확인합니다. 두 블록 그물에 상당한 파편이 수집된 경우 손으로 따로 제거하십시오.
- 1.2-1.3 단계를 반복하여 나머지 고갈 통과 샘플을 수집합니다. 샘플링 노력이 세 가공 패스 모두 일관되게 유지되도록 합니다. 동일한 이동 속도(프로세스 타이밍 권장)와 동일한 승무원을 사용하여 샘플링 범위를 다시 조사합니다.
- 작업이 완료되면 블록 그물을 분해하고 모든 앵커 재료를 제거합니다.
2. 벤틱 거대 척추 동물 샘플 수집 및 처리
- 연구 도달 범위에서 관찰된 주요 유형의 물리적 서식지(예: 리플 또는 런)를 대표하는 물고기 샘플링 범위의 경계 내에서 벤틱 거대 척추 동물 샘플 사이트를 선택합니다.
- 고정 영역 샘플러를 사용하여 첫 번째 벤틱 거대 척추 동물 샘플을 수집합니다. 광범위한 자갈 - 투 - 페블 크기 재료와 얕은 스트림에서, Surber 샘플러와 헤스 샘플러는 가장 일반적으로 사용되는 장치이지만, 모든 고정 영역 샘플러를 사용할 수 있습니다. 이러한 장치가 작동하지 않는 다른 유형의 서식지를 샘플링 할 때 Merritt 등을 참조하십시오. 23 과 하우어와 레쉬24.
- 샘플링 장치를 다운스트림 방향의 샘플 수집 망으로 스트림 바닥에 단단히 놓습니다. 기판으로 단단한 밀봉을 확립하기 위해 필요에 따라 큰 자갈을 이동합니다.
- 와이어 또는 플라스틱 브러시를 사용하여 샘플링 영역 내의 기판을 2분 동안 적극적으로 스크럽하여 빼낸 벤틱 거대 척추동물이 샘플 그물로 표류할 수 있도록 합니다.
- 샘플 내용물에서 플라스틱 항아리로 옮기고 보존을 위해 70 % 이소 프로필 알코올로 덮습니다. 항아리에 라벨을 부착하고 실험실로 옮길 수 있는 안전한 장소에 보관하십시오.
- 추가 벤틱 거대 척추 동물 샘플을 수집하고 보존, 단계를 반복 2.2.
참고: 수집해야 하는 거대 척추동물 샘플의 수는 가변적이고 다소 임의적입니다. 이상적으로는 5-10개의 복제 샘플을 수집하고 개별적으로 보존해야 합니다. 최소한 3개의 복제 샘플을 수집해야 합니다. - 수집된 모든 샘플을 처리를 위해 랩에 반환합니다.
참고: 이소프로필 알코올은 인화성 액체이며 보존된 샘플이 지상 또는 항공 운송업체를 통해 배송되는 경우, 모든 관련 위험물/위험물 교육, 포장 및 운송 요구 사항을 먼저 완료하고 충족시켜야 합니다. - 실험실에서 보존된 벤틱 거대 척추 동물 샘플을 정렬하고 식별합니다.
- 시료 내용물을 미세 메쉬 체(예: 125 또는 250 μm)에 조심스럽게 붓고 헹구어 미세 퇴적물에서 분리합니다.
- 헹군 내용물을 흰색 플라스틱 또는 에나멜 트레이로 옮기고 소량의 물로 덮고 남은 잔류물에서 미세한 점 집게로 수동으로 거대 척추 동물을 선택합니다. 추출된 거대 척추동물을 70% 이소프로필 알코올의 작은 용기에 놓습니다.
참고: 다량의 거친 식물이나 미네랄 잔류물이 샘플 내용물과 혼합되어 트레이에서 거대 척추 동물을 보기 어렵게 하는 경우, 먼저 재료를 세분화하고 작업하여 나머지 샘플 내용물을 처리해야 할 수 있습니다. 여러 개의 작은 수량. - 안구 마이크로미터가 장착된 해부 스테레오 현미경을 사용하여 시편을 가장 낮은 실용적인 분류학 수준으로 식별합니다. 대부분의 경우, 이것은 가족 또는 속 수준이 될 것입니다.
참고: 단일 무척추 동물 샘플의 전체 내용을 처리하고 식별하는 데는 종종 2-5 시간 이상이 필요합니다. 충분한 시간을 예산하고 분류 키25,26,27,28의 적절한 라이브러리가 식별을 지원하기 위해 사용할 수 있는지 확인하십시오. - 현미경 접안렌즈에 안구 마이크로미터를 사용하여 각 시편의 전체 신체 길이를 측정합니다. 신체 길이 측정이 불가능한 경우(예: 복부 손상 또는 누락), 헤드 캡슐 폭의 측정으로 충분할 수 있습니다.
- 각 시편에대해 각각의 건량(M)을 추정하여 본체 길이 또는 헤드 캡슐 폭 측정 및 분류별 신체 길이 대 M 또는 헤드 폭 대 M 회귀 방정식을 공표한출처(29)에서, 30. 예를 들어, 벤케 외에서 보고된 경험적 신체 길이(mm) 대 M(mg) 방정식. 29 알더플라이 시알리스 sp. (메갈로페라, 시알리대)는 M = 0.0031 × 총 길이2.801이다. 따라서, 총 길이가 15 mm인 시편S에 대한 추정 M은 6.104 mg이다.
참고: 게시된 길이 와 M 방정식을 특정 분류에 사용할 수 없는 경우 더 높은 수준의 분류학적 해상도에서 적절한 방정식으로 대체합니다(예: 속 수준 방정식이 있을 때 적절한 패밀리 레벨 방정식을 대체합니다. 사용할 수 없습니다) 또는 비슷한 체형을 가진 밀접하게 관련된 분류에서.
3. 로그2 크기 저장소 내에서 물고기와 벤틱 거대 척추 동물 밀도의 추정
크기 스펙트럼 분석에 사용하기 위해 물고기와 무척추 동물 데이터를 포맷하는 방법을 보여주는 애니메이션은 http://bit.ly/SizeSpectraDensities.
- 가장 작은 벤틱 거대 척추 동물에서 가장 큰 물고기에 이르기까지 모든 무척추 동물과 물고기 표본을 포괄하는 일련의 로그2 크기 의 쓰레기통을 설정합니다. 모든 크기 추정치가 mg 건식 질량 단위로 되어 있는지 확인합니다.
참고: 일관성을 위해 McGarvey 및 Kirk17에서사용하는 크기 저장소를 사용하는 것이 좋습니다. 이 크기 저장소 범위는 0.0001에서 214,748.3648 mg입니다. 이러한 31개의 로그2 크기 저장소 각각에 대한 하한 및 상한이 있는 스프레드시트는 보충 파일2에 제공됩니다. - 해당 크기의 각 쓰레기통 내에서 물고기의 풍요로움을 추정합니다.
- 먼저 모든 개별 물고기 가중치를 g 습식 질량(필드 데이터 시트에 기록됨)에서 mg 건성 질량으로 변환합니다. Waters31의 습식 에서 건식 질량 변환 계수(1 g 습식 질량 = 0.2 g의 건조 질량)는 g에서 mg으로 변환한 후에 사용할 수 있습니다.
- 첫 번째, 두 번째 및 세 번째 고갈 샘플 동안 각각의 크기 저장소 (종 정체성에 관계없이)에서 캡처 된 개별 물고기의 총 수를 합산합니다. 예제는 보충 파일2에 표시됩니다.
참고 : 매우 작은 물고기의 바이어스 언더 샘플링은 증기 물고기 샘플링에서 일반적이며 개인이 로그2 크기 저장소 내에서 합산 될 때 분명합니다. 가장 작은 물고기의 합계 풍부는 큰 쓰레기통 (예를 들어, 인접한 크기의 쓰레기통에 5 대 100 개인)보다 눈에 띄게 낮을 것입니다. 크기 스펙트럼 분석 전에 명확하게 편향된 로그2 크기 저장소를 제거합니다(4단계 참조). - Zippin 최대 우도 방정식15,32를 사용하여 가장 작은 물고기 크기 저장소 내에서 총 물고기 풍부도 (n)를 추정합니다.
- 중간 X 통계를 다음으로 계산하여 시작합니다.

ith 샘플링 패스(i = 1, 2, 3 등)를 나타내면 k는 총 가공 패스 수(k = 3, 추가 가공 패스가 조사되지 않는 한)를 나타내고 Ci는 총 가공 패스입니다. ith 패스 중에 포획된 물고기의 수입니다. - 수학식 2에서 감소하는 n값을 반복적으로 대체하여 n의 최대 우도 추정치를 계산합니다.

여기서 T는 k 가공 패스 중에 캡처된 총 개인 수이며 나머지 모든 변수는 수학식 1에서 위에 정의된 대로 입니다. - 첫 번째, 두 번째 또는 세 번째 고갈 샘플에서 0카운트가 관찰되는 경우, 3개의 고갈 샘플 중에서 포획된 개인의 합계로 n을 추정합니다. 방정식 1과 2의 작업 예는 보충 파일2에 표시됩니다.
참고: R 패키지 'FSA'(수산 재고 평가)33의'제거' 기능과 같이 고갈 샘플에서 Zippin 풍부도 추정치를 계산하는 데 여러 소프트웨어 응용 프로그램을 사용할 수 있습니다. 그러나 스프레드시트에서 방정식 1과 2를 수동으로 해결하는 것이 더 유익합니다. 자세한 지침은 록우드 와 슈나이더34 및 보충 파일2에서 제공됩니다.
- 중간 X 통계를 다음으로 계산하여 시작합니다.
- 나머지 물고기 크기 저장소각각에 대해 3.2.3 단계를 반복합니다.
- 상기 1.1.2단계에서 조사된 도달범위의 총 표면적 추정치로 n을 나누어 물고기를 포함하는 각 크기의 빈에 대한 n 추정치를 1 m2D 추정치당 1m로 변환한다. 예를 들어 Zippin n 추정치가 70마리이고 조사된 도달 범위의 표면적이 1,200m2인경우 D = 0.058 물고기/m2입니다.
- 각 필드 샘플의 결과를 풀링하여 로그2 크기 저장소 내에서 벤틱 거대 척추 동물의 풍부도를 추정한 다음(즉, 복제 된 샘플의 결과를 개별 표본의 단일 목록으로 결합) 총 수를 합산합니다. 각 크기의 빈 내에서 개인.
참고: 2.5.5단계에서 사용된 길이 질량 방정식이 mg 건식 질량 단위로 개별 중량 추정치를 생성하는 경우 벤틱 거대 척추동물에 추가 단위 변환이 필요하지 않습니다. - 각 크기의 빈 내에서 벤틱 거대 척추 동물 D를 추정
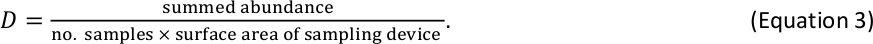
예를 들어, 6개의 벤틱 거대척추동물 샘플을 표준 Hess 장치(표면적 = 0.086 m2)로 수집하고 총 110명의 개인이 주어진 크기의 빈 내에서 계산된 경우 해당 크기의 Bin에 대한 D 추정치는 213개인/m2입니다. . - 물고기와 벤틱 거대 척추 동물에 대한 D 결과를 로그2 크기 저장소당 D 추정의 단일 테이블에 결합합니다. 물고기와 거대 척추 동물이 같은 크기의 빈에서 발생하는 경우 (가장 큰 무척추 동물과 가장 작은 물고기에 대해 발생할 수있는 드문 이벤트), 해당 크기의 빈에 대한 총 D 추정을 얻기 위해 각각의 D 추정치를 합산.
- 빈 저장소는 크기 스펙트럼 매개변수35,36을추정하는 데 사용되는 선형 회귀 모델을 편향하므로 '빈' 로그2 크기 저장소(즉, D 값이 0인 크기 bin)를 삭제합니다.
4. 벤틱 거대 척추 동물 및 물고기 크기 스펙트럼 모델링
- 다음 값 중 하나를 사용하여 각 로그2 크기 bin(들)에 대한 평균 건조 질량을 추정한다: (i) 각 크기 bin에 대한 최소값(lower boundary); (ii) 최대값(상한선); (iii) 산술 평균 (최소 및 최대); 또는 (iv) 기하학적 평균 (최소 및 최대)35.
참고: 아래 표시된 예에서, 각 로그2 크기 저장소의 산술 평균으로 추정되었습니다(보충 파일 2참조). - 각 로그2 크기 저장소에 대한 D 추정치를 각각의 너비(즉, 상하 경계 간의 차이)로 나누어 '정규화'(16,35). 이렇게 하면 크기 스펙트럼 매개변수35,37,38을추정하는 데 사용되는 선형 회귀 모델에서 비균일 로그2 크기 간격이 바이어스를 생성하지 못하게 됩니다.
- 로그10은 모든 및 변환 데이터를 변환하여 곡선 D
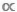 M 관계를 선형 관계로 변환합니다. 그런 다음 로그10(10)과로그10(△)와 함께 일반 최소 제곱 회귀를 사용하여 크기 스펙트럼을 모델링합니다.
M 관계를 선형 관계로 변환합니다. 그런 다음 로그10(10)과로그10(△)와 함께 일반 최소 제곱 회귀를 사용하여 크기 스펙트럼을 모델링합니다. 
여기서 로그10(a)은 절편이고 b는 선형 크기 스펙트럼 모델의 경사입니다.
결과
원본 필드 데이터를 포함한 모범 적인 결과는 웨스트 버지니아 남부의 작은 스트림인 웨스트 버지니아 주 Slaunch Fork에 대해 표시됩니다. 캠프 크릭과 캐빈 크릭, 웨스트 버지니아 : 추가 크기 스펙트럼 모델 결과는 같은 지역의 두 개의 다른 스트림에 대해 표시됩니다. 이들은 McGarvey와 Kirk17에포함된 3개의 연구 사이트입니다, 그러나 여기에서 제시된 데이터는 2015년 5월에 집합된 ...
토론
이 무색 크기 스펙트럼 프로토콜은 스트림 물고기와 무척추 동물의 지역 사회 내에서 크기 구조를 정량화하고 모델링하는 데 사용할 수 있습니다. 스트림 생태계에서의 이전 크기 스펙트럼 연구는 기본 설명 연구에서 범위39,40 세로 강 프로파일을 따라 비교에41 뚜렷한 생물 지리 영역 중42. 계절별 비교는
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품에 대한 자금은 국립 과학 재단에 의해 제공되었다 (보조금 DEB-1553111) 과학 연구를위한 Eppley 재단. 이 원고는 #89 VCU 라이스 리버 센터 기부금입니다.
자료
| Name | Company | Catalog Number | Comments |
| Chest waders | Multiple options | n/a | Personal protective equipment for use during electrofishing. Do NOT use 'breatheable' waders as electrical current will pass through them. |
| Rubber lineman's gloves | Multiple options | n/a | Personal protective equipment for use during electrofishing. |
| Dip nets with fiberglass poles | Multiple options | n/a | Used to capture stunned fishes during electrofishing. |
| Backpack electrofishing unit | Smith-Root; Halltech; Midwest Lake Management; Aqua Shock Solutions | www.smith-root.com; www.halltechaquatic.com; https://midwestlake.com; https://aquashocksolutions.com/ | Backpack electrofishers are currently manufactured and distributed by four independent companies in North America. Prices and warranty/technical support are the most important factors in choosing a vendor. |
| Block nets/seines (×2) | Duluth Nets | https://duluthfishnets.com/ | Necessary length will depend on stream width. 3/8 inch mesh is recommended. |
| Cam-action utility straps with 1 inch nylon webbing (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at auto supply, hardware, and department stores. |
| Large tent stakes (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at camping and department stores. |
| 5 gallon plastic buckets (×5) | Multiple options | n/a | Used to hold and transport fish during electrofishing. Available at hardware and paint supply stores. |
| 10-20 gallon totes (×3) | Multiple options | n/a | Used as livewells, sedation tanks, and recovery bins for captured fishes. Available at hardware and department stores. |
| Battery powered 'bait bucket' aeration pumps | Cabelas | IK-019008 | Used to aerate fish holding bins during field processing. |
| Fish anesthesia (Tricaine-S) | Syndel | www.syndel.com | Used to sedate fishes for field processing. Tricaine-S is regulated by the U.S. Food and Drug Administration. |
| Folding camp table and chairs | Cabelas | IK-518976; IK-552777 | Used to process fish samples. |
| Pop-up canopy | Multiple options | n/a | Used as necessary for sun and rain protection. |
| Fish measuring board | Wildco | 3-118-E40 | Used to measure fish lengths. |
| Battery powered field scale with weighing dish | Multiple options | n/a | Used to weigh fishes. Must weigh be accurate to 0.1 or 0.01 grams. |
| Clear plastic wind/rain baffle | Multiple options | n/a | Used to shield scale in rainy or windy conditions. Must be large enough to cover the scale and a weighing dish. |
| White plastic or enamel examination trays | Multiple options | n/a | Trays are essential for examining fishes in the field. |
| Stainless steel forceps | Multiple options | n/a | Forceps are helpful when examining small fishes and in transfering invertebrates to specimen jars. |
| Hand magnifiers | Multiple options | n/a | Magnification is often helpful when identifying fish specimens in the field. |
| Fish identification keys | n/a | n/a | Laminated keys that are custom prepared for specific locations are most effective. |
| Datasheets printed on waterproof paper | Rite in the Rain | n/a | Waterproof paper is essential when working with aquatic specimens. |
| Retractable fiberglass field tapes | Lufkin | n/a | Used to measure stream channel dimensions. |
| Surber sampler or Hess sampler | Wildco | 3-12-D56; 3-16-C52 | Either of these fixed-area benthic samplers will work well in shallow streams with gravel or pebble substrate. |
| 70% ethanol or isopropyl alcohol | Multiple options | n/a | Used as invertebrate preservative. |
| Widemouth invertebrate specimen jars (20-32 oz.) | U.S. Plastic Corp. | 67712 | Any widemouth plastic jars will work but these particular jars are durable and inexpensive. |
참고문헌
- Peters, R. H. . The ecological implications of body size. , (1983).
- Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M., West, G. B. Toward a metabolic theory of ecology. Ecology. 85 (7), 1771-1789 (2004).
- Marquet, P. A., et al. Scaling and power-laws in ecological systems. Journal of Experimental Biology. 208 (9), 1749-1769 (2005).
- Bohlin, T., Dellefors, C., Faremo, U., Johlander, A. The energetic equivalence hypothesis and the relation between population-density and body-size in stream-living salmonids. The American Naturalist. 143 (3), 478-493 (1994).
- Dunham, J. B., Vinyard, G. L. Relationships between body mass, population density, and the self-thinning rule in stream-living salmonids. Canadian Journal of Fisheries and Aquatic Sciences. 54 (5), 1025-1030 (1997).
- Jennings, S., Blanchard, J. L. Fish abundance with no fishing: predictions based on macroecological theory. Journal of Animal Ecology. 73 (4), 632-642 (2004).
- Petchey, O. L., Belgrano, A. Body-size distributions and size-spectra: universal indicators of ecological status?. Biology Letters. 6 (4), 434-437 (2010).
- Woodward, G., et al. Body size in ecological networks. Trends in Ecology and Evolution. 20 (7), 402-409 (2005).
- Trebilco, R., Baum, J. K., Salomon, A. K., Dulvy, N. K. Ecosystem ecology: size-based constraints on the pyramids of life. Trends in Ecology and Evolution. 28 (7), 423-431 (2013).
- White, E. P., Ernest, S. K. M., Kerkhoff, A. J., Enquist, B. J. Relationships between body size and abundance in ecology. Trends in Ecology and Evolution. 22 (6), 323-330 (2007).
- Schmid, P. E., Tokeshi, M., Schmid-Araya, J. M. Relation between population density and body size in stream communities. Science. 289 (5484), 1557-1560 (2000).
- Morin, A., Nadon, D. Size distribution of epilithic lotic invertebrates and implications for community metabolism. Journal of the North American Benthological Society. 10 (3), 300-308 (1991).
- Mittelbach, G. G., Persson, L. The ontogeny of piscivory and its ecological consequences. Canadian Journal of Fisheries and Aquatic Sciences. 55 (6), 1454-1465 (1998).
- Woodward, G., Hildrew, A. G. Body-size determinants of niche overlap and intraguild predation within a complex food web. Journal of Animal Ecology. 71 (6), 1063-1074 (2002).
- Zippin, C. The removal method of population estimation. Journal of Wildlife Management. 22 (1), 82-90 (1958).
- Kerr, S. R., Dickie, L. M. . The biomass spectrum: a predator-prey theory of aquatic production. , (2001).
- McGarvey, D. J., Kirk, A. J. Seasonal comparison of community-level size-spectra in southern coalfield streams of West Virginia (USA). Hydrobiologia. 809 (1), 65-77 (2018).
- Reynolds, J. B., Kolz, A. L., Zale, A. V., Parrish, D. L., Sutton, T. M. Electrofishing. Fisheries techniques. 8, 305-361 (2012).
- Bowker, J., Trushenski, J. Fish drug questions answered by the FDA. Fisheries. 38 (12), 549-552 (2013).
- Topic Popovic, N., et al. Tricaine methane-sulfonate (MS-222) application in fish anaesthesia. Journal of Applied Ichthyology. 28 (4), 553-564 (2012).
- Trautman, M. B. . The fishes of Ohio. , (1981).
- Riley, S. C., Fausch, K. D. Underestimation of trout population size by maximum-likelihood removal estimates in small streams. North American Journal of Fisheries Management. 12 (4), 768-776 (1992).
- Merritt, R. W., Cummins, K. W., Resh, V. H., Batzer, D. P., Merritt, R. W., Cummins, K. W., Berg, M. B. Sampling aquatic insects: collection devices, statistical considerations, and rearing procedures. An introduction to the aquatic insects of North America. , 15-37 (2008).
- Hauer, F. R., Resh, V. H., Hauer, F. R., Lamberti, G. A. Macroinvertebrates. Methods in stream ecology. 1, 297-319 (2017).
- Thorp, J. H., Covich, A. P. . Ecology and classification of North American freshwater invertebrates. , (2010).
- Merritt, R. W., Cummins, K. W., Berg, M. B. . An introduction to the aquatic insects of North America. , (2008).
- Stewart, K. W., Stark, B. P. . Nymphs of North American stonefly genera (Plecoptera). , (2002).
- Wiggins, G. B. . Larvae of the North American caddisfly genera (Trichoptera). , (1998).
- Benke, A. C., Huryn, A. D., Smock, L. A., Wallace, J. B. Length-mass relationships for freshwater macroinvertebrates in North America with particular reference to the Southeastern United States. Journal of the North American Benthological Society. 18 (3), 308-343 (1999).
- Smock, L. A. Relationships between body size and biomass of aquatic insects. Freshwater Biology. 10 (4), 375-383 (1980).
- Waters, T. F. Secondary production in inland waters. Adv. Ecol. Res. 10, 91-164 (1977).
- Carle, F. L., Strub, M. R. New method for estimating population-size from removal data. Biometrics. 34 (4), 621-630 (1978).
- Ogle, D. H., Wheeler, P., Dinno, A. FSA: fisheries stock analysis. R package version 0.8.22.9000. , (2018).
- Lockwood, R. N., Schneider, J. C., Schneider, J. C. Stream fish population estimates by mark-and-recapture and depletion methods. Manual of fisheries survey methods II: with periodic updates. 7, (2000).
- Blanco, J. M., Echevarría, F., García, C. M. Dealing with size-spectra: some conceptual and mathematical problems. Scientia Marina. 58 (1-2), 17-29 (1994).
- White, E. P., Enquist, B. J., Green, J. L. On estimating the exponent of power-law frequency distributions. Ecology. 89 (4), 905-912 (2008).
- Vidondo, B., Prairie, Y. T., Blanco, J. M., Duarte, C. M. Some aspects of the analysis of size spectra in aquatic ecology. Limnology and Oceanography. 42 (1), 184-192 (1997).
- Sprules, W. G., Barth, L. E. Surfing the biomass size spectrum: some remarks on history, theory, and application. Canadian Journal of Fisheries and Aquatic Sciences. 73 (4), 477-495 (2016).
- Poff, N. L., et al. Size structure of the metazoan community in a Piedmont stream. Oecologia. 95 (2), 202-209 (1993).
- Ramsay, P. M., et al. A rapid method for estimating biomass size spectra of benthic metazoan communities. Canadian Journal of Fisheries and Aquatic Sciences. 54 (8), 1716-1724 (1997).
- Solimini, A. G., Benvenuti, A., D’Olimpio, R., Cicco, M. D., Carchini, G. Size structure of benthic invertebrate assemblages in a Mediterranean river. Journal of the North American Benthological Society. 20 (3), 421-431 (2001).
- Huryn, A. D., Benke, A. C., Hildrew, A., Raffaelli, D., Edmonds-Brown, R. Relationship between biomass turnover and body size for stream communities. Body size: the structure and function of aquatic ecosystems. 4, 55-76 (2007).
- Gaedke, U. The size distribution of plankton biomass in a large lake and its seasonal variability. Limnology and Oceanography. 37 (6), 1202-1220 (1992).
- Stead, T. K., Schmid-Araya, J. M., Schmid, P. E., Hildrew, A. G. The distribution of body size in a stream community: one system, many patterns. Journal of Animal Ecology. 74 (3), 475-487 (2005).
- Brose, U., et al. Consumer-resource body-size relationships in natural food webs. Ecology. 87 (10), 2411-2417 (2006).
- Mehner, T., et al. Empirical correspondence between trophic transfer efficiency in freshwater food webs and the slope of their size spectra. Ecology. 99 (6), 1463-1472 (2018).
- Daan, N., Gislason, H. G., Pope, J. C., Rice, J. Changes in the North Sea fish community: evidence of indirect effects of fishing?. ICES Journal of Marine Science. 62 (2), 177-188 (2005).
- Murry, B. A., Farrell, J. M. Resistance of the size structure of the fish community to ecological perturbations in a large river ecosystem. Freshwater Biology. 59 (1), 155-167 (2014).
- Broadway, K. J., Pyron, M., Gammon, J. R., Murry, B. A. Shift in a large river fish assemblage: body-size and trophic structure dynamics. PLoS ONE. 10 (4), e0124954 (2015).
- Vila-Martínez, N., Caiola, N., Ibáñez, C., Benejam, L., Brucet, S. Normalized abundance spectra of fish community reflect hydro-peaking on a Mediterranean large river. Ecological Indicators. 97, 280-289 (2019).
- Brucet, S., et al. Size-based interactions across trophic levels in food webs of shallow Mediterranean lakes. Freshwater Biology. 62 (11), 1819-1830 (2017).
- Ersoy, Z., et al. Size-based interactions and trophic transfer efficiency are modified by fish predation and cyanobacteria blooms in Lake Mývatn, Iceland. Freshwater Biology. 62 (11), 1942-1952 (2017).
- Arranz, I., Hsieh, C. H., Mehner, T., Brucet, S. Systematic deviations from linear size spectra of lake fish communities are correlated with predator–prey interactions and lake-use intensity. Oikos. 128 (1), 33-44 (2019).
- Jennings, S., et al. Long-term trends in the trophic structure of the North Sea fish community: evidence from stable-isotope analysis, size-spectra and community metrics. Marine Biology. 141 (6), 1085-1097 (2002).
- Guiet, J., Poggiale, J. C., Maury, O. Modelling the community size-spectrum: recent developments and new directions. Ecological Modelling. 337, 4-14 (2016).
- Robinson, J. P. W., et al. Fishing degrades size structure of coral reef fish communities. Global Change Biology. 23 (3), 1009-1022 (2017).
- Reuman, D. C., Mulder, C., Raffaelli, D., Cohen, J. E. Three allometric relations of population density to body mass: theoretical integration and empirical tests in 149 food webs. Ecology Letters. 11 (11), 1216-1228 (2008).
- Huryn, A. D., Wallace, J. B., Anderson, N. H., Merritt, R. W., Cummins, K. W., Berg, M. B. Habitat, life history, secondary production, and behavioral adaptations of aquatic insects. An introduction to the aquatic insects of. 5, 55-103 (2008).
- Werner, E. E., Gilliam, J. F. The ontogenetic niche and species interactions in size-structured populations. Annual Review of Ecology and Systematics. 15 (1), 393-425 (1984).
- Edwards, A. M., Robinson, J. P. W., Plank, M. J., Baum, J. K., Blanchard, J. L. Testing and recommending methods for fitting size spectra to data. Methods in Ecology and Evolution. 8 (1), 57-67 (2017).
- Roell, M., Orth, D. Production of three crayfish populations in the New River of West Virginia, USA. Hydrobiologia. 228 (3), 185-194 (1992).
- Hawkins, C. P., Murphy, M. L., Anderson, N. H., Wilzbach, M. A. Density of fish and salamanders in relation to riparian canopy and physical habitat in streams of the northwestern United States. Canadian Journal of Fisheries and Aquatic Sciences. 40 (8), 1173-1185 (1983).
- Rabeni, C. F., Collier, K. J., Parkyn, S. M., Hicks, B. J. Evaluating techniques for sampling stream crayfish (Paranephrops planifrons). New Zealand Journal of Marine and Freshwater Research. 31 (5), 693-700 (1997).
- DiStefano, R. J., Gale, C. M., Wagner, B. A., Zweifel, R. D. A sampling method to assess lotic crayfish communities. Journal of Crustacean Biology. 23 (3), 678-690 (2003).
- Price, J. E., Welch, S. M. Semi-quantitative methods for crayfish sampling: sex, size, and habitat bias. Journal of Crustacean Biology. 29 (2), 208-216 (2009).
- Sheldon, R. W., Sutcliffe, W. H., Paranjape, A. M. Structure of pelagic food chain and relationship between plankton and fish production. Journal of the Fisheries Research Board of Canada. 34 (12), 2344-2353 (1977).
- Andersen, K., et al. Asymptotic size determines species abundance in the marine size spectrum. The American Naturalist. 168 (1), 54-61 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유