需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
对河流生态系统中巨脊椎动物和鱼类的大小谱进行建模
摘要
这是一个协议,用于对来自可涉水溪流和河流的鱼类和无脊椎动物数据的大小谱(个体质量与种群密度之间的缩放关系)进行建模。方法包括:采集定量鱼类和无脊椎动物样品的田间技术;实验室方法标准化现场数据;和统计数据分析。
摘要
大小谱是平均身体质量(M)与生态社区或食物网内个体密度(D)之间的反向、均等缩放关系。重要的是,大小谱假定个体大小,而不是物种的行为或生命历史特征,是生态系统内丰度的主要决定因素。因此,与侧重于物种级数据(例如,平均物种的体型与种群密度)的传统等值关系不同,大小光谱分析是"非正数"-单个标本仅按其大小进行识别,而不考虑分类标识。尺寸光谱模型是传统复杂食品网的有效表示形式,可用于描述性和预测性上下文(例如,预测大型消费者对基础资源变化的反应)。来自不同水生生态系统的实证研究也报告,大小光谱斜率的中度到高水平相似程度,表明共同过程可能调节在非常不同的环境中小型和大型生物体的丰度。这是一种在可涉水流中模拟社区级大小频谱的协议。该协议由三个主要步骤组成。首先,收集定量底栖鱼类和无脊椎动物样本,用于估计局部密度。其次,通过将所有个体转换为非塔克单位(即按大小识别的个人,而不考虑分类身份),并在日志2大小箱内对个体进行求和,使鱼类和无脊椎动物数据标准化。第三,使用线性回归来建模非税M和D估计值之间的关系。 此处提供了详细说明,以完成每个步骤,包括自定义软件,以方便D估计和大小光谱建模。
引言
体型缩放关系,如身体质量和代谢率之间的正关联,在个体生物体水平上是众所周知的,目前正在组织1,2,3的较高层次进行研究.这些等分关系通常是形式Y = aMb的功率定律函数,其中Y是感兴趣的变量(例如,新陈代谢、丰度或家庭范围大小),M 是单个或平均值的体质量单个,b 是缩放系数,a 是常量。 为了便于统计,Y 和M数据通常在分析之前进行对数转换,然后用形式日志 (Y) 的线性方程 + 日志 (a) = b日志 (M) 进行建模,其中b和日志 ( a) 分别成为线性模型斜率和截距。
大小谱是一种等值关系,用于预测密度(D,单位面积的个体数量)或生物量(B,单位面积的个体总质量)作为M的函数(参见第 4节,用于增加关于使用"标准化"D 或B估计的信息。与M和D之间或M和B之间的其他缩放关系一样,大小谱在基础生态学和应用生态学中起着核心作用。在种群一级,生物学家经常将负D 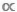 M关系解释为密度依赖生存的证据,或解释为生态系统承载能力的模型(即"自我稀释规则")4, 5.在社区一级,B
M关系解释为密度依赖生存的证据,或解释为生态系统承载能力的模型(即"自我稀释规则")4, 5.在社区一级,B 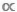 M关系可用于研究人为扰动的系统级影响,如大小选择性捕鱼6,7。D和B与M的均值缩放也是最近将人口、社区和生态系统生态统一到2、8、9的努力的核心。
M关系可用于研究人为扰动的系统级影响,如大小选择性捕鱼6,7。D和B与M的均值缩放也是最近将人口、社区和生态系统生态统一到2、8、9的努力的核心。
大小谱的一个特别重要的特点是它完全是无税的9,10。在比较D 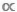 M或B
M或B 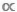 M数据的散点图时,很容易遗漏这一点,但分类模型和非税模型之间的区别至关重要。在分类模型中,单个M值用于表示给定物种或 taxa11中每个人的平均身体质量。在 ataxic 模型中,数据集中的所有个体都分区在一系列正文大小间隔或M bin 之间,而不管其分类标识12 。后者,无税方法在水生生态系统中是有利的,因为许多分类动物表现出不确定的生长,在喂养行为中经历一种或多次遗传变化;在这些情况下,单个物种级M平均值将掩盖一个事实,即一个物种可以在其生命史9、13、14中扮演不同的功能角色。
M数据的散点图时,很容易遗漏这一点,但分类模型和非税模型之间的区别至关重要。在分类模型中,单个M值用于表示给定物种或 taxa11中每个人的平均身体质量。在 ataxic 模型中,数据集中的所有个体都分区在一系列正文大小间隔或M bin 之间,而不管其分类标识12 。后者,无税方法在水生生态系统中是有利的,因为许多分类动物表现出不确定的生长,在喂养行为中经历一种或多次遗传变化;在这些情况下,单个物种级M平均值将掩盖一个事实,即一个物种可以在其生命史9、13、14中扮演不同的功能角色。
在这里,我们提出了一个完整的协议,以量化在可涉水溪流和河流的大小频谱。该协议从现场采样方法开始,以收集必要的鱼类和底栖巨脊椎动物数据。鱼将通过"三通耗竭"取样过程收集。然后,将从使用 Zippin 方法15的损耗数据中估计丰度。在消耗取样中,封闭研究范围内的单个鱼类(即,个人不能进入或离开封闭接触)通过连续三个样本从接触点中取出。因此,剩余的鱼类数量将逐渐枯竭。从这个消耗趋势,可以估计研究范围内的总丰度,然后根据研究范围的已知表面积转换为D(以每米2的鱼)。底栖巨脊椎动物将采用标准固定区域取样器收集,然后在实验室中识别和测量。
接下来,组合的鱼和宏无脊椎动物数据将在大小箱之间划分。传统上,倍频程或对数2刻度(即双倍间隔)用于设置大小 bin 边界16。建立大小箱列表后,将单个底栖宏脊椎动物划分到各自的大小箱中非常简单,因为无脊椎动物直接枚举为单位区域的个体数。然而,估计大小箱内的鱼类丰度更抽象,因为这些估计是从消耗数据中推断的。因此,提供了详细的说明,以便从损耗样本数据中估计大小箱内的鱼类丰度,而不论分类特征如何。
最后,线性回归将用于对大小频谱进行建模。该协议与克尔和Dickie16的原始一般方法完全兼容,与麦加维和柯克在西弗吉尼亚州溪流中鱼类和无脊椎动物大小光谱研究中所使用的方法相同。通过使用这个协议,研究人员可以确保他们的结果能够与基于克尔和Dickie16的其他研究直接比较,从而加速对淡水体尺寸缩放关系的广泛而有力的理解生态系统和推动他们的机制。
研究方案
这里描述的所有方法都已获得弗吉尼亚联邦大学机构动物护理和使用委员会(IACUC)的批准。
1. 鱼类样品的收集和加工
- 在研究范围内隔离鱼类,以创建封闭的鱼群
- 确定研究到达的上游和下游(方向相对于面向"上游"和水流的测量器)末端,然后用可拆卸的标记胶带标记末端。
注:研究范围的总长度是任意的,但应足够长,以包括整个溪流中存在的不同生境类型(例如,带树道、运行、池、下切的河岸)的代表性选择。在大多数情况下,100-200 米的学习范围就足够了。 - 测量5±10横切的湿流通道的宽度,沿研究范围的长度均匀分布。估计研究的总表面积,以平均润湿通道宽度乘以覆盖的总长度。
- 在研究到达的上游和下游端的流道上固定块网(即,在顶线上浮子和无结的塞内,使用中至粗网网(6.3*9.5 mm 或 1⁄4*3/8 英寸网),以尽量减少碎屑堆积和堵塞。不要使用大(>12.7 mm)网网,因为小鱼会通过。
注:取样前,准备一个装配套件,其中包括:(i) 8 根长(±15 米长)的聚丙烯绳(直径为 9.5 毫米或 3/8 英寸);(三) 8 根长(±15 米长)的聚丙烯绳(直径为 9.5 毫米或 3/8 英寸);和 (ii) 8凸轮动作系带。请勿使用棘轮作用带,因为当释放其负载时,这些带可能会卡住并造成严重伤害。- 在研究到达的上游端,找到一棵树、根、大岩石或其他固体物体,这些物体可用于在溪流的每一侧锚定一个网。流两侧是否有合适的锚点可能会影响上游边界的位置。
- 选择一块聚丙烯绳,并使用弓形结在每一端创建一个循环。只使用弓线结,因为当暴露于潮湿和高张力时,其他结可能会永久密封。有关绑结结的说明,请参阅图 1。
- 将绳索缠绕在树/根/岩石周围,并在一端通过另一端的循环将循环馈送,以创建一个锚点(图 2)。通过添加或删除环绕树/根/岩石的包裹来缩短或延长绳索锚点。
- 重复步骤 1.1.3.1_1.1.3.3,在流的另一侧建立第二个锚点。
- 使用弓形结在块网的四个角的每个角的线条中创建一个循环。仅使用弓形结 (图 1)。
- 使用凸轮动作系紧带将块网顶线的两侧(带浮子的线)连接到锚点。将系紧带两端的挂钩插入块网和锚点角处的环中(图 2)。通过凸轮扣拉动系带的自由系带,以拧紧每个接触点。
注:要释放锚上的张力(用于调整块网设置或在采样完成后拆下块网),请按下每个系紧带上的凸轮按钮。 - 用帐篷桩固定块网的底线(带权重的线)。
- 使用大岩石将块网固定下来,在溪流底部建立密封。将岩石放在网的一侧,朝上游。确保网的顶部保持在水位以上(图2)。根据需要调整锚点的高度。
- 通过在研究到达的下游端重复步骤 1.1.3.1=1.1.3.8 来设置第二个块网。
- 确定研究到达的上游和下游(方向相对于面向"上游"和水流的测量器)末端,然后用可拆卸的标记胶带标记末端。
- 在封闭的研究范围内执行 3 条鱼采样消耗通道中的第一个。此协议假定有一个背包电鸟可用,并且所有测量人员都经过适当的培训,以便使用它。其他方法可能使用,但在收集有代表性的鱼样本方面可能不太有效。
注:在小溪中,4-5人是理想的船员规模:一个操作电捕鱼,两个净惊呆了的鱼,一个或两个携带桶和穿梭捕获的鱼。此外,背包电捕鱼可造成重大伤害,无论是流鱼和人类18。因此,必须谨慎行事,并接受适当的培训。- 从封闭研究到达的下游端开始,打开背包电捕鱼器,向上游方向移动。进展缓慢,在整个研究过程中一直移动,以确保所有进流栖息地都得到采样。到达上游网络时,第一个损耗通道完成。
- 让支持船员跟随领导(操作电渔器),收集震惊的鱼与浸网,因为他们被发现,并转移到临时桶,然后到加气的保持浴缸。使用小型电池供电的"诱饵桶"泵,带曝气石,以确保捕获的鱼保持健康。
- 特别注意非常小的,年轻的年幼鱼,因为它们很难发现和捕获。当捕获最小的鱼效率很低时,结果可能会有偏差。在这种情况下,可能需要从 fish 数据中删除最小的日志2大小类,然后估计日志2大小条箱内的密度(请参阅步骤 3.2.2)。
注:成功网捕眩晕的鱼会随着许多生物和环境条件而变化。例如,能见度低的浑浊水将限制有效定位和捕获鱼类的能力;如果浊度过高,应重新安排采样,或选择备用采样点。
- 特别注意非常小的,年轻的年幼鱼,因为它们很难发现和捕获。当捕获最小的鱼效率很低时,结果可能会有偏差。在这种情况下,可能需要从 fish 数据中删除最小的日志2大小类,然后估计日志2大小条箱内的密度(请参阅步骤 3.2.2)。
- 处理在第一次消耗通道中收集的鱼类
- 确定是否需要麻醉。活鱼通常难以处理,可能需要镇定,以尽量减少对鱼标本的压力和伤害。如果使用麻醉,有两种选择(截至2019年4月)广泛可用:三联体-S(三甲甲甲酸酯,MS-222)和二氧化碳(小苏打)。
注:Tricaine-S需要21天的持有期,才能安全食用19,20,但它目前(截至2019年4月)唯一的鱼镇静剂批准美国食品和药物管理局。 - 使用镇静剂时,请仔细遵循麻醉剂产品提供的所有说明。在所有情况下,在加气水浴中混合麻醉化合物。在浴中收集鱼,直到观察到镇定。一旦镇静,尽快处理鱼,因为长时间接触镇静剂可能会导致死亡。
- 使用小型浸渍网从储罐(带或不带镇液)中单独或小批量检索取样的鱼,以便进行识别。将标本放入白色塑料或釉质托盘中,并使用钳子和放大镜进行检查。使用本地或区域识别密钥(例如,"俄亥俄州的鱼类")21 来帮助识别。
- 测量每个试样的总长度(从鼻尖到鱼翅末端),然后对场平衡进行称重。如果使用电子天平,请选择精度为 0.1 或 0.01 g 的天平。将透明塑料盒放在手边,以便在必要时用作风雨挡板(必须足够大,以覆盖天平和被称重的样品)。
- 在防水数据表上记录所有信息(物种标识、总长度和重量)。补充文件1提供了鱼类数据表的可打印示例。
- 处理后,将鱼返回到单独的加气保持/回收箱。处理完所有鱼类后,将其释放到下游网的下游。
注意:如果您不小心将它们释放到封闭的研究范围,您将破坏您的样本!如果使用麻醉,等待释放,直到所有鱼类恢复并恢复平衡。
- 确定是否需要麻醉。活鱼通常难以处理,可能需要镇定,以尽量减少对鱼标本的压力和伤害。如果使用麻醉,有两种选择(截至2019年4月)广泛可用:三联体-S(三甲甲甲酸酯,MS-222)和二氧化碳(小苏打)。
- 执行第二次和第三次损耗刀路
注:如果在前三次通过中未引起强耗竭趋势(即,如果第三次通过时取样的鱼类数量没有明显减少),则可能需要额外通过以准确估计鱼类丰度22。如果时间允许,通常最好主动执行四到五次连续耗尽刀路。- 检查上游和下游块网仍然安全。如果两个块网中收集了大量碎屑,请用手拾取将其清除。
- 通过重复步骤 1.2_1.3 收集剩余的损耗通过样本。确保所有三个通道的采样工作保持一致。使用相同的移动速度(建议对流程进行计时)和相同的船员重新测量采样范围。
- 完成后,拆解块网并拆下所有锚点材料。
2. 海底巨脊椎动物样品的收集和处理
- 选择在鱼类取样范围范围内的底栖巨脊椎动物取样点,这些地点代表在研究范围中观察到的主要物理生境类型(例如,鱼群或流群)。
- 使用固定区域采样器,收集第一个底栖巨脊椎动物样本。在具有广泛砾石到卵石尺寸材料的浅溪中,Surber 采样器和 Hess 采样器是最常用的设备,但可以使用任何固定区域采样器。在取样这些设备不起作用的其他类型的生境时,请咨询 Merritt等人。23和豪尔和雷什24。
- 将取样装置牢固地放在流底,将样品收集网朝向下游;根据需要移动大型鹅卵石,以与基板建立牢固的密封。
- 使用电线或塑料刷在取样区域内大力擦洗基材 2 分钟,使脱落的底栖巨脊椎动物漂移到样品网中。
- 将样品内容物从网转移到塑料罐中,并盖上70%的等丙醇,用于保存。标记罐子并将其存放在安全位置,以便转移到实验室。
- 收集并保存额外的底栖巨脊椎动物样本,重复步骤 2.2。
注: 应收集的宏类脊椎动物样本数量是可变的,有些任意性。理想情况下,应收集 5-10 个复制样本并单独保存。至少应收集 3 个复制样本。 - 将所有采集的样品返回实验室进行处理。
注:二丙醇是一种易燃液体,如果保存的样品将通过地面或航空承运人运输,则首先必须完成并满足所有相关危险品/危险品的培训、包装和运输要求。 - 在实验室中,对保存的底栖巨脊椎动物样本进行分类和鉴定。
- 将样品从细沉积物中分离出来,将样品中加入细网筛(例如 125 或 250 μm)并进行灌注。
- 将冲洗后的内容转移到白色塑料或釉质托盘中,用少量水盖住,然后用细点钳子手动从剩余残留物中挑选宏类动物。将提取的巨脊椎动物放入70%等丙醇的小容器中。
注:如果大量粗植物或矿物残留物与样品中含量混合,因此难以在托盘中看到巨脊椎动物,则可能需要首先对材料进行细分和处理,以处理剩余的样品内容。几个较小的数量。 - 使用带有目视仪的观察千分尺的解剖立体显微镜,将标本识别到最低实用的分类水平。在大多数情况下,这将是家族或属级。
注:处理和识别单个无脊椎动物样本的完整内容通常需要 2–5 小时或更长时间。预算足够的时间,并确保一个合适的分类键库25,26,27,28是可以帮助识别。 - 使用显微镜目镜中的眼缩微计测量每个试样的完整体长。如果无法进行身体长度测量(例如腹部受损或缺失),则头部胶囊宽度的测量可能就足够了。
- 使用人体长度或头部胶囊宽度测量和分类特定体长度与M或头部宽度与来自已发布来源的M回归方程 29 估计每个试样的各个干质量(M) 30.例如,Benke等人中报告的经验体长度 (mm) 与M (mg) 方程。29为阿尔德弗利·西亚里斯 sp。(梅加洛普特拉,西亚利达)是M = 0.0031 = 总长度2.801。因此,总长度为 15 mm 的Sialis sp.试样的估计M为 6.104 mg。
注: 如果公布的长度与M方程对于特定分类不可用,则在较高的分类分辨率级别上替换适当的方程(例如,当属级方程为不可用)或来自具有类似体形的密切相关的分类。
3. 对原点2大小箱内的鱼类和底栖巨脊椎动物密度的估计
http://bit.ly/SizeSpectraDensities,http://bit.ly/SizeSpectraDensities提供了一个动画,演示如何格式化鱼类和无脊椎动物数据,以便用于大小光谱分析。
- 建立一系列对数2大小的垃圾箱,将涵盖所有无脊椎动物和鱼类标本,从最小的底栖巨脊椎动物到最大的鱼类。确保所有尺寸估计值均以毫克干质量为单位。
注意:为了一致性,我们建议麦加维和柯克17使用的尺寸箱。这些尺寸的箱范围从0.0001到214,748.3648毫克。补充文件2提供了一个电子表格,其中31个日志2大小箱的下限和上限。 - 估计每个相应大小箱内的鱼的丰度。
- 首先将所有单独的鱼重量从g湿质量(记录在田间数据表)转换为毫克干质量。水31的湿-干质量转换系数(1克湿质量= 0.2克干质量)在从g到mg转换后可以使用。
- 在第一、第二和第三个消耗样本中,将捕获在每个大小箱内捕获的单个鱼类总数(无论物种身份如何)相加。补充文件 2中显示了一个示例。
注:在蒸汽鱼取样中,对非常小的鱼进行偏少取样是常见的,当个体在日志2大小箱内求和时,将很明显;最小鱼的加量将明显低于大鱼箱(例如,相邻大小箱中的 5 对 100 个个体)。在尺寸光谱分析之前,移除明显偏置的日志2大小箱(参见步骤 4)。 - 使用 Zippin 最大可能性方程15,32来估计最小鱼箱内的鱼总丰度 (n)。
- 首先计算中间X统计量

其中i表示ith采样通道(i = 1、2、3 等),k 表示通数总数(k = 3,除非已测量其他刀路),Ci表示总刀路数在I第一次传递期间捕获的鱼的数量。 - 通过迭代替换公式 2 中的递减n值,计算n的最大可能性估计值,直到

其中T是k刀路期间捕获的个体总数,所有剩余变量均如上文公式 1 中定义的那样。 - 如果在第一个、第二个或第三个损耗样本中观察到零计数,则估计n为三个损耗样本中捕获的个体的总和。公式 1 和 2 的工作示例显示在补充文件 2中。
注:可以使用多个软件应用程序计算从损耗样本中估计的Zippin丰度估计值,例如R包"FSA"(渔业库存评估)33中的"去除"功能。但是,在电子表格中手动求解公式 1 和公式 2 更有启发性。详细的说明在洛克伍德和施耐德34和补充文件2中提供。
- 首先计算中间X统计量
- 对剩余的每个鱼尺寸箱重复步骤 3.2.3。
- 将包含鱼类的每个大小箱的n估计值转换为每 1 m2D估计值,方法是将n除以上述步骤 1.1.2 中调查范围的总表面积估计值。例如,如果 Zippin n估计为 70 条鱼,而调查范围的表面面积为 1,200 m2,则D = 0.058 鱼/米2。
- 通过将每个场样本的结果(即将复制样本的结果合并到单个单个样本列表中),估计日志2大小箱内的底栖巨脊椎动物丰度,然后对每个大小箱内的个人。
注:如果步骤 2.5.5 中使用的长质量方程以 mg 干质量单位生成单个重量估计值,则底栖巨脊椎动物无需额外单位转换。 - 估计每个大小箱内的底栖巨脊椎动物D
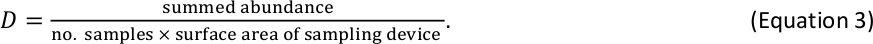
例如,如果使用标准 Hess 设备(表面积 = 0.086 m 2)收集了 6 个底栖巨脊椎动物样本,并且在给定大小箱内总共计算了 110 个个体,则该大小箱的D估计值为 213 个个体/m2. - 将鱼类和底栖巨脊椎动物的D结果合并到每个日志2大小箱的D估计值表中。如果鱼类和巨脊椎动物发生在相同大小的鱼缸中(为最大的无脊椎动物和最小的鱼类可能发生的罕见事件),则求和各自的D估计值,以获得该大小鱼箱的总D估计值。
- 删除任何"空"日志2大小条柱(即D值为零的大小条柱),因为空条柱将偏置用于估计大小光谱参数 35、36 的线性回归模型。
4. 对底栖巨脊椎动物和鱼类大小光谱进行建模
- 使用以下值之一估计每个日志2大小箱的平均干质量(*):(i) 每个大小箱的最小值(下边界);(i) 每个大小箱的最小值(下边界);(二) 最大值(上边界);(三) 算术均值(最小和最大值);或 (iv) 几何平均值(最小和最大值)35。
注: 在下面的示例中, *被估算为每个日志2大小 bin 的算术平均值(请参阅补充文件 2)。 - "标准化"每个日志2大小箱的D估计值,方法是将其除以各自的宽度(即上边界和下边界之间的差值)16,35。这将防止非均匀的日志2大小间隔在线性回归模型中产生偏差,这些模型用于估计大小光谱参数 35、37、38 。
- 日志10转换所有*和*数据,将曲线D
 M关系转换为线性关系。然后使用普通最小二乘回归与日志10(*) 和日志10(*) 数据建模大小频谱为
M关系转换为线性关系。然后使用普通最小二乘回归与日志10(*) 和日志10(*) 数据建模大小频谱为 
其中日志10(a) 是截距, b是线性大小频谱模型的斜率.
结果
范例结果,包括原始现场数据,呈现在西弗吉尼亚州的Slaunch Fork,西弗吉尼亚州南部的一个小流。还提供了同一区域的另外两个溪流的其他大小光谱模型结果:西弗吉尼亚州的坎普克里克和卡宾溪。这些是麦加维和柯克17号中的三个研究地点,但这里提供的数据来自2015年5月收集的新样本。补充文件2中包括一个完全工作、手动的大小光谱建模过程示例。Slaunch Fork 数据。或者...
讨论
这种非税大小光谱协议可用于定量和建模流鱼和无脊椎动物群落内的大小结构。以往在河流生态系统中的大小光谱研究范围包括基本描述性研究39、40、纵向河流剖面41和不同生物地理区域42的比较。季节比较已经进行了43,44和最近,大小光谱参数的季节性变化已与水温和水文17。
披露声明
作者没有什么可透露的。
致谢
这项工作的资金由美国国家科学基金会(DEB-1553111赠款)和埃普利科学研究基金会提供。本手稿是VCU赖斯河中心贡献#89。
材料
| Name | Company | Catalog Number | Comments |
| Chest waders | Multiple options | n/a | Personal protective equipment for use during electrofishing. Do NOT use 'breatheable' waders as electrical current will pass through them. |
| Rubber lineman's gloves | Multiple options | n/a | Personal protective equipment for use during electrofishing. |
| Dip nets with fiberglass poles | Multiple options | n/a | Used to capture stunned fishes during electrofishing. |
| Backpack electrofishing unit | Smith-Root; Halltech; Midwest Lake Management; Aqua Shock Solutions | www.smith-root.com; www.halltechaquatic.com; https://midwestlake.com; https://aquashocksolutions.com/ | Backpack electrofishers are currently manufactured and distributed by four independent companies in North America. Prices and warranty/technical support are the most important factors in choosing a vendor. |
| Block nets/seines (×2) | Duluth Nets | https://duluthfishnets.com/ | Necessary length will depend on stream width. 3/8 inch mesh is recommended. |
| Cam-action utility straps with 1 inch nylon webbing (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at auto supply, hardware, and department stores. |
| Large tent stakes (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at camping and department stores. |
| 5 gallon plastic buckets (×5) | Multiple options | n/a | Used to hold and transport fish during electrofishing. Available at hardware and paint supply stores. |
| 10-20 gallon totes (×3) | Multiple options | n/a | Used as livewells, sedation tanks, and recovery bins for captured fishes. Available at hardware and department stores. |
| Battery powered 'bait bucket' aeration pumps | Cabelas | IK-019008 | Used to aerate fish holding bins during field processing. |
| Fish anesthesia (Tricaine-S) | Syndel | www.syndel.com | Used to sedate fishes for field processing. Tricaine-S is regulated by the U.S. Food and Drug Administration. |
| Folding camp table and chairs | Cabelas | IK-518976; IK-552777 | Used to process fish samples. |
| Pop-up canopy | Multiple options | n/a | Used as necessary for sun and rain protection. |
| Fish measuring board | Wildco | 3-118-E40 | Used to measure fish lengths. |
| Battery powered field scale with weighing dish | Multiple options | n/a | Used to weigh fishes. Must weigh be accurate to 0.1 or 0.01 grams. |
| Clear plastic wind/rain baffle | Multiple options | n/a | Used to shield scale in rainy or windy conditions. Must be large enough to cover the scale and a weighing dish. |
| White plastic or enamel examination trays | Multiple options | n/a | Trays are essential for examining fishes in the field. |
| Stainless steel forceps | Multiple options | n/a | Forceps are helpful when examining small fishes and in transfering invertebrates to specimen jars. |
| Hand magnifiers | Multiple options | n/a | Magnification is often helpful when identifying fish specimens in the field. |
| Fish identification keys | n/a | n/a | Laminated keys that are custom prepared for specific locations are most effective. |
| Datasheets printed on waterproof paper | Rite in the Rain | n/a | Waterproof paper is essential when working with aquatic specimens. |
| Retractable fiberglass field tapes | Lufkin | n/a | Used to measure stream channel dimensions. |
| Surber sampler or Hess sampler | Wildco | 3-12-D56; 3-16-C52 | Either of these fixed-area benthic samplers will work well in shallow streams with gravel or pebble substrate. |
| 70% ethanol or isopropyl alcohol | Multiple options | n/a | Used as invertebrate preservative. |
| Widemouth invertebrate specimen jars (20-32 oz.) | U.S. Plastic Corp. | 67712 | Any widemouth plastic jars will work but these particular jars are durable and inexpensive. |
参考文献
- Peters, R. H. . The ecological implications of body size. , (1983).
- Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M., West, G. B. Toward a metabolic theory of ecology. Ecology. 85 (7), 1771-1789 (2004).
- Marquet, P. A., et al. Scaling and power-laws in ecological systems. Journal of Experimental Biology. 208 (9), 1749-1769 (2005).
- Bohlin, T., Dellefors, C., Faremo, U., Johlander, A. The energetic equivalence hypothesis and the relation between population-density and body-size in stream-living salmonids. The American Naturalist. 143 (3), 478-493 (1994).
- Dunham, J. B., Vinyard, G. L. Relationships between body mass, population density, and the self-thinning rule in stream-living salmonids. Canadian Journal of Fisheries and Aquatic Sciences. 54 (5), 1025-1030 (1997).
- Jennings, S., Blanchard, J. L. Fish abundance with no fishing: predictions based on macroecological theory. Journal of Animal Ecology. 73 (4), 632-642 (2004).
- Petchey, O. L., Belgrano, A. Body-size distributions and size-spectra: universal indicators of ecological status?. Biology Letters. 6 (4), 434-437 (2010).
- Woodward, G., et al. Body size in ecological networks. Trends in Ecology and Evolution. 20 (7), 402-409 (2005).
- Trebilco, R., Baum, J. K., Salomon, A. K., Dulvy, N. K. Ecosystem ecology: size-based constraints on the pyramids of life. Trends in Ecology and Evolution. 28 (7), 423-431 (2013).
- White, E. P., Ernest, S. K. M., Kerkhoff, A. J., Enquist, B. J. Relationships between body size and abundance in ecology. Trends in Ecology and Evolution. 22 (6), 323-330 (2007).
- Schmid, P. E., Tokeshi, M., Schmid-Araya, J. M. Relation between population density and body size in stream communities. Science. 289 (5484), 1557-1560 (2000).
- Morin, A., Nadon, D. Size distribution of epilithic lotic invertebrates and implications for community metabolism. Journal of the North American Benthological Society. 10 (3), 300-308 (1991).
- Mittelbach, G. G., Persson, L. The ontogeny of piscivory and its ecological consequences. Canadian Journal of Fisheries and Aquatic Sciences. 55 (6), 1454-1465 (1998).
- Woodward, G., Hildrew, A. G. Body-size determinants of niche overlap and intraguild predation within a complex food web. Journal of Animal Ecology. 71 (6), 1063-1074 (2002).
- Zippin, C. The removal method of population estimation. Journal of Wildlife Management. 22 (1), 82-90 (1958).
- Kerr, S. R., Dickie, L. M. . The biomass spectrum: a predator-prey theory of aquatic production. , (2001).
- McGarvey, D. J., Kirk, A. J. Seasonal comparison of community-level size-spectra in southern coalfield streams of West Virginia (USA). Hydrobiologia. 809 (1), 65-77 (2018).
- Reynolds, J. B., Kolz, A. L., Zale, A. V., Parrish, D. L., Sutton, T. M. Electrofishing. Fisheries techniques. 8, 305-361 (2012).
- Bowker, J., Trushenski, J. Fish drug questions answered by the FDA. Fisheries. 38 (12), 549-552 (2013).
- Topic Popovic, N., et al. Tricaine methane-sulfonate (MS-222) application in fish anaesthesia. Journal of Applied Ichthyology. 28 (4), 553-564 (2012).
- Trautman, M. B. . The fishes of Ohio. , (1981).
- Riley, S. C., Fausch, K. D. Underestimation of trout population size by maximum-likelihood removal estimates in small streams. North American Journal of Fisheries Management. 12 (4), 768-776 (1992).
- Merritt, R. W., Cummins, K. W., Resh, V. H., Batzer, D. P., Merritt, R. W., Cummins, K. W., Berg, M. B. Sampling aquatic insects: collection devices, statistical considerations, and rearing procedures. An introduction to the aquatic insects of North America. , 15-37 (2008).
- Hauer, F. R., Resh, V. H., Hauer, F. R., Lamberti, G. A. Macroinvertebrates. Methods in stream ecology. 1, 297-319 (2017).
- Thorp, J. H., Covich, A. P. . Ecology and classification of North American freshwater invertebrates. , (2010).
- Merritt, R. W., Cummins, K. W., Berg, M. B. . An introduction to the aquatic insects of North America. , (2008).
- Stewart, K. W., Stark, B. P. . Nymphs of North American stonefly genera (Plecoptera). , (2002).
- Wiggins, G. B. . Larvae of the North American caddisfly genera (Trichoptera). , (1998).
- Benke, A. C., Huryn, A. D., Smock, L. A., Wallace, J. B. Length-mass relationships for freshwater macroinvertebrates in North America with particular reference to the Southeastern United States. Journal of the North American Benthological Society. 18 (3), 308-343 (1999).
- Smock, L. A. Relationships between body size and biomass of aquatic insects. Freshwater Biology. 10 (4), 375-383 (1980).
- Waters, T. F. Secondary production in inland waters. Adv. Ecol. Res. 10, 91-164 (1977).
- Carle, F. L., Strub, M. R. New method for estimating population-size from removal data. Biometrics. 34 (4), 621-630 (1978).
- Ogle, D. H., Wheeler, P., Dinno, A. FSA: fisheries stock analysis. R package version 0.8.22.9000. , (2018).
- Lockwood, R. N., Schneider, J. C., Schneider, J. C. Stream fish population estimates by mark-and-recapture and depletion methods. Manual of fisheries survey methods II: with periodic updates. 7, (2000).
- Blanco, J. M., Echevarría, F., García, C. M. Dealing with size-spectra: some conceptual and mathematical problems. Scientia Marina. 58 (1-2), 17-29 (1994).
- White, E. P., Enquist, B. J., Green, J. L. On estimating the exponent of power-law frequency distributions. Ecology. 89 (4), 905-912 (2008).
- Vidondo, B., Prairie, Y. T., Blanco, J. M., Duarte, C. M. Some aspects of the analysis of size spectra in aquatic ecology. Limnology and Oceanography. 42 (1), 184-192 (1997).
- Sprules, W. G., Barth, L. E. Surfing the biomass size spectrum: some remarks on history, theory, and application. Canadian Journal of Fisheries and Aquatic Sciences. 73 (4), 477-495 (2016).
- Poff, N. L., et al. Size structure of the metazoan community in a Piedmont stream. Oecologia. 95 (2), 202-209 (1993).
- Ramsay, P. M., et al. A rapid method for estimating biomass size spectra of benthic metazoan communities. Canadian Journal of Fisheries and Aquatic Sciences. 54 (8), 1716-1724 (1997).
- Solimini, A. G., Benvenuti, A., D’Olimpio, R., Cicco, M. D., Carchini, G. Size structure of benthic invertebrate assemblages in a Mediterranean river. Journal of the North American Benthological Society. 20 (3), 421-431 (2001).
- Huryn, A. D., Benke, A. C., Hildrew, A., Raffaelli, D., Edmonds-Brown, R. Relationship between biomass turnover and body size for stream communities. Body size: the structure and function of aquatic ecosystems. 4, 55-76 (2007).
- Gaedke, U. The size distribution of plankton biomass in a large lake and its seasonal variability. Limnology and Oceanography. 37 (6), 1202-1220 (1992).
- Stead, T. K., Schmid-Araya, J. M., Schmid, P. E., Hildrew, A. G. The distribution of body size in a stream community: one system, many patterns. Journal of Animal Ecology. 74 (3), 475-487 (2005).
- Brose, U., et al. Consumer-resource body-size relationships in natural food webs. Ecology. 87 (10), 2411-2417 (2006).
- Mehner, T., et al. Empirical correspondence between trophic transfer efficiency in freshwater food webs and the slope of their size spectra. Ecology. 99 (6), 1463-1472 (2018).
- Daan, N., Gislason, H. G., Pope, J. C., Rice, J. Changes in the North Sea fish community: evidence of indirect effects of fishing?. ICES Journal of Marine Science. 62 (2), 177-188 (2005).
- Murry, B. A., Farrell, J. M. Resistance of the size structure of the fish community to ecological perturbations in a large river ecosystem. Freshwater Biology. 59 (1), 155-167 (2014).
- Broadway, K. J., Pyron, M., Gammon, J. R., Murry, B. A. Shift in a large river fish assemblage: body-size and trophic structure dynamics. PLoS ONE. 10 (4), e0124954 (2015).
- Vila-Martínez, N., Caiola, N., Ibáñez, C., Benejam, L., Brucet, S. Normalized abundance spectra of fish community reflect hydro-peaking on a Mediterranean large river. Ecological Indicators. 97, 280-289 (2019).
- Brucet, S., et al. Size-based interactions across trophic levels in food webs of shallow Mediterranean lakes. Freshwater Biology. 62 (11), 1819-1830 (2017).
- Ersoy, Z., et al. Size-based interactions and trophic transfer efficiency are modified by fish predation and cyanobacteria blooms in Lake Mývatn, Iceland. Freshwater Biology. 62 (11), 1942-1952 (2017).
- Arranz, I., Hsieh, C. H., Mehner, T., Brucet, S. Systematic deviations from linear size spectra of lake fish communities are correlated with predator–prey interactions and lake-use intensity. Oikos. 128 (1), 33-44 (2019).
- Jennings, S., et al. Long-term trends in the trophic structure of the North Sea fish community: evidence from stable-isotope analysis, size-spectra and community metrics. Marine Biology. 141 (6), 1085-1097 (2002).
- Guiet, J., Poggiale, J. C., Maury, O. Modelling the community size-spectrum: recent developments and new directions. Ecological Modelling. 337, 4-14 (2016).
- Robinson, J. P. W., et al. Fishing degrades size structure of coral reef fish communities. Global Change Biology. 23 (3), 1009-1022 (2017).
- Reuman, D. C., Mulder, C., Raffaelli, D., Cohen, J. E. Three allometric relations of population density to body mass: theoretical integration and empirical tests in 149 food webs. Ecology Letters. 11 (11), 1216-1228 (2008).
- Huryn, A. D., Wallace, J. B., Anderson, N. H., Merritt, R. W., Cummins, K. W., Berg, M. B. Habitat, life history, secondary production, and behavioral adaptations of aquatic insects. An introduction to the aquatic insects of. 5, 55-103 (2008).
- Werner, E. E., Gilliam, J. F. The ontogenetic niche and species interactions in size-structured populations. Annual Review of Ecology and Systematics. 15 (1), 393-425 (1984).
- Edwards, A. M., Robinson, J. P. W., Plank, M. J., Baum, J. K., Blanchard, J. L. Testing and recommending methods for fitting size spectra to data. Methods in Ecology and Evolution. 8 (1), 57-67 (2017).
- Roell, M., Orth, D. Production of three crayfish populations in the New River of West Virginia, USA. Hydrobiologia. 228 (3), 185-194 (1992).
- Hawkins, C. P., Murphy, M. L., Anderson, N. H., Wilzbach, M. A. Density of fish and salamanders in relation to riparian canopy and physical habitat in streams of the northwestern United States. Canadian Journal of Fisheries and Aquatic Sciences. 40 (8), 1173-1185 (1983).
- Rabeni, C. F., Collier, K. J., Parkyn, S. M., Hicks, B. J. Evaluating techniques for sampling stream crayfish (Paranephrops planifrons). New Zealand Journal of Marine and Freshwater Research. 31 (5), 693-700 (1997).
- DiStefano, R. J., Gale, C. M., Wagner, B. A., Zweifel, R. D. A sampling method to assess lotic crayfish communities. Journal of Crustacean Biology. 23 (3), 678-690 (2003).
- Price, J. E., Welch, S. M. Semi-quantitative methods for crayfish sampling: sex, size, and habitat bias. Journal of Crustacean Biology. 29 (2), 208-216 (2009).
- Sheldon, R. W., Sutcliffe, W. H., Paranjape, A. M. Structure of pelagic food chain and relationship between plankton and fish production. Journal of the Fisheries Research Board of Canada. 34 (12), 2344-2353 (1977).
- Andersen, K., et al. Asymptotic size determines species abundance in the marine size spectrum. The American Naturalist. 168 (1), 54-61 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。