È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modellazione dello spettro delle dimensioni per macroinvertebrati e pesci negli ecosistemi di flusso
In questo articolo
Riepilogo
Questo è un protocollo per modellare lo spettro delle dimensioni (relazione di ridimensionamento tra massa individuale e densità di popolazione) per i pesci combinati e i dati invertebrati provenienti da corsi d'acqua e fiumi guadolabili. I metodi includono: tecniche sul campo per raccogliere campioni quantitativi di pesci e invertebrati; metodi di laboratorio per standardizzare i dati di campo; e l'analisi statistica dei dati.
Abstract
Lo spettro delle dimensioni è una relazione di scala inversa e allometrica tra la massa corporea media (M) e la densità (D) degli individui all'interno di una comunità ecologica o di una rete alimentare. È importante sottolineare che lo spettro delle dimensioni presuppone che la dimensione individuale, piuttosto che le caratteristiche comportamentali o di storia della vita delle specie, sia il principale determinante dell'abbondanza all'interno di un ecosistema. Così, a differenza delle tradizionali relazioni allometriche che si concentrano sui dati a livello di specie (ad esempio, la dimensione corporea delle specie medie rispetto alla densità della popolazione), le analisi degli spettri di dimensioni sono "ataxiche": i singoli esemplari sono identificati solo dalle loro dimensioni, senza considerare la loro identità tassonomica. I modelli di spettri di dimensione sono rappresentazioni efficienti di web alimentari tradizionali e complesse e possono essere utilizzati in contesti descrittivi e predittivi (ad esempio, prevedere le risposte dei grandi consumatori ai cambiamenti nelle risorse basali). Studi empirici provenienti da diversi ecosistemi acquatici hanno anche segnalato livelli da moderati ad alti di somiglianza nei pendii degli spettri di dimensioni, suggerendo che i processi comuni possono regolare l'abbondanza di organismi piccoli e grandi in contesti molto diversi. Questo è un protocollo per modellare lo spettro delle dimensioni a livello di comunità in flussi guadibili. Il protocollo è costituito da tre passaggi principali. In primo luogo, raccogliere campioni quantitativi di pesci benthici e invertebrati che possono essere utilizzati per stimare le densità locali. In secondo luogo, standardizzare i dati relativi ai pesci e agli invertebrati convertendo tutti gli individui in unità atassiche (cioè individui identificati per dimensione, indipendentemente dall'identità tassonomica) e sommando gli individui all'interno di contenitori di dimensioni log 2. In terzo luogo, utilizzare la regressione lineare per modellare la relazione tra le stime ataxic M e D. Istruzioni dettagliate sono fornite qui per completare ciascuno di questi passaggi, tra cui software personalizzato per facilitare la stima D e la modellazione degli spettri di dimensioni.
Introduzione
Le relazioni di scala delle dimensioni del corpo, come l'associazione positiva tra la massa corporea e il tasso metabolico, sono ben note a livello di singolo organismo e sono ora studiate a livelli più elevati di organizzazione1,2,3 . Queste relazioni allometriche sono più spesso funzioni di diritto-potere della forma Y - aMb, dove Y è la variabile di interesse (ad esempio, metabolismo, abbondanza o dimensione della gamma domestica), M è la massa corporea di un singolo o medio individual, b è un coefficiente di scala e a è una costante. Per comodità statistica, i dati Y e M sono spesso trasformati in registro prima dell'analisi, quindi modellati con equazioni lineari del log del modulo (Y) , log (a ) e registro b (M), dove b e log ( a) diventano rispettivamente la pendenza e l'intercettazione del modello lineare.
Lo spettro delle dimensioni è un tipo di relazione allometrica che prevede la densità (D, il numero di individui per unità di superficie) o biomassa (B, la massa sommata di individui per unità di area) in funzione di M (vedere la sezione 4 per ulteriori informazioni sull'uso di stime "normalizzate" di D o B.) Come altre relazioni di ridimensionamento tra M e D o tra M e B, lo spettro delle dimensioni svolge un ruolo centrale nell'ecologia di base e applicata. A livello di popolazione, i biologi spesso interpretano le relazioni D 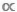 M negative come prova della sopravvivenza dipendente dalla densità o come modelli di capacità di trasporto dell'ecosistema (cioè la "regola di auto-sottilezione")4, 5. A livello di comunità, le relazioni B
M negative come prova della sopravvivenza dipendente dalla densità o come modelli di capacità di trasporto dell'ecosistema (cioè la "regola di auto-sottilezione")4, 5. A livello di comunità, le relazioni B 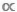 M possono essere utilizzate per studiare gli effetti a livello di sistema delle perturbazioni antropogeniche, come la pesca selettiva delle dimensioni6,7. La scala allometrica di D e B con M sono anche al centro dei recenti sforzi per unire l'ecologia della popolazione, della comunità e dell'ecosistema2,8,9.
M possono essere utilizzate per studiare gli effetti a livello di sistema delle perturbazioni antropogeniche, come la pesca selettiva delle dimensioni6,7. La scala allometrica di D e B con M sono anche al centro dei recenti sforzi per unire l'ecologia della popolazione, della comunità e dell'ecosistema2,8,9.
Una caratteristica particolarmente importante dello spettro di dimensioni è il fatto che è interamente ataxic9,10. Questo punto è facile da perdere quando si confrontano grafici scatter di dati D 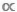 M o B
M o B 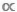 M, ma la distinzione tra modelli taxie e atassici è fondamentale. Nei modelli di taxi, un singolo valore M viene utilizzato per rappresentare la massa corporea media di ogni individuo di una data specie o taxa11. Nei modelli atassici, tutti gli individui all'interno di un set di dati sono partizionati tra una serie di intervalli di dimensioni del corpo o contenitori M, indipendentemente dalla loro identità tassonomica12. Quest'ultimo approccio atassico è vantaggioso negli ecosistemi acquatici in cui molti taxa mostrano una crescita indeterminata e sperimentano uno o più cambiamenti ontogenetici nel comportamento alimentare; in questi casi, una singola media M a livello di specie oscurerà il fatto che una specie può ricoprire diversi ruoli funzionali nel corso della sua storia di vita9,13,14.
M, ma la distinzione tra modelli taxie e atassici è fondamentale. Nei modelli di taxi, un singolo valore M viene utilizzato per rappresentare la massa corporea media di ogni individuo di una data specie o taxa11. Nei modelli atassici, tutti gli individui all'interno di un set di dati sono partizionati tra una serie di intervalli di dimensioni del corpo o contenitori M, indipendentemente dalla loro identità tassonomica12. Quest'ultimo approccio atassico è vantaggioso negli ecosistemi acquatici in cui molti taxa mostrano una crescita indeterminata e sperimentano uno o più cambiamenti ontogenetici nel comportamento alimentare; in questi casi, una singola media M a livello di specie oscurerà il fatto che una specie può ricoprire diversi ruoli funzionali nel corso della sua storia di vita9,13,14.
Qui, presentiamo un protocollo completo per quantificare lo spettro delle dimensioni all'interno di corsi d'acqua guachetabili e fiumi. Il protocollo inizia con i metodi di campionamento sul campo per raccogliere i pesci necessari e i dati macroinvertebrati bentici. I pesci saranno raccolti attraverso un processo di campionamento "esaurimento a tre passaggi". L'abbondanza sarà quindi stimata dai dati di esaurimento con il metodo15. Nel campionamento di esaurimento, i singoli pesci entro una portata di studio chiusa (cioè, gli individui non possono entrare né uscire dalla portata chiusa) vengono rimossi dalla portata attraverso tre campioni successivi. Pertanto, il numero di pesci rimanenti si esaurirà progressivamente. Da questa tendenza di esaurimento, l'abbondanza totale all'interno della portata dello studio può essere stimata poi convertito in D (nel pesce per m2), utilizzando la superficie nota della portata dello studio. I macroinvertebrati bentici saranno raccolti con campionatori di area fissa standard, quindi identificati e misurati in laboratorio.
Successivamente, i dati combinati di pesci e macroinvertebrati saranno partizionati tra i contenitori di dimensioni. Tradizionalmente, l'ottava o la scala del log2 (cioè gli intervalli di raddoppio) è stata utilizzata per impostare i limiti del contenitore di dimensioni16. Una volta stabilito un elenco di contenitori di dimensioni, il partizionamento dei singoli macroinvertebrati bentici tra i rispettivi contenitori di dimensioni è semplice perché gli invertebrati sono direttamente enumerati come numero di individui per area unitaria. Tuttavia, la stima dell'abbondanza di pesce all'interno dei bidoni di dimensioni è più astratta perché queste stime vengono dedotte dai dati di esaurimento. Vengono quindi fornite istruzioni dettagliate per stimare l'abbondanza di pesce all'interno dei contenitori di dimensioni, indipendentemente dall'identità tassonomica, dai dati del campione di esaurimento.
Infine, la regressione lineare verrà utilizzata per modellare lo spettro delle dimensioni. Questo protocollo è pienamente compatibile con il metodo originale e generale di Kerr e Dickie16 ed identico ai metodi utilizzati da McGarvey e Kirk, 201817 in uno studio degli spettri di dimensioni dei pesci e degli invertebrati nei corsi d'acqua della Virginia Occidentale. Utilizzando questo protocollo, i ricercatori possono assicurarsi che i loro risultati siano direttamente comparabili con altri studi che si basano su Kerr e Dickie16, accelerando così una comprensione ampia e solida delle relazioni di ridimensionamento delle dimensioni del corpo in acqua dolce ecosistemi e i meccanismi che li guidano.
Protocollo
Tutti i metodi qui descritti sono stati approvati dal Comitato istituzionale per la cura e l'uso degli animali (IACUC) della Virginia Commonwealth University.
1. Raccolta e trattamento di campioni di pesce
- Isolare i pesci all'interno dello studio raggiungono la creazione di un assemblaggio di pesci chiusi
- Identificare le estremità a monte e a valle (direzione rispetto a un geometra rivolto verso "a monte" e contro la corrente d'acqua) della portata dello studio, quindi contrassegnare le estremità con nastro di segnalazione rimovibile.
NOTA: La durata totale della portata dello studio è arbitraria, ma dovrebbe essere sufficientemente lunga da comprendere una selezione rappresentativa dei diversi tipi di habitat (ad esempio, riffle, piste, piscine, banche sottostagliate) presenti all'interno dell'intero flusso. Nella maggior parte dei casi, una portata di studio di 100-200 m sarà adeguata. - Misura la larghezza del canale del flusso bagnato a 5-10 transetti, distribuiti uniformemente lungo la lunghezza della copertura dello studio. Stimare la superficie totale dello studio raggiungere come la larghezza media del canale bagnato moltiplicato per la lunghezza totale della portata.
- Reti a blocchi sicure (ad esempio, sere senza nodi con galleggianti sulla linea superiore e pesi sulla linea di fondo) attraverso il canale del flusso alle estremità a monte e a valle della portata dello studio. Utilizzare reti a maglie medio-grossolane (6,3, 9,5 mm o reti da 1/4,8 pollici) per ridurre al minimo l'accumulo di detriti e intasamenti. Non utilizzare reti a maglie grandi (>12,7 mm) mentre piccoli pesci passeranno attraverso.
NOTA: Prima del campionamento, preparare un kit di rigging che include: (i) 8 pezzi di corda di polipropilene (9,5 mm o 3/8 di pollice di diametro); e (ii) 8 cinghie di fissaggio cam-action. Non utilizzare cinghie a cricchetto-azione in quanto questi possono scattare e causare gravi lesioni quando il loro carico viene rilasciato.- All'estremità a monte dello studio, individuare un albero, una radice, una roccia grande o un altro oggetto solido che può essere utilizzato per ancorare una rete su ogni lato del torrente. La disponibilità di punti di ancoraggio adatti su ciascun lato del flusso influirà probabilmente sulla posizione del contorno a monte.
- Selezionare un pezzo di corda di polipropilene e creare un anello ad ogni estremità utilizzando un nodo di bowline. Utilizzare solo un nodo di bowline, come altri nodi possono diventare permanentemente sigillati quando esposti all'umidità e alta tensione. Per istruzioni su come legare un nodo di bowline, vedere Figura 1.
- Avvolgere la corda intorno all'albero/radice/roccia e alimentare il loop ad un'estremità attraverso il ciclo all'altra estremità per creare un punto di ancoraggio (Figura 2). Accorciare o allungare l'ancora della corda aggiungendo o rimuovendo avvolgimenti intorno all'albero/radice/roccia.
- Ripetete i passaggi 1.1.3.1 - 1.1.3.3 per stabilire un secondo punto di ancoraggio sul lato opposto del flusso.
- Creare un anello nelle linee in corrispondenza di ciascuno dei quattro angoli della rete a blocchi utilizzando un nodo di bowline. Utilizzare solo un nodo di bowline (Figura 1).
- Collegare entrambi i lati della linea superiore della rete a blocchi (la linea con galleggianti) ai punti di ancoraggio utilizzando cinghie di fissaggio cam-action. Inserire i ganci alle estremità del cinturino a scheggio nei loop agli angoli della rete a blocchi e dei punti di ancoraggio (Figura 2). Tirare il legame libero della cinghia di legatura verso il basso attraverso la fibbia della camma per stringere ogni punto di contatto.
NOTA: Per rilasciare la tensione sulle ancore (per regolare la configurazione della rete a blocchi o per rimuovere la rete a blocchi al termine del campionamento), premere il pulsante della camma su ciascuna delle cinghie di legatura verso il basso. - Fissare la linea di fondo della rete a blocchi (la linea con pesi) appuntandoli alla banca del torrente con puntate tenda.
- Stabilire un sigillo con il fondo del torrente utilizzando grandi rocce per fissare la rete di blocco verso il basso. Posizionare le rocce sul lato della rete rivolto a monte. Assicurarsi che la parte superiore della rete rimane al di sopra del livello dell'acqua (Figura 2). Regolare l'altezza dei punti di ancoraggio in base alle esigenze.
- Impostare una seconda rete di blocco ripetendo i passaggi 1.1.3.1 - 1.1.3.8 all'estremità a valle della portata dello studio.
- Identificare le estremità a monte e a valle (direzione rispetto a un geometra rivolto verso "a monte" e contro la corrente d'acqua) della portata dello studio, quindi contrassegnare le estremità con nastro di segnalazione rimovibile.
- Eseguire il primo dei 3 passaggi di esaurimento del campionamento di pesce all'interno della portata dello studio chiusa. Questo protocollo presuppone che sia disponibile un elettrofisher zaino e che tutto il personale dell'equipaggio di rilevamento sia adeguatamente addestrato per utilizzarlo. Altri metodi possono potenzialmente essere utilizzati, ma potrebbero non essere altrettanto efficaci nella raccolta di campioni di pesce rappresentativi.
NOTA: Nei piccoli corsi d'acqua, le persone da 4 a 5 sono una dimensione ideale per l'equipaggio: una per far funzionare l'elettrofisher, due per far funzionare i pesci storditi netti e una o due per trasportare secchi e pesci catturati dalla navetta. Inoltre, la pesca elettronica zaino può causare lesioni significative, sia per lo streaming di pesci e gli esseri umani18. È quindi fondamentale prestare attenzione e ricevere una formazione adeguata.- Partendo dall'estremità a valle della copertura dello studio chiusa, accendere l'elettrofisher zaino e muoversi nella direzione a monte. Progressi lentamente, muovendosi da un lato all'altro durante tutto lo studio per garantire che tutti gli habitat in corso siano campionati. Il primo passaggio di esaurimento è completo quando viene raggiunta la rete a monte.
- Lascia che i membri dell'equipaggio di supporto seguano il leader (che gestisce l'elettrofisher), raccogliendo pesci storditi con reti da immersione mentre vengono avvistati e trasferendoli a secchi temporanei, quindi in vasche con vista. Utilizzare piccole pompe 'bait bucket' alimentate a batteria con pietre di aerazione per garantire che i pesci catturati rimangano sani.
- Prestare particolare attenzione ai pesci molto piccoli di poco l'anno in quanto sono difficili da individuare e catturare. Quando la cattura dei pesci più piccoli è altamente inefficiente, i risultati possono essere di parte. In questo caso, potrebbe essere necessario rimuovere le classi di dimensioni di log2 più piccole dai dati del pesce, prima di stimare le densità all'interno dei contenitori di dimensioni log2 (vedere il passaggio 3.2.2).
NOTA: Il successo nella rete di pesci storditi varierà con una serie di condizioni biologiche e ambientali. Ad esempio, l'acqua torbida in cui la visibilità è bassa vincola la capacità di individuare e catturare efficacemente i pesci; se la torbidità è troppo alta, il campionamento deve essere riprogrammato o deve essere selezionato un sito di campionamento alternativo.
- Prestare particolare attenzione ai pesci molto piccoli di poco l'anno in quanto sono difficili da individuare e catturare. Quando la cattura dei pesci più piccoli è altamente inefficiente, i risultati possono essere di parte. In questo caso, potrebbe essere necessario rimuovere le classi di dimensioni di log2 più piccole dai dati del pesce, prima di stimare le densità all'interno dei contenitori di dimensioni log2 (vedere il passaggio 3.2.2).
- Lavorazione dei pesci raccolti nel primo passaggio di esaurimento
- Determinare se sarà necessaria l'anestesia. I pesci vivi sono spesso difficili da maneggiare e la sedazione può essere necessaria per ridurre al minimo lo stress e le lesioni agli esemplari di pesce. Se viene utilizzata l'anestesia, due opzioni sono ampiamente (a partire da aprile 2019) disponibili: Tricaine-S (tricaine metanosulfonato, MS-222) e anidride carbonica (bicarbonato di sodio).
NOTA: Tricaine-S comporta un periodo di detenzione di 21 giorni prima che i pesci esposti possano essere consumati in modo sicuro19,20, ma è attualmente (a partire da aprile 2019) l'unico sedativo di pesce approvato dalla Food and Drug Administration degli Stati Uniti. - Quando si utilizzano sedativi, seguire attentamente tutte le istruzioni fornite con il prodotto anestetico. In tutti i casi, mescolare il composto anestetico in un bagno d'acqua aerato. Sommerso pesci raccolti nella vasca da bagno fino a quando non si osserva la sedazione. Una volta sedati, elaborare i pesci il più rapidamente possibile, poiché l'esposizione prolungata ai sedativi può causare la morte.
- Utilizzare piccole reti da immersione per recuperare i pesci campionati dal serbatoio (con o senza sedazione), singolarmente o in piccoli lotti, per l'identificazione. Mettere i campioni in vassoi di plastica o smalto bianchi e utilizzare pinze e lente di ingrandimento per l'esame. Utilizzare chiavi di identificazione locali o regionali (ad esempio, "I pesci dell'Ohio")21 per facilitare l'identificazione.
- Misurare la lunghezza totale (dalla punta del muso alla fine della pinna caudale) per ogni esemplare, quindi pesare su un equilibrio di campo. Se si utilizza un saldo elettronico, selezionarne uno con una precisione di 0,1 o 0,01 g. Tenere una scatola di plastica trasparente a portata di mano per utilizzare, se necessario, come un vento e pioggia deflettore (deve essere abbastanza grande per coprire l'equilibrio e campioni pesati).
- Registrare tutte le informazioni (identità della specie, lunghezza totale e peso) su schede tecniche impermeabili. Un esempio stampabile di un foglio dati di pesce è riportato nel file supplementare 1.
- Una volta elaborati, riportare i pesci in un contenitore di ritenuta/recupero aerated separato. Quando tutti i pesci sono stati elaborati, rilasciarli a valle della rete a blocchi a valle.
NOTA: Se li rilasciate accidentalmente nella vostra copertura di studio chiusa, rovinerete il vostro campione! Se è stata utilizzata l'anestesia, attendere di rilasciare fino a quando tutti i pesci hanno recuperato e riacquistato l'equilibrio.
- Determinare se sarà necessaria l'anestesia. I pesci vivi sono spesso difficili da maneggiare e la sedazione può essere necessaria per ridurre al minimo lo stress e le lesioni agli esemplari di pesce. Se viene utilizzata l'anestesia, due opzioni sono ampiamente (a partire da aprile 2019) disponibili: Tricaine-S (tricaine metanosulfonato, MS-222) e anidride carbonica (bicarbonato di sodio).
- Esecuzione del secondo e terzo passaggi di esaurimento
NOTA: Se una forte tendenza all'esaurimento non viene indotta nei primi tre passaggi (cioè, se il numero di pesci campionati non è notevolmente diminuito entro il terzo passaggio), potrebbero essere necessari passaggi aggiuntivi per stimare con precisione l'abbondanza di pesce22. Tempo permettendo, è spesso una buona idea condurre in modo proattivo quattro o cinque passaggi di esaurimento successivi.- Verificare che le reti a blocchi a monte e a valle siano ancora sicure. Se sono stati raccolti detriti significativi in entrambi i blocchi, rimuoverlo a mano.
- Raccogliere i restanti campioni di passate di esaurimento ripetendo i passaggi da 1.2 a 1.3. Assicurarsi che lo sforzo di campionamento rimanga coerente tra tutti e tre i passaggi. Utilizzare lo stesso ritmo di movimento (si consiglia di programmare il processo) e gli stessi membri dell'equipaggio per riesaminare la portata di campionamento.
- Al termine, smontare le reti a blocchi e rimuovere tutti i materiali di ancoraggio.
2. Raccolta e lavorazione di campioni di macroinvertebrati bentoci
- Selezionare siti di campionamento macroinvertebrati benthici entro i confini della portata di campionamento dei pesci che sono rappresentativi dei principali tipi di habitat fisici (ad esempio, riffleo o piste) osservati nella portata dello studio.
- Utilizzando un campionatore ad area fissa, raccogliere il primo campione di macroinvertebrati bentico. Nei corsi d'acqua poco profondi con ampio materiale di dimensioni ghiaia-ciottoli, il campionatore Surber e campionatore Hess sono i dispositivi più comunemente utilizzati, ma qualsiasi campionatore ad area fissa può essere utilizzato. Quando si campionano altri tipi di habitat in cui questi dispositivi non funzionano, consultare Merritt et al. 23 e Hauer e Resh24.
- Posizionare saldamente il dispositivo di campionamento rispetto alla parte inferiore del flusso con la raccolta di campioni orientata alla rete a valle; spostare grandi ciottoli, se necessario, per stabilire una foca solida con il substrato.
- Utilizzare un filo o un pennello di plastica per strofinare vigorosamente il substrato all'interno dell'area di campionamento per un periodo di 2 min, permettendo ai macroinvertebrati benthici slogati di scivolare nella rete campione.
- Trasferire il contenuto del campione dalla rete a un barattolo di plastica e coprire con 70% di alcool isopropile per la conservazione. Etichettare il barattolo e conservarlo in un luogo sicuro per il trasferimento al laboratorio.
- Raccogliere e conservare ulteriori campioni di macroinvertebrati benthici, ripetendo il passaggio 2.2.
NOTA: Il numero di campioni di macroinvertebrati che devono essere raccolti è variabile e in qualche modo arbitrario. Idealmente, i campioni replicati da 5 a 10 dovrebbero essere raccolti e conservati individualmente. Come minimo, devono essere raccolti 3 campioni di replica. - Restituire tutti i campioni raccolti al laboratorio per l'elaborazione.
NOTA: L'alcool isopropile è un liquido infiammabile e se i campioni conservati saranno spediti via terra o vettore aereo, sarà necessario prima completare e soddisfare tutti i relativi requisiti di formazione, imballaggio e spedizione di merci pericolose. - In laboratorio, ordinare e identificare campioni di macroinvertebrati bentici conservati.
- Separare le campioni dai sedimenti fini versando con cura il contenuto del campione in un setaccio a maglie fini (ad es., 125 o 250 m) e risciacquo.
- Trasferire il contenuto risciacquato in un vassoio di plastica o smalto bianco, coprire con un piccolo volume d'acqua e prelevare manualmente i macroinvertebrati dai residui rimanenti con pinze a punto fine. Posizionare i macroinvertebrati estratti in un piccolo contenitore di alcool isopropile del 70%.
NOTA: Se una grande quantità di residui di piante o minerali grossolani viene miscelata con il contenuto del campione, rendendo difficile vedere i macroinvertebrati nel vassoio, potrebbe essere necessario elaborare il contenuto del campione rimanente suddividendo prima il materiale e lavorando con diverse quantità più piccole. - Utilizzando un microscopio stereo sezionato con un micrometro oculare installato in uno degli oculari, identificare i campioni al più basso livello pratico tassonomica. Nella maggior parte dei casi, questo sarà il livello di famiglia o di genere.
NOTA: l'elaborazione e l'identificazione dell'intero contenuto di un singolo campione di invertebrati spesso richiedono 2 x 5 h o più. Budget tempo sufficiente ed essere sicuri che una libreria adeguata di chiavi tassonomiche25,26,27,28 è disponibile per assistere nell'identificazione. - Utilizzare il micrometro oculare nell'oculare al microscopio per misurare la lunghezza completa del corpo di ogni campione. Se la misurazione della lunghezza del corpo non è possibile (ad esempio, addome danneggiato o mancante), la misurazione della larghezza della capsula della testa può essere sufficiente.
- Stimare la massa secca individuale (M) per ogni campione utilizzando le misure della lunghezza del corpo o della larghezza della capsula della testa e la lunghezza del corpo specifica del taxon rispetto a M o la larghezza della testa rispetto alle equazioni di regressione M da fonti pubblicate29, 30. Ad esempio, l'equazione della lunghezza del corpo empirico (mm) e M (mg) riportata in Benke et al. 29 per l'alderfly Sialis sp. (Megaloptera, Sialidae) è M - 0.0031 - lunghezza totale2.801. Pertanto, stimato M per un provino Sialis sp. con una lunghezza totale di 15 mm è 6.104 mg.
NOTA: Se un'equazione di lunghezza e M pubblicata non è disponibile per un determinato taxon, sostituire un'equazione appropriata a un livello superiore di risoluzione tassonomica (ad esempio, sostituire l'equazione a livello familiare appropriato quando l'equazione di livello del genere è un taxon strettamente correlato con una forma del corpo simile.
3. Stima dei pesci e densità di macroinvertebrati bentici all'interno dei bidoni di dimensioni log2
Un'animazione che dimostra come formattare i dati di pesci e invertebrati per l'utilizzo nell'analisi degli spettri di dimensione è disponibile all'http://bit.ly/SizeSpectraDensities .
- Stabilire una serie di bidoni di dimensioni di log2 che comprenderanno tutti gli esemplari di invertebrati e pesci, che vanno dal più piccolo macroinvertebrato bentico al pesce più grande. Assicurarsi che tutte le stime delle dimensioni siano in unità di massa secca mg.
NOTA: per coerenza, si consiglia noto i contenitori di dimensioni utilizzati da McGarvey e Kirk17. Questi contenitori di dimensioni variano da 0.0001 a 214,748.3648 mg. Un foglio di calcolo con i limiti inferiore e superiore per ciascuno di questi contenitori di dimensioni 31 log2 è disponibile in Supplementary File 2. - Stimare l'abbondanza di pesce all'interno di ciascuno dei bidoni di dimensioni corrispondenti.
- In primo luogo convertire tutti i singoli pesi di pesce da g massa umida (registrata sulle schede tecniche di campo) in massa secca mg. Il fattore di conversione di massa wet-to-dry di Waters31 (1 g di massa umida - 0,2 g di massa secca) può essere utilizzato dopo la conversione da g a mg.
- Sommare il numero totale di singoli pesci catturati all'interno di ciascuno dei rispettivi contenitori di dimensioni (indipendentemente dall'identità della specie) durante i campioni del primo, secondo e terzo esaurimento. Un esempio è mostrato nel file supplementare 2.
NOTA: il sottocampionamento di pesci molto piccoli è comune nel campionamento di pesce a vapore e sarà evidente quando gli individui sono sommati all'interno di bidoni di dimensioni log 2; l'abbondanza sommata dei pesci più piccoli sarà vistosamente inferiore rispetto ai bidoni più grandi (ad esempio, 5 vs. 100 individui in bidoni di dimensioni adiacenti). Rimuovere i contenitori di dimensioni log2 chiaramente distorti prima dell'analisi degli spettri di dimensione (vedere il passaggio 4). - Utilizzare l'equazione di massima probabilità di15,32 per stimare l'abbondanza totale di pesci (n) all'interno del bidone di dimensioni del pesce più piccolo.
- Iniziare calcolando una statistica X intermedia come

dove i indica il passaggio di campionamento ith (i - 1, 2, 3, ecc.), k rappresenta il numero totale di passate (k - 3, a meno che non siano state esaminate le passate aggiuntive), e Ci è il totale numero di pesci catturati durante il passo ith. - Calcolare la stima della probabilità massima di n sostituendo in modo iterativo i valori n decrescenti nell'equazione 2 fino

dove T è il numero totale di individui catturati durante k passate e tutte le variabili rimanenti sono come definito sopra nell'equazione 1. - Se si osservano conteggi zero nel primo, secondo o terzo campione di esaurimento, stimare n come somma di individui che sono stati catturati tra i tre campioni di esaurimento. Un esempio di equazione 1 e 2 viene visualizzato nel file supplementare 2.
NOTA: Diverse applicazioni software possono essere utilizzate per calcolare le stime di abbondanza di zippin dai campioni di deplezione, come la funzione 'rimozione' nel pacchetto R 'FSA' (Fisheries Stock Assessment)33. Tuttavia, è più istruttivo risolvere manualmente le equazioni 1 e 2 in un foglio di calcolo. Istruzioni dettagliate sono fornite in Lockwood e Schneider34 e Supplementary File 2.
- Iniziare calcolando una statistica X intermedia come
- Ripetere il passaggio 3.2.3 per ciascuno dei contenitori di dimensioni del pesce rimanenti.
- Convertire la stima n per ogni contenitore di dimensioni contenente pesce in una stima per 1 m2D dividendo n per la stima totale della superficie della copertura esaminata dal punto 1.1.2 sopra. Ad esempio, se la stima di .ippin n è 70 pesci e la superficie della portata esaminata è 1.200 m2, allora D : 0,058 pesce/m2.
- Stimare l'abbondanza di macroinvertebrati benthic all'interno di bidoni di dimensioni log2 raggruppando i risultati di ciascuno dei campioni di campo (cioè combinare i risultati dei campioni replicati in un unico elenco di singoli campioni), quindi sommando il numero totale di individui all'interno di ogni contenitore di dimensioni.
NOTA: Se le equazioni di massa di lunghezza utilizzate nel passaggio 2.5.5 producono stime di peso individuali in unità di massa secca mg, non è necessaria alcuna conversione di unità aggiuntiva per i macroinvertebrati bentici. - Stimare la macroinvertebrate bentica D all'interno di ogni contenitore di dimensioni come
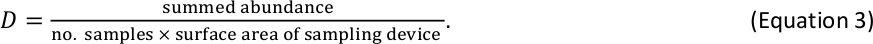
Ad esempio, se sono stati raccolti 6 campioni di macroinvertebrati benthici con un dispositivo Hess standard (superficie di 0,086 m2) e un totale di 110 individui sono stati conteggiati all'interno di un contenitore di dimensioni specificato, la stima D per tale contenitore di dimensioni è 213 individui/m2 . - Combina i risultati D per i pesci e le macroinvertebrati benthici in un'unica tabella di stime D per bidone di dimensioni del log2. Se i pesci e i macroinvertebrati si verificano nel bidone delle stesse dimensioni (un evento raro che può verificarsi per gli invertebrati più grandi e i pesci più piccoli), sommare le rispettive stime D per ottenere una stima D totale per quel contenitore di dimensioni.
- Eliminare eventuali contenitori di dimensionidel log 2 'vuoti (ad esempio, contenitori di dimensioni con valori D pari a zero), poiché i contenitori vuoti spotranno la distorsione dei modelli di regressione lineare utilizzati per stimare i parametri degli spettri di dimensione35,36.
4. Modellazione dello spettro macroinvertebrato e dimensione dei pesci
- Stimare la massa secca media perogni contenitore di dimensioni2 del tronco utilizzando uno dei seguenti valori: (i) il valore minimo (limite inferiore) per ogni contenitore di dimensioni; ii) il valore massimo (limite superiore); (iii) la media aritmetica (del minimo e del massimo); o (iv) la media geometrica (del minimo e massimo)35.
NOTA: negli esempi riportati di seguito, è stata stimata come media aritmetica di ogni contenitore di dimensioni del registro2 (vedere File supplementare 2). - 'Normalizza' la stima D per ogni contenitore di dimensioni del registro2 dividendolo per la rispettiva larghezza (cioè differenza tra il limite superiore e inferiore)16,35. In questo modo si eviterà agli intervalli di dimensioni del log non uniforme2 di creare distorsioni nei modelli di regressione lineare utilizzati per stimare i parametri degli spectra di dimensione35,37,38.
- Il log10 trasforma tutti i dati di trasformazione per convertire la relazione curvilineo D
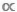 M in una relazione lineare. Quindi utilizzare la regressione dei minimiquadrati ordinari con idati del log10( ) e del log10( ) per modellare lo spettro delle dimensioni come
M in una relazione lineare. Quindi utilizzare la regressione dei minimiquadrati ordinari con idati del log10( ) e del log10( ) per modellare lo spettro delle dimensioni come 
dove log10(a) è l'intercetta e b è la pendenza del modello dello spettro di dimensioni lineari.
Risultati
Risultati esemplari, compresi i dati originali sul campo, sono presentati per Slaunch Fork, Virginia Occidentale, un piccolo ruscello nel sud della Virginia Occidentale. Ulteriori risultati del modello di spettri di dimensioni sono presentati anche per altri due corsi d'acqua nella stessa regione: Camp Creek e Cabin Creek, West Virginia. Questi sono i tre siti di studio inclusi in McGarvey e Kirk17, ma i dati presentati qui sono da nuovi campioni raccolti nel maggio 2015. Un esempio manuale comple...
Discussione
Questo protocollo spettrale di dimensioni atassiche può essere utilizzato per quantificare e modellare la struttura delle dimensioni all'interno di comunità di pesci di flusso e invertebrati. Precedenti studi sugli spettri di dimensioni negli ecosistemi dei corsi d'acqua hanno spaziato dalla ricerca descrittiva di base39,40 ai confronti lungo un profilo longitudinale del fiume41 e tra regioni biogeografiche distinte42
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
I finanziamenti per questo lavoro sono stati forniti dalla National Science Foundation (grant DEB-1553111) e dalla Eppley Foundation for Scientific Research. Questo manoscritto è il contributo del VCU Rice Rivers Center #89.
Materiali
| Name | Company | Catalog Number | Comments |
| Chest waders | Multiple options | n/a | Personal protective equipment for use during electrofishing. Do NOT use 'breatheable' waders as electrical current will pass through them. |
| Rubber lineman's gloves | Multiple options | n/a | Personal protective equipment for use during electrofishing. |
| Dip nets with fiberglass poles | Multiple options | n/a | Used to capture stunned fishes during electrofishing. |
| Backpack electrofishing unit | Smith-Root; Halltech; Midwest Lake Management; Aqua Shock Solutions | www.smith-root.com; www.halltechaquatic.com; https://midwestlake.com; https://aquashocksolutions.com/ | Backpack electrofishers are currently manufactured and distributed by four independent companies in North America. Prices and warranty/technical support are the most important factors in choosing a vendor. |
| Block nets/seines (×2) | Duluth Nets | https://duluthfishnets.com/ | Necessary length will depend on stream width. 3/8 inch mesh is recommended. |
| Cam-action utility straps with 1 inch nylon webbing (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at auto supply, hardware, and department stores. |
| Large tent stakes (×4) | Multiple options | n/a | Used to secure/anchor block nets. Available at camping and department stores. |
| 5 gallon plastic buckets (×5) | Multiple options | n/a | Used to hold and transport fish during electrofishing. Available at hardware and paint supply stores. |
| 10-20 gallon totes (×3) | Multiple options | n/a | Used as livewells, sedation tanks, and recovery bins for captured fishes. Available at hardware and department stores. |
| Battery powered 'bait bucket' aeration pumps | Cabelas | IK-019008 | Used to aerate fish holding bins during field processing. |
| Fish anesthesia (Tricaine-S) | Syndel | www.syndel.com | Used to sedate fishes for field processing. Tricaine-S is regulated by the U.S. Food and Drug Administration. |
| Folding camp table and chairs | Cabelas | IK-518976; IK-552777 | Used to process fish samples. |
| Pop-up canopy | Multiple options | n/a | Used as necessary for sun and rain protection. |
| Fish measuring board | Wildco | 3-118-E40 | Used to measure fish lengths. |
| Battery powered field scale with weighing dish | Multiple options | n/a | Used to weigh fishes. Must weigh be accurate to 0.1 or 0.01 grams. |
| Clear plastic wind/rain baffle | Multiple options | n/a | Used to shield scale in rainy or windy conditions. Must be large enough to cover the scale and a weighing dish. |
| White plastic or enamel examination trays | Multiple options | n/a | Trays are essential for examining fishes in the field. |
| Stainless steel forceps | Multiple options | n/a | Forceps are helpful when examining small fishes and in transfering invertebrates to specimen jars. |
| Hand magnifiers | Multiple options | n/a | Magnification is often helpful when identifying fish specimens in the field. |
| Fish identification keys | n/a | n/a | Laminated keys that are custom prepared for specific locations are most effective. |
| Datasheets printed on waterproof paper | Rite in the Rain | n/a | Waterproof paper is essential when working with aquatic specimens. |
| Retractable fiberglass field tapes | Lufkin | n/a | Used to measure stream channel dimensions. |
| Surber sampler or Hess sampler | Wildco | 3-12-D56; 3-16-C52 | Either of these fixed-area benthic samplers will work well in shallow streams with gravel or pebble substrate. |
| 70% ethanol or isopropyl alcohol | Multiple options | n/a | Used as invertebrate preservative. |
| Widemouth invertebrate specimen jars (20-32 oz.) | U.S. Plastic Corp. | 67712 | Any widemouth plastic jars will work but these particular jars are durable and inexpensive. |
Riferimenti
- Peters, R. H. . The ecological implications of body size. , (1983).
- Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M., West, G. B. Toward a metabolic theory of ecology. Ecology. 85 (7), 1771-1789 (2004).
- Marquet, P. A., et al. Scaling and power-laws in ecological systems. Journal of Experimental Biology. 208 (9), 1749-1769 (2005).
- Bohlin, T., Dellefors, C., Faremo, U., Johlander, A. The energetic equivalence hypothesis and the relation between population-density and body-size in stream-living salmonids. The American Naturalist. 143 (3), 478-493 (1994).
- Dunham, J. B., Vinyard, G. L. Relationships between body mass, population density, and the self-thinning rule in stream-living salmonids. Canadian Journal of Fisheries and Aquatic Sciences. 54 (5), 1025-1030 (1997).
- Jennings, S., Blanchard, J. L. Fish abundance with no fishing: predictions based on macroecological theory. Journal of Animal Ecology. 73 (4), 632-642 (2004).
- Petchey, O. L., Belgrano, A. Body-size distributions and size-spectra: universal indicators of ecological status?. Biology Letters. 6 (4), 434-437 (2010).
- Woodward, G., et al. Body size in ecological networks. Trends in Ecology and Evolution. 20 (7), 402-409 (2005).
- Trebilco, R., Baum, J. K., Salomon, A. K., Dulvy, N. K. Ecosystem ecology: size-based constraints on the pyramids of life. Trends in Ecology and Evolution. 28 (7), 423-431 (2013).
- White, E. P., Ernest, S. K. M., Kerkhoff, A. J., Enquist, B. J. Relationships between body size and abundance in ecology. Trends in Ecology and Evolution. 22 (6), 323-330 (2007).
- Schmid, P. E., Tokeshi, M., Schmid-Araya, J. M. Relation between population density and body size in stream communities. Science. 289 (5484), 1557-1560 (2000).
- Morin, A., Nadon, D. Size distribution of epilithic lotic invertebrates and implications for community metabolism. Journal of the North American Benthological Society. 10 (3), 300-308 (1991).
- Mittelbach, G. G., Persson, L. The ontogeny of piscivory and its ecological consequences. Canadian Journal of Fisheries and Aquatic Sciences. 55 (6), 1454-1465 (1998).
- Woodward, G., Hildrew, A. G. Body-size determinants of niche overlap and intraguild predation within a complex food web. Journal of Animal Ecology. 71 (6), 1063-1074 (2002).
- Zippin, C. The removal method of population estimation. Journal of Wildlife Management. 22 (1), 82-90 (1958).
- Kerr, S. R., Dickie, L. M. . The biomass spectrum: a predator-prey theory of aquatic production. , (2001).
- McGarvey, D. J., Kirk, A. J. Seasonal comparison of community-level size-spectra in southern coalfield streams of West Virginia (USA). Hydrobiologia. 809 (1), 65-77 (2018).
- Reynolds, J. B., Kolz, A. L., Zale, A. V., Parrish, D. L., Sutton, T. M. Electrofishing. Fisheries techniques. 8, 305-361 (2012).
- Bowker, J., Trushenski, J. Fish drug questions answered by the FDA. Fisheries. 38 (12), 549-552 (2013).
- Topic Popovic, N., et al. Tricaine methane-sulfonate (MS-222) application in fish anaesthesia. Journal of Applied Ichthyology. 28 (4), 553-564 (2012).
- Trautman, M. B. . The fishes of Ohio. , (1981).
- Riley, S. C., Fausch, K. D. Underestimation of trout population size by maximum-likelihood removal estimates in small streams. North American Journal of Fisheries Management. 12 (4), 768-776 (1992).
- Merritt, R. W., Cummins, K. W., Resh, V. H., Batzer, D. P., Merritt, R. W., Cummins, K. W., Berg, M. B. Sampling aquatic insects: collection devices, statistical considerations, and rearing procedures. An introduction to the aquatic insects of North America. , 15-37 (2008).
- Hauer, F. R., Resh, V. H., Hauer, F. R., Lamberti, G. A. Macroinvertebrates. Methods in stream ecology. 1, 297-319 (2017).
- Thorp, J. H., Covich, A. P. . Ecology and classification of North American freshwater invertebrates. , (2010).
- Merritt, R. W., Cummins, K. W., Berg, M. B. . An introduction to the aquatic insects of North America. , (2008).
- Stewart, K. W., Stark, B. P. . Nymphs of North American stonefly genera (Plecoptera). , (2002).
- Wiggins, G. B. . Larvae of the North American caddisfly genera (Trichoptera). , (1998).
- Benke, A. C., Huryn, A. D., Smock, L. A., Wallace, J. B. Length-mass relationships for freshwater macroinvertebrates in North America with particular reference to the Southeastern United States. Journal of the North American Benthological Society. 18 (3), 308-343 (1999).
- Smock, L. A. Relationships between body size and biomass of aquatic insects. Freshwater Biology. 10 (4), 375-383 (1980).
- Waters, T. F. Secondary production in inland waters. Adv. Ecol. Res. 10, 91-164 (1977).
- Carle, F. L., Strub, M. R. New method for estimating population-size from removal data. Biometrics. 34 (4), 621-630 (1978).
- Ogle, D. H., Wheeler, P., Dinno, A. FSA: fisheries stock analysis. R package version 0.8.22.9000. , (2018).
- Lockwood, R. N., Schneider, J. C., Schneider, J. C. Stream fish population estimates by mark-and-recapture and depletion methods. Manual of fisheries survey methods II: with periodic updates. 7, (2000).
- Blanco, J. M., Echevarría, F., García, C. M. Dealing with size-spectra: some conceptual and mathematical problems. Scientia Marina. 58 (1-2), 17-29 (1994).
- White, E. P., Enquist, B. J., Green, J. L. On estimating the exponent of power-law frequency distributions. Ecology. 89 (4), 905-912 (2008).
- Vidondo, B., Prairie, Y. T., Blanco, J. M., Duarte, C. M. Some aspects of the analysis of size spectra in aquatic ecology. Limnology and Oceanography. 42 (1), 184-192 (1997).
- Sprules, W. G., Barth, L. E. Surfing the biomass size spectrum: some remarks on history, theory, and application. Canadian Journal of Fisheries and Aquatic Sciences. 73 (4), 477-495 (2016).
- Poff, N. L., et al. Size structure of the metazoan community in a Piedmont stream. Oecologia. 95 (2), 202-209 (1993).
- Ramsay, P. M., et al. A rapid method for estimating biomass size spectra of benthic metazoan communities. Canadian Journal of Fisheries and Aquatic Sciences. 54 (8), 1716-1724 (1997).
- Solimini, A. G., Benvenuti, A., D’Olimpio, R., Cicco, M. D., Carchini, G. Size structure of benthic invertebrate assemblages in a Mediterranean river. Journal of the North American Benthological Society. 20 (3), 421-431 (2001).
- Huryn, A. D., Benke, A. C., Hildrew, A., Raffaelli, D., Edmonds-Brown, R. Relationship between biomass turnover and body size for stream communities. Body size: the structure and function of aquatic ecosystems. 4, 55-76 (2007).
- Gaedke, U. The size distribution of plankton biomass in a large lake and its seasonal variability. Limnology and Oceanography. 37 (6), 1202-1220 (1992).
- Stead, T. K., Schmid-Araya, J. M., Schmid, P. E., Hildrew, A. G. The distribution of body size in a stream community: one system, many patterns. Journal of Animal Ecology. 74 (3), 475-487 (2005).
- Brose, U., et al. Consumer-resource body-size relationships in natural food webs. Ecology. 87 (10), 2411-2417 (2006).
- Mehner, T., et al. Empirical correspondence between trophic transfer efficiency in freshwater food webs and the slope of their size spectra. Ecology. 99 (6), 1463-1472 (2018).
- Daan, N., Gislason, H. G., Pope, J. C., Rice, J. Changes in the North Sea fish community: evidence of indirect effects of fishing?. ICES Journal of Marine Science. 62 (2), 177-188 (2005).
- Murry, B. A., Farrell, J. M. Resistance of the size structure of the fish community to ecological perturbations in a large river ecosystem. Freshwater Biology. 59 (1), 155-167 (2014).
- Broadway, K. J., Pyron, M., Gammon, J. R., Murry, B. A. Shift in a large river fish assemblage: body-size and trophic structure dynamics. PLoS ONE. 10 (4), e0124954 (2015).
- Vila-Martínez, N., Caiola, N., Ibáñez, C., Benejam, L., Brucet, S. Normalized abundance spectra of fish community reflect hydro-peaking on a Mediterranean large river. Ecological Indicators. 97, 280-289 (2019).
- Brucet, S., et al. Size-based interactions across trophic levels in food webs of shallow Mediterranean lakes. Freshwater Biology. 62 (11), 1819-1830 (2017).
- Ersoy, Z., et al. Size-based interactions and trophic transfer efficiency are modified by fish predation and cyanobacteria blooms in Lake Mývatn, Iceland. Freshwater Biology. 62 (11), 1942-1952 (2017).
- Arranz, I., Hsieh, C. H., Mehner, T., Brucet, S. Systematic deviations from linear size spectra of lake fish communities are correlated with predator–prey interactions and lake-use intensity. Oikos. 128 (1), 33-44 (2019).
- Jennings, S., et al. Long-term trends in the trophic structure of the North Sea fish community: evidence from stable-isotope analysis, size-spectra and community metrics. Marine Biology. 141 (6), 1085-1097 (2002).
- Guiet, J., Poggiale, J. C., Maury, O. Modelling the community size-spectrum: recent developments and new directions. Ecological Modelling. 337, 4-14 (2016).
- Robinson, J. P. W., et al. Fishing degrades size structure of coral reef fish communities. Global Change Biology. 23 (3), 1009-1022 (2017).
- Reuman, D. C., Mulder, C., Raffaelli, D., Cohen, J. E. Three allometric relations of population density to body mass: theoretical integration and empirical tests in 149 food webs. Ecology Letters. 11 (11), 1216-1228 (2008).
- Huryn, A. D., Wallace, J. B., Anderson, N. H., Merritt, R. W., Cummins, K. W., Berg, M. B. Habitat, life history, secondary production, and behavioral adaptations of aquatic insects. An introduction to the aquatic insects of. 5, 55-103 (2008).
- Werner, E. E., Gilliam, J. F. The ontogenetic niche and species interactions in size-structured populations. Annual Review of Ecology and Systematics. 15 (1), 393-425 (1984).
- Edwards, A. M., Robinson, J. P. W., Plank, M. J., Baum, J. K., Blanchard, J. L. Testing and recommending methods for fitting size spectra to data. Methods in Ecology and Evolution. 8 (1), 57-67 (2017).
- Roell, M., Orth, D. Production of three crayfish populations in the New River of West Virginia, USA. Hydrobiologia. 228 (3), 185-194 (1992).
- Hawkins, C. P., Murphy, M. L., Anderson, N. H., Wilzbach, M. A. Density of fish and salamanders in relation to riparian canopy and physical habitat in streams of the northwestern United States. Canadian Journal of Fisheries and Aquatic Sciences. 40 (8), 1173-1185 (1983).
- Rabeni, C. F., Collier, K. J., Parkyn, S. M., Hicks, B. J. Evaluating techniques for sampling stream crayfish (Paranephrops planifrons). New Zealand Journal of Marine and Freshwater Research. 31 (5), 693-700 (1997).
- DiStefano, R. J., Gale, C. M., Wagner, B. A., Zweifel, R. D. A sampling method to assess lotic crayfish communities. Journal of Crustacean Biology. 23 (3), 678-690 (2003).
- Price, J. E., Welch, S. M. Semi-quantitative methods for crayfish sampling: sex, size, and habitat bias. Journal of Crustacean Biology. 29 (2), 208-216 (2009).
- Sheldon, R. W., Sutcliffe, W. H., Paranjape, A. M. Structure of pelagic food chain and relationship between plankton and fish production. Journal of the Fisheries Research Board of Canada. 34 (12), 2344-2353 (1977).
- Andersen, K., et al. Asymptotic size determines species abundance in the marine size spectrum. The American Naturalist. 168 (1), 54-61 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon